Вступ
Результати епідеміологічних досліджень свідчать про те, що ризик коронарних ускладнень у хворих на цукровий діабет (ЦД) без ішемічної хвороби серця (ІХС) дорівнює ризику у хворих, які вже мають клінічні прояви ІХС. Так, за даними S. Haffher та співавторів (1998), при 7-річному спостереженні інфаркт міокарда (ІМ) або коронарна смерть виявлені у 20% пацієнтів з ЦД і лише у 3,5% — без ЦД. У групі хворих, які страждали на ЦД і перенесли ІМ, повторний ІМ та смерть відзначали у 45% випадків, на відміну від хворих без ЦД 2-го типу, в яких подібні стани траплялися у 18,8% випадків. Аналогічні дані отримані S.G. Wannamethee та співавторами (2004): частота серцево-судинних подій у хворих на ЦД чоловіків, які перенесли ІМ, становила 50,2%, тоді як у чоловіків без ЦД, які перенесли ІМ, — 29%. При цьому ризик коронарної смерті у пацієнтів із ЦД та ІХС перевищував у 3 рази ризик у осіб із ІХС або ЦД окремо. За даними метааналізу 37 проспективних досліджень, ризик коронарної смерті, що асоціюється з ЦД, у жінок на 50% вищий, ніж у чоловіків (Roe M.T. et al., 2008).
Проблема зниження смертності від серцево-судинних захворювань, які є основним чинником смертності хворих на ЦД 2-го типу, залишається предметом особливої уваги сучасної медицини, служби охорони здоров’я, всього суспільства. При ураженні серцево-судинної системи вмирають 65–70% хворих на ЦД 2-го типу (Долженко М.М. та співавт., 2010).
Отже, найпоширеніші коморбідні захворювання, якими є ЦД 2-го типу та ІХС, нерідко привносять труднощі в діагностичний процес, вибір лікувальної тактики і ведення пацієнтів, підвищуючи частоту ускладнень і смертність.
В останній час з’явилося багато робіт відносно прогностичного значення ремоделювання міокарда та діастолічної дисфункції лівого шлуночка (ДДЛШ) у хворих після ІМ (Petrie M.C. et al., 2004; Poulsen S.H. et al., 2006; Следзевская И.К. и соавт., 2013; Батушкин В.В. и соавт., 2014). Що стосується змін внутрішньосерцевої гемодинаміки у хворих із коморбідною патологією (ІХС та ЦД 2-го типу), то цей розділ найменш досліджений.
Вищенаведені положення визначають доцільність проведення дослідження з вивчення особливостей розвитку та прогресування структурно-функціональних змін міокарда у разі поєднаного перебігу ІХС та ЦД 2-го типу, що дозволить покращити діагностику, визначити тактику диференційованої терапії, ефективність та повноту корекції систоло-діастолічної дисфункції.
Мета роботи — оцінити показники центральної кардіогемодинаміки та діастолічної функції лівого шлуночка (ЛШ) у пацієнтів із постінфарктним кардіосклерозом та ЦД 2-го типу.
Об’єкт і методи дослідження
До дослідження ретроспективно включено 68 пацієнтів із ІХС, які перенесли ІМ, із супутнім ЦД 2-го типу. Середній вік обстежених становив 64,38±1,08 року, з них чоловіків було 32 (47,1%), жінок — 36 (52,9%). У дослідження не залучали хворих із тяжкою супутньою патологією органів дихання, травлення, нирок та осіб з онкологічними захворюваннями. Групу порівняння становили 80 осіб із ІХС, які перенесли ІМ без ЦД. Середній вік пацієнтів групи порівняння становив 63,47±1,28 року, із них чоловіків було 42 (52,5%), жінок — 38 (47,5%). Групи були зіставні за віком і статтю. До контрольної групи включено 35 практично здорових осіб (середній вік — 58,23±1,39 року).
Діагноз перенесеного ІМ визначали за критеріями European Society of Cardiology/American College of Cardiology Foundation/American Heart Association/World Heart Federation (ESC/ACCF/AHA/WHF) (Thygesen K. et al., 2012).
Усім хворим проводили загальноклінічні та інструментальні обстеження. Ехокардіографічне дослідження проводили за стандартною методикою Х. Фейгенбаум на ультразвуковому апараті «RADMIR» («Ultima PRO 30», Харків, Україна). У М- режимі визначали такі параметри ЛШ (см): кінцевий діастолічний розмір (КДР), кінцевий систолічний розмір (КСР), товщину задньої стінки (ТЗСЛШ), товщину міжшлуночкової перегородки (ТМШП). Кінцевий діастолічний об’єм (КДО, мл) і систолічний об’єм (КСО, мл) ЛШ розраховували за методом Simpson (1991), після чого обчислювали фракцію викиду (ФВ) ЛШ (%). Масу міокарда ЛШ (ММЛШ) обчислювали за формулою R.B. Devereux, N. Reichek (1977):
1,04 • [(ТМШП + ТЗСЛШ + КДР)3] – КДР3 – 13,6.
Розрахунок індексу товщини стінки міокарда ЛШ (ІТСМЛШ) проводили за формулою:
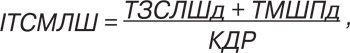
де д — показник у діастолу.
Потім розраховували індекс маси міокарда ЛШ (ІММЛШ) щодо росту пацієнтів:
![]()
де Р — зріст пацієнтів (м).
Також визначали розмір лівого передсердя (ЛП, см) та аорти (см). Діастолічну функцію ЛШ досліджували шляхом реєстрації допплерівського трансмітрального діастолічного потоку. Визначали максимальні швидкості раннього (Е, см/с) і пізнього (А, см/с) наповнення ЛШ, їх співвідношення (Е/А, од.), час ізоволюметричного розслаблення ЛШ (iVRT, мс). Структуру діастолічного наповнення ЛШ класифікували відповідно до традиційних критеріїв (Алехин М.Н., Седов В.П., 1996). Псевдонормальний тип трансмітрального діастолічного потоку ідентифікували за допомогою проби Вальсальви.
Статистичну обробку отриманих даних проведено за допомогою пакета статистичних програм «Statistica 8.0» («StatSoft Inc», США), «Microsoft Office Exсel-2003» (Реброва О.Ю., 2002). Кількісні ознаки при нормальному розподілі представлені у вигляді середнє ± стандартна похибка середнього (М±m); для порівняння середніх двох вибірок використовували критерій Стьюдента. Для всіх видів аналізу відмінності вважали статистично значимими при р<0,05.
Результати та їх обговорення
Зіставлення показників кардіогемодинаміки у групах, де порівнювали хворих із постінфарктним кардіосклерозом залежно від наявності ЦД, показало відсутність достовірних відмін (р>0,05), окрім таких показників, як ТЗСЛШ, ТМШП, відносна товщина міжшлуночкової перегородки (ВТМШП), відносна товщина задньої стінки ЛШ (ВТЗСЛШ), ІММЛШ та ІТСМЛШ (р<0,05) (табл. 1). ТЗСЛШ була більша на 8%, ТМШП на 9,5%, ВТМШП на 24%, ВТЗСЛШ на 30%, ІММЛШ на 11%, а ІТСМЛШ на 15% (р<0,05) у хворих при поєднанні постінфарктного кардіосклерозу та ЦД 2-го типу. Водночас середні значення показників ТЗСЛШ, ТМШП, ВТМШП, ВТЗСЛШ, ІММЛШ та ІТСМЛШ перевищували значення таких у групі порівняння, що свідчило про наявність у пацієнтів гіпертрофії ЛШ, зокрема концентричного типу.
кардіосклерозом залежно від наявності ЦД 2-го типу (M±m)
| Показник | Група | р | |
|---|---|---|---|
| Постінфарктний кардіосклероз + ЦД 2-го типу (n=68) | Постінфарктний кардіосклероз (n=80) | ||
| САТ, мм рт. ст. | 159,4±3,0 | 158,2±3,1 | >0,05 |
| ДАТ, мм рт. ст. | 92,4±1,9 | 91,6±2,1 | >0,05 |
| ЧСС, уд./хв | 76,8±2,1 | 76,4±2,3 | >0,05 |
| Пульс, уд./хв | 76,6±1,9 | 76,3±2,3 | >0,05 |
| КДО, мл | 180,36±3,4 | 178,26±3,1 | >0,05 |
| КСО, мл | 82,8±1,7 | 81,4±1,8 | >0,05 |
| КДР, см | 6,54±0,09 | 6,41±0,11 | >0,05 |
| КСР, см | 3,16±0,07 | 3,11±0,08 | >0,05 |
| ФВ, % | 47,63±0,8 | 48,12±0,9 | >0,05 |
| ВТМШП, см | 0,67±0,05 | 0,51±0,06 | <0,05 |
| ВТЗСЛШ, см | 0,54±0,03 | 0,38±0,04 | <0,05 |
| ТЗСЛШ, см | 1,52±0,02 | 1,40±0,02 | <0,05 |
| ТМШП, см | 1,47±0,03 | 1,33±0,01 | <0,05 |
| ЛП, см | 4,01±0,07 | 3,95±0,12 | >0,05 |
| Аорта, см | 3,31±0,05 | 3,29±0,06 | >0,05 |
| ММЛШ, г | 263,28±6,9 | 251,35±6,7 | >0,05 |
| ІТСМЛШ | 0,53±0,02 | 0,45±0,01 | <0,05 |
| ІММЛШ, г/м2 | 142,68±4,69 | 127,25±5,01 | <0,05 |
Таким чином, ЦД 2-го типу є предиктором розвитку концентричної гіпертрофії міокарда ЛШ у хворих із постінфарктним кардіосклерозом, яка є реакцією серця на тривале підвищення навантаження і порушення процесів мікроциркуляції в міокарді, а також сприяє комплексній структурно-функціональній перебудові серця з виникненням переважно концентричного ремоделювання та концентричної гіпертрофії ЛШ із тенденцією до зменшення скоротної здатності міокарда, що збігається з думкою інших дослідників (Маслаева Л.В. и соавт., 2005; Коваль С.Н., Старченко Т.Г., 2010). Переважна більшість хворих на ЦД 2-го типу має гіпертрофію ЛШ, тому на думку лікарів-практиків, заслуговує на увагу вивчення поширеності порушень діастолічної функції ЛШ у цієї категорії хворих. Тому нами вивчено діастолічну функцію міокарда ЛШ у хворих із постінфарктним кардіосклерозом та ЦД 2-го типу.
| Показник | Група | р | |
|---|---|---|---|
| Постінфарктний кардіосклероз + ЦД 2-го типу (n=68) | Постінфарктний кардіосклероз (n=80) | ||
| Е, мм/с | 63,47±2,8 | 57,92±2,6 | <0,05 |
| А, мм/с | 71,14±1,6 | 62,28±1,7 | <0,05 |
| iVRT, мс | 107,6±2,1 | 103,9±1,9 | <0,05 |
| DT, мс | 234,5±9,8 | 221,4±8,7 | <0,05 |
| Е/А, од. | 0,89±0,06 | 0,93±0,05 | <0,05 |
Відзначали відмінності в показниках діастолічної функції ЛШ залежно від наявності ЦД: максимальна швидкість раннього наповнення (Е) у хворих на ЦД 2-го типу становила 63,47±2,8 см/с, без ЦД — 57,92±2,6 см/с (р<0,05) (табл. 2). Максимальна швидкість пізнього наповнення передсердь (A) становила при ЦД 2-го типу 71,14±1,6 см/с, у пацієнтів 2-ї групи — 62,28±1,7 см/с (р<0,05). Співвідношення піків Е/А, що має важливе значення у визначенні ДДЛШ, у пацієнтів із постінфарктним кардіосклерозом виявилося <1 (р<0,05) і становило 0,89±0,06 у хворих на ЦД 2-го типу та 0,93±0,05 — у хворих без ЦД, що свідчить про уповільнене розслаблення ЛШ. Показник iVRT вірогідно перевищував такий у всіх хворих із постінфарктним кардіосклерозом, проте найбільш високе його значення визначали при поєднанні з ЦД 2-го типу (107,6±2,1 мс), тоді як у хворих 2-ї групи він становив 103,9±1,9 мс (р<0,05). Визначали відмінності в показнику часу уповільнення швидкості раннього діастолічного потоку (DT), що становив при ЦД 2-го типу 234,5±9,8 мс, а без нього — 221,4±8,7 мс (р<0,05). У більшості пацієнтів із постінфарктним кардіосклерозом та ЦД 2-го типу ДДЛШ за типом порушення релаксації.
Таким чином, найбільш низьке співвідношення Е/А визначали в пацієнтів із ЦД (тип порушення релаксації), що в поєднанні з нормальними значеннями ФВ, КДР, КСР, КДО, КСО свідчить про перевагу ДДЛШ за гіпертрофічним типом у цій групі, що не суперечить результатам, отриманим іншими дослідниками (Danzmann L.C. et al., 2008; Свищенко Е.П., Матова Е.А., 2009; Schmidt A., Pieske B., 2012; Сукманова И.А. и соавт., 2010; Cohen-Solal A., 2010; Collier P. et al., 2011; Edelmann F. et al., 2011; Phan T.T., Frenneaux M., 2010; Ruelland V., 2011). Таким чином, поєднання постінфарктного кардіосклерозу та ЦД 2-го типу підвищувало частоту виникнення ознак ДДЛШ I типу та сприяло погіршенню прогнозу розвитку серцево-судинних ускладнень у цієї когорти хворих.
Висновки
1. ЦД 2-го типу — предиктор розвитку концентричної гіпертрофії міокарда ЛШ у хворих із постінфарктним кардіосклерозом, яка є реакцією серця на тривале підвищення навантаження і порушення процесів мікроциркуляції в міокарді, а також сприяє комплексній структурно-функціональній перебудові серця з виникненням переважно концентричної гіпертрофії ЛШ з тенденцією до зменшення скоротної здатності міокарда.
2. Поєднання постінфарктного кардіосклерозу та ЦД 2-го типу підвищувало частоту виникнення ознак ДДЛШ I типу (тип порушення релаксації) та сприяло погіршенню прогнозу розвитку серцево-судинних ускладнень у цієї когорти хворих.
Список використаної літератури
- Алехин М.Н., Седов В.П. (1996) Допплерэхокардиография в оценке диастолической функции левого желудочка: обзор. Терапевт. арх., 68(12): 84–88.
- Долженко М.М., Перепельченко Н.А., Базилевич А.Я. (2010) Ішемічна хвороба серця на тлі цукрового діабету типу 2: особливості перебігу та обґрунтування терапії. Медкнига, Київ, 100 с.
- Батушкин В.В., Ашдари М., Гема А.И., Комаревич Н.А. (2014) Изменения внутрисердечной гемодинамики и уровней провоспалительных цитокинов под влиянием зофеноприла и лизиноприла в постинфарктный период у больных с сопутствующей артериальной гипертензией. Укр. кардіол. журн., 2: 69–80.
- Коваль С.Н., Старченко Т.Г. (2010) Особенности ремоделирования левого желудочка сердца у больных гипертонической болезнью, ассоциированной с сахарным диабетом 2-го типа. Укр. терапевт. журн., 1: 68–72.
- Масляева Л.В., Резник Л.А., Коваль С.Н. и др. (2005) Особенности ремоделирования сердца и сосудов у больных гипертонической болезнью и сахарным диабетом 2-го типа. Укр. терапевт. журн., 3: 62–66.
- Реброва О.Ю. (2002) Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. МедиаСфера, Москва, 312 с.
- Свищенко Е.П., Матова Е.А. (2009) Диастолическая сердечная недостаточность. Здоров’я України, 1: 47–54.
- Следзевская И.К., Бабий Л.Н., Строганова Н.П. и др. (2013) Компенсаторные факторы, определяющие функциональное состояние сердца у больных, перенесших инфаркт миокарда (двухлетнее наблюдение). Матеріали ХIV Національного конгресу кардіологів України, 18–20 вересня, Київ, с. 169.
- Сукманова И.А., Яхонтов Д.А., Поспелова Т.И. (2010) Показатели функции эндотелия, морфо-функциональные параметры сердца и метаболический статус при диастолической хронической сердечной недостаточности у больных разных возрастных групп. Кард. и серд.-сосуд. хирургия, 3(3): 72–75.
- Cohen-Solal A. (2010) Diastolic heart failure. Rev. Prat., 60(7): 933–934.
- Collier P., Watson C.J., Voon V. et al. (2011) Can emerging biomarkers of myocardial remodelling identify asymptomatic hypertensive patients at risk for diastolic dysfunction and diastolic heart failure? Eur. J. Heart Fail., 13(10): 1087–1095.
- Danzmann L.C., Bodanese L.C., Kohler I., Torres M.R. (2008) Left atrioventricular remodeling in the assessment of the left ventricle diastolic function in patients with heart failure: a review of the currently studied echocardiographic variables. Cardiovasc. Ultrasound, 6: 56.
- Devereux R.B., Reichek N. (1977) Echocardiographic determination of left ventricular mass in man. Anatomic validation of the method. Circulation, 55(4): 613–618.
- Edelmann F., Stahrenberg R., Polzin F. et al. (2011) Impaired physical quality of life in patients with diastolic dysfunction associates more strongly with neurohumoral activation than with echocardiographic parameters: quality of life in diastolic dysfunction. Am. Heart J., 161(4): 797–804.
- Haffner M., Lehto S., Ronnema Т. et al. (1998) Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N. Engl. J. Med., 339: 229–234.
- Petrie M.C., Hogg K., Caruana L., McMurray J.J. (2004) Poor concordance of commonly used echocardiographic measures of left ventricular diastolic function in patients with suspected heart failure but preserved systolic function: is there a reliable echocardiographic measure of diastolic dysfunction? Heart, 90(5): 511–517.
- Phan T.T., Frenneaux M. (2010) The pathophysiology of diastolic heart failure. Biol. Rep., 24(2): 1–16.
- Poulsen S.H., Jensen S.E., Gotzsche О. et al. (2006) Evaluation and prognostic significance of LV diastolic function assessed by Doppler echocardiography in the very early phase of a first myocardial infarction. Eur. Heart J., 27: 1882–1889.
- Roe M.T., Ou F.S., Alexander K.P. et al. (2008) Patterns and prognostic implications of low high-density lipoprotein levels in patients with non-ST-segment elevation acute coronary syndromes. Eur. Heart J., 29: 2480–2488.
- Ruelland V. (2011) Diastolic dysfunction in the elderly. Soins., 756(Cardiologie): S11–S12.
- Schmidt A., Pieske B. (2012) Diagnostics and therapy of diastolic heart failure. MMW Fortschr. Med., 151(15): 27–30.
- Thygesen K., Alpert J.S., Jaffe A.S. et al.; Joint ESC/ACCF/AHA/WHF Task Force for the Universal Definition of Myocardial Infarction et al. (2012) Third universal definition of myocardial infarction. Circulation, 126(16): 2020–2035.
- Wannamethee S.G., Shaper A.G., Lennon L. (2004) Cardio vascular disease incidence and mortality in older men with diabetes and in men with coronary heart disease. Heart, 90(12): 1398–1403.
Резюме. В статье оценены показатели центральной кардиогемодинамики и диастолической функции левого желудочка у 68 пациентов с постинфарктным кардиосклерозом и сахарным диабетом (СД) 2-го типа. В группу сравнения вошли 80 больных постинфарктным кардиосклерозом, в контрольную группу — 35 практически здоровых лиц. Всем пациентам проведено определение показателей кардиогемодинамики. Установлено, что СД 2-го типа является предиктором развития концентрической гипертрофии миокарда левого желудочка у больных постинфарктным кардиосклерозом. Сочетание постинфарктного кардиосклероза и СД 2-го типа повышало частоту возникновения признаков диастолической дисфункции левого желудочка I типа (тип нарушения релаксации) и способствовало ухудшению прогноза развития сердечно-сосудистых осложнений у этой когорты больных.
Ключевые слова: кардиогемодинамика, диастолическая дисфункция левого желудочка, постинфарктный кардиосклероз, сахарный диабет 2-го типа.
Summary. The central cardiohemodynamics indexes and left ventricular diastolic function in 68 patients with postinfarction cardiosclerosis and type 2 diabetes were estimated in the article. The comparison group was consisted of 80 patients with postinfarction cardiosclerosis and control group — of 35 healthy individuals. All patients were conducted to identify cardiohemodynamics indexes. It was determined that type 2 diabetes is a predictor of concentric left ventricular hypertrophy in patients with postinfarction cardiosclerosis. The combination of postinfarction cardiosclerosis and type 2 diabetes increased incidence of signs of left ventricular diastolic dysfunction type I (type of abuse relaxation) and contributed to worsening prognosis of cardiovascular complications in this cohort of patients.
Key words: cardiohemodynamics, left ventricular diastolic dysfunction, postinfarction cardiosclerosis, type 2 diabetes.
Адреса для листування:
Кравчун Павло Павлович
61022, Харків, просп. Леніна, 4
Харківський національний
медичний університет,
кафедра внутрішньої медицини № 2
і клінічної імунології та алергології





