Вступ
 Альбумінурія — загальновизнаний маркер ризику розвитку ниркової недостатності та серцево-судинних подій у пацієнтів із хронічною хворобою нирок (ХХН) [1, 2]. Фармакологічні втручання, включаючи застосування інгібіторів ренін-ангіотензинової системи, інгібіторів натрійзалежного котранспортера глюкози 2-го типу (іНЗКТГ‑2) та агоністів рецепторів глюкагоноподібного пептиду-1, знижують альбумінурію [3, 4]. Метааналіз клінічних досліджень показав, що раннє зниження альбумінурії пов’язане з нижчим ризиком розвитку ниркової недостатності [5].
Альбумінурія — загальновизнаний маркер ризику розвитку ниркової недостатності та серцево-судинних подій у пацієнтів із хронічною хворобою нирок (ХХН) [1, 2]. Фармакологічні втручання, включаючи застосування інгібіторів ренін-ангіотензинової системи, інгібіторів натрійзалежного котранспортера глюкози 2-го типу (іНЗКТГ‑2) та агоністів рецепторів глюкагоноподібного пептиду-1, знижують альбумінурію [3, 4]. Метааналіз клінічних досліджень показав, що раннє зниження альбумінурії пов’язане з нижчим ризиком розвитку ниркової недостатності [5].
іНЗКТГ‑2 уповільнюють прогресування та знижують ризик розвитку ниркової недостатності у пацієнтів із ХХН та без неї. іНЗКТГ‑2 спочатку були розроблені як пероральні антигіперглікемічні препарати для пацієнтів із цукровим діабетом (ЦД) 2-го типу і не були рекомендовані пацієнтам із ХХН через нижчу глікемічну ефективність у пацієнтів із нижчою розрахунковою швидкістю клубочкової фільтрації (рШКФ). Проте клінічні дослідження свідчать, що іНЗКТГ‑2 знижують альбумінурію у пацієнтів із ЦД 2-го типу та ХХН [6, 7]. Ці дані викликали інтерес до вивчення впливу іНЗКТГ‑2 на віддалені наслідки з боку нирок. Дослідження CREDENCE показало, що канагліфлозин знижує ризик клінічно значущих ускладнень з боку нирок і серцево-судинної системи у пацієнтів із ЦД 2-го типу та ХХН [8]. Дослідження DAPA-CKD поширило ці результати на пацієнтів із ХХН із ЦД 2-го типу та без нього, демонструючи значно нижчі показники прогресування ХХН, серцево-судинної смерті або госпіталізації з приводу серцевої недостатності та смертності від усіх причин [9].
Нижче наведено дані дослідження DAPA-CKD щодо впливу дапагліфлозину на альбумінурію, узгодженість цього ефекту у пацієнтів із ЦД 2-го типу та без нього, а також зв’язок між ранніми змінами альбумінурії та подальшими довгостроковими змінами функції нирок.
Об’єкт і методи дослідження
Дизайн дослідження та учасники
DAPA-CKD — багатоцентрове подвійне сліпе плацебо-контрольоване рандомізоване дослідження, проведене у 386 центрах у 21 країні (Аргентина, Бразилія, Канада, Китай, Данія, Німеччина, Угорщина, Індія, Японія, Мексика, Перу, Філіппіни, Польща, Російська Федерація, Південна Корея, Іспанія, Швеція, Великобританія, Україна, США та В’єтнам). Протокол дослідження схвалений центральним або місцевим комітетом з етики в кожному центрі. Основним результатом дослідження було визначення, чи знижує дапагліфлозин частоту ниркових і серцево-судинних подій у пацієнтів із ХХН із ЦД 2-го типу чи без нього. Комбінована кінцева точка — стійке зниження рШКФ на ≥50% (підтверджене другим вимірюванням сироваткового креатиніну через ≥28 днів), початок термінальної стадії захворювання нирок (що визначали як підтримувальний діаліз протягом ≥28 днів), трансплантація нирки або рШКФ <15 мл/хв/1,73 м² (підтверджена другим вимірюванням через ≥28 днів) або смерть з ниркових або серцево-судинних причин.
Пацієнти брали участь у дослідженні, якщо в них була наявна ХХН, визначена як рШКФ 25–75 мл/хв/1,73 м², і співвідношення альбумін/креатинін (САК) у сечі 200–5000 мг/г (22,6–565,6 мг/ммоль).
Для визначення функції нирок у дослідженні DAPA-CKD використовували показник рШКФ, який розраховували за формулою CKD-EPI, та показник альбумінурії (протеїнурії), який розраховували як визначення САК. Показник САК має наступні переваги:
1. Не залежить від гідратації, дозволяє точно оцінити екскрецію білків та альбуміну з сечею. При визначенні саме САК виключається похибка, ймовірна за наявності дегідратації, що може підвищувати екскрецію альбумінів із сечею, за наявності гідратації — знижуються показники протеїнурії.
2. Не потребує збору добової сечі, що забезпечує зручність та швидкість діагностики. Для визначення САК використовують аналіз разової сечі (перша ранкова порція).
САК являє собою альтернативний метод кількісної оцінки протеїнурії.
Усі учасники отримували стабільну дозу інгібітора ангіотензинперетворювального ферменту або блокатора рецепторів ангіотензину ІІ протягом щонайменше 4 тиж до включення в дослідження, якщо не було протипоказань. Пацієнтів із ЦД 1-го типу, полікістозом нирок, вовчаковим нефритом або васкулітом, асоційованим із антинейтрофільними цитоплазматичними антитілами, виключали з дослідження.
Рандомізація та маскування
Учасники випадковим чином були розподілені на прийом дапагліфлозину 1 раз на добу або плацебо у приблизному співвідношенні 1:1. Рандомізацію проводили за допомогою інтерактивної голосової або вебсистеми та стратифікували за глікемічним профілем та САК (≤1000 або >1000 мг/г). Персонал, окрім незалежного комітету з моніторингу даних, і учасники були замасковані для лікування, що призначалося. Препарат і плацебо були однаково упаковані, з однаковим зовнішнім виглядом таблеток, маркуванням і графіком прийому.
Процедура дослідження
Учасники отримували дапагліфлозин перорально в дозі 10 мг 1 раз на добу або плацебо на додаток до стандартного лікування. Прийом досліджуваного препарату слід було продовжувати до появи діабетичного кетоацидозу, настання вагітності або завершення дослідження. Після рандомізації проводили особисті візити через 2 тиж; 2; 4 та 8 міс, а потім з інтервалом у 4 міс. Під час кожного візиту реєстрували життєво важливі показники, брали зразки крові та сечі для лабораторного аналізу, а також збирали інформацію щодо потенційних кінцевих точок дослідження, побічних явищ, супутньої терапії та дотримання режиму лікування.
САК визначали на вихідному етапі як середнє значення зі зразків, взятих під час скринінгу та рандомізаційного візиту. САК на вихідному етапі та під час кожного візиту вимірювали в одному першому ранковому зразку сечі та аналізували в центральній лабораторії.
Дослідницькі результати
Середню зміну логарифмічно перетвореного САК від вихідного рівня до кінця дослідження попередньо визначено як дослідницький результат. Середні логарифмічно перетворені САК розрахували методом найменших квадратів, щоб визначити ефект лікування. Встановлювали вплив дапагліфлозину на прогресування або регрес САК. Прогресування визначали як початковий розвиток нефротичного діапазону альбумінурії (САК ≥3000 мг/г), регрес — як початковий перехід від макро- (САК ≥300 мг/г) до мікро- або нормоальбумінурії (САК <300 мг/г). Для врахування щоденних коливань показників САК результати мали бути підтверджені другим вимірюванням під час наступного контрольного візиту. Зниження рШКФ з 2-го тижня до останнього візиту також попередньо визначено як дослідницький результат. Визначали зв’язок між зміною САК від вихідного рівня до 2-го тижня та подальше зниження рШКФ у пацієнтів, рандомізованих для прийому дапагліфлозину, порівняно з плацебо, з ЦД 2-го типу та без нього.
Статистичний аналіз
Усі аналізи проведено з дотриманням принципу «намір лікувати» (intention-to-treat). Вихідні характеристики узагальнено за базовим САК (≤1000 та >1000 мг/г). Безперервні змінні зазначені як середні значення та стандартні відхилення для змінних із наближеним симетричним розподілом. Змінні з асиметричним розподілом представлені як медіана (міжквартильний розмах — МР) або середнє геометричне, категоріальні змінні — як n (%).
Проаналізовано вплив дапагліфлозину на САК шляхом підбору моделей повторних вимірювань з використанням обмеженої максимальної ймовірності. Для наочного відображення відсоткових змін середнього геометричного САК по групах лікування протягом періоду спостереження використовували поздовжню модель із категоріальними фіксованими ефектами для лікування, відвідування, взаємодії лікування та візиту (treatment-by-visit), а також безперервні коваріати з фіксованим ефектом для базового log САК та взаємодії базового log САК та візиту. Для оцінки впливу дапагліфлозину порівняно з плацебо на САК в усій когорті використовували середній коефіцієнт лікування для оцінки впливу дапагліфлозину на середнє геометричне САК у ході подальших оцінок. Для різних категорійних факторів підгруп, які викликають інтерес (наприклад пацієнтів із ЦД 2-го типу або без нього), цю модель розширили, додавши основний ефект для підгрупи та умови тристоронньої взаємодії фактора підгрупи, лікування і наступного візиту. Використовували лінійні контрасти для оцінки та порівняння впливу випадково призначеного лікування на середнє геометричне САК при подальших оцінках для різних рівнів фактора підгрупи. Для всіх моделей використовували неструктуровану дисперсійно-коваріаційну матрицю, щоб врахувати загальні закономірності стандартних відхилень і кореляції між повторними вимірюваннями результатів. Розраховували логарифмічно перетворене відношення САК під час візиту до показника вихідного рівня (ln[САКвізит÷САКвихідний]). За моделлю повторних вимірювань оцінювали вплив дапагліфлозину порівняно з плацебо на систолічний (САТ) і діастолічний артеріальний тиск (ДАТ). Для оцінки зв’язку між змінами вихідного САТ та log САК на 2-му тижні використовували кореляцію Пірсона.
Використовували модель пропорційних ризиків Кокса для обчислення відношення ризиків (ВР) і 95% довірчого інтервалу (ДІ) (дапагліфлозин проти плацебо) для прогресування САК і результатів регресії. У цій моделі базова функція ризику стратифікована за ЦД 2-го типу та рівнем САК (≤1000 та >1000 мг/г), а базова рШКФ включена як коваріата. Також оцінювали вплив дапагліфлозину на ці кінцеві точки за вихідним статусом ЦД 2-го типу. Для цього аналізу виключили з моделі ЦД 2-го типу як фактор стратифікації. Перевіряли гетерогенність ефекту лікування дапагліфлозином у пацієнтів із ЦД 2-го типу та без нього, додавши до моделі ефект мультиплікативної взаємодії. Для візуалізації результатів прогресування та регресії САК у групі лікування використовували криві Каплана — Мейєра.
Результати
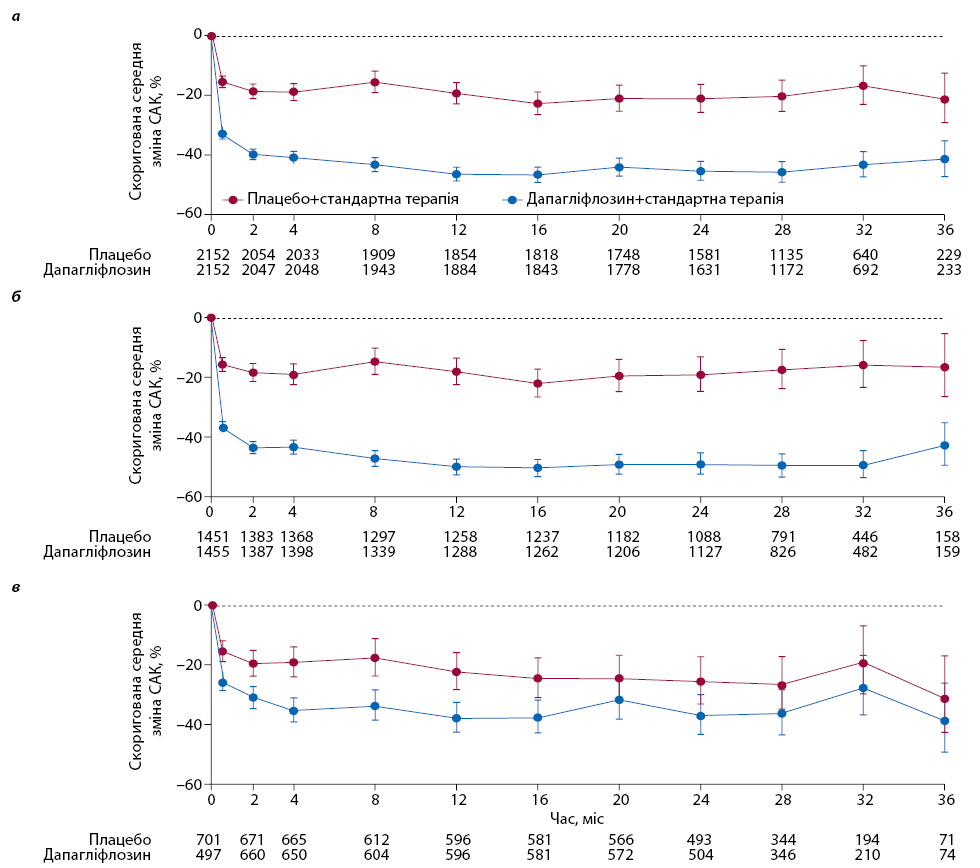
У період 02.02.2017–03.04.2020 р. набрано 4304 пацієнти, яких випадковим чином розподілили для прийому дапагліфлозину (n=2152) або плацебо (n=2152). Спостереження тривало в середньому 2,4 року (МР 2,0–2,7). Середнє САК на початку дослідження становило 949 мг/г (МР 477–1885; 107 мг/ммоль, МР 53,9–213): 965 мг/г (МР 472–1903) у групі дапагліфлозину та 934 мг/г (МР 482–1868) — у групі плацебо. У 2079 (48%) пацієнтів початковий рівень САК становив >1000 мг/г. Порівняно з учасниками з нижчим рівнем САК, особи з вищим базовим САК були молодшими та частіше мали ЦД 2-го типу. У підгрупі з вищим САК також відмічали вищий АТ, нижчу рШКФ та нижчий рівень гемоглобіну. Вихідні характеристики були подібними між групами (таблиця). Порівняно з плацебо середні відсоткові зміни САК становили –26,5% (95% ДІ –22,1…–30,9; p<0,0001) при прийомі дапагліфлозину вже на 2-му тижні. Це зниження САК зберігалося до кінця спостереження. Беручи до уваги всі подальші вимірювання САК, середні геометричні відсоткові зміни САК під час спостереження становили –29,3% (95% ДІ –33,1…–25,2; p<0,0001) відносно плацебо (рис. 1).
Таблиця. Вихідні характеристики учасників дослідження
| Показник | САК ≤1000 мг/г | САК >1000 мг/г | ||||
|---|---|---|---|---|---|---|
| Дапагліфлозин (n=1104) | Плацебо (n=1121) | Загалом (n=2225) | Дапагліфлозин (n=1048) | Плацебо (n=1031) | Загалом (n=2079) | |
| Вік, роки | 62,6 (12,3) | 62,8 (12,1) | 62,7 (12,2) | 61,0 (11,8) | 60,8 (12,2) | 60,9 (12,0) |
| Стать: | ||||||
|
351 (31,8%) | 372 (33,2%) | 723 (32,5%) | 358 (34,2%) | 344 (33,4%) | 702 (33,8%) |
|
753 (68,2%) | 749 (66,8%) | 1502 (67,5%) | 690 (65,8%) | 687 (66,6%) | 1377 (66,%) |
| Раса: | ||||||
|
602 (54,5%) | 636 (56,7%) | 1238 (55,6%) | 522 (49,8%) | 530 (51,4%) | 1052 (50,6%) |
|
55 (5,0%) | 49 (4,4%) | 104 (4,7%) | 49 (4,7%) | 38 (3,7%) | 87 (4,2%) |
|
383 (34,7%) | 377 (33,6%) | 760 (34,2%) | 366 (34,9%) | 341 (33,1%) | 707 (34,0%) |
|
64 (5,8%) | 59 (5,3%) | 123 (5,5%) | 111 (10,6%) | 122 (11,8%) | 233 (11,2%) |
| Маса тіла, кг | 81,8 (20,1) | 82,2 (20,8) | 82,0 (20,5) | 81,1 (20,1) | 81,8 (21,0) | 81,5 (20,6) |
| Індекс маси тіла, кг/м2 | 29,4 (6,0) | 29,6 (6,2) | 29,5 (6,1) | 29,4 (6,0) | 29,7 (6,3) | 29,6 (6,2) |
| Артеріальний тиск, мм рт. ст.: | ||||||
|
133,9 (16,6) | 134,6 (16,6) | 134,2 (16,6) | 139,8 (17,8) | 140,5 (17,6) | 140,1 (17,7) |
|
76,3 (10,6) | 76,4 (10,1) | 76,4 (10,4) | 78,7 (10,6) | 78,7 (10,3) | 78,7 (10,4) |
| HbA1c, % | 7,0 (1,7) | 6,9 (1,6) | 7,0 (1,7) | 7,1 (1,7) | 7,2 (1,8) | 7,2 (1,7) |
| рШКФ, мл/хв/1,73 м2 | 44,2 (12,1) | 43,7 (12,4) | 44,0 (12,2) | 42,2 (12,5) | 42,2 (12,4) | 42,2 (12,4) |
| Гемоглобін, г/л | 129,9 (17,2) | 129,8 (17,4) | 129,8 (17,3) | 127,3 (19,0) | 125,9 (18,5) | 126,6 (18,8) |
| Сироватковий калій, мг-екв/л | 4,6 (0,5) | 4,6 (0,6) | 4,6 (0,5) | 4,7 (0,6) | 4,7 (0,6) | 4,7 (0,6) |
| САК, мг/г | 480 (318–692) | 495 (337–703) | 488 (326–698) | 1933 (1373–2907) | 1931 (1380–2920) | 1931 (1377–2910) |
| ЦД 2-го типу | 714 (64,7%) | 719 (64,1%) | 1433 (64,4%) | 741 (70,7%) | 732 (71,0%) | 1473 (70,9%) |
| Кардіоваскулярні захворювання | 401 (36,3%) | 414 (36,9%) | 815 (36,6%) | 412 (39,3%) | 383 (37,1%) | 795 (38,2%) |
| Серцева недостатність | 110 (10,0%) | 127 (11,3%) | 237 (10,7%) | 125 (11,9%) | 106 (10,3%) | 231 (11,1%) |
| Попередній прийом ліків: | ||||||
|
362 (32,8%) | 362 (32,3%) | 724 (32,5%) | 311 (29,7%) | 319 (30,9%) | 630 (30,3%) |
|
720 (65,2%) | 737 (65,7%) | 1457 (65,5%) | 724 (69,1%) | 689 (66,8%) | 1413 (68,0%) |
|
459 (41,6%) | 483 (43,1%) | 942 (42,3%) | 469 (44,8%) | 471 (45,7%) | 940 (45,2%) |
| Статини | 692 (62,7%) | 715 (63,8%) | 1407 (63,2%) | 703 (67,1%) | 684 (66,3%) | 1387 (66,7%) |
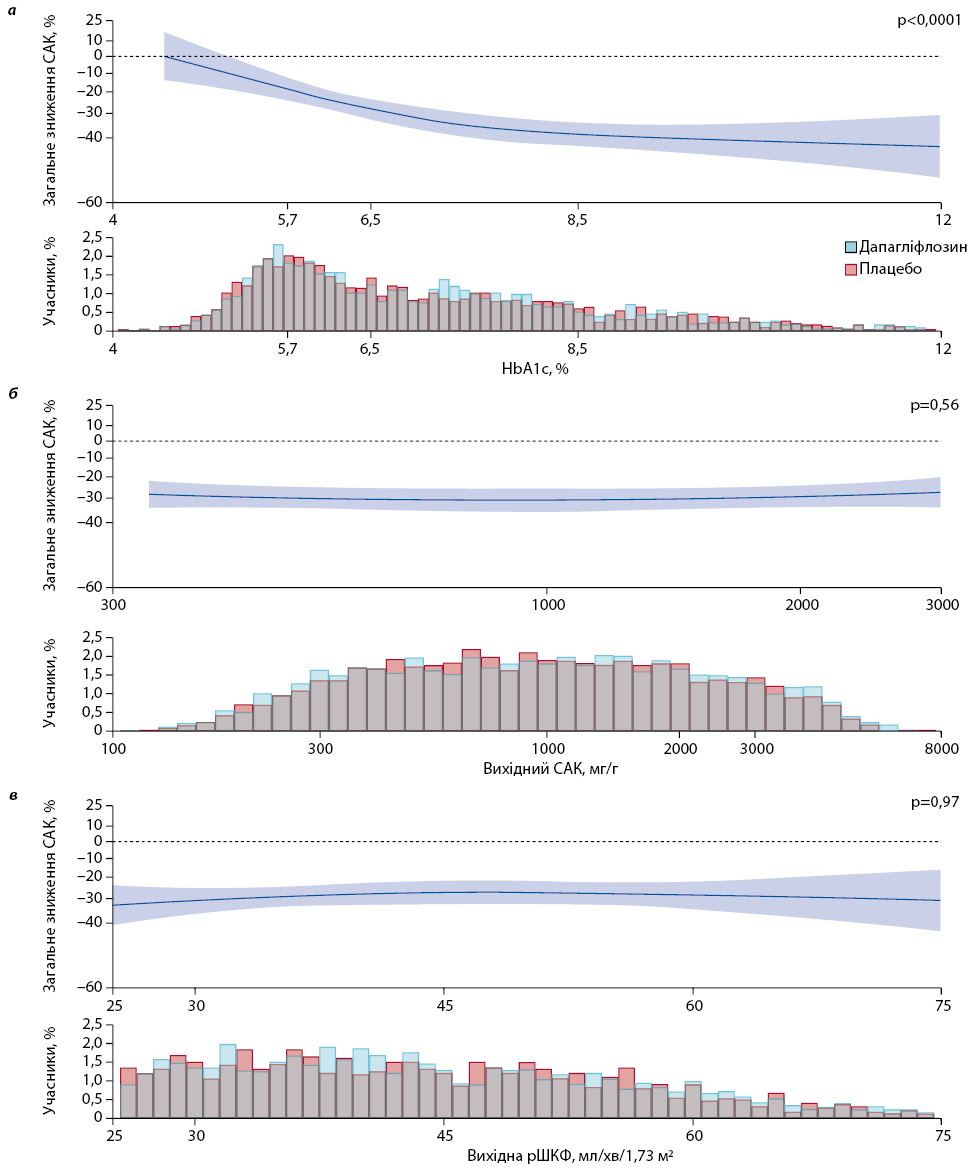
Вплив дапагліфлозину на САК порівняно з плацебо був більшим у пацієнтів із діабетичною нефропатією порівняно з іншими причинами ХХН (рис. 2). Аналіз за категоріями глікемічного контролю (нормоглікемічний стан, переддіабет, ЦД 2-го типу з HbA1c ≥6,5…<8,5% і ЦД 2-го типу з HbA1c ≥8,5%) показав більш виражений ефект дапагліфлозину на САК у пацієнтів із гіршим глікемічним контролем (див. рис. 2). Додатковий аналіз продемонстрував більш виражений ефект дапагліфлозину при вищому вихідному рівні HbA1c (рис. 3). Ефект дапагліфлозину на САК узгоджений у всьому спектрі вихідної рШКФ (<45 і ≥45 мл/хв/1,73 м²) і САК (≤1000 та >1000 мг/г; див. рис. 2 та 3).
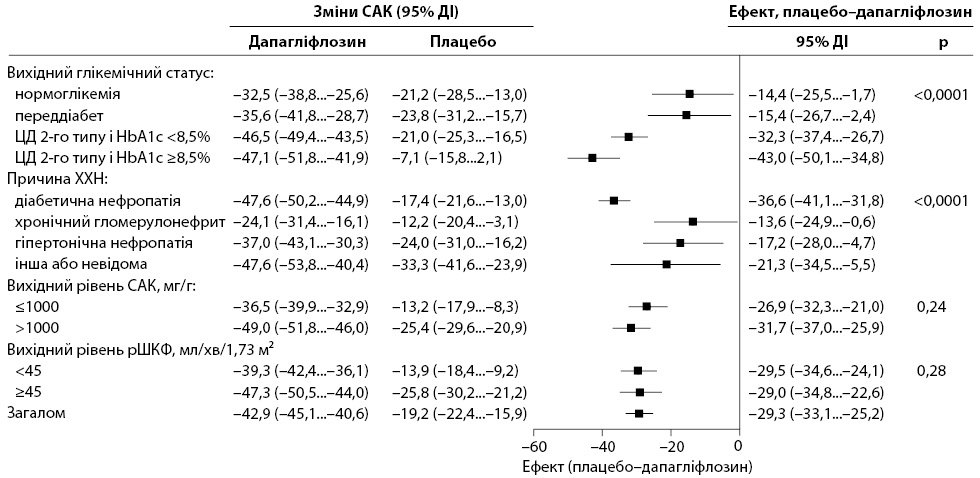
Лікування дапагліфлозином суттєво підвищувало вірогідність регресу САК. Серед 3860 пацієнтів із вихідним САК ≥300 мг/г у групі дапагліфлозину відмічали регрес альбумінурії порівняно з групою плацебо (ВР 1,81; 95% ДІ 1,60–2,05), що відповідало достовірному регресу на 81% у пацієнтів, які отримували дапагліфлозин 10 мг до лікування на фоні стандартної терапії. Лікування дапагліфлозином суттєво підвищувало ймовірність регресу САК у пацієнтів із ЦД 2-го типу (ВР 2,06; 95% ДІ 1,78–2,39) та без нього (ВР 1,33; 95% ДІ 1,07–1,66); ефект був значно більш вираженим у пацієнтів із ЦД 2-го типу (p=0,0011). При цьому лікування дапагліфлозином значно знижувало ймовірність прогресування альбумінурії. Серед 3820 пацієнтів із САК <3000 мг/г на вихідному етапі лише у 95 пацієнтів, які отримували дапагліфлозин, виявлено прогресування альбумінурії до нефротичного діапазону ≥3000 мг/г порівняно з 215 пацієнтами, які отримували плацебо (ВР 0,41, 95% ДІ 0,32–0,52), що відповідає достовірному зниженню ВР розвитку прогресування альбумінурії на 59%. Вплив дапагліфлозину на прогресування альбумінурії суттєво не відрізнявся у пацієнтів із ЦД 2-го типу (ВР 0,39; 95% ДІ 0,29–0,51) та без нього (ВР 0,50; 95% ДІ 0,30–0,82; p=0,40). У групі плацебо САТ і ДАТ залишався стабільним протягом тривалого часу. У групі дапагліфлозину САТ і ДАТ знизився через 2 тиж, і це зниження зберігалося протягом усього періоду спостереження. Порівняно з плацебо дапагліфлозин знизив САТ і ДАТ на 2,9 (95% ДІ 2,3–3,6; p<0,0001) і 1,0 мм рт.ст. (95% ДІ 0,6–1,4; p<0,0001). Не виявлено доказів того, що зниження САТ та ДАТ при застосуванні дапагліфлозину порівняно з плацебо відрізнялося у пацієнтів із ЦД 2-го типу (3,2 мм рт.ст., 95% ДІ 2,5–4,0 та 0,8 мм рт.ст., 95% ДІ 0,4–1,3 відповідно) порівняно з пацієнтами без ЦД (2,3 мм рт.ст., 95% ДІ 1,2–3,4 і 1,4 мм рт.ст., 95% ДІ 0,7–2,1 відповідно; p=0,17 для САТ та p=0,15 для ДАТ). Зміни САТ порівняно з вихідним рівнем на 2-му тижні слабко корелювали з 2-тижневими змінами САК у групах дапагліфлозину та плацебо (коефіцієнт кореляції Пірсона 0,167 та 0,133 відповідно).
Відмічено, що більш різке зниження рШКФ через 2 тиж після випадкового розподілу значною мірою пов’язане з більшим зниженням САК на 14-й день (β=0,25; p<0,0001) (рис. 4а). Цей ефект також виявлено у групі плацебо (β=0,18; p<0,0001) (рис. 4б). У групі дапагліфлозину даний зв’язок був подібним у пацієнтів із ЦД 2-го типу та без нього, хоча відмічено більш значне зниження рШКФ у пацієнтів із ЦД 2-го типу (p=0,32) (рис. 4в). У групі плацебо зв’язок також був подібним у пацієнтів із ЦД 2-го типу та без нього (рис. 4г).
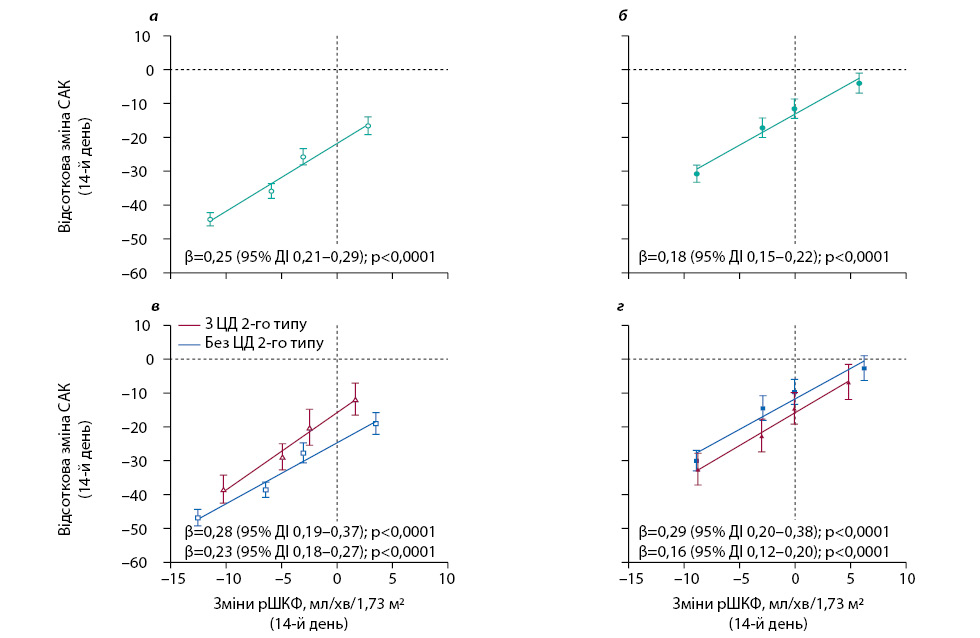
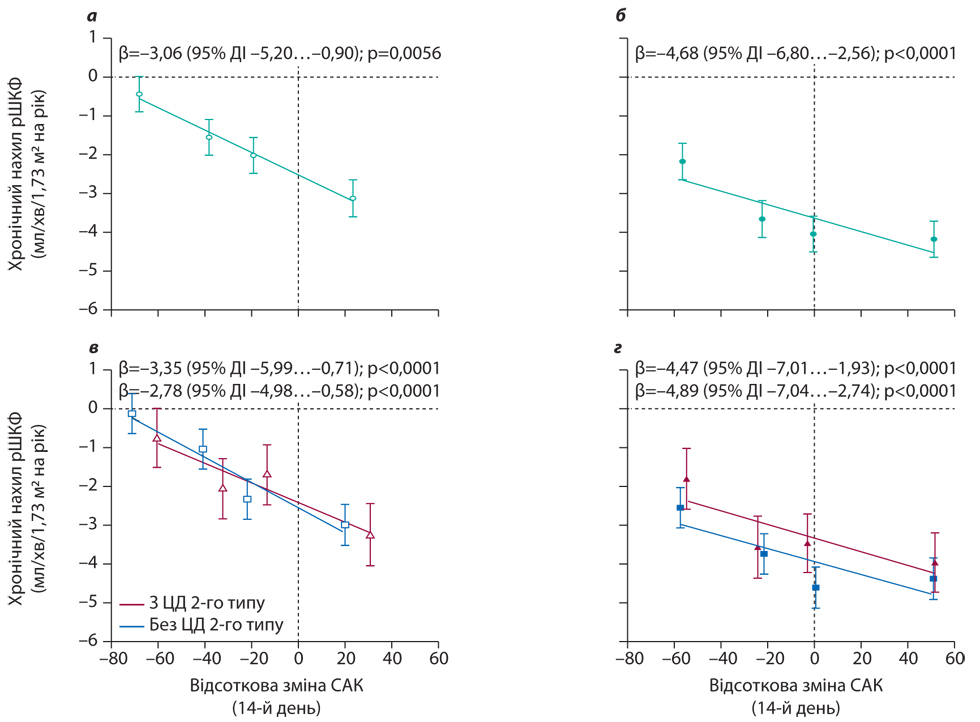
При дослідженні змін САК від вихідного рівня протягом перших 2 тиж дослідження з подальшою швидкістю зниження рШКФ під час підтримувальної терапії дапагліфлозином відмічали зворотну кореляцію, так що більші зниження САК на 2-му тижні асоціювалися з менш різким зниженням рШКФ з часом (β=–3,06; p=0,0056; рис. 5а). Аналіз у підгрупах свідчить, що ця кореляція наявна у пацієнтів із ЦД 2-го типу та без нього (β=–2,78; p<0,0001 та β=–3,35; p<0,0001 відповідно; рис. 5в), хоча у пацієнтів із ЦД 2-го типу зафіксоване більше зниження САК на 2-му тижні. Зв’язок між ранніми змінами САК і довгостроковим зниженням рШКФ також був очевидним у пацієнтів, випадково розподілених на прийом плацебо, але сила цього зв’язку була слабшою порівняно з пацієнтами, випадково розподіленими на прийом дапагліфлозину (р<0,0001; рис. 5б, г). Результати були по суті подібними при повторних аналізах змін показника САК від вихідного рівня до 4-го місяця.
Обговорення
У попередніх дослідженнях доведено, що іНЗКТГ‑2 зменшують вираженість альбумінурії у пацієнтів із ЦД 2-го типу [11]. У представленому дослідженні розширено ці дані; показано, що дапагліфлозин знижує альбумінурію у пацієнтів із ХХН незалежно від глікемічного статусу. Дапагліфлозин значно підвищує імовірність регресії до нормо- або мікроальбумінурії та знижує ймовірність прогресування до більш тяжких ступенів альбумінурії. Крім того, показано, що раннє зниження рШКФ після початку застосування дапагліфлозину пов’язане з раннім зниженням альбумінурії. Нарешті раннє зниження альбумінурії пов’язане зі зменшенням довгострокового зниження рШКФ, особливо у пацієнтів, які отримували дапагліфлозин. У сукупності ці результати підтверджують властивості дапагліфлозину знижувати альбумінурію у пацієнтів із ХХН і підкреслюють важливість моніторингу альбумінурії після початку лікування дапагліфлозином.
У пацієнтів, які отримували дапагліфлозин, зниження альбумінурії приблизно на 30% досягалося вже через 2 тиж після початку терапії і зберігалося протягом тривалого часу. Зміни показників альбумінурії були більш вираженими у пацієнтів із ЦД 2-го типу. Вплив дапагліфлозину на альбумінурію у пацієнтів із ХХН без ЦД оцінювали раніше лише у двох дослідженнях [12, 13]. У рандомізованому відкритому пілотному дослідженні показано зниження протеїнурії на 10% у 10 пацієнтів із фокально-сегментарним гломерулосклерозом [12]. В іншому подвійному сліпому перехресному дослідженні за участю 53 пацієнтів із ХХН без ЦД 2-го типу порівняння дапагліфлозину з плацебо продемонструвало середнє геометричне зниження альбумінурії на 17% [13]. Однак відносно невеликий розмір вибірки та великий ДІ не виключали можливості більшого впливу на альбумінурію. У більшій підгрупі пацієнтів із ХХН в дослідженні DAPA-CKD з вищою точністю виявлено вплив дапагліфлозину на зниження альбумінурії.
Мінімальний поріг ефекту зниження альбумінурії, що забезпечує високу ймовірність клінічної користі щодо покращення стану нирок, за оцінками, становить 20–30% [5]. Дапагліфлозин знижував альбумінурію на 35% у пацієнтів із ЦД 2-го типу та ризик ниркової комбінованої кінцевої точки на 36% у цих пацієнтів [14]. Ці дані узгоджуються із запропонованими пороговими значеннями альбумінурії для того, щоб зробити висновок про клінічну користь, а також свідчать про те, що раннє зниження альбумінурії після початку прийому іНЗКТГ‑2 може пояснити значну частку тривалого захисного ефекту щодо нирок [15, 16]. Дапагліфлозин суттєво знизив ризик комбінованого ниркового результату на 50% і покращував виживаність пацієнтів із ХХН [14]. Інші потенційні механізми, опосередковані неальбумінуричними шляхами, такі як зменшення навантаження на канальці, зниження гіпоксії, збільшення здатності доставки кисню, метаболічні і, можливо, протизапальні та протифіброзні ефекти, можуть пояснити довгострокові захисні ефекти дапагліфлозину на нирки у пацієнтів з ХХН, хоча більшість із цих ефектів описано в доклінічних дослідженнях [17–19].
Значний ефект щодо зниження альбумінурії у пацієнтів із ХХН та ЦД 2-го типу можна пояснити більшим зниженням внутрішньоклубочкового тиску. іНЗКТГ‑2 підвищують індукований глюкозою осмотичний діурез і натрійурез і викликають гостре зворотне зниження клубочкової фільтрації [20, 21]. Ця картина зворотного зв’язку свідчить про те, що зазначені препарати зменшують вираженість внутрішньоклубочкової гіпертензії [22, 23]. Ініціальне зниження рШКФ прямо корелювало зі зниженням альбумінурії в учасників DAPA-CKD [24]. Цікаво, що ініціальне зниження рШКФ було номінально більшим у пацієнтів із ЦД 2-го типу, що свідчить про більш значне зниження внутрішньоклубочкового тиску і зумовлює більше зниження альбумінурії.
У дослідженні DAPA-CKD показано, що більш значне зниження альбумінурії протягом перших 2 тиж лікування дапагліфлозином пов’язане з меншою швидкістю подальшого зниження функції нирок. Цей зв’язок був постійним у пацієнтів із ХХН незалежно від глікемічного статусу. Попередні дослідження інгібіторів ренін-ангіотензин-альдостеронової системи показали, що ранні зміни альбумінурії корелюють зі зниженням рШКФ і пояснюють значну частку довгострокового захисного ефекту на результати з боку нирок [25, 26]. У представленому дослідженні ці дані поширено на велику сучасну популяцію осіб, які отримували дапагліфлозин 10 мг (іНЗКТГ‑2). Результати свідчать, що більш значне зниження альбумінурії у пацієнтів із ЦД 2-го типу може пояснити більший вплив дапагліфлозину на швидкість зниження рШКФ у цих пацієнтів [24].
Дапагліфлозин знижував САТ і ДАТ порівняно з плацебо. Величина цього ефекту не відрізнялася між пацієнтами з ЦД 2-го типу та без нього та узгоджується з даними попередніх досліджень дапагліфлозину у пацієнтів із ХХН [11, 13, 27]. Слабка кореляція між змінами САК та АТ свідчить про те, що помірне зниження АТ не є причиною ефекту дапагліфлозину щодо зниження САК.
У пацієнтів із хронічним гломерулонефритом ефект дапагліфлозину щодо зниження альбумінурії може відрізнятися залежно від основної причини захворювання нирок. Наприклад, у пацієнтів із IgA-нефропатією зниження альбумінурії при застосуванні дапагліфлозину виявилося більш вираженим та подібним до такого у пацієнтів із ЦД 2-го типу [28].
Висновок
Таким чином, у пацієнтів із ХХН дапагліфлозин значно знижував альбумінурію, при цьому ефект був достовірним вже на 2-му тижні терапії. Ренопротекторні ефекти дапагліфлозину на кінцеві клінічні точки (прогресування ХХН, серцево-судинна смерть, госпіталізація з приводу серцевої недостатності, смертність від усіх причин) у пацієнтів із ХХН, з різним впливом на альбумінурію, свідчать, що захисні ефекти дапагліфлозину у пацієнтів із ХХН можуть бути опосередковані різними шляхами, а саме прямим впливом на клубочок — зниження внутрішньоклубочкового тиску, зменшення проявів фіброзу, зниження гіпоксії та інші, що впливає на ренопротекцію на фоні застосування дапагліфлозину 10 мг.
Список використаної літератури
- Fox C.S., Matsushita K., Woodward M. et al. (2012) Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without diabetes: a meta-analysis. Lancet, 380: 1662–1673.
- Roscioni S.S., Lambers Heerspink H.J., de Zeeuw D. (2014) Microalbuminuria: target for renoprotective therapy PRO. Kidney Int., 86: 40–49.
- Petrykiv S.I., Laverman G.D., de Zeeuw D., Heerspink H.J.L. (2017) The albuminuria-lowering response to dapagliflozin is variable and reproducible among individual patients. Diabetes Obes. Metab., 19: 1363–1970.
- von Scholten B.J., Persson F., Rosenlund S. et al. (2017) The effect of liraglutide on renal function: a randomized clinical trial. Diabetes Obes. Metab., 19: 239–247.
- Heerspink H.J.L., Greene T., Tighiouart H. et al. (2019) Change in albuminuria as a surrogate endpoint for progression of kidney disease: a meta-analysis of treatment effects in randomised clinical trials. Lancet Diabetes Endocrinol., 7: 128–139.
- Petrykiv S., Sjöström C.D., Greasley P.J. et al. (2017) Differential effects of dapagliflozin on cardiovascular risk factors at varying degrees of renal function. Clin. J. Am. Soc. Nephrol., 12: 751–759.
- Barnett A.H., Mithal A., Manassie J. et al. (2014) Efficacy and safety of empagliflozin added to existing antidiabetes treatment in patients with type 2 diabetes and chronic kidney disease: a randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol., 2: 369–384.
- Perkovic V., Jardine M.J., Neal B. et al. (2019) Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N. Engl. J. Med., 380: 2295–2306.
- Heerspink H.J.L., Stefánsson B.V., Correa-Rotter R. et al. (2020) Dapagliflozin in patients with chronic kidney disease. N. Engl. J. Med., 383: 1436–1446.
- Heerspink H.J.L., Stefansson B.V., Chertow G.M. et al. (2020) Rationale and protocol of the dapagliflozin and prevention of adverse outcomes in chronic kidney disease (DAPA-CKD) randomized controlled trial. Nephrol. Dial. Transplant., 35: 274–282.
- Pollock C., Stefánsson B., Reyner D. et al. (2019) Albuminuria-lowering effect of dapagliflozin alone and in combination with saxagliptin and effect of dapagliflozin and saxagliptin on glycaemic control in patients with type 2 diabetes and chronic kidney disease (DELIGHT): a randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol., 7: 429–441.
- Rajasekeran H., Reich H.N., Hladunewich M.A. et al. (2018) Dapagliflozin in focal segmental glomerulosclerosis: a combined human-rodent pilot study. Am. J. Physiol. Renal Physiol., 314: F412–F422.
- Cherney D.Z.I., Dekkers C.C.J., Barbour S.J. et al. (2020) Effects of the SGLT2 inhibitor dapagliflozin on proteinuria in non-diabetic patients with chronic kidney disease (DIAMOND): a randomised, double-blind, crossover trial. Lancet Diabetes Endocrinol., 8: 582–593.





