Актуальність
20–22 травня 2021 р. відбулася науково-практична конференція з міжнародною участю «Актуальні питання сучасної діабетології», програма якої включала обговорення таких важливих тем сучасної діабетології, як:
- успіхи та невирішені питання сучасної діабетології;
- гострі та хронічні ускладнення цукрового діабету (ЦД);
- супутні захворювання у хворих на ЦД;
- клінічний досвід діагностики та лікування ЦД;
- сучасні можливості діагностики та лікування ЦД та його ускладнень.
 У рамках першого дня конференції Борис Маньковський, доктор медичних наук, професор, член‑кореспондент Національної академії медичних наук України, завідувач кафедри діабетології Національного університету охорони здоров’я України (НУОЗ) імені П.Л. Шупика, виступив з доповіддю «Чи є альтернатива базисно-болюсній інсулінотерапії при ЦД 2-го типу?», фокус якої стосувався сучасних можливостей інсулінотерапії ЦД 2-го типу. Як відомо, ЦД 2-го типу є прогресуючим захворюванням, саме тому на певних етапах його розвитку у деяких пацієнтів (30–40%) виникає потреба у призначенні інсулінотерапії. Відповідно до останнього гайдлайну Американської діабетичної асоціації (American Diabetes Association — ADA) 2021 р. при менеджменті пацієнтів з ЦД 2-го типу рекомендовано дотримуватися загальних глікемічних цілей, які підходять для більшості невагітних дорослих (таблиця) [1]. І якщо порівнювати оновлений документ з редакціями гайдлайну минулих років, то стає зрозумілим, що глікемічні цілі є доволі сталими вже значну кількість часу, і в останні роки лише з’явилися два нових показники: час у цільовому діапазоні (TIR) та час нижче цільового діапазону (TBR).
У рамках першого дня конференції Борис Маньковський, доктор медичних наук, професор, член‑кореспондент Національної академії медичних наук України, завідувач кафедри діабетології Національного університету охорони здоров’я України (НУОЗ) імені П.Л. Шупика, виступив з доповіддю «Чи є альтернатива базисно-болюсній інсулінотерапії при ЦД 2-го типу?», фокус якої стосувався сучасних можливостей інсулінотерапії ЦД 2-го типу. Як відомо, ЦД 2-го типу є прогресуючим захворюванням, саме тому на певних етапах його розвитку у деяких пацієнтів (30–40%) виникає потреба у призначенні інсулінотерапії. Відповідно до останнього гайдлайну Американської діабетичної асоціації (American Diabetes Association — ADA) 2021 р. при менеджменті пацієнтів з ЦД 2-го типу рекомендовано дотримуватися загальних глікемічних цілей, які підходять для більшості невагітних дорослих (таблиця) [1]. І якщо порівнювати оновлений документ з редакціями гайдлайну минулих років, то стає зрозумілим, що глікемічні цілі є доволі сталими вже значну кількість часу, і в останні роки лише з’явилися два нових показники: час у цільовому діапазоні (TIR) та час нижче цільового діапазону (TBR).
Таблиця. Цілі глікемічного контролю для більшості пацієнтів з ЦД 2-го типу
| Глікемічні цілі для більшості пацієнтів з ЦД 2-го типу | |
|---|---|
| Параметр | Ціль терапії |
| Рівень глюкози в плазмі крові натще | 4,4–7,2 ммоль/л |
| Рівень глюкози в плазмі крові через 2 год після їди | <10 ммоль/л |
| HbA1c | ≤7% |
| TIR | >70% |
| TBR | <4% |
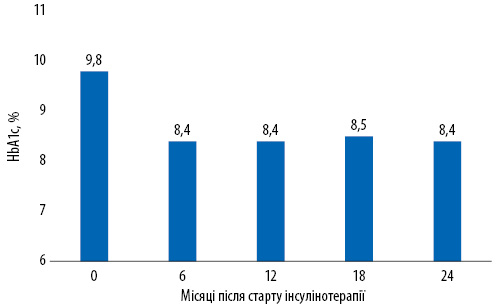
Відомо, що навіть короткий період гіперглікемії чинить негативний вплив на підвищення ризику розвитку мікро- та макроваскулярних ускладнень, саме тому вкрай важливо досягнути компенсації ЦД, однак для більшості пацієнтів глікемічні цілі є недосяжними, і декомпенсованими залишаються значна частина хворих на ЦД, лише в 64,2% випадків пацієнти досягають глікемічних цілей — рівень глікозильованого гемоглобіну (HbA1c) ≥7,0% [2, 3]. Таким чином, пацієнти з ЦД 2-го типу часто залишаються декомпенсованими. Цей факт пов’язаний з вибором неправильних стратегій лікування, зокрема клініцисти часто не призначають вчасно інсулін. Результати дослідження A.G. Smith та співавторів (2006), в якому були проаналізовані дані амбулаторних центрів, продемонстрували, що інсулінотерапію зазвичай призначають досить пізно при рівні HbA1c >9,8% (рис. 1) [4]. Однак важливо розуміти, що призначення інсулінотерапії не дає гарантій щодо досягнення контролю ЦД. Так, результати цього ж дослідження свідчать, що навіть після призначення інсуліну рівень HbA1c знижувався до 8,4%, після чого продовжував залишатися в межах цього значення протягом наступних місяців (6–24 міс). Ці дані показують, що наявна проблема у виборі стратегій лікування ЦД, зокрема, після призначення інсуліну клініцисти часто вважають своє завдання щодо лікування пацієнта виконаним. Проте призначення інсуліну є лише половиною справи, оскільки надалі пацієнт з ЦД потребує інтенсифікації інсулінотерапії з підбором найбільш оптимальної дози інсуліну.
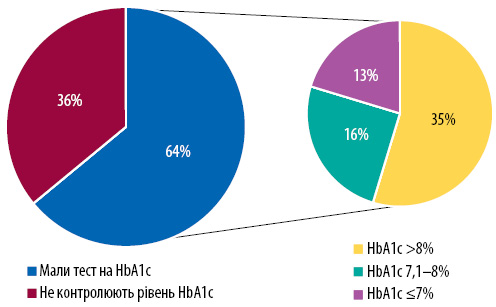
Сьогодні наявний прогрес у досягненні контролю рівня HbA1c серед хворих на ЦД 2-го типу, які отримують інсулінотерапію. Так, за даними 2018 р., 64% пацієнтів із ЦД 2-го типу досягли контролю HbA1c, з яких 13% мали рівень HbA1c ≤7%, а 15% — 7,1–8% (рис. 2) [5]. Окрім того, при менеджменті хворих на ЦД 2-го типу важливо пам’ятати, що ЦД — мультифакторне захворювання, яке має досить складний патогенез, включно з порушенням дії/вироблення інсуліну, порушенням глюкагонової відповіді, дефіцитом інкретинів, підвищенням реабсорбції глюкози, підвищенням продукції глюкози в печінці та порушеннями з боку центру ситості (рис. 3). Розуміння шляхів патогенезу ЦД важливо для клініцистів, оскільки кожен з антигіперглікемічних препаратів (АГГП) має свою ланку впливу і, відповідно, включення АГГП у алгоритм лікування ЦД потребує від клініциста розуміння механізму їх дії.

Враховуючи ці дані, 15 січня 2021 р. в цифровому форматі відбулася національна нарада експертів, присвячена питанням оптимізації та безпеки лікування пацієнтів із ЦД 2-го типу, логічним продовженням якої стало створення резолюції Національної наради експертів «Нова парадигма лікування ЦД 2-го типу», в якій експертами були надані рекомендації щодо менеджменту пацієнтів з ЦД.
Резолюції Національної наради експертів «Нова парадигма лікування ЦД 2-го типу»:
- враховуючи, що ключовими ланками патогенезу ЦД 2-го типу є не лише порушення функції β-клітин підшлункової залози та інсулінорезистентність, а й наявність інкретинового дефекту, застосування фіксованої комбінації базального інсуліну ультратривалої дії та аналога аГПП-1 забезпечує комплексний вплив майже на всі складові патофізіологічного процесу;
- при призначенні базисно-болюсної інсулінотерапії хворому на ЦД 2-го типу і лікар, і пацієнт мають низку проблем. З боку лікаря — збільшення часу на навчання пацієнта відповідному режиму харчування і фізичного навантаження, необхідність виконання додаткового контролю рівня глюкози в крові з урахуванням можливості розвитку прихованих і явних гіпоглікемій, а також імовірне збільшення маси тіла внаслідок додавання болюсного інсуліну. З боку пацієнта — незручна й обтяжлива схема лікування, що не відповідає його ритму життя внаслідок збільшення кількості ін’єкцій і частоти самоконтролю рівня глюкози, збільшення маси тіла, підвищення ризику гіпоглікемії;
- на відміну від використання комбінації базального та болюсного інсулінів у складі базисно-болюсної інсулінотерапії, призначення фіксованої комбінації базального інсуліну ультратривалої дії, а також аналога аГПП-1 асоціюється з нижчим ризиком гіпоглікемії та забезпечує більшу комплаєнтність пацієнтів за рахунок зменшення кількості ін’єкцій. Додатково цукрознижувальний ефект фіксованої комбінації базального інсуліну ультратривалої дії та аналога аГПП-1 не поступається базисно-болюсній інсулінотерапії при застосуванні нижчої дози інсуліну;
- призначення фіксованої комбінації базального інсуліну й аналога аГПП-1 може бути першою лінією інтенсифікації терапії, коли базального інсуліну недостатньо для контролю ЦД. Така комбінація надасть змогу вплинути на ключові патогенетичні ланки прогресування ЦД 2-го типу та його ускладнень. Крім того, такий варіант лікування пов’язаний з меншою кількістю ін’єкцій і нижчим ризиком гіпоглікемій порівняно з вільною комбінацією аналога аГПП-1, базального інсуліну та з базисно-болюсною інсулінотерапією;
- імплементація цього варіанта інтенсифікації лікування ЦД 2-го типу в Україні потребує проведення науково-практичних семінарів, присвячених потребі покращення контролю глікемії у лікуванні ЦД 2-го типу, та розроблення методичних рекомендацій із практичних аспектів застосування фіксованої комбінації базального інсуліну ультратривалої дії та аналога аГПП-1.
Таким чином, призначення інсулінотерапії потребує її інтенсифікації, що передбачає застосування комбінації декількох АГГП (рис. 4). І пріоритетними при інтенсифікації інсулінотерапії є її ефективність і мінімізація небажаних явищ — гіпоглікемії та збільшення маси тіла. Можливі режими інтенсифікації гіпоглікемічної терапії: базал-плюс, базал-болюс, премікс, фіксована комбінація базального інсуліну та аГПП-1. Окрім того, необхідно пам’ятати, що пацієнти з ЦД 2-го типу — переважно особи літнього віку, які на додаток до ЦД мають також когнітивні порушення різного ступеня вираженості, що ускладнює дотримання ними складних схем антигіперглікемічної терапії (АГГТ). Відповідно, інтенсифікація інсулінотерапії має значну кількість бар’єрів, які включають не лише складність щодо дотримання складних режимів інсулінотерапії, а й ризик збільшення маси тіла, розвитку гіпоглікемії та погіршення якості життя [7, 8]. Таким чином, незважаючи на усі клінічні настанови, при недосягненні рекомендованих глікемічних цілей інтенсифікація інсулінотерапії не відбувається, що потребує пошуку альтернативних варіантів її інтенсифікації. Далі спікер зупинився на сучасних альтернативних варіантах інтенсифікації інсулінотерапії.

Список використаної літератури:
- 1. American Diabetes Association (2021) Standards of Medical Care in Diabetes-2021. Diabetes Care; 44 (Suppl. 1): S4–S6. doi: 10.2337/dc21-Srev.
- 2. Unger S., Cunningham S. (2008) Effect of oxygen supplementation on length of stay for infants hospitalized with acute viral bronchiolitis. Pediatrics; 121(3): 470–5. doi: 10.1542/peds.2007-1135.
- 3. American Diabetes Association (2014) Standards of medical care in diabetes—2014. Diabetes Care; 37, Suppl. 1: S14–80. doi: 10.2337/dc14-S014.
- 4. Smith A.G., Russell G., Feldman E.L. et al. (2006) Lifestyle intervention for pre-diabetic neuropathy. Diabetes Care; 29(6): 1294–9. doi: 10.2337/dc06-0224.
- 5. Маньковський Б.М., Кондрацька І.М., Соколова Л.К. (2019) Шляхи поліпшення глікемічного контролю в Україні з урахуванням досвіду референтних країн. Здоров’я України «Діабетологія, Тиреоїдологія, Метаболічні розлади», № 3 (47), жовтень.
- 6. Cernea S., Raz I. (2011) Therapy in the early stage: incretins. Diabetes Care; 34 (Suppl. 2): S264–71. doi: 10.2337/dc11-s223.
- 7. Peyrot M., Barnett A.H., Meneghini L.F. et al. (2012) Insulin adherence behaviours and barriers in the multinational Global Attitudes of Patients and Physicians in Insulin Therapy study. Diabet Med.; 29(5): 682–9. doi: 10.1111/j.1464-5491.2012.03605.x.
- 8. Russell-Jones D., Pouwer F., Khunti K. (2018) Identification of barriers to insulin therapy and approaches to overcoming them. Diabetes Obes. Metab.; 20(3): 488–496. doi: 10.1111/dom.13132.





