Всесвітній день нирки
Відкриваючи науково-практичну конференцію, зі вступним словом до присутніх звернувся Микола Колесник, президент Української асоціації нефрологів і фахівців з трансплантації нирки, який привітав з 15-ю річницею Всесвітнього дня нирки, що відзначається щорічно у другий четвер березня. Так, у березні 2006 р. почав свою історію Всесвітній день нирки (World Kidney Day), який було запроваджено за ініціативою Світової асоціації нефрологів (International Society of Nephrology — ISN) та Американської асоціації нефрологів (American Society of Nephrology — ASN). Основна мета Всесвітнього дня нирки полягає у приверненні уваги міжнародних і державних організацій охорони здоров’я, а також політичних структур, здатних сприяти розвитку системи охорони здоров’я, до проблеми зростання кількості людей із захворюваннями нирок.
Цьогорічний захід присвячений проблемі захворювання нирок та способів її вирішення. Відповідно до сучасної парадигми медична допомога загалом, включно зі спеціалізованою медичною допомогою, повинна бути прецезійною, тобто пацієнтоорієнтованою. Ідея орієнтованості на пацієнта полягає у тому, що медична допомога надається пацієнту залежно від його потреб, уподобань, обставин та добробуту [1]. У свою чергу, Всесвітня організація охорони здоров’я (ВООЗ) визначає розширення прав і можливостей пацієнтоорієнтованості як «процес», завдяки якому пацієнт має право отримувати кращий контроль над рішеннями та діями клініциста, що впливають на його здоров’я [2].
Основні компоненти розширення можливостей пацієнта:
- розуміння пацієнтом своєї ролі;
- обізнаність пацієнта для поліпшення взаємодії зі своїм лікуючим лікарем;
- навички пацієнта;
- зацікавленість членів родини та близьких пацієнта.
Таким чином, пацієнтоорієнтованість являє собою процес, в якому пацієнт розуміє свою роль та завдяки отриманим за допомогою медичних працівників знань і навичок може виконувати завдання в середовищі, яке визнає спільноту, культурні відмінності та заохочує участь пацієнта [3]. Далі М. Колесник представив першу доповідь конференції «Трансплантаційна нефрологія: час настав».
Сучасна організація трансплантаційної допомоги — мультидисциплінарний комплекс, що охоплює пре-, пери- та посттрансплантаційний період та потребує злагодженої роботи таких фахівців, як претрансплантаційний лікар-нефролог та трансплантаційний нефролог. Основними завданнями трансплантаційних неврологів є забезпечення всіх трьох складових менеджменту пацієнта з трансплантованою ниркою, а саме претрансплантаційний етап, власне трансплантація та посттрансплантаційний етап (рис. 1).

 Модератор заходу Ірина Дудар, доктор медичних наук, професор, завідувач відділу еферентних технологій державної установи (ДУ) «Інститут нефрології НАМН України», виступила з доповіддю, яка стосувалася прогресування діабетичної хвороби нирок (ДХН) з фокусом на можливих терапевтичних мішенях лікування. Спікер зазначила, що ця доповідь буде корисною не лише для нефрологів, а й фахівців інших галузей, зокрема ендокринологів та сімейних лікарів, які несуть основні навантаження щодо лікування хворих з ДХН. Статистичні дані свідчать, що сьогодні цукровий діабет (ЦД) є поширеним у популяції захворюванням, частота якого становить 9–12% у світі, поширеність якого з кожним роком буде лише зростати, особливо в країнах Африки та Азії.
Модератор заходу Ірина Дудар, доктор медичних наук, професор, завідувач відділу еферентних технологій державної установи (ДУ) «Інститут нефрології НАМН України», виступила з доповіддю, яка стосувалася прогресування діабетичної хвороби нирок (ДХН) з фокусом на можливих терапевтичних мішенях лікування. Спікер зазначила, що ця доповідь буде корисною не лише для нефрологів, а й фахівців інших галузей, зокрема ендокринологів та сімейних лікарів, які несуть основні навантаження щодо лікування хворих з ДХН. Статистичні дані свідчать, що сьогодні цукровий діабет (ЦД) є поширеним у популяції захворюванням, частота якого становить 9–12% у світі, поширеність якого з кожним роком буде лише зростати, особливо в країнах Африки та Азії.
У більшості пацієнтів із супутнім ЦД характерним є розвиток такого ускладнення, як ДХН — специфічне ураження нирок, що являє собою хронічну хворобу нирок (ХХН) та є проявом системної васкулопатії, зумовленої порушенням вуглеводного обміну у хворих на ЦД, частота її становить 20–45% у пацієнтів з ЦД 1-го типу та 15–30% у пацієнтів з ЦД 2-го типу. ДХН є дуже частим ускладненням, що характеризується прогресуючим перебігом і спочатку проявляється альбумінурією з подальшим зниженням швидкості клубочкової фільтрації (ШКФ). Іншими, менш поширеними ускладненнями з боку нирок у пацієнтів з ЦД є ішемічна нефропатія частота якої становить 30%, гіпертензивна нефропатія — 20%, токсична нефропатія, що розвивається внаслідок дії лікарських засобів/контрастних речовин, — 15% та інфекції сечовидільної системи, що становлять найбільш поширену групу ускладнень і сягають 60%.
Особливість перебігу діабетичної нефропатії полягає у тому, що наявний значний безсимптомний перебіг захворювання, коли хворий навіть не підозрює про ураження нирок. Однак з прогресуванням захворювання та появою таких симптомів, як артеріальна гіпертензія (АГ), зниження ШКФ та зміни в інструментально-лабораторних показниках, стає зрозуміло про наявність діабетичної нефропатії у пацієнта, що свідчить про необхідність надання спеціалізованої медичної допомоги. При цьому, за словами спікера, вкрай важливим є те, що клініцист, який здійснює менеджмент пацієнта з діабетичною нефропатією, обов’язково повинен знати фактори ризику розвитку цієї патології, оскільки саме на них необхідно впливати при призначенні лікування з метою зниження прогресування захворювання та затримки застосування гемодіалізу та необхідності у трансплантації нирок (рис. 2).

Фактори ризику розвитку діабетичної нефропатії:
- рівень протеїнурії;
- компенсація ЦД;
- АТ;
- анемія;
- високий рівень сечової кислоти;
- гіперхолестеринемія;
- гіперкаліємія;
- ацидоз;
- початок лікування.
Модифікуючі фактори ризику розвитку діабетичної нефропатії:
- поганий метаболічний контроль ЦД (гіперглікемія);
- куріння;
- високобілкова дієта і підвищене споживання натрію з їжею;
- інфекція сечових каналів;
- ожиріння;
- вагітність [4].
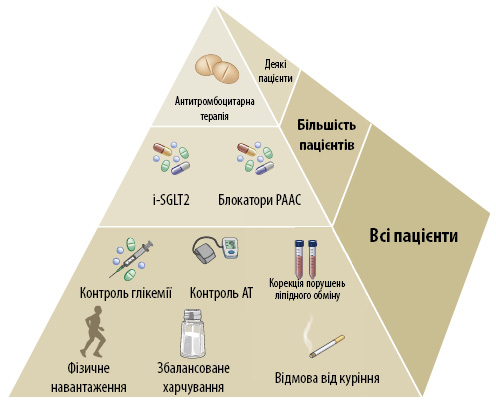
Сучасні рекомендації щодо менеджменту пацієнтів з діабетичною нефропатією стосуються в першу чергу стратегій, спрямованих на управління факторами ризику розвитку цієї патології (рис. 3). Медикаментозна терапія лікування діабетичної нефропатії полягає у призначенні інгібіторів ангіотензинперетворювального ферменту (іАПФ), блокаторів рецепторів ангіотензину ІІ (БРА) у хворих на ЦД із супутньою АГ та альбумінурією (рис. 4). Дозу препаратів слід титрувати до максимально переносимої, яка перебуває у межах схваленого діапазону для кожного з препаратів.
Валентина Савчук, кандидат медичних наук, виступила з доповіддю «Сучасні підходи до корекції гіперглікемії у хворих на ДХН». Відповідно до сучасних рекомендацій управління нирковими та кардіоваскулярними факторами ризику у хворих на ЦД полягає у корекції способу життя, включно з фізичним навантаженням, відмові від шкідливих звичок та контролі рівня глікемії. Глікемічний моніторинг у пацієнтів цієї групи здійснюється за допомогою визначення рівня глікозильованого гемоглобіну (HbA1c).

Рекомендації Товариства KDIGO (Kidney Disease: Improving Global Outcomes, 2020) щодо глікемічного моніторингу
- Робоча група наголошує на важливості проведення визначення рівня HbA1c для моніторингу контролю рівня глікемії у пацієнтів із ЦД та ДХН.
- Моніторинг довгострокового контролю рівня глікемії за допомогою HbA1c 2 рази на рік є доцільним у пацієнтів з ЦД. HbA1c можна вимірювати частіше, зокрема 4 рази на рік, у випадку, якщо цільові значення глікемії не досягнуті, або після зміни антигіперглікемічної терапії (АГГТ).
- Правильність та точність вимірювання HbA1c знижується при ХХН IV–V стадії, особливо серед пацієнтів, які перебувають на діалізі та мають низьку надійність щодо показників вимірювання HbA1c.
- Індикатор контролю рівня глюкози (glucose management indicator — GMI), отриманий на основі даних безперервного моніторингу глюкози (continuous glucose monitoring — СGM), може бути корисним та використовуватися для оцінки глікемії у осіб, у яких HbA1c не відповідає безпосередньо виміряним рівням глюкози в крові або клінічним симптомам.
- Щоденний глікемічний моніторинг за допомогою СGM або самоконтроль рівня глюкози в крові (self-monitoring of blood glucose — SMBG) може допомогти попередити розвиток гіпоглікемії та поліпшити глікемічний контроль при використанні антигіперглікемічних препаратів (АГГП), у пацієнтів з ризиком розвитку гіпоглікемії.
- Для пацієнтів з ЦД 2-го типу та ХХН, які не бажають проводити щоденний глікемічний моніторинг за допомогою СGM або SMBG, слід надавати перевагу АГГП з нижчим ризиком розвитку гіпоглікемії, а також їх слід вводити в дозах, що відповідають рівню ШКФ.
- Пристрої СGM швидко розвиваються та мають велику кількість функцій, що можуть давати переваги для певних груп пацієнтів відповідно до їх цінностей, цілей та вподобань.
Наступний спікер — Людмила Снісар, кандидат медичних наук, старший науковий співробітник ДУ «Інститут нефрології НАМН України, представила доповідь «Грип у хворих на ХХН в умовах пандемії СOVІD-19». Вона зазначила, що, враховуючи пандемію СOVІD-19, грип є актуальною проблемою, оскільки має багато симптомів, подібних до COVID-19. Як відомо, грип — інфекційне, висококонтагіозне захворювання, що передається повітряно-крапельним шляхом, яке проявляється фібрилітетом з різним ступенем системних симптомів (від легкої втоми аж до розвитку дихальної недостатності та смерті). Сучасні дані свідчать, що грип є причиною близько 650 тис. випадків смерті у світі щорічно. За даними CDC (Centers for Disease Control and Prevention — Центри з контролю та профілактики захворювань США) протягом 2019–2020 рр. сезонний грип спричинив 24–62 тис. випадків смерті.
Спільні симптоми для COVID-19 та сезонного грипу:
- лихоманка або відчуття лихоманки/озноб;
- кашель;
- задишка або утруднене дихання;
- втома;
- біль у горлі;
- нежить або закладений ніс;
- міалгія або біль у тілі;
- головний біль;
- симптоми з боку шлунково-кишкового тракту (діарея, блювання).
І хоча COVID-19 і грип викликають респіраторні захворювання та мають схожу клінічну картину, між цими двома вірусами і тим, як вони поширюються, є важливі відмінності (табл. 1). Так, дані літератури свідчать, що COVID-19, на відміну від сезонного грипу, має триваліший інкубаційний період, діти інфікуються рідше за дорослих, а прояви ускладненого перебігу хвороби настають на 2-й тиждень захворювання. Крім того, у серії досліджень описано, що SARS-CoV-2 може викликати коінфекцію з вірусами грипу А та В, що також асоціюється з факторами ризику для пацієнтів, однак дані щодо частоти, тяжкості та ризику розвитку даної коінфекції відсутні [5]. Сьогодні відомо, що найвищий ризик інфікування та розвитку тяжкого перебігу COVID-19 наявний у пацієнтів з коморбідною патологією, включно з ХХН або ДХН (табл. 2).
Таблиця 1. Ключові відмінності між COVID-19 і грипом
| Відмінності в клінічному перебігу сезонного грипу та COVID-19 | |
|---|---|
| Грип | COVID-19 |
| Симптоми зазвичай розвиваються швидше після інфікування (через 1–4 доби) | Поява клінічних симптомів захворювання зазвичай відбувається через 5 діб з моменту інфікування, хоча існують випадки й більш швидкої появи симптомів (через 2 доби або після 14 діб) |
| Найбільш заразними виявляються хворі на грип протягом перших 3–4 діб | Інфікована особа може бути заразною протягом усього періоду (інформація не підтверджена) |
| Ускладнення зазвичай виникають протягом 1 тиж від початку хвороби | Початок ускладненого перебігу COVID-19 зазвичай настає на 2-й тиждень хвороби |
| Ризик ускладнень серед дітей вищий | Діти з коморбідною патологією мають вищий ризик розвитку ускладнень |
Таблиця 2. Декретовані групи щодо ризику інфікування SARS-CoV-2
| Групи ризику інфікування COVID-19 серед пацієнтів з ХХН або ДХН | ||||
|---|---|---|---|---|
| Характеристика | Ризик інфікування SARS-CoV-2 | |||
| Низький | Середній | Високий | Дуже високий | |
| Вік пацієнта | <65 років | <65 років | >65 років | >65 років |
| Клас хвороби | ГПН 0, І
ХХН ІІІ |
ГПН ІІ
ХХН І–ІІ |
ГПН ІІІ
ХХН IV |
ГПН ІІІ
ХХН V |
| Рівень добової протеїнурії | ≤500 мг/добу | >500 мг/добу
<3000 мг/добу |
≥3000 мг/добу | ≥7000 мг/добу |
| ШКФ | ≥60 мл/хв/м2 або стабільний рівень ШКФ протягом останніх 3–6 міс | 30–59 мл/хв/м2 | ≤30 мл/хв/м2 | ≤15 мл/хв/м2 або перебувають на замісній нирковій терапії |
| АГ | І ст. | І ст. | ІІ ст. | ІІ ст. |
| Імуносупресивна терапія | – | Преднізолон ≤10 мг/добу |
Преднізолон ≥20 мг/добу Азатіоприн Мофетилу мікофенолат Циклофосфамід Циклоспорин Такролімус Ритуксимаб |
|
Марина Величко, кандидат медичних наук, у своїй доповіді приділила увагу вкрай важливій темі нефрології, а саме менеджменту пацієнтів з ХХН та вторинним гіперпаратиреозом. Актуальність теми підтверджується тим фактом, що вторинний гіперпаратиреоз у пацієнтів з ХХН є поширеним коморбідним станом, що характеризується наявністю структурного ураження нирок, змін рівня паратиреоїдного гормону (ПТГ) та інших лабораторних показників, включно з кальцієм, фосфором, фактором росту фібробластів і вітаміном D, які з’являються вже на ранній стадії прогресування ХХН та призводять до підвищення ризику переломів кісток у когорті пацієнтів з ХХН. Відповідно, при менеджменті пацієнтів цієї групи для клініциста важливим моментом є досягнення цільових рівнів кальцію, фосфору та ПТГ, оскільки їх зниження впливає не лише на кісткову тканину й нирки, а зачіпає весь організм в цілому, включно з судинами та кишечником (рис. 5). Таким чином, пацієнти цієї групи потребують регулярного контролю ключових лабораторних показників та їх корекції з урахуванням трьох складових: вживання — виведення — регуляція. Крім того, важливою складовою щодо сповільнення прогресування ХХН у пацієнтів із вторинним гіперпаратиреозом є дотримання дієтичних обмежень і характеру харчування, диференційоване призначення фосфат-біндерів, вітаміну D, кальциміметиків та, за потреби, діалізу.

Доповідь Ольги Лавренчук, доктора медичних наук, стосувалася гострого пошкодження нирок (ГПН) у дітей. Відсутність чіткого визначення ГПН, а також даних про особливості перебігу, вікову структуру, відмінності залежно від географічних, культурних і економічних регіонів, ускладнює прийняття клінічних рішень та створення стратегій профілактики і лікування пацієнтів цієї групи. Дані щодо поширення ГПН обмежені ще й відсутністю епідеміологічних досліджень, особливо серед педіатричних пацієнтів. Крім того, важливо розуміти, що пацієнт з ГПН потребує особливих стратегій менеджменту, оскільки пацієнти цієї групи мають високий ризик розвитку ХХН, а їх виявлення є визначальним фактором щодо запобігання еволюції ГПН до гострої хвороби нирок та ХХН з незворотною втратою нефронів. Так, Робоча група з ініціативи щодо лікування гострих захворювань (Acute Disease Quality Initiative Workgroup) наголошує на важливості підвищення інформованості щодо ГПН, заохочення до проведення відповідних епідеміологічних досліджень, визначення механізмів розвитку ГПН та нових шляхів менеджменту пацієнтів цієї групи [6].
Список використаної літератури
- 1. Cosgrove D.M., Fisher M., Gabow P. et al. (2013) Ten strategies to lower costs, improve quality, and engage patients: the view from leading health system CEOs. Health Aff (Millwood); 32(2): 321–7. doi: 10.1377/hlthaff.2012.1074.
- 2. World Health Organization (1998) Health promotion glossary, Geneva: s.n.
- 3. World Health Organization (2009). Patient empowerment and health care. In: WHO Guidelines on Hand Hygiene in Health Care: First Global Patient Safety Challenge Clean Care Is Safer Care 2 ed. Geneva: s.n
- 4. KDIGO Diabetes Work Group (2020) KDIGO 2020 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int; 98(4S): S1–S115. doi: 10.1016/j.kint.2020.06.019.
- 5. Soo R.J.J., Chiew C.J., Ma S. et al. (2020) Decreased Influenza Incidence under COVID-19 Control Measures, Singapore. Emerg. Infect. Dis.; 26(8): 1933–1935. doi: 10.3201/eid2608.201229.
- 6. Câmara N.O.S., Iseki K., Kramer H. et al. (2017) Kidney disease and obesity: epidemiology, mechanisms and treatment. Nat .Rev. Nephrol.; 13(3): 181–190. doi: 10.1038/nrneph.2016.191.





