Покращення охорони здоров’я та сприяння здоров’ю населення
 Кількість пацієнтів з цукровим діабетом (ЦД), які досягають рекомендованого рівня глікозильованого гемоглобіну (HbА1с), артеріального тиску та рівня холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ), за останні роки зросла. Як показують дані програми NHANES, середній показник HbA1с на національному рівні серед людей із ЦД знизився з 7,6% у 1999–2002 рр. до 7,2% у 2007–2010 рр. Це супроводжувалося покращенням серцево-судинних наслідків і значним зниженням частоти мікросудинних ускладнень. Проте у 33–49% пацієнтів не вдається забезпечити глікемічний контроль, цільові рівні артеріального тиску і холестерину. Лише 14% хворих досягають глобальної мети — трьох цілей, які є головними в лікуванні при ЦД.
Кількість пацієнтів з цукровим діабетом (ЦД), які досягають рекомендованого рівня глікозильованого гемоглобіну (HbА1с), артеріального тиску та рівня холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ), за останні роки зросла. Як показують дані програми NHANES, середній показник HbA1с на національному рівні серед людей із ЦД знизився з 7,6% у 1999–2002 рр. до 7,2% у 2007–2010 рр. Це супроводжувалося покращенням серцево-судинних наслідків і значним зниженням частоти мікросудинних ускладнень. Проте у 33–49% пацієнтів не вдається забезпечити глікемічний контроль, цільові рівні артеріального тиску і холестерину. Лише 14% хворих досягають глобальної мети — трьох цілей, які є головними в лікуванні при ЦД.
«За даними дослідження IDMPS, в Україні ситуація не настільки оптимістична: у 2011 р. досягти глобальної мети вдавалося вкрай рідко (6 із 533 учасників); тільки у 40,1% пацієнтів спостерігалися цільові рівні одного з параметрів — HbА1с, артеріального тиску або рівня ХС ЛПНЩ. Через 3 роки зафіксовано погіршення відповідних показників: трьох цілей терапії досягли 3 із 589 учасників, однієї — 38,9%, — повідомила спікер. — У 88% пацієнтів із ЦД 2-го типу, які перебувають на інсулінотерапії, не вдається знизити рівень HbA1c ≤7%. Дані Реєстру лікарських засобів, які підлягають реімбурсації (2018), вказують на те, що понад 90% хворих знаходяться у стані декомпенсації за цим параметром».
Класифікація та діагностика цукрового діабету
Виділяють 4 форми захворювання:
- ЦД 1-го типу (розвивається внаслідок аутоімунної деструкції β-клітин, що зазвичай призводить до абсолютного дефіциту інсуліну);
- ЦД 2-го типу (виникнення спричинене прогресуючим зниженням секреції інсуліну β-клітинами, що часто поєднується з резистентністю до інсуліну);
- гестаційний ЦД (діагностують у ІІ або ІІІ триместр вагітності у пацієнток, які не мали порушень вуглеводного обміну до вагітності);
- специфічні типи ЦД, зумовлені іншими причинами (моногенні синдроми, наприклад ЦД новонароджених і ЦД дорослих у молоді — MODY; ЦД на фоні порушення екзокринної функції підшлункової залози — при кістозному фіброзі та панкреатиті; ЦД, індукований застосуванням лікарських засобів або хімічним шляхом — при використанні глюкокортикоїдів, на фоні лікування ВІЛ/СНІДу або після трансплантації органів).
«При підозрі на ЦД 1-го типу необхідно визначати антитіла до тканин підшлункової залози. Від того, наскільки точно і вчасно вдасться встановити діагноз, залежить результат подальшого лікування. В Інституті ендокринології та обміну речовин створено реєстр дітей зі схильністю до розвитку ЦД (ті, які мають родичів першої лінії, хворих на ЦД), у них періодично оцінюють титр антитіл до острівцевого апарату підшлункової залози», — наголосила Любов Костянтинівна.
Критерії діагностики ЦД (достатньо одного із наведених):
- концентрація глюкози натщесерце ≥7 ммоль/л (період голоду до моменту виконання дослідження має становити щонайменше 8 год; якщо результати аналізів суперечать один одному, їх потрібно повторно перевірити або в тому ж зразку, або двома окремими тестами, виконаними у різний час);
- порушена толерантність до глюкози (через 2 год після навантаження глюкозою рівень глікемії ≥11,1 ммоль/л);
- HbА1с ≥6,5%;
- рівень глюкози крові ≥11,1 ммоль/л при випадковому вимірюванні за наявності класичних симптомів гіперглікемії.
Критерії скринінгу ЦД та предіабету в асимптоматичних пацієнтів:
- Дорослі з надмірною масою тіла (індекс маси тіла (ІМТ) ≥25 або ≥23 кг/м2 — для американців азіатського походження), що мають ≥1 факторів ризику:
− родичі першої лінії, хворі на ЦД;
− високий ризик, пов’язаний з належністю до певних етнічних груп (афроамериканці, латиноамериканці, корінні американці, американські азіати, тихоокеанські острів’яни);
− кардіоваскулярні хвороби в анамнезі;
− артеріальна гіпертензія (≥140/90 мм рт. ст.) або застосування антигіпертензивної терапії;
− рівень холестерину ліпопротеїнів високої щільності <35 мг/дл (<0,9 ммоль/л) та/чи тригліцеридів >250 мг/дл (>2,82 ммоль/л);
− жінки із синдромом полікістозних яєчників;
− низька фізична активність;
− інші клінічні стани, що асоціюються з резистентністю до інсуліну.
- Пацієнти з предіабетом (HbА1с ≥5,7%, порушення глікемії натщесерце або толерантності до глюкози).
- Жінки з гестаційним ЦД в анамнезі (скринінг кожні 3 роки протягом життя).
- Інші пацієнти віком >45 років.
Якщо результати скринінгу в межах норми, тестування слід повторювати кожні 3 роки. У разі виявлення порушень — частіше.
Профілактика й відтермінування розвитку цукрового діабету 2-го типу
В осіб із предіабетом потрібен моніторинг розвитку ЦД 2-го типу з частотою щонайменше 1 раз на рік. Необхідно мотивувати пацієнтів із предіабетом змінювати спосіб життя. У програмі профілактики ЦД (DPP) визначено, що для відтермінування розвитку ЦД 2-го типу потрібно зменшити початкову масу тіла на 7% і збільшити тривалість фізичних вправ середньої інтенсивності (наприклад швидкої ходьби) до ≥150 хв на тиждень.
Важливу роль відіграє правильне харчування. Згідно з рекомендаціями Міжнародної федерації діабету (IDF, 2018), слід надавати перевагу воді, каві або чаю замість фруктових соків, газованих та інших цукровмісних напоїв; щонайменше тричі протягом дня споживати овочі (включаючи зеленолистові); тричі на день куштувати свіжі фрукти (1 порція = 1 вид фруктів); заміняти горіхами або фруктами перекуси підсолодженими йогуртами чи снеками; обмежити максимальну кількість алкоголю двома стандартними порціями на день; вибирати біле м’ясо або морепродукти замість червоного чи обробленого м’яса; заміняти джеми й шоколадні пасти горіховою олією; використовувати цільнозерновий хліб, коричневий рис як альтернативу пшеничному хлібу, білому рису, макаронним виробам (вживати лише тверді сорти); включати в раціон рослинні олії (оливкову, кукурудзяну, соняшникову) замість кокосової, пальмової олій, вершкового масла, тваринних жирів.
Також слід зменшити загальну калорійність раціону, споживання вуглеводів, вживати їжу і напої повільніше, збільшити в раціоні вміст клітковини, сповільнити вивільнення шлунка, інгібувати ензиматичне перетворення полісахаридів у моносахариди (наприклад за допомогою інгібіторів α-глюкозидази, рослинних засобів).
Терапію метформіном як спосіб профілактики ЦД 2-го типу можна розглядати у пацієнтів із предіабетом, особливо в осіб з ІМТ ≥35 кг/м2, хворих віком <60 років і жінок із гестаційним ЦД в анамнезі. Є дані, що прийом метформіну цими категоріями пацієнтів допомагає відтермінувати появу ЦД 2-го типу на 10 років. Тривале застосування метформіну може викликати дефіцит вітаміну В12, тому періодично слід вимірювати його рівень у пацієнтів, які отримують терапію, особливо в осіб з анемією чи периферичною нейропатією.
Хоча аналоги глюкагоноподібного пептиду 1 (ГПП-1), інгібітори натрій-глюкозного котранспортера 2-го типу (SGLT2) за механізмом дії здатні зменшувати масу тіла і теоретично — сприяти зниженню інсулінорезистентності та відтермінуванню розвитку ЦД 2-го типу, їх не можна застосовувати на етапі предіабету (особливо інгібітори SGLT2 для зменшення маси тіла в осіб без порушень вуглеводного обміну). Стосовно аналогів ГПП-1 питання неоднозначне, оскільки в США ліраглутид 3 мг застосовують для лікування при ожирінні, як зауважила спікер.
Комплексна медична оцінка та оцінка супутніх захворювань
Цей розділ рекомендацій зазнав найсуттєвіших змін. Зараз ключовий при виборі цукрознижувальної терапії — пацієнторієнтований, а не глюкозоцентричний підхід.
«Пацієнт повинен залучатися до прийняття рішень, розуміти, що ми йому пропонуємо і навіщо, якого результату очікувати. Якщо він розділить із лікарем відповідальність, шанси на успішне лікування значно зростуть. Цікавитися враженнями та уподобаннями пацієнта потрібно під час першої зустрічі і при кожному відвідуванні у подальшому. Обов’язково слід запитувати про сімейний анамнез, умови життя, досвід дотримання дієт (чим він триваліший, тим меншою буде прихильність пацієнта до корекції харчування), застосування ліків, використання технологій. Пацієнтів молодого віку доцільно інформувати про інноваційні стратегії, варіанти моніторингу глюкози за допомогою сучасних гаджетів, ведення електронного щоденника», — акцентувала увагу аудиторії Л. Соколова.
Фізикальний огляд передбачає вимірювання росту, маси тіла, ІМТ, артеріального тиску (на кожному візиті), ортостатичну пробу (за наявності показань), оцінку стану очного дна (офтальмологом), пальпацію щитовидної залози, огляд шкіри, нижніх кінцівок, периферичного кровотоку, визначення температурної, вібраційної і тактильної чутливості.
Лабораторна діагностика, крім стандартних тестів (HbА1с, ліпідний профіль, печінкові проби, співвідношення альбуміну та креатиніну у сечі тощо), має включати визначення рівня гормонів щитовидної залози у пацієнтів із ЦД1-го типу, вітаміну В12 — у пацієнтів, які застосовують метформін, калію — у пацієнтів, які отримують терапію інгібіторами ангіотензинперетворювального ферменту (АПФ), блокаторами рецепторів ангіотензину II, діуретиками.
Зміна способу життя
Перш за все йдеться про навчання та підтримку самостійного управління ЦД (Diabetes self-management education and support — DSMES), правильне харчування, фізичну активність, консультації щодо відмови від куріння та психосоціальну допомогу. Детальне навчання слід проводити при діагностиці ЦД, під час щорічного огляду, у разі виникнення ускладнюючих факторів і при корекції терапії.
Надзвичайно важливу роль відіграють раціональне харчування (документ ADA 2019 містить вичерпний перелік рекомендацій стосовно його корекції з високим рівнем доказовості — А, В) та фізична активність.
Діти та підлітки з ЦД 1-го чи 2-го типу або предіабетом повинні виконувати помірні чи інтенсивні аеробні фізичні вправи протягом 60 хв на день не менше 3 днів на тиждень. Більшості дорослих із ЦД 1-го і 2-го типу слід мати хоча б 150 хв вираженої аеробної фізичної активності тричі на тиждень, перерва між заняттями не повинна перевищувати 2 днів. Коротша тривалість (мінімум 75 хв на тиждень) навантажень дуже високої інтенсивності або інтервальних тренувань може бути достатньою для молодших і фізично тренованіших осіб. Усі дорослі, особливо з ЦД 2-го типу, повинні скорочувати безперервну тривалість роботи сидячи до 30 хв. Для пацієнтів похилого віку із ЦД 1-го та 2-го типу рекомендовані вправи на гнучкість і рівновагу (йога, тай чи (тайцзіцюань)) 2–3 рази на тиждень.
Глікемічні цілі
Рівень HbA1с слід визначати щонайменше двічі на рік у пацієнтів, які досягли терапевтичних цілей (і мають стабільний глікемічний контроль); щоквартально — у хворих, які потребують корекції терапії чи не відповідають глікемічним цілям.
«На глікемічні цілі впливає велика кількість факторів: ризик гіпоглікемії та інших побічних ефектів, тривалість захворювання, очікувана тривалість життя, супутня патологія, наявність кардіоваскулярних ускладнень, уподобання пацієнта і наявні в нього ресурси. Чим триваліший анамнез захворювання і тяжчий стан пацієнта, тим менш активними повинні бути терапевтичні втручання. Чим молодший пацієнт, тим активніше необхідно діяти для досягнення глікемічної цілі — рівня HbA1с <7% (а краще — 6,5%)», — зазначила доповідач.
Технології
Новий розділ в ADA 2019
Інсулінові помпи. Більшості дорослих, дітей та підлітків з ЦД 1-го типу слід призначати інтенсивну інсулінотерапію шляхом щоденних ін’єкцій або за допомогою інсулінової помпи. Терапію за допомогою інсулінової помпи можна розглядати як варіант для всіх дітей і підлітків, особливо у пацієнтів віком до 7 років.
Самоконтроль рівня глюкози крові. Більшість пацієнтів, які знаходяться на інтенсивних режимах інсулінотерапії (кілька щоденних ін’єкцій або терапія інсуліновою помпою), повинні самостійно оцінювати рівень глюкози в крові (або здійснювати безперервний моніторинг глюкози) перед прийомом їжі та перекусів, перед сном, інколи постпрандіально, перед тренуванням, коли є підозра на зниження рівня глюкози в крові, після лікування епізодів гіпоглікемії, доки вони не стануть нормоглікемічними, і напередодні виконання таких видів діяльності, як керування транспортом.
Постійний моніторинг глюкози. При правильному використанні безперервний моніторинг глюкози в режимі реального часу в поєднанні з інтенсивними режимами інсулінотерапії є корисним інструментом для зниження рівня HbA1с у дорослих із ЦД 1-го типу, які не досягли цільових значень глікемії. Безперервний моніторинг глюкози в реальному часі може бути корисним інструментом у осіб із втратою свідомості на фоні гіпоглікемії та/чи за наявності частих епізодів гіпоглікемії. Цей метод може бути ефективним для покращення показника HbA1с і неонатальних наслідків у вагітних з ЦД 1-го типу.
Постійний моніторинг глюкози зі скануванням може розглядатися як альтернатива самоконтролю глюкози в крові у дорослих з ЦД, який потребує частого вимірювання глюкози.
Ожиріння
Якщо ІМТ у межах 27–29 кг/м2, можна пропонувати пацієнту фармакотерапію (орлістат, ліраглутид, проте він ще не зареєстрований в Україні для лікування при ожирінні). Метаболічну терапію дозволено призначати, коли ІМТ >30 кг/м2. Це єдина можлива опція у пацієнта з морбідним ожирінням.
Фармакологічні цілі
ЦД 1-го типу. Більшість осіб з ЦД 1-го типу слід лікувати за допомогою щоденної ін’єкційної інсулінотерапії (прандіальний та базальний інсулін) або безперервної підшкірної інфузії інсуліну. Більшість осіб з ЦД 1-го типу повинні використовувати швидкодіючі аналоги інсуліну для зниження ризику гіпоглікемії. Особи з ЦД 1-го типу, які успішно використовують безперервну підшкірну інфузію інсуліну, повинні мати доступ до цієї терапії у віці старше 65 років.
Новий підрозділ у рекомендаціях — «Неінсулінотерапія цукрового діабету 1-го типу».
Оцінювалася ефективність використання ін’єкційних та пероральних цукрознижувальних препаратів як доповнення до інсулінотерапії ЦД 1-го типу. Зокрема, прамлінтид, аналог гормону аміліну, який продукується β-клітинами, схвалений для застосування у дорослих з ЦД 1-го типу (в Україні не зареєстрований. — Прим. спікера).
Призначення метформіну дорослим з ЦД 1-го типу супроводжувалося незначним зменшенням маси тіла і позитивним впливом на ліпідний обмін, але не покращило рівня HbА1c. Додавання аналогів ГПП-1 ліраглутиду й ексенатиду до інсулінотерапії забезпечило невелике (0,2%) зниження рівня HbA1с порівняно з інсуліном у осіб з ЦД 1-го типу, а також зменшення маси тіла на 3 кг. Додавання інгібітора SGLT2 до інсулінотерапії асоціювалося з покращенням рівня HbA1с і маси тіла в порівнянні з інсуліном; однак використання інгібітора SGLT2 також спричиняло більшу кількість побічних ефектів, включаючи кетоацидоз, при ЦД 1-го типу.
Інгібітор SGLT1/2 сотагліфлозин на сьогодні розглядається Управлінням з контролю якості харчових продуктів і лікарських препаратів США (FDA) і, якщо буде схвалений, стане першим додатковим пероральним засобом для використання при ЦД 1-го типу (в Україні не зареєстрований. — Прим. спікера).
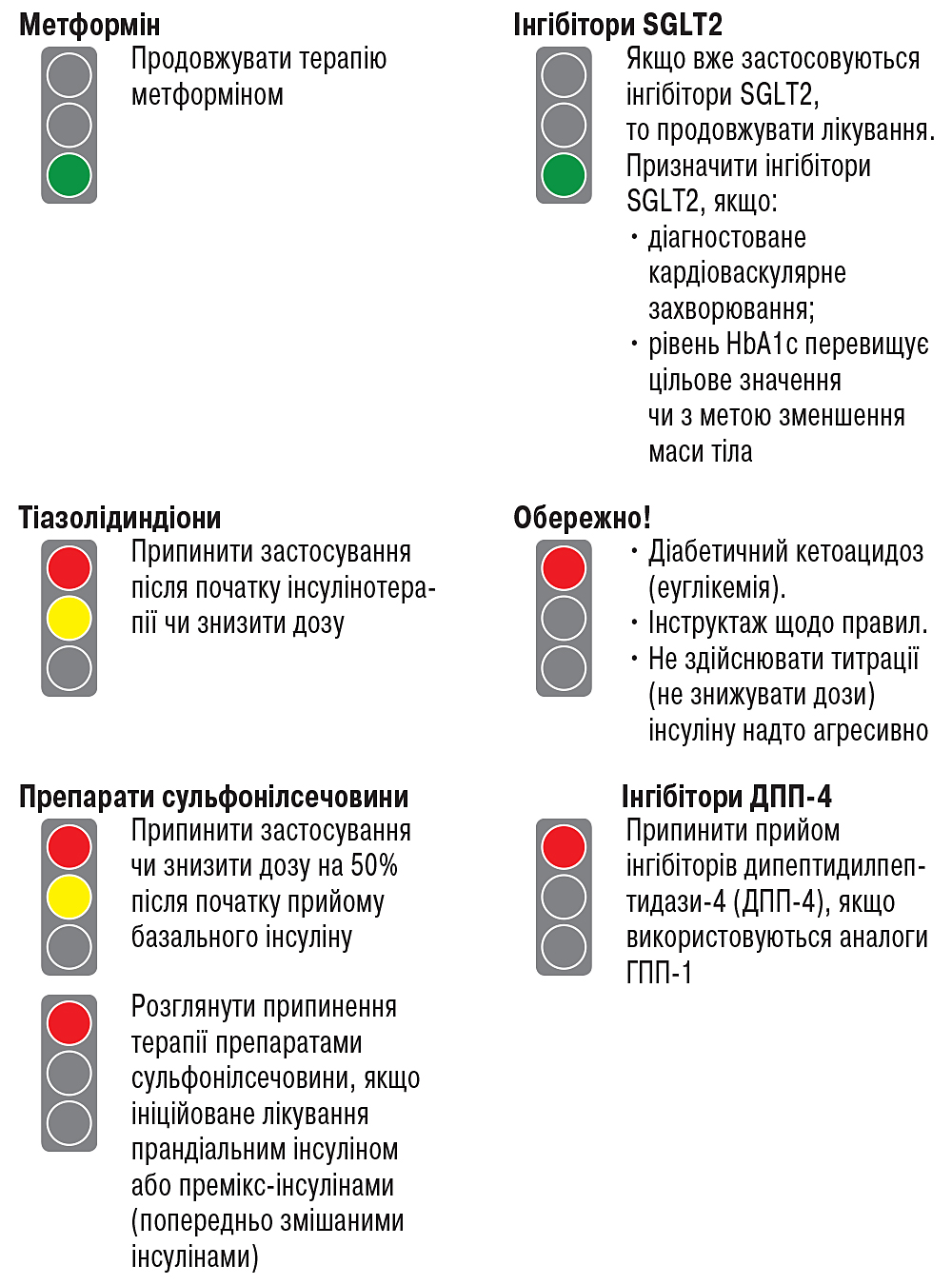
ЦД 2-го типу. Метформін є оптимальним засобом першої лінії для лікування пацієнтів із ЦД 2-го типу. Після початку лікування метформін слід застосовувати доти, поки він переноситься і не протипоказаний; інші засоби, включаючи інсулін, необхідно додавати до метформіну. Тривале застосування метформіну може викликати біохімічний дефіцит вітаміну В12. У пацієнтів, які отримують метформін, особливо в осіб з анемією чи периферичною нейропатією, варто здійснювати періодичну оцінку рівня вітаміну В12.
Можливість введення інсуліну слід розглянути, якщо є докази катаболізму (втрати маси тіла), наявні симптоми гіперглікемії, рівень HbA1c >10% або концентрація глюкози в крові дуже висока (≥16,7 ммоль/л); подвійну терапію — у пацієнтів із нещодавно діагностованим ЦД 2-го типу з НbA1c, який на ≥1,5% вище їхніх цільових показників глікемії.
Пацієнтцентричний підхід є основним при виборі цукрознижувальної терапії — з урахуванням супутніх захворювань (атеросклероз, серцева недостатність, хронічна хвороба нирок), ризику гіпоглікемії, впливу на масу тіла, вартості, ризику побічних ефектів і переваг для пацієнтів.
У пацієнтів із ЦД 2-го типу й атеросклеротичним серцево-судинним захворюванням доступні тільки дві опції для вибору другої лінії терапії — інгібітори SGLT2 та аналоги ГПП-1. Ті засоби, що продемонстрували переваги у пацієнтів із серцево-судинними захворюваннями, рекомендуються як частина цукрознижувального режиму (ліраглутид > семаглутид > ексенатид; емпагліфлозин > канагліфлозин).
У пацієнтів з атеросклерозом і високим ризиком/наявністю серцевої недостатності доцільним є використання інгібіторів SGLT2 (емпагліфлозин, канагліфлозин). У пацієнтів із ЦД 2-го типу та хронічною хворобою нирок оптимальним вважається застосування інгібітора SGLT2 або аналога ГПП-1, що знижує ризик прогресування хронічної хвороби нирок та/чи серцево-судинних подій. У більшості пацієнтів, які потребують вищої цукрознижувальної ефективності ін’єкційної терапії, аналоги ГПП-1 мають переваги порівняно з інсуліном (і мають призначатися в першу чергу. — Прим. спікера).
Можливості поєднання пероральних засобів з ін’єкційною терапією представлені на рисунку.
Кардіоваскулярні захворювання і управління ризиками
Терміном «Серцево-судинні захворювання, асоційовані з атеросклерозом (ASCVD)» визначаються ішемічна хвороба серця, цереброваскулярне захворювання та захворювання периферичних артерій, які, як вважається, мають атеросклеротичне походження.
Корисним інструментом для оцінки 10-річного ризику ASCVD є калькулятор ризику, розроблений Американською колегією кардіологів й Американською асоціацією серця: tools.acc.org/ASCVD-Risk-Estimator-Plus.
Артеріальна гіпертензія/контроль артеріального тиску. Артеріальний тиск слід вимірювати при кожному рутинному клінічному візиті. У пацієнтів, в яких виявили підвищений артеріальний тиск (≥140/90 мм рт. ст.), слід провести кілька вимірювань, включаючи вимірювання в окремий день, для діагностики гіпертензії. Всі пацієнти з гіпертензією та ЦД повинні здійснювати моніторинг рівня артеріального тиску в домашніх умовах.
Для осіб з ЦД і гіпертензією на фоні високого серцево-судинного ризику (наявне ASCVD або 10-річний ризик їх виникнення >15%) цільове значення артеріального тиску <130/80 мм рт. ст. може бути доцільним, якщо можливо безпечно його досягти. Для осіб з ЦД і гіпертензією з низьким ризиком серцево-судинних захворювань (10-річний ризик ASCVD <15%) цільовий показник становить <140/90 мм рт. ст.
У вагітних із ЦД і діагностованою гіпертензією, які вже отримують антигіпертензивну терапію, пропонуються такі цільові значення: 120–160/80–105 мм рт. ст. Для лікування артеріальної гіпертензії у хворих на ЦД радять використовувати інгібітори АПФ, блокатори рецепторів ангіотензину II, тіазидоподібні діуретики, блокатори кальцієвих каналів.
Нормалізація ліпідного обміну передбачає зміну способу життя з фокусом на зменшення маси тіла (за потреби); застосування середземноморської дієти або дієти DASH; зменшення споживання насичених жирів і транс-жирів і збільшення — ω3-поліненасичених жирних кислот, клітковини, рослинних станолів/стеринів; підвищення фізичної активності.
Статинотерапія рекомендується пацієнтам із ЦД, які:
- мають ASCVD або 10-річний ризик їх виникнення >20% (високої інтенсивності);
- віком <40 років з додатковими факторами ризику ASCVD (середньої інтенсивності як доповнення до модифікації способу життя);
- віком 40–75 та >75 років без ASCVD (середньої інтенсивності як доповнення до модифікації способу життя);
- мають численні фактори ризику ASCVD (високої інтенсивності).
Хворим, які не переносять терапії рекомендованої інтенсивності, потрібно призначати статин у максимально допустимій дозі. У пацієнтів з ЦД і ASCVD, якщо ХС ЛПНЩ становить ≥70 мг/дл на фоні застосування максимальної переносимої дози статину, розглянути можливість додаткового приєднання засобів, що знижують рівень ХС ЛПНЩ (наприклад езетимібу або інгібітора PCSK9). Езетимібу може надаватися перевага у зв’язку з нижчою вартістю. Статинотерапія протипоказана у період вагітності.
Високоінтенсивними дозами вважають 40–80 мг аторвастатину та 20–40 мг розувастатину; помірними — 10–20 мг аторвастатину, 5–10 мг розувастатину, 20–40 мг симвастатину, 40–80 мг правастатину, 40 мг ловастатину, 80 мг флувастатину, 2–4 мг пітавастатину.
Мікроваскулярні ускладнення і догляд за ногами
Хронічна хвороба нирок. Принаймні один раз на рік визначають рівень альбуміну в сечі (наприклад співвідношення альбумін/креатинін в сечі) та оцінюють швидкість клубочкової фільтрації:
- у пацієнтів з ЦД 1-го типу тривалістю ≥5 років;
- у всіх пацієнтів з ЦД 2-го типу;
- у всіх пацієнтів з коморбідною гіпертензією.
Лікування включає антигіпертензивні засоби, цукрознижувальні препарати (інгібітори SGLT2 або аналоги ГПП-1), обмеження споживання білків до 0,8 г/кг маси тіла на добу у пацієнтів, які не знаходяться на діалізі (для хворих, які перебувають на діалізі, слід розглядати вищі рівні споживання білкових продуктів). Невагітним пацієнтам із ЦД і гіпертензією інгібітор АПФ або блокатор рецепторів ангіотензину II рекомендується при незначному підвищенні співвідношення альбумін/креатинін у сечі (30–299 мг/г креатиніну) і суворо рекомендується, якщо співвідношення ≥300 мг/г креатиніну та/чи швидкість клубочкової фільтрації <60 мл/хв/1,73 м2.
Здійснюється моніторинг рівня креатиніну та калію у хворих, які отримують інгібітори АПФ. Не рекомендується застосовувати інгібітор АПФ або блокатор рецепторів ангіотензину II для первинної профілактики хронічної хвороби нирок у пацієнтів з ЦД, які мають нормальні показники артеріального тиску, співвідношення альбумін/креатинін у сечі (<30 мг/г креатиніну) і швидкість клубочкової фільтрації.
Діабетична ретинопатія. Для зниження ризику розвитку або уповільнення її прогресування необхідні оптимізація контролю глікемії, артеріального тиску й ліпідного обміну.
Діабетична нейропатія. Скринінг варто проводити усім пацієнтам із ЦД 2-го типу та пацієнтам із 5-річним анамнезом ЦД 1-го типу і, як мінімум, щорічно після цього. Як стартову терапію у разі нейропатичного болю при ЦД застосовують прегабалін, дулоксетин або габапентин.
Пацієнти похилого віку
У пацієнтів похилого віку, які є здоровими з незначною коморбідністю і збереженими когнітивними функціями та функціональним статусом, цільові значення глікемії нижчі (HbA1c <7,5%), а в осіб із супутньою патологією, когнітивними порушеннями або функціональними розладами вони повинні бути менш жорсткими (HbA1c <8,0–8,5%).
У всіх пацієнтів похилого віку слід уникати гіперглікемії, яка зумовлює ризик гострих тяжких ускладнень.
Діти та підлітки
Цільові значення фармакотерапії: рівень глюкози до прийому їжі — 5,0–7,2 ммоль/л, напередодні сну/вночі — 5,0–8,3 ммоль/л, HbA1c <7,5% (або <7,0%, якщо цього можна досягти без епізодів гіпоглікемії).
Після встановлення діагнозу ЦД 1-го типу таким хворим проводять тестування на наявність антитиреоїдних та антитиреоглобулінових антитіл. Концентрацію тиреотропного гормону вимірюють після встановлення діагнозу, коли стан клінічно стабільний, або незабаром після досягнення глікемічного контролю. Якщо показник у межах норми, пропонують повторну перевірку кожні 1–2 роки (або раніше за потреби — при збільшенні щитовидної залози, аномально швидкому рості або незрозумілій варіабельності глікемії).
Наголошується в документі ADA 2019 і на необхідності скринінгу целіакії. Повторити скринінг потрібно протягом 2 років після встановлення діагнозу ЦД, а потім через 5 років (частіше — за наявності у дитини симптомів або родичів першої лінії з целіакією).
Якщо у дитини/підлітка з ожирінням вперше виявлено ЦД і:
- HbA1c <8,5%, відсутні ознаки ацидозу й кетоацидозу — призначається метформін 2000 мг щоденно;
- HbA1c >8,5%, відсутні ознаки ацидозу й кетоацидозу — застосовують базальний інсулін і пропонують метформін 2000 мг;
- спостерігаються ознаки ацидозу й кетоацидозу — усувають кетоацидоз, проводять внутрішньовенну інсулінотерапію (дотримуються стратегії для ЦД 1-го типу).
Ведення цукрового діабету в період вагітності
Критерії гестаційного ЦД — рівень глюкози натщесерце >5,1 ммоль/л, порушення толерантності до глюкози (визначається на 24–28-му тижні) >8,6 ммоль/л через 2 год після навантаження глюкозою.
У вагітних цільові показники такі: глюкоза натщесерце <5,3 ммоль/л, через 1 год після прийому їжі <7,8 ммоль/л, через 2 год після прийому їжі <6,7 ммоль/л; HbA1с <6%, коли його можна досягти без вираженої гіпоглікемії, та <7%, якщо це необхідно для запобігання епізодам гіпоглікемії.
Лікування при гестаційному ЦД включає модифікацію способу життя, підвищення фізичної активності, призначення інсуліну. Метформін і глібурид не повинні використовуватися як препарати першої лінії, оскільки здатні проникати через плаценту. У всіх пероральних препаратів відсутні довгострокові дані щодо безпеки.
Метформін, що застосовувався для лікування при синдромі полікістозних яєчників та індукції овуляції, слід відмінити після підтвердження вагітності.
Науково-освітній проект «Школа ендокринолога» започаткований за ініціативи Української асоціації клінічних ендокринологів та ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України» (Київ). У наступних публікаціях ми продовжимо знайомити шановних читачів з останніми новинами ендокринології, що обговорювалися під час заходу.
Долучайтеся до нас у Viber-спільноті, Telegram-каналі, Instagram, на сторінці Facebook, а також Twitter, щоб першими отримувати найсвіжіші та найактуальніші новини зі світу медицини.
Ольга Радучич,
фото Сергія Бека