Алопеція: стан проблеми, патогенез та варіанти впливу на аутоімунне запалення
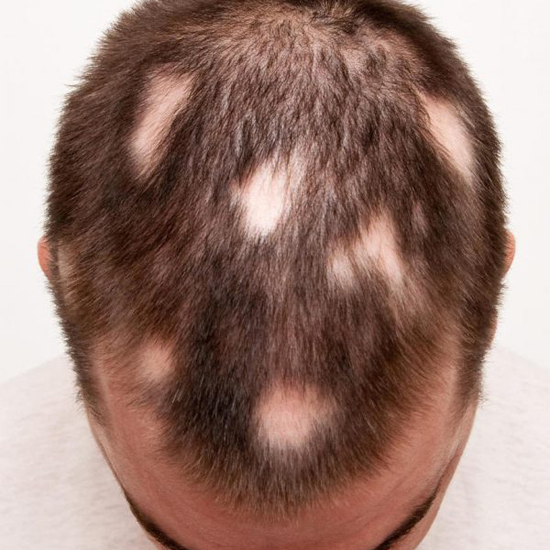 Вогнищева алопеція (ВА) відома також як гніздова алопеція — хронічне аутоімунне запальне захворювання, яке уражує волосяний фолікул, а іноді й нігті. Алопеція характеризується рецидивуючою нерубцевою втратою волосся, і хоча ВА не чинить прямого впливу на загальний стан, вона значно впливає на якість життя пацієнтів, оскільки супроводжується значними косметичними вадами. Зазвичай волосся втрачається на шкірі голови, але може бути задіяна будь-яка ділянка шкіри. Статистичні дані свідчать, що у близько 2% населення планети відмічають ВА, як правило, захворювання виникає у дітей та осіб молодого віку (до 30 років) незалежно від статі [1]. Захворювання починається з появи на волосистій частині голови одного або декількох округлих чітко обмежених вогнищ повного випадіння волосся без будь-яких змін з боку шкіри. Можуть також бути наявні ознаки легкого дерматиту (почервоніння шкіри) в ділянці випадіння волосся. При прогресуванні захворювання наявне злиття вогнищ з формуванням тотального облисіння.
Вогнищева алопеція (ВА) відома також як гніздова алопеція — хронічне аутоімунне запальне захворювання, яке уражує волосяний фолікул, а іноді й нігті. Алопеція характеризується рецидивуючою нерубцевою втратою волосся, і хоча ВА не чинить прямого впливу на загальний стан, вона значно впливає на якість життя пацієнтів, оскільки супроводжується значними косметичними вадами. Зазвичай волосся втрачається на шкірі голови, але може бути задіяна будь-яка ділянка шкіри. Статистичні дані свідчать, що у близько 2% населення планети відмічають ВА, як правило, захворювання виникає у дітей та осіб молодого віку (до 30 років) незалежно від статі [1]. Захворювання починається з появи на волосистій частині голови одного або декількох округлих чітко обмежених вогнищ повного випадіння волосся без будь-яких змін з боку шкіри. Можуть також бути наявні ознаки легкого дерматиту (почервоніння шкіри) в ділянці випадіння волосся. При прогресуванні захворювання наявне злиття вогнищ з формуванням тотального облисіння.
Класифікація алопеції:
- тотальна алопеція — повне випадіння волосся виключно на шкірі голови та обличчя;
- субтотальна — задіяно близько 50% поверхні шкіри голови;
- універсальна алопеція — характеризується випадінням волосся як на голові, так і на всьому шкірному покриві тіла;
- крайова алопеція (офіаз) — проявляється облисінням периферичних ділянок волосистої частини голови, особливо потиличних та скроневих [2].
На сьогодні не існує жодних схвалених Управлінням з з контролю за харчовими продуктами і лікарськими засобами США (U.S. Food and Drug Administration — FDA) препаратів для лікування ВА. При лікуванні обмеженої та бляшкоподібної алопеції показані топічні глюкокортикостероїди та імунотерапія, тоді як терапія тотальної алопеції передбачає застосування системних глюкокортикостероїдів та інших імуносупресантів [3].
У патогенезі алопеції ключову роль відіграє аутоімунне запалення [4]. ВА супроводжується інфільтрацією Т-клітинами групи CD8 і CD4 +, що виділяють інтерферон-γ, який передає сигнали через янус-кіназу (JAK)-1 і JAK2 в епітеліальні клітини волосяного фолікула і стимулює секрецію інтерлейкіну-15, який передає сигнали через JAK-1 і JAK-3 в Т-клітини. Гістологічно при біопсії ділянок ВА виявляють перифолікулярну лімфоцитарну інфільтрацію навколо волосяного фолікула в аногеновій фазі. Внаслідок цього відбуваються пошкодження волосяних фолікулів і випадіння волосся. Інфільтрат складається переважно з Т-хелперів та меншою мірою — з Т-супресорів. Враховуючи роль аутоімунного запалення у розвитку ВА, постає питання щодо доцільності застосування інгібіторів JAK (іJAK). Результати невеликих клінічних досліджень із застосування іJAK продемонстрували ефективність такої терапії. Перевага застосування іJAK пояснюється пригніченням передачі сигналів JAK1 і JAK2, що пов’язано з опосередкованою цитокінами імунною дисфункцією, яка призводить до пошкодження волосяних фолікулів.
Барицитиніб — синтетичний пероральний лікарський препарат, який належить до групи іJAK. Механізм дії препарату полягає в інгібуванні ферментів JAK 1, JAK-2, а також меншою мірою JAK-3 та JAK-2, які, як відомо, активують транспортери сигналу та активатори транскрипції, які, у свою чергу, активують експресію гена та беруть участь у реакціях запалення, імунної відповіді та кровотворення. Препарат схвалений більш ніж у 70 країнах для лікування ревматоїдного артриту середнього та високого ступеня активності. Проведено дослідження щодо оцінки ефективності застосування барицитинібу при лікуванні ВА [5].
Дослідження BRAVE-AA1 2-ї фази: методи та результати
BRAVE-AA1 (NCT03570749) — подвійне сліпе плацебо-контрольоване дослідження 2-ї/3-ї фази, метою якого є оцінка ефективності та безпеки барицитинібу у пацієнтів з ВА.
Пацієнти були рандомізовані у співвідношенні 1:1:1:1 залежно від прийому плацебо або барицитинібу у дозі 1 мг, 2 мг або 4 мг один раз на добу. Два послідовні проміжні аналізи були проведені після того, як усі пацієнти завершили 12- і 36-тижневе лікування або припинили лікування до цього моменту.
Первинною кінцевою точкою дослідження обрана частка пацієнтів, які досягли показника тяжкості алопеції (Severity of Alopecia Too — SALT) ≤20 на 36-му тижні. Шкала SALT має градацію від 0 (відсутність випадання волосся) до 100 (повне випадіння волосся).
Загалом у дослідження включено 110 пацієнтів, рандомізованих у співвідношенні 1:1:1:1: плацебо — 28 пацієнтів; барицитиніб у дозі 1 мг — 28; 2 мг — 27; 4 мг — 27. Дозу барицитинібу 1 мг було знижено після першого проміжного аналізу на основі нижчої частоти відповіді відповідно до SALT.
На 36-й тиждень лікування частка пацієнтів, які досягли показника SALT ≤20, була значно більшою в групах барицитинібу 2 мг (33,3%, р=0,016) і 4 мг (51,9%, р=0,001) порівняно з плацебо (3,6%). Барицитиніб добре переносився та не супроводжувався розвитком побічних ефектів.
Дослідження BRAVE-AA2 3-ї фази
3 березня 2021 р. на щорічному з’їзді Європейської академії дерматології та венерології (European Academy of Dermatology and Venereology — EADV) оприлюднені результати 3-ї фази дослідження BRAVE-AA2, в якому оцінювали ефективність барицитинібу при лікуванні ВА [6].
У двох майже ідентичних випробуваннях BRAVE-AA1 та BRAVE-AA2 взяли участь 654 та 546 пацієнтів відповідно. У дослідження BRAVE-AA2 включені дані 546 пацієнтів з ВА, яких рандомізували залежно від дози прийому барицитинібу: 2 мг і 4 мг один раз на добу або плацебо. Повторне зростання волосся на бровах і віях було вторинним результатом.
Після закінчення 36 тиж, коли криві відповіді все ще мали висхідну траєкторію, частка тих, хто отримував 4 мг барицитинібу, досягнули показника SALT ≤20 (35,2% у групі BRAVE-AA1 та 32,5% у групі BRAVE-AA2). Відмічено явний дозозалежний ефект: ріст волосся збільшувався швидше при дозі барицитинібу 4 мг, ніж при дозі 2 мг.
Різниця між активною терапією та плацебо була значною до 16-го тижня терапії при дозі 4 мг. До 24-го тижня перевага дози 2 мг над плацебо також досягла значущості, але швидкість відповіді при дозі 4 мг була майже вдвічі вищою.
Після закінчення 36-тижневих випробувань частка пацієнтів, які отримували барицитиніб у дозі 2 мг і досягли основної кінцевої точки, становила 21,7 та 17,3% у дослідженнях BRAVE-AA1 та BRAVE-AA2 відповідно. Серед пацієнтів, які приймали плацебо, основну кінцеву точку було досягнуто в кінці двох випробувань: 5,3 і 2,6% відповідно.
Відмінності у відповідях на дози 4 мг та 2 мг були значно вищими порівняно з плацебо (р≤0,001 для обох доз порівняно з плацебо).
Вторинна кінцева точка: при використанні системи бальної оцінки випадіння волосся на бровах і віях частка пацієнтів, які отримали оцінку 0 (повне покриття) або 1 (мінімальні ділянки), знову була більшою в обох дослідженнях для пацієнтів, які приймали вищу дозу барицитинібу. Такий рівень відповіді був досягнутий приблизно у 31–35% пацієнтів, які приймали дозу 4 мг BRAVE-AA1 та BRAVE-AA2 (р≤0,001 порівняно з плацебо), тоді як при нижчій дозі показники становили 19,1 та 13,5% відповідно. Ця кінцева точка була досягнута лише у 3% пацієнтів, які приймали плацебо.
Частота небажаних явищ була дещо вищою у двох групах активного лікування порівняно з групою, яка приймала плацебо. Найпоширеніші побічні ефекти барицитинібу включали інфекції верхніх дихальних шляхів, назофарингіт, інфекції сечовивідних шляхів і головний біль. Більшість побічних ефектів варіювала від легкого до помірного ступеня тяжкості. Жодне з цих небажаних явищ не виявлено більш ніж у 10% пацієнтів, і не відмічено випадків інших ускладнень терапії. Частота припинення прийому через небажані явища при активній терапії становила <3% в обох дослідженнях.
Висновок
Результати дослідження продемонстрували, що обидві дози барицитинібу досягли первинної кінцевої точки ефективності на 36-й тиждень лікування, продемонструвавши статистично значуще покращення росту волосся на шкірі голови порівняно з пацієнтами з групи плацебо. Отримані результати підтверджують ефективність та безпеку застосування барицитинібу при лікуванні ВА.
«Ці позитивні результати є дуже обіцяючими і свідчать про те, що барицитиніб є ефективним препаратом та може задовільнити потребу людей, які живут з ВА», — зазначив Бретт Кінг (Brett King), доктор медичних наук, доцент кафедри дерматології Єльської школи медицини (Dermatology at Yale School of Medicine).
Список використаної літератури:
- Liu L.Y., King B.A., Craiglow B.G. (2018) Alopecia areata is associated with impaired health-related quality of life: a survey of affected adults and children and their families. J. Am. Acad. Dermatol.; 79: 556—558.e1.
- Darwin E., Hirt P.A., Fertig R. et al. (2018) Alopecia areata: review of epidemiology, clinical features, pathogenesis, and new treatment options. Int. J. Tricholog.; 10: 51–60.
- Кушнір В.О., Катілов О.В., Лободюк А.О. та ін. (2019) Вогнищева (гніздова) алопеція: загальні рекомендації щодо діагностики та лікування. Дит. лік. 1(64): 5–14.
- Bolduc C., Shapiro J. (2002) The treatment of alopecia areata. Dermatologic Therapy, Vol. 14, Iss. 4: 306–316.
- King B., Ko J., Forman S. et al. (2021) Efficacy and safety of the oral Janus kinase inhibitor baricitinib in the treatment of adults with alopecia areata: Phase 2 results from a randomized controlled study. J. Am. Acad. Dermatol.; 85(4): 847–853. doi: 10.1016/j.jaad.2021.05.050.
- Bosworth T. JAK Inhibitor Provides Impressive Hair Growth for Patients With Alopecia Areata. Medscape, Oct 4.
Анна Хиць
Редакція журналу «Український медичний часопис»





