Полторак Виктория Витальевна — доктор медицинских наук, профессор, заведующая отделом экспериментальной эндокринологии ГУ «Институт проблем эндокринной патологии имени В.Я. Данилевского НАМН Украины», Харьков
Горшунская Марьяна Юрьевна — доктор медицинских наук, профессор кафедры эндокринологии и детской эндокринологии Харьковской медицинской академии последипломного образования
Жердева Надежда Николаевна — кандидат медицинских наук, доцент кафедры диабетологии Национальной медицинской академии последипломного образования имени П.Л. Шупика, Киев
Красова Наталья Сергеевна — кандидат биологических наук, ведущий сотрудник отдела экспериментальной эндокринологии ГУ «Институт проблем эндокринной патологии имени В.Я. Данилевского НАМН Украины», Харьков
Сахарный диабет (СД) 2-го типа, на долю которого приходится 80–90% всех больных СД, относится к числу широко распространенных заболеваний и характеризуется эпидемиологическим ростом: в 2013 г. в мире насчитывали 382 млн больных, а к 2035 г. прогнозируют увеличение их количества до 592 млн (International Diabetes Federation, 2013). Патофизиология заболевания определяется дефектной секрецией инсулина и инсулинорезистентностью тканей (Abdul-Ghani M.A. et al., 2006). Важность гликемического контроля подтверждена в проспективном исследовании сахарного диабета, проведенном в Великобритании (UК Prospective Diabetes Study — UKPDS), показавшем благоприятный эффект раннего интенсивного контроля уровня глюкозы в крови у пациентов с впервые диагностированным СД 2-го типа, а именно снижение риска развития микро- и макрососудистых осложнений и общей смертности. Также подтвержден клинический феномен метаболического наследия (гликемической памяти) как патогенетической основы формирования алгоритма современной противодиабетической терапии (UК Prospective Diabetes Study Group 1998a; b; Holman R.R. et al., 2008).
При СД 2-го типа активно применяют пероральные антигипергликемические препараты (ПАП) с такими механизмами действия, как стимуляция функции β-клеток поджелудочной железы относительно секреции инсулина, снижение инсулинорезистентности тканей, повышение концентрации глюкагоноподобного пептида-1. Производные сульфонилмочевины (ПС) и метформин — наиболее часто назначаемые ПАП с доказанной клинической эффективностью и безопасностью. Вместе с тем у них разные механизмы действия: ПС уменьшают гипергликемию, повышая секрецию инсулина, а метформин улучшает чувствительность тканей к инсулину и подавляет продукцию глюкозы печенью. Поскольку для пациентов с СД 2-го типа преимущественно характерна тучность и инсулинорезистентность с высоким риском развития атеросклероза, метформин является препаратом первой линии терапии (Inzucchi S.E. et al., 2012). Метформин — широко применяемый противодиабетический препарат, снижающий риск связанных с СД фатальных и нефатальных осложнений, при этом у пациентов отмечают меньшую прибавку в массе тела и незначительное число случаев гипогликемии по сравнению с применением инсулина. Монотерапия метформином наряду с модификацией образа жизни первоначально рекомендована при манифестации СД. При недостаточном гликемическом контроле для достижения последнего терапию дополняют противодиабетическими препаратами других классов (Nyenwe E.A. et al., 2011; American Diabetes Association, 2014).
ПС, широко применяемые у больных СД 2-го типа, обеспечивают у >80% из них достижение нормогликемии, однако способны вызывать гипогликемию, а при продолжительном применении — увеличение массы тела, что может усилить инсулинорезистентность. Глимепирид — ПС III поколения с выраженной антигипергликемической активностью и большей, по сравнению с глибенкламидом, длительностью действия, позволяющей применять его 1 раз в сутки (Davis S.N., 2004). Глимепириду присущ целый спектр благоприятных экстрапанкреатических (помимо гликемического контроля) эффектов, оптимизирующих его терапевтическое действие (Jolima T. et al., 2009; Полторак В.В., Горшунская М.Ю., 2010; Полторак В.В. и соавт., 2014; Nakamura I. et al., 2014).
Отметим, что монотерапия антигипергликемическими препаратами замедляет, но не предупреждает прогрессирование заболевания. Со временем контроль гликемии становится неэффективным, что требует применения комбинации противодиабетических препаратов или введения инсулина (Turner R.C. et al., 1999; American Diabetes Association, 2014). Успешный менеджмент базируется на комбинированной терапии, направленной на оба патогенетических механизма развития СД 2-го типа, а именно инсулинорезистентность и дисфункцию β-клеток поджелудочной железы (Cefalu W.T., 2007).
Метформин и глимепирид часто назначают вместе для улучшения гликемического контроля и снижения риска неблагоприятных эффектов (гипогликемия, увеличение массы тела); синергизм достигается сочетанием разных механизмов действия препаратов: метформин тормозит глюконеогенез в печени за счет аденозинмонофосфатактивируемой протеинкиназы, а глимепирид щадяще стимулирует секрецию инсулина, связываясь с аденозинтрифосфатзависимыми калиевыми каналами на поверхности β-клеток поджелудочной железы, а также оказывает экстрапанкреатическое влияние, дополняющее/усиливающее инсулинсенситайзерное действие метформина (Davis S.N., 2004; Kim Y.D. et al., 2008; Полторак В.В., Горшунская М.Ю., 2010; Полторак В.В. и соавт., 2014).
Получены убедительные доказательства целесообразности применения комбинированной терапии ПС и метформином при недостаточной эффективности монотерапии (табл. 1).
| Режим терапии | Снижение уровня HbA1c, % |
|---|---|
| ПС + метформин | 1,7 |
| ПС + розиглитазон | 1,4 |
| ПС + пиоглитазон | 1,2 |
| ПС + акарбоза | 1,3 |
| Репаглинид + метформин | 1,4 |
| Пиоглитазон + метформин | 0,7 |
| Розиглитазон + метформин | 0,8 |
| иДДП-4 + метформин | 0,7 |
| иДДП-4 + пиоглитазон | 0,7 |
Применение комбинации ПС + метформин является хорошо обоснованным. По данным UKPDS, доля пациентов с уровнем НbA1c <7% увеличилась с 21 до 33% при добавлении метформина к монотерапии ПС (р<0,05) (UK Prospective Diabetes Study Group, 1998c). Повышение эффективности может быть объяснено комплементарными механизмами антигипергликемического действия двух препаратов (Cusi K. et al., 1996).
Глимепирид как компонент комбинированной с метформином терапии обладает рядом преимуществ, связанных с его экстрапанкреатической активностью и более благоприятным профилем безопасности по сравнению с другими ПС (Schiekofer S. et al., 2003; Weitgasser R.et al., 2003; Koshiba K. et al., 2006). Так, в рандомизированном контролируемом исследовании K. Koshiba и соавторов (2006) у пациентов с СД 2-го типа лечение глимепиридом в течение 28 нед способствовало значимому улучшению чувствительности периферических тканей к инсулину и антиатеросклеротическому эффекту по сравнению с глибенкламидом.
В исследовании UKPDS 49 с участием 4075 пациентов с СД 2-го типа и нормальной/избыточной массой тела, получавших ПС, или избыточной массой тела, получавших метформин, целевого уровня HbA1c не удалось достичь у 56% пациентов, получавших монотерапию ПС, и 76% пациентов, получавших метформин, через 3 года и у 56 и 87% — спустя 9 лет лечения соответственно. Это свидетельствует о необходимости комбинированной терапии ≥1 ПАП или введения инсулина (Turner R.C. et al., 1999).
Ввиду комплементарных механизмов действия такая терапия является рациональной и может не только способствовать улучшению гликемического контроля, но и обладать лучшей переносимостью благодаря применению отдельных препаратов в более низких дозах (Rendell M., 2004). Так, добавление глимепирида к метформину у пациентов с СД 2-го типа (n=372), неадекватно контролируемых одним метформином, улучшало гликемический контроль по сравнению с монотерапией глимепиридом или метформином (рис. 1) (Charpentier G. et al., 2001).
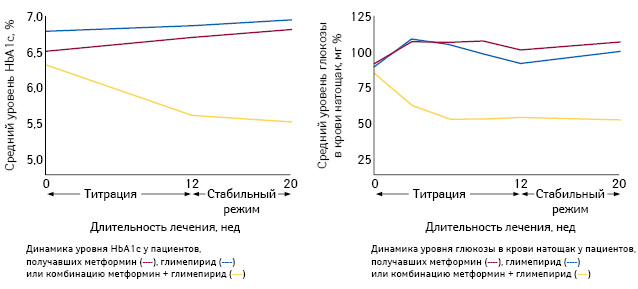
В рандомизированном исследовании с форсированным титрованием дозы препарата участвовали 203 пациента с СД 2-го типа с неадекватным гликемическим контролем (уровень HbA1c 7,5–10%) на фоне монотерапии метформином в течение ≥8 нед. Добавление к монотерапии метформином глимепирида (начальная доза 2 мг/сут титрована до 8 мг/сут в течение 6 нед) на протяжении 26 нед приводило к значимому сокращению времени, необходимому для достижения целевого уровня HbA1c (≤7%), более низкому уровню общего холестерина и холестерина липопротеидов низкой плотности по сравнению с добавлением к монотерапии метформином пиоглитазона (начальная доза 30 мг/сут титрована до 45 мг/сут в течение 12 нед) (Umpierrez G. et al., 2006).
Терапевтическая оптимальность комбинации метформин + глимепирид базируется также на способности метформина устранять феномен метаболического наследия.
Преимущества глимепирида по сравнению с другими ПС относительно оптимизации комбинированного с метформином применения состоят в том, что глимепирид:
- щадяще стимулирует секрецию инсулина с воспроизведением ее физиологического биоритма (повышает, прежде всего, фазу I секреции гормона);
- сохраняет физиологический ответ на физическую нагрузку, включая снижение секреции инсулина;
- повышает синтез и секрецию адипонектина — единственного гормона жировой ткани с доказанным антиатерогенным действием;
- обладает прямым (вне гликемического контроля) снижающим инсулинорезистентность действием путем повышения уровня адипонектина, снижения фактора некроза опухоли-α, оксидативного стресса и др.;
- является единственным ПС с клинически доказанной способностью сохранять защитный феномен ишемического прекондиционирования (Lee T.M., Chou T.F. , 2003; Полторак В.В. и соавт., 2014).
Глимепирид расширяет спектр реабилитирующего влияния на патофизиологические составляющие инсулинорезистентности, а также потенцирует благоприятные эффекты метформина (в частности через адипонектин, являющийся активатором аденозинмонофосфатактивируемой протеинкиназы — ключевого фермента в реализации снижающего инсулинорезистентность действия метформина). С этим связано достижение оптимизированной терапевтической эффективности указанной комбинации при снижении риска побочных эффектов (благодаря снижению доз глимепирида и метформина).
Поскольку СД 2-го типа является хроническим прогрессирующим заболеванием, менеджмент которого обеспечивается длительным применением ПАП, низкий комплаенс к последним является главным препятствием гликемическому контролю. Приверженность лечению снижается при повышении частоты приема препарата, политерапии (Cramer J.A., 2004).
Приверженность терапии ПАП очень важна для поддержания гликемического контроля. Так, в ретроспективном обсервационном исследовании с участием 2741 пациента с СД 2-го типа, применявшего ПАП, показано, что повышение приверженности лечению на 10% ассоциировано с 0,1% абсолютным снижением уровня HbA1c (Rozenfeld Y. et al., 2008). P.T. Donnan и соавторы (2002), проанализировав медицинские базы данных округа Тэйсайд (Шотландия), провели ретроспективное исследование соблюдения врачебных назначений всеми больными СД 2-го типа в этом регионе, принимавшими ПАП. Адекватная приверженность лечению (≥90%) составила 31 и 34% для ПС и метформина соответственно. Отмечено статистически значимое линейное ухудшение этого показателя в зависимости от количества принимаемых таблеток и увеличения перечня сопутствующих препаратов для ПС. В повседневных условиях лишь у 1 из 3 пациентов отмечена адекватная приверженность терапии ПАП. N.S. Ahmad и соавторы (2013) акцентировали внимание на положительной роли осведомленности пациентов о терапии для повышения приверженности лечению. По данным MCQ (Medication Compliance Questionnaire), лишь 47% малазийцев с СД 2-го типа привержены терапии (основной причиной неприверженности являлся пропуск приема лекарств, связанный с забывчивостью). СД-коморбидный статус в 1,78 раза повышал вероятность неприверженности лечению. Уменьшение возраста пациента на 1 год повышало вероятность неприверженности лечению на 3,4%, а каждый 1% снижения по шкале медицинской терапевтической осведомленности — на 3,6% (табл. 2).
| Фактор | Отношение шансов | 95% доверительный интервал | р |
|---|---|---|---|
| Возраст, лет | 0,967 | 0,948–0,986 | 0,010 |
| Шкала терапевтической осведомленности, каждый 1% снижения | 0,965 | 0,946–0,984 | <0,001 |
| СД-коморбидный статус (прием polypill!) | 1,781 | 1,064–2,981 | 0,028 |
Итак, низкая приверженность терапии — одна из основных причин плохого метаболического контроля (чем меньше количество принимаемых таблеток, тем выше приверженность терапии) (Johnson S.B., 1992). Эта проблема может быть преодолена путем применения фиксированных дозовых комбинаций для перорального приема, благодаря которым снижается кратность приема таблеток (Pan F. et al., 2008; Kim B.H. et al., 2009; Gu N. et al., 2010). Потенциальные преимущества раннего начала комбинированной терапии фиксированными комбинациями включают:
- более раннее достижение терапевтических целей;
- снижение риска развития побочных эффектов при комбинации препаратов в низких дозах по сравнению с повышением дозы одного препарата;
- возможность комбинации антигипергликемических препаратов со взаимодополняющими механизмами действия;
- повышение комплаенса на 30% по сравнению с применением свободной комбинации препаратов;
- потенциальная возможность замедления прогрессирования заболевания (Del Prato S. et al., 2005).
Фиксированная дозовая комбинация ПС + метформин может улучшить комплаенс по сравнению с многократным приемом таблеток с ожидаемой минимизацией побочных эффектов, вызванных монотерапией высокими дозами препарата, при эффективно контролируемом уровне глюкозы в крови (Melikian C. et al., 2002). В частности показано, что фиксированная комбинация глимепирид + метформин (начальная доза 1 мг/250 мг 2 раза в сутки) более эффективна относительно гликемического контроля, нежели титрование дозы метформина (начальная доза — 500 мг 2 раза в сутки). Отмечена хорошая переносимость комбинации пациентами с СД 2-го типа, неадекватно контролируемыми монотерапией метформином в низких дозах (Kim H.S. et al., 2014).
Фиксированную комбинацию глимепирида и метформина гидрохлорида (1 мг/250 мг соответственно) — препарат Амарил® М — широко применяют в клинической практике. Это эффективная комбинация с хорошей переносимостью, эквивалентная свободной комбинации (Lee S.-H. et al., 2006) (рис. 2).

Случаев тяжелой гипогликемии в группах не отмечено.
Заслуживают внимания результаты обсервационного с участием нескольких стран мультицентрового проспективного исследования S.A.A. Javaz и соавторов (2012), в котором применение фиксированной комбинации Амарил® M в течение 6 мес у представителей азиатской популяции с СД 2-го типа (n=1309) в повседневной практике было ассоциировано с высокой приверженностью терапии, эффективным улучшением гликемического контроля и благоприятным профилем безопасности (табл. 3).
| Параметр | Исходный | Спустя 6 мес | р |
|---|---|---|---|
| Уровень HbA1c, % | 8,92 | 7,17 | <0,001 |
| Гипогликемия, количество больных (%) | 39 (2,9); случаев тяжелой гипогликемии не отмечено | ||
| Тяжелые побочные эффекты, количество больных (%) | 4 (0,3) | ||
| Прекращение терапии ввиду отсутствия эффективности, количество больных (%) | 40 (3,06) | ||
Недавно разработана новая форма выпуска препарата с замедленным высвобождением (sustained release — SR) — Амарил® М СР. Предпосылки для создания фиксированных комбинаций с компонентом замедленного действия определяются:
- потенциально лучшей компенсацией СД при их применении по сравнению с применением свободной комбинации, эффективность которой зависит от приверженности лечению;
- преодолением побочных эффектов бигуанидов — прежде всего со стороны желудочно-кишечного тракта (ЖКТ), — отмечаемых чаще, чем при применении ПС (20 и 4% соответственно);
- очень редким развитием гипогликемии при применении бигуанидов (например метформина), в отличие от ПС.
В связи с этим подчеркнем особенности фармакокинетики метформина. Его абсолютная биодоступность при пероральном применении cоставляет 50–60%. Почти весь метформин, попадающий в кровоток, всасывается на ограниченном участке верхних отделов ЖКТ и лишь незначительная доля — в дистальных отделах. Кроме того, всасывание метформина в тонком кишечнике является насыщающимся:
- при повышении концентрации метформина в просвете кишечника выше порогового уровня происходит «насыщение всасывания», тем самым значительная часть препарата проходит мимо «окна абсорбции» и не всасывается вовсе;
- уровень всасывания метформина в ЖКТ зависит от скорости его эвакуации из желудка.
Эти особенности определяют сложность разработки таблеток метформина SR, доступных для приема 1 раз в сутки. Однако в последнее время эта проблема преодолена благодаря созданию системы доставки для контролируемого (замедленного) выделения метформина — GelShield Diffusion System и мультиполимерному гидрофильному матриксу, использованным при разработке фиксированной дозовой комбинации метформина SR и глимепирида (Aмарил® M СР) (Timmins P. et al., 2005).
Таблетки Aмарил® M СР имеют:
- матриксный слой, в котором метформина гидрохлорид смешан с гидрофильными макромолекулами, контролирующими выделение лекарства;
- промежуточный покрывающий слой, состоящий из гидрофильных макромолекул для независимого выделения метформина гидрохлорида из внутреннего слоя;
- наружный глимепиридный слой и гидрофильные макромолекулы, покрывающие слой, содержащий глимепирид.
После приема таблетки полимеры наружного слоя гидратируются и вызывают превращение ее в гелеподобную массу. Первоначальный размер таблетки и ее трансформация в неразрушающийся (non-disintegrating) гель могут временно предупредить ее транзит через привратник желудка (при введении с пищей), что увеличивает продолжительность ее нахождения в желудке (Timmins P. et al., 2005).
Отметим, что в одном из исследований III фазы клинических испытаний показана терапевтическая эффективность, а именно изменение уровня HbA1c после 16-недельной терапии комбинацией глимепирид/метформин SR 2 мг/500 мг 1 раз в сутки, эквивалентная комбинации глимепирид/ метформин IR (immediate release — немедленного высвобождения) 1 мг/250 мг 2 раза в сутки (Lee S.-H. et al., 2006). Это значит, что новую форму глимепирид/ метформин SR можно применять 1 раз в сутки, основываясь на терапевтической эквивалентности, несмотря на несколько сниженную биодоступность SR-формы (Kim K.P. et al., 2012).
Обратим внимание на то, что всасывание метформина в форме таблеток пролонгированного действия происходит на ограниченном участке верхних отделов ЖКТ. Это весьма существенно, поскольку при повышении концентрации препарата в просвете кишечника выше порогового уровня происходит «насыщение всасывания», а при простом замедлении высвобождения активного вещества из таблетки его всасывание происходит на всем протяжении кишечника.
Преимущества устройства для доставки метформина гидрохлорида включают:
- оптимальную абсорбцию;
- меньшее вовлечение/раздражение нижних отделов ЖКТ;
- лучшую биодоступность и достижение оптимальной концентрации в плазме крови.
У пациентов с СД 2-го типа таблетки Амарил® М СР можно применять менее часто, с меньшими побочными эффектами со стороны ЖКТ и с ожидаемым повышением приверженности терапии, а также соотношения стоимость/выгода препарата при длительном применении новой лекарственной формы по сравнению с таблетками Амарил® М.
Список использованной литературы
- Полторак В.В., Горшунская М.Ю. (2010) Сахарный диабет 2-го типа: два патогенетических дефекта, две мишени для терапевтического воздействия. Ліки України, 6(142): 82–85.
- Полторак В.В., Кравчун Н.С., Горшунская М.Ю., Красова Н.С. (2014) Глимепирид (Амарил®) в терапии больных сахарным диабетом 2 типа (патофизиологическое обоснование и клиническая реализация). Мiжнар. ендокринол. журн., 1(57): 77–89.
- Abdul-Ghani M.A., Tripathy D., DeFronzo R.A. (2006) Contribution of beta-cell dysfunction and insulin resistance to the pathogenesis of impaired glucose tolerance and impaired fasting glucose. Diabetes Care, 29(5): 1130–1139.
- Ahmad N.S., Ramli A., Islahudin F., Paraidathathu T. (2013) Medication adherence in patients with type 2 diabetes mellitus treated at primary health clinics in Malaysia. Patient Prefer. Adherence, 7: 525–530.
- American Diabetes Association (2014) Executive summary: Standards of medical care in diabetes-2014. Diabetes Care, 37(Suppl.1): S5–S13.
- Cefalu W.T. (2007) Pharmacotherapy for the treatment of patients with type 2 diabetes mellitus: rationale and specific agents. Clin. Pharmacol. Ther., 81(5): 636–649.
- Charpentier G., Fleury F., Kabir M. et al. (2001) Improved glycaemic control by addition of glimepiride to metformin monotherapy in type 2 diabetic patients. Diabet. Med., 18(10): 828–834.
- Cramer J.A. (2004) A systematic review of adherence with medications for diabetes. Diabetes Care, 27(5): 1218–1224.
- Cusi K., Consoli A., DeFronzo R.A. (1996) Metabolic effects of metformin on glucose and lactate metabolism in noninsulin-dependent diabetes mellitus. J. Clin. Endocrinol. Metab., 81(11): 4059–4067.
- Davis S.N. (2004) The role of glimepiride in the effective management of type 2 diabetes. J. Diabetes Complications, 18(6): 367–376.
- Del Prato S., Felton A.M., Munro N. et al. (2005) Improving glucose management: ten steps to get more patients with type 2 diabetes to glycaemic goal. Int. J. Clin. Pract., 59(11): 1345–1355.
- Donnan P.T., MacDonald T.M., Morris A.D. (2002) Adherence to prescribed oral hypoglycaemic medication in a population of patients with type 2 diabetes: a retrospective cohort study. Diabet. Med., 19(4): 279–284.
- Gu N., Kim B.H., Rhim H. et al. (2010) Comparison of the bioavailability and tolerability of fixed dose combination glimepiride/metformin 2/500-mg tablets versus separate tablets: A single-dose, randomized-sequence, open-label, two-period, crossover study in healthy Korean volunteers. Clin. Ther., 32(7): 1408–1418.
- Holman R.R., Paul S.K., Bethel M.A. et al. (2008) 10-year follow-up of intensive glucose control in type 2 diabetes. N. Engl. J. Med., 359(15): 1577–1589.
- International Diabetes Federation (2013) IDF Diabetes Atlas (http://www.idf.org/diabetesatlas).
- Inzucchi S.E., Bergenstal R.M., Buse J.B. et al.; American Diabetes Association (ADA), European Association for the Study of Diabetes (EASD) (2012) Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care, 35(6): 1364–1379.
- Javaz S.A.A., Soewondo P., Wang E., Admane K. (2012) PERSISTence on Glimepiride-Metformin (Amaryl M®) Fixed Combination in Everyday Practice in Asian Type 2 Diabetes Patients. American Diabetes Association, 72nd scientific sessions, June 8–12, Philadelphia, Abstract № 1124-P (http://diabetes.diabetesjournals.org/content/61/Supplement_1/A212.full.pdf).
- Johnson S.B. (1992) Methodological issues in diabetes research. Measuring adherence. Diabetes Care, 15(11): 1658–1667.
- Jojima T., Suzuki K., Hirama N. et al. (2009) Glimepiride upregulates eNOS activity and inhibits cytokine-induced NF-kappaB activation through a phosphoinoside 3-kinase-Akt-dependent pathway. Diabetes Obes. Metab., 11(2): 143–149.
- Kim B.H., Shin K.H., Kim J. et al. (2009) Pharmacokinetic comparison of a new glimepiride 1-mg + metformin 500-mg combination tablet formulation and a glimepiride 2-mg + metformin 500-mg combination tablet formulation: a single-dose, randomized, open-label, two-period, two-way crossover study in healthy, fasting Korean male volunteers. Clin. Ther., 31(11): 2755–2764.
- Kim H.S., Kim D.M., Cha B.S. et al. (2014) Efficacy of glimepiride/metformin fixed-dose combination vs metformin uptitration in type 2 diabetic patients inadequately controlled on low-dose metformin monotherapy: A randomized, open label, parallel group, multicenter study in Korea. J. Diabetes Investig., 5(6): 701–708.
- Kim K.P., Lim K.S., Kim B.H. et al. (2012) Pharmacokinetics of a fixed-dose glimepiride/sustained-release metformin combination. Int. J. Clin. Pharmacol. Ther., 50(2): 142–149.
- Kim Y.D., Park K.G., Lee Y.S. et al. (2008) Metformin inhibits hepatic gluconeogenesis through AMP-activated protein kinase-dependent regulation of the orphan nuclear receptor SHP. Diabetes, 57(2): 306–314.
- Koshiba K., Nomura M., Nakaya Y., Ito S. (2006) Efficacy of glimepiride on insulin resistance, adipocytokines, and atherosclerosis. J. Med. Invest., 53(1–2): 87–94.
- Lee S.-H., Lee I.-K., Baik S.-H. et al. (2006) Comparison of the Efficacy and Safety of Glimepiride/Metformin Fixed Combination Versus Free Combination in Patients with Type 2 Diabetes: Multicenter, Randomized, Controlled Trial. J. Korean Diabetes Assoc., 30(6): 466–475.
- Lee T.M., Chou T.F. (2003) Impairment of myocardial protection in type 2 diabetic patients. J. Clin. Endocrinol. Metab., 88(2): 531–537.
- Melikian C., White T.J., Vanderplas A. et al. (2002) Adherence to oral antidiabetic therapy in a managed care organization: a comparison of monotherapy, combination therapy, and fixed-dose combination therapy. Clin. Ther., 24(3): 460–467.Nakamura I., Oyama J., Komoda H. et al. (2014) Possible effects of glimepiride beyond glycemic control in patients with type 2 diabetes: a preliminary report. Cardiovasc. Diabetol., 13: 15.
- Nyenwe E.A., Jerkins T.W., Umpierrez G.E., Kitabchi A.E. (2011) Management of type 2 diabetes: evolving strategies for the treatment of patients with type 2 diabetes. Metabolism, 60(1): 1–23.
- Pan F., Chernew M.E., Fendrick A.M. (2008) Impact of fixed-dose combination drugs on adherence to prescription medications. J. Gen. Intern. Med., 23(5): 611–614.
- Rendell M. (2004) The role of sulphonylureas in the management of type 2 diabetes mellitus. Drugs, 64(12): 1339–1358.
- Rodbard H.W., Blonde L., Braithwaite S.S. et al.; AACE Diabetes Mellitus Clinical Practice Guidelines Task Force (2007) American Association of Clinical Endocrinologists medical guidelines for clinical practice for the management of diabetes mellitus. Endocr. Pract., 13 Suppl. 1: 1–68.
- Rozenfeld Y., Hunt J.S., Plauschinat C., Wong K.S. (2008) Oral antidiabetic medication adherence and glycemic control in managed care. Am. J. Manag. Care, 14(2): 71–75.
- Schiekofer S., Rudofsky G. Jr., Andrassy M. et al. (2003) Glimepiride reduces mononuclear activation of the redox-sensitive transcription factor nuclear factor-kappa B. Diabetes Obes. Metab., 5(4): 251–261.
- Timmins P., Donahue S., Meeker J., Marathe P. (2005) Steady-state pharmacokinetics of a novel extended-release metformin formulation. Clin. Pharmacokinet., 44(7): 721–729.
- Turner R.C., Cull C.A., Frighi V., Holman R.R. (1999) Glycemic control with diet, sulfonylurea, metformin, or insulin in patients with type 2 diabetes mellitus: progressive requirement for multiple therapies (UKPDS 49). UK Prospective Diabetes Study (UKPDS) Group. JAMA, 281(21): 2005–2012.
- UK Prospective Diabetes Study Group (1998a) Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet, 352(9131): 854–865.
- UK Prospective Diabetes Study Group (1998b) Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet, 352(9131): 837–853.
- UK Prospective Diabetes Study Group (1998c) UKPDS 28: a randomized trial of efficacy of early addition of metformin in sulfonylurea-treated type 2 diabetes. U.K. Prospective Diabetes Study Group. Diabetes Care, 21(1): 87–92.
- Umpierrez G., Issa M., Vlajnic A. (2006) Glimepiride versus pioglitazone combination therapy in subjects with type 2 diabetes inadequately controlled on metformin monotherapy: results of a randomized clinical trial. Curr. Med. Res. Opin., 22(4): 751–759.
- Weitgasser R., Lechleitner M., Luger A., Klingler A. (2003) Effects of glimepiride on HbA(1c) and body weight in Type 2 diabetes: results of a 1.5-year follow-up study. Diabetes. Res. Clin. Pract., 61(1): 13–19.
Получено 25.12.2014