Діагноз хронічний лімфоїдний лейкоз (ХЛЛ) (хронічна лімфоїдна/лейкоцитарна лейкемія) встановлюють на основі морфологічного дослідження лімфоцитів периферичної крові, наявності циркулюючих клональних В-клітин у кількості >5·109/л, що зберігається протягом більше 2 міс, та імунофенотипування клітин периферичної крові у закладах спеціалізованої допомоги або підрозділах закладів охорони здоров’я, в яких здійснюється спеціальне протипухлинне лікування (далі — спеціальні структурні підрозділи). У випадках прогресування захворювання, коли відсутні показання до продовження спеціального лікування, пацієнти потребують адекватного знеболення згідно з Уніфікованим клінічним протоколом паліативної медичної допомоги при хронічному больовому синдромі, інших заходів із паліативної допомоги, а також симптоматичного лікування (рис. 1).

Діагностика ХЛЛ
Діагностика ХЛЛ полягає у підтвердженні за допомогою морфологічного методу наявності злоякісного новоутворення, яке походить із лімфоїдної тканини, та обов’язково — імунофенотипування патологічних лімфоцитів периферичної крові.
Обов’язковим є визначення поширення пухлинного процесу та встановлення стадії.
Перед початком спеціального лікування необхідно обстежити пацієнта з метою оцінки протипоказань до застосування спеціального лікування.
Перед початком спеціального лікування необхідно визначити прогностичні фактори з метою визначення групи ризику (див. рис. 1, табл. 1–3).
| Стадія | Клінічні характеристики |
|---|---|
| 0 | Лімфоцитоз у периферичній крові/кістковому мозку ізольовано |
| I | Лімфоцитоз та лімфаденопатія |
| II | Лімфоцитоз та гепатомегалія та/чи спленомегалія (+/– лімфаденопатія) |
| III | Лімфоцитоз та анемія (гемоглобін <110 г/л) +/– лімфаденопатія, спленомегалія та/чи гепатомегалія |
| IV | Лімфоцитоз і тромбоцитопенія (кількість тромбоцитів <100 Г/л) +/– анемія, лімфаденопатія, спленомегалія та/чи гепатомегалія |
| Стадія | Клінічні характеристики |
|---|---|
| А | Гемоглобін >100 г/л, тромбоцити >100 Г/л, залучення до процесу <3 лімфатичних зон |
| В | Гемоглобін >100 г/л, тромбоцити >100 Г/л, залучення до процесу ≥3 лімфатичних зон |
| С | Гемоглобін ≤100 г/л, або кількість тромбоцитів ≤100 Г/л, або поєднання цих ознак |
Міжнародного семінару з ХЛЛ
(International Workshop on Chronic Lymphocytic Leukemia, 1989)
| Стадія | Клінічні характеристики | Співвідношення зі стадіями за Rai та Binet |
|---|---|---|
| А | Відсутність анемії та тромбоцитопенії та залучення до процесу <3 лімфатичних зон | A(0), A(I), A(II) |
| В | Відсутність анемії та тромбоцитопенії та залучення до процесу ≥3 лімфатичних зон | B(I), B(II) |
| С | Анемія та/чи тромбоцитопенія незалежно від кількості уражених лімфатичних зон | C(III), C(IV) |
Системи стaдіювання ХЛЛ
В організмі людини виділяють 8 лімфоїдних зон:
- Шийно-надключична (двобічна) включає привушний, верхньошийний, середньо- або нижньошийний, задньошийний, надключичний лімфоїдні регіони.
- Аксилярна (двобічна).
- Ліктьова (двобічна).
- Медіастинальна (однобічна) включає паратрахеальний, медіастинальний лімфоїдні регіони, лімфатичні вузли кореня легені.
- Мезентеріальна (однобічна) включає мезентеріальний, портальний, черевний, воріт селезінки лімфоїдні регіони.
- Парааортальна (однобічна) включає парааортальний, загальний клубовий, зовнішній клубовий лімфоїдні регіони.
- Пахова (двобічна) включає паховий, стегновий лімфоїдні регіони.
- Підколінна (двобічна).
Пацієнти можуть звернутися з лімфаденопатією, системними симптомами, такими як втома, нічна пітливість і втрата маси тіла, чи симптомами анемії або інфекції. Однак у більшості пацієнтів діагностування є випадковим при виконанні розгорнутого аналізу крові. Під час проведення клінічної оцінки необхідно дослідити: сімейний анамнез лімфоїдних злоякісних пухлин, визначення клінічної стадії та встановлення зв’язку B-симптомів і цитопенії із ХЛЛ.
Обстеження кісткового мозку не є суттєвим для діагностики ХЛЛ, але обов’язкове для визначення повної відповіді. Біопсія лімфатичних вузлів передбачена, за наявності діагностичної чи клінічної невизначеності щодо лімфоматозних трансформацій. Комп’ютерна томографія (КТ) не є обов’язковим методом для стадіювання захворювання, а у безсимптомних пацієнтів після лікування не відіграє важливої ролі для моніторингу. Тест на визначення вагітності необхідний для уникнення тератогенного впливу спеціального лікування на плід, якщо хвора на ХЛЛ фертильного віку.
Дії лікаря
Обов’язкові
1. Збір анамнестичних даних, зокрема виявлення В-симптомів.
2. Фізикальне обстеження, спрямоване на виявлення збільшених периферичних лімфатичних вузлів, визначення розмірів печінки, селезінки.
3. Для жінок фертильного віку — тест на вагітність, при позитивному результаті необхідно обговорити можливість подальшого зберігання вагітності.
4. Оцінка загального стану пацієнта за допомогою шкали Карновського та ECOG (табл. 4).
| Індекс Карновського | Активність, % | Шкала ECOG-ВООЗ | Оцінка |
|---|---|---|---|
| Стан нормальний, скарг немає | 100 | Нормальна активність | – |
| Здатен до нормальної діяльності, незначні симптоми чи ознаки захворювання | 90 | Є симптоми захворювання, але ближче до нормального стану | 1 |
| Нормальна активність із зусиллям | 80 | ||
| Обслуговує себе самостійно, не здатен до нормальної діяльності чи активної роботи | 70 | >50% денного часу проводить не в ліжку, але іноді потребує відпочинку | 2 |
| Часом потребує допомоги, але здатен самостійно задовольняти більшість своїх потреб | 60 | ||
| Потребує значної допомоги та медичного обслуговування | 50 | Потребує знаходження в ліжку >50% денного часу | 3 |
| Інвалід, потребує спеціальної допомоги, в тому числі медичної | 40 | ||
| Тяжка інвалідність, показана госпіталізація, але смерть не прогнозується | 30 | Не здатен себе обслуговувати, прикутий до ліжка | 4 |
| Тяжкий пацієнт. Необхідне активне лікування та госпіталізація | 20 | ||
| Пацієнт помирає | 0 |
5. Верифікація діагнозу.
5.1. Розгорнутий загальний аналіз крові.
5.2. Стернальна пункція/трепанобіопсія кісткового мозку з подальшим морфологічним дослідженням матеріалу. Якщо матеріал неналежної якості — повторне (до 3 разів) дослідження до отримання результатів належної якості (за показаннями).
5.3. Імунофенотипування патологічних лімфоцитів периферичної крові та кісткового мозку (мінімальна панель для імунофенотипування має включати — CD19, CD5, CD23, CD79b, κ, λ, CD20, CD10, CD38).
6. З метою уточнення стадії злоякісного новоутворення та обґрунтування плану лікування пацієнта.
6.1. Лабораторні дослідження:
а) біохімічний аналіз крові (лактатдегідрогеназа (ЛДГ), загальний білок, креатинін, сечовина, аланінамінотрансфераза (АлАТ), аспартатамінотрансфераза (АсАТ), рівень глюкози);
б) коагулограма;
в) обстеження на сифіліс, ВІЛ;
г) обстеження на гепатит В, С, при позитивних результатах — кількісна полімеразна ланцюгова реакція (ПЛР) і консультація інфекціоніста;
д) загальний аналіз сечі;
е) тест Кумбса — виконується при підозрі щодо розвитку аутоімунної гемолітичної анемії (АІГА).
6.2. Інструментальні дослідження:
а) електрокардіографії (ЕКГ)/ехокардіографії;
б) ендоскопія — за наявності симптомів ураження шлунково-кишкового тракту (ШКТ);
в) ультразвукове дослідження (УЗД) черевної порожнини та заочеревинного простору, малого таза — за показаннями;
г) КТ та магнітно-резонансну томографію головного мозку призначають при симптомах ураження центральної нервової системи.
7. При підозрі трансформації ХЛЛ.
7.1. Хірургічна біопсія вогнища ураження з цитологічним/гістологічним дослідженням матеріалу, мазків-відбитків для проведення диференційної діагностики.
Перелік оперативних втручань, які застосовують для діагностики: ексцизійна біопсія ураженого периферичного лімфатичного вузла чи органа; діагностична торако-/лапаротомія з біопсією, або трепанобіопсія вогнища ураження, або торако-, медіастино-, лапароскопія із прицільною біопсією.
7.2. КТ шиї, органів грудної клітки, черевної порожнини, заочеревинного простору, малого таза із внутрішньовенним (в/в) введенням контрасту.
Бажані
1. Рівень β2-мікроглобуліну в сироватці крові.
2. Цитогенетичне/FISH-дослідження (для виявлення хромосомних аберацій: t(11;14); t(11q;v); +12; del(11q); del(13q); del(17p), TP53).
3. Цитофлуорометричне чи імуногістохімічне дослідження для визначення CD38.
4. Молекулярно-генетичне дослідження для встановлення мутаційного статусу IgVH.
Госпіталізація
До спеціального структурного підрозділу пацієнт з підозрою на ХЛЛ направляє лікар загальної практики — сімейний лікар/дільничний терапевт, районний онколог, гематолог, інший лікар-спеціаліст.
Запідозрений діагноз ХЛЛ потребує проведення інвазивних діагностичних процедур, спеціального лікування за відсутності протипоказань.
Дії лікаря
Ознайомити пацієнта з переліком можливих втручань, очікуваними ризиками та отримати перед госпіталізацією до стаціонару Інформовану добровільну згоду пацієнта на проведення діагностики, лікування та на проведення операції та знеболення (форма № 003-6/о), погодити Інформовану добровільну згоду пацієнта на обробку персональних даних (Вкладний листок до облікової форми № 003/о).
Лікування пацієнтів із ХЛЛ
Спеціальне лікування ХЛЛ полягає у застосуванні хіміо-, імунотерапії в різних комбінаціях залежно від стану пацієнта і стадії пухлини, іноді — променевої терапії.
Терапію при ХЛЛ необхідно починати лише за наявності показань для лікування (див. Дії лікаря).
Пацієнти, які мають стадію А та статус «стабільного захворювання», підлягають щорічному спостереженню.
Пацієнти, які мають стадію А та АІГА чи ідіопатичну тромбоцитопенію, мають отримувати лікування з приводу цих ускладнень, а не протипухлинну терапію. Виявлення маркерів негативного прогнозу, у тому числі 17q, при невеликій масі пухлини не є показанням до початку терапії.
Вибір лікування при ХЛЛ визначається стадією захворювання, наявністю прогностичних факторів, віком та загальним станом пацієнта, а також додатковими даними, які характеризують певні властивості пухлини й організму пацієнта.
Доведено, що у групах порівняння пацієнтів зі стабільним перебігом ХЛЛ із низьким ризиком 10-річна виживаність була однаковою як при відстроченому, так і невідкладному лікуванні.
Протипухлинна медикаментозна та променева терапія спрямована на біохімічні процеси в оболонці, цитоплазмі, органелах або генетичному апараті клітин злоякісного новоутворення. Спільною властивістю цих процесів є певний часовий порядок. Саме тому застосування лікувальних втручань упорядковане у вигляді схем із точним визначенням дози і терміну прийому кожного лікарського засобу.
Дії лікаря
1. Призначити спостереження/спеціальне лікування та обстеження у процесі лікування.
Вибір лікування при ХЛЛ визначається стадією захворювання, морфологічною формою пухлини, віком та загальним станом пацієнта, а також додатковими даними, які характеризують окремі властивості пухлини й організму пацієнта.
Перед призначенням лікування обов’язкова морфологічна верифікація діагнозу і максимально точне визначення стадії захворювання, групи ризику.
Загальний план лікування та спостереження, хіміо- та імунотерапії складає гематолог, який залучає для планування оперативних втручань хірурга-онколога, для планування променевої терапії — лікаря з променевої терапії, за необхідності — інших спеціалістів.
2. Моніторинг стану пацієнта, виявлення побічних ефектів спеціального протипухлинного лікування, симптоматична терапія, лікування супутньої патології згідно з відповідними медико-технологічними документами (див. табл. 5–11, рис. 2–3).
| Пов’язані з пацієнтом | Вік |
| Стать | |
| Загальний стан | |
| Супутні захворювання, особливо кліренс креатиніну <60 мл/хв | |
| Пов’язані із захворюванням | Стадія хвороби |
| Ураження кісткового мозку | |
| Імунодефіцит/аутоімунність | |
| Лімфоматозна трансформація | |
| Біомаркери | |
| Пов’язані з лікуванням | Тип лікування |
| Відповідь/токсичність | |
| Статус МЗХ |
Міжнародного семінару з хронічної лімфоцитарної лейкемії
(International Workshop on Chronic Lymphocytic Leukemia, IWCLL)
| Результат лікування | Критерії |
|---|---|
| Повна відповідь (ПВ) | Відсутність лімфаденопатії та гепатоспленомегалії;
відсутність «загальних симптомів» (втрата маси тіла, профузне нічне потіння); нормальні показники крові, а саме: кількість нейтрофілів ≥1,5 Г/л, кількість тромбоцитів ≥ 100 Г/л, кількість лімфоцитів ≤4 Г/л, вміст гемоглобіну ≥110 г/л; в мієлограмі та трепанобіоптаті кількість лімфоцитів менше 30%. Якщо в біоптаті кісткового мозку виявляються нодулярні скупчення лімфоцитів, це не суперечить критеріям повної ремісії |
| Часткова відповідь (ЧВ) | ≥50% зниження кількості лімфоцитів периферичної крові;
≥50% зменшення лімфаденопатії та/або ≥50% зменшення розмірів селезінки та/або печінки + один із нижчевказаних критеріїв: – кількість гранулоцитів ≥1,5 Г/л (або збільшення на 50% порівняно з вихідними показниками); – кількість тромбоцитів ≥100 Г/л (або збільшення на 50% порівняно з вихідними показниками); – вміст гемоглобіну ≥110 г/л (або збільшення на 50% порівняно з вихідними показниками) |
| Прогресування захворювання (ПЗ) | ≥50% збільшення в діаметрі хоча б двох лімфовузлів під час двох останніх оглядів з інтервалом у 2 тиж. Щонайменше один лімфовузол має становити ≥2 см в діаметрі; поява нових збільшених лімфовузлів; ≥50% збільшення розмірів печінки та/чи селезінки; поява гепато- або спленомегалії, які раніше не визначалися; ≥50% підвищення абсолютної кількості циркулюючих лімфоцитів (загальна кількість при цьому повинна бути не менше ніж 5 Г/л); трансформація в більш агресивні форми захворювання (синдром Ріхтера, пролімфоцитарний лейкоз) |
| Стабілізація захворювання (СЗ) | Не настало ні повної, ні часткової ремісії та відсутні ознаки прогресування захворювання |
які застосовують для лікування пацієнтів із ХЛЛ
| Назва схеми | Склад схеми та особливості застосування | |
|---|---|---|
| ChL±R | Хлорамбуцил у дозі 10 мг/добу 7–14 днів.
Ритуксимаб 375 мг/м2 поверхні тіла в/в у 1-й день. Проводять кожні 3 тиж. Наступний курс починають на 22-й день від 1-го дня попереднього курсу |
|
| ChL±Офатумумаб | Хлорамбуцил у дозі 10 мг/добу 7–14 днів.
Офатумумаб 2000 мг в/в у 1-й день. Проводять кожні 4 тиж. Наступний курс починають на 29-й день від 1-го дня попереднього курсу |
|
| ChL+Oбінутузумаб* | Обінутузумаб: 1 цикл: 1000 мг в/в в 1-, 8- та 15-й день.
2–6 цикл: 1000 мг в/в у 1-й день. Хлорамбуцил перорально в 1-й та 15-й день у дозі 0,5 мг/кг маси тіла. Проводять кожні 4 тиж. Наступний курс починають на 29-й день від 1-го дня попереднього курсу. *Особи похилого віку, які попередньо не отримували лікування, мають супутні захворювання та яким неможливе проведення терапії на основі флударабіну в повних дозах |
|
| B±R* | Бендамустин 90мг/ м2 в/в 1-й та 2-й день.
Ритуксимаб 375 мг/м2 1 цикл, потім із 2-го циклу — 500 мг/м2 в/в в 1-й день. Проводять кожні 4 тиж. Наступний курс починають на 2-й день від 1-го дня попереднього курсу. *Для пацієнтів віком старше 70 років або осіб молодше 70 років із наявною супутньою патологією |
|
| F±R | Флударабін 25 мг/м2 в/в — 1–5-й день.
Ритуксимаб 375 мг/м2 в/в у 1-й день, починаючи з 3-го циклу. Проводять кожні 4 тиж. Наступний курс починають на 29-й день від 1-го дня попереднього курсу |
|
| FC±R | Флударабін 25 мг/м2 в/в — 1–3-й день.
Циклофосфамід 200 мг/м2 в/в — 1–3-й день. Ритуксимаб 375 мг/м2 в/в у 1-й день. Проводять кожні 4 тиж. Наступний курс починають на 29-й день від 1-го дня попереднього курсу |
|
| FC±R-редукована | Ритуксимаб 375 мг/м2 в/в інфузія в 1-й день.
Флударабін 20 мг/м2 в/в у 1–3-й день. Циклофосфамід 150 мг/м2 в/в у 1–3-й день. Проводять кожні 4 тиж. Наступний курс починають на 29-й день від 1-го дня попереднього курсу |
|
| Ібрутиніб | Ібрутиніб 420 мг перорально щоденно | |
| Офатумумаб | Офатумумаб 300 мг в/в інфузія в 1-й день 1-го тижня, потім 2000 мг в/в інфузія 1 раз на 7 днів.
Проводять 8 тиж, потім кожні 4 тиж — 4 інфузії |
|
| CVР±R | Ритуксимаб 375 мг/м2 в/в 2–3-годинна інфузія в 1-й день.
Циклофосфамід 300 мг/м2 в/в у 1–5-й день. Вінкристин 1,4 мг/м2 (максимально — 2 мг) в/в у 1-й день. Преднізолон 40 мг/м2 перорально 1–5-й день. Проводять кожні 3 тиж. Наступний курс починають на 22-й день від 1-го дня попереднього курсу |
|
| HDMP±R | Ритуксимаб 375 мг/м2 в/в у 1-й день.
Метилпреднізолон 1 г/м2 в/в у 1–5-й день. Проводять кожні 3 тиж. Наступний курс починають на 22-й день від 1-го дня попереднього курсу |
|
| FCM±R | Флударабін 25 мг/м2 в/в у 1–3-й день.
Циклофосфамід 200 мг/м2 в/в у 1–3-й день. Мітоксантрон 6 мг/м2 в/в у 1-й день. Ритуксимаб 375 мг/м2 в/в у 1-й день. Проводять кожні 4 тиж. Наступний курс починають на 29-й день від 1-го дня попереднього курсу |
|
| CHOP±R | Ритуксимаб 375 мг/м2 в/в 2–3-годинна інфузія в 1-й день.
Циклофосфамід 750 мг/м2 в/в у 1-й день. Доксорубіцин 50 мг/м2 в/в у 1-й день. Вінкристин 1,4 мг/м2 (максимально — 2 мг) в/в у 1-й день. Преднізолон 60 мг/м2 перорально у 1–5-й день. Проводять кожні 3 тиж. Наступний курс починають на 22-й день від 1-го дня попереднього курсу |
|
| Стан пацієнта з ХЛЛ | Схеми, що застосовуються |
|---|---|
| Пацієнти будь-якого віку з поганим соматичним станом та наявністю тяжкої супутньої патології | ChL±R/обінутузумаб/офатумумаб; HDMP±R; В±R; офатумумаб; CVР±R |
| Пацієнти віком старше 70 років або пацієнти молодші 70 років із наявною супутньою патологією | ChL±R/обінутузумаб/офатумумаб; CVР±R; F±R;
FC±R-редукована; B±R; офатумумаб |
| Пацієнти віком молодші 70 років без наявної супутньої патології | FC±R; F±R; B±R; CVР± R |
| Стадія та прогностичні фактори | Обсяг лікування |
|---|---|
| I — IV | 6–8 курсів ПХТ.
Обов’язкова оцінка відповіді після 4 курсів ПХТ. За відсутності відповіді проводять терапію згідно з правилами лікування рефрактерної форми (або призначають редуковані схеми ПХТ) |
або рецидивною формою ХЛЛ
| Стан пацієнта з ХЛЛ | Схеми ПХТ, що застосовують для лікування |
|---|---|
| Пацієнти з рецидивом після тривалої ремісії | Повторити терапію першої лінії |
| Пацієнти віком 70 років і старше з нетривалою відповіддю на терапію першої лінії | Ібрутиніб; FC±R-редукована; HDMP±R; ChL±R; F±R; CVР±R; B±R; офатумумаб |
| Пацієнти віком молодше 70 років із нетривалою відповіддю на терапію першої лінії без супутньої патології | Ібрутиніб; FC±R; F±R; HDMP±R; B±R; CHOP±R; FCM±R |
| Пацієнти з наявністю делеції 17q/наявністю аномалії TP53 | Ібрутиніб; HDMP±R; B±R; CHOP±R; ChL±R, FC±R; F±R; обінутузумаб+Chl |
| Пацієнти з рецидивом із наявністю делеції 17q/наявністю аномалії TP53 | Ібрутиніб; HDMP±R; CHOP±R; офатумумаб |
| Пацієнти з наявністю делеції 11 q | FC±R; B±R; HDMP±R; обінутузумаб+Chl.
Похилий вік, поліморбідність: Chl±R/обінутузумаб/офатумумаб; B±R; FC±R — редукована; Chl; R |
| Пацієнти з рецидивом та наявністю делеції 11 q | Ібрутиніб; FC±R; B±R; обінутузумаб; офатумумаб; HDMP±R.
Похилий вік, поліморбідність: ібрутиніб; B±R; FC±R-редукована HDMP±R; Chl+R; CHOP±R; обінутузумаб; офатумумаб |
| Стадії та прогностичні фактори | Обсяг лікування |
|---|---|
| I–IV | 6–8 курсів ПХТ.
Обов’язкова оцінка відповіді після 4 курсів ПХТ. За відсутності відповіді проводять терапію згідно з алгоритмом лікування рефрактерної форми або призначають редуковані схеми ПХТ |
| Побічні явища | Ступінь | |||
|---|---|---|---|---|
| І | ІІ | ІІІ | ІV | |
| Гемоглобін, г/л | <НМН — 100 г/л | 80–100 г/л | 65–80 г/л | <65 г/л |
| Лейкоцити 109/л | <НМН — 3,0·109 | 2,0–2,9·109 | 1,0–1,9·109 | <1,0·109 |
| Гранулоцити 109/л | <НМН — 1,5·109 | 1,0–1,4·109 | 0,5–0,9·109 | <0,5·109 |
| Тромбоцити 109/л | <НМН — 75·109 | 50–74·109 | 25–49·109 | <25·109 |
| Білірубін | >ВМН — 1,5·ВМН | >1,5–3,0·ВМН | >3,0–10·ВМН | >10,0·ВМН |
| Лужна фосфатаза | >ВМН — 2,5·ВМН | >2,5–5·ВМН | >5–20,0·ВМН | >20,0·ВМН |
| АсАТ, АлАТ | >ВМН — 2,5·ВМН | >2,5–5,0·ВМН | >5,0–20,0 ·ВМН | >20,0·ВМН |
| Діарея | 2–3 епізоди випорожнення на добу | 4–6 епізодів на добу чи випорожнення декілька разів уночі | 7–9 епізодів на добу, нетримання, синдром мальадсорбції | ≥10 разів на добу, кров’яна діарея, дегідратація, потребує в/в введення рідини |
| Нудота | Вживає помірну кількість їжі | Кількість їжі значно зменшена | Практично не вживає їжі | – |
| Блювання | 1 раз на добу | 2–5 разів на добу | 6–10 разів на добу | >10 разів на добу |
| Мукозит/стоматит | Свербіж, печія, еритема | Еритема, виразки, прийом їжі вільний | Виразки, важко приймати їжу, необхідна лише рідка їжа | Приймати їжу неможливо. Некроз слизової оболонки |
| Креатинін | >ВМН — 1,5·ВМН | >1,5–3·ВМН | >3–6·ВМН | >6·ВМН |
| Протеїнурія | 0,15–1,0 г/24 год | >1,0–3,5 г/24год | >3,5 г/24 год | Нефротичний синдром |
| Гіперглікемія | >ВМН — 8,9 ммоль/л | >8,9—13,9 ммоль/л | >13,9—27,8 ммоль/л | >27,8 ммоль/л |
| Гіпоглікемія | <НМН — 3,0 ммоль/л | 3,0—2,2 ммоль/л | 2,2—1,7 ммоль/л | <1,7 ммоль/л |
| Гіпертермія | 38–39 °С | 39–40 °С | >40 °С протягом ≤24 год | >40 °С протягом >24 год |
| Алергічні реакції | Почервоніння чи висип
Медикаментозна лихоманка >38 °С |
Висип
Почервоніння Кропивниця Задишка Медикаментозна лихоманка >38 °С |
Симптоматичний бронхоспазм з/без кропивниці
Набряк Гіпотонія |
Анафілактичний шок |
| Волосся | Мінімальна втрата волосся | Помірна гніздова алопеція | Повна алопеція | |
| Порушення серцевого ритму | Середнє | Виражене | Серйозне | Загроза життю |
| Гіпертензія | Асимптоматична, транзиторна, <24 год >20 мм рт. ст. (діастолічний АТ) або >150/100 мм рт. ст. | Періодичне чи постійне >24 год >20 мм рт. ст. (діастолічний АТ) або >150/100 мм рт. ст. | Потребує >1 лікарського засобу або інтенсивнішої терапії, ніж раніше | Загроза життю |
| Периферичні невропатії | Парестезії/чи зниження сухожильних рефлексів | Тяжкі парестезії, помірна слабкість | Нестерпні парестезії, втрата рухових реакцій | Параліч |
| Синдром лізису пухлини | – | – | Наявний | Загроза життю, необхідна інтенсивна терапія |
| Фебрильна нейтропенія | – | – | Наявна | Загроза життю, необхідна інтенсивна терапія |
| Екстравазація в місці введення | – | Еритема із супутніми симптомами (флебіт, біль, набряк) | Виразка або некроз тканин. Показане оперативне втручання | Стан загрожує життю, потрібна невідкладна терапія |
| Біль | Слабкий | Помірний | Сильний | Нестерпний, який потребує застосування наркотичних лікарських засобів |
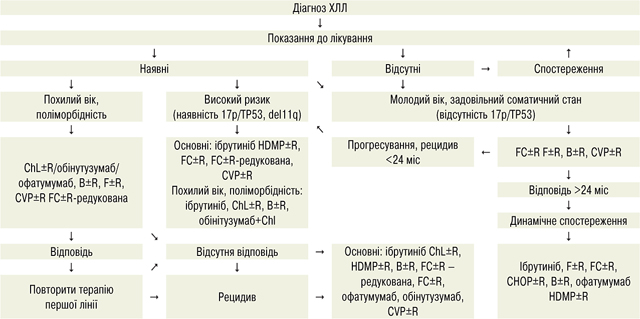
CVР±R — може використовуватися при неможливості проведення іншого лікування.
Показання до початку спеціального лікування ХЛЛ — наявність одного із зазначених патологічних станів (нумерація не відображає важливості симптомів):
1. Прогресуючий лімфоцитоз: збільшення кількості лімфоцитів >50% за 2 міс, період подвоєння кількості лімфоцитів — менше ніж 6 міс.
2. Анемія (гемоглобін <110 г/л) та/чи тромбоцитопенія (<100 Г/л), зумовлені інфільтрацією кісткового мозку патологічними лімфоцитами.
3. Загальні симптоми:
а) лихоманка без ознак інфекційного процесу (температура тіла ≥38 °С впродовж ≥2 тиж);
б) нічна пітливість протягом 1 міс без ознак інфекційного процесу;
в) ненавмисна втрата маси тіла ≥10% за 6 міс;
г) значна втомлюваність, виражена слабкість, ECOG ≥2.
4. Аутоімунна анемія та/чи тромбоцитопенія.
5. Масивна (>10 см у найбільшому діаметрі) чи прогресуюча лімфаденопатія.
6. Масивна (>6 см нижче лівої реберної дуги) чи прогресуюча спленомегалія.
Протипоказання до спеціального лікування
- Стан за шкалою ECOG 4 бали.
- Порушення функції печінки, нирок, серцево-судинної та будь-якої іншої системи тяжкого ступеня.
- Прояви будь-якого типу токсичності протипухлинного лікування (III–IV ступеня за шкалою побічних ефектів CTCAE — див. табл. 11) до усунення проявів токсичності.
Визначення відповіді після лікування пацієнтів
Оцінка відповіді на терапію здійснюється за критеріями Міжнародного семінару з хронічної лімфоцитарної лейкемії (IWCLL) (див. табл. 5).
Лікування пацієнтів із рефрактерною чи рецидивною формою ХЛЛ
Пацієнтів із рефрактерною чи рецидивною формою ХЛЛ необхідно дослідити щодо наявності аномалій TP53 до початкової та подальшої терапії. Оцінку TP53 здійснюють за допомогою цитогенетичного/FISH-аналізу.
До групи високого ризику входять пацієнти, які мають аномалію TP53 та раніше не отримували лікування чи мають рецидив, а також ті, хто має рецидив протягом 2 років, або пацієнти, які не відповідають на терапію аналогами пуринів. У цих пацієнтів поганий прогноз при звичайній терапії, вони потребують розгляду щодо альтернативних методів лікування.
Замісна терапія імуноглобуліном
Показання
Періодичні або тяжкі інфекції, незважаючи на профілактичний прийом антибіотиків, у пацієнтів із сироватковим імуноглобуліном IgG < 5 г/л (без урахування парапротеїну).
Доза і шляхи введення
Імуноглобулін вводять в/в кожні 3–4 тиж з використанням початкової дози 0,4 г/кг маси тіла чи шляхом щотижневих підшкірних введень, до досягнення рівня 6–8 г/л.
Доза імуноглобуліну має бути скоригована відповідно до клінічної реакції та мінімального рівня після 3-ї дози.
Моніторинг
Пацієнтам необхідно проходити регулярне обстеження, особливо в перші 12 міс лікування.
Звичайні аналізи крові мають включати щорічну перевірку на гепатит В (HBsAg) та С (ПЛР на гепатит С).
Тривалість
Лікування має бути припинене, якщо немає зниження частоти і тяжкості бактеріальних інфекцій після 1 року терапії. Якщо рішення про припинення імуноглобулінзамісної терапії прийняте, це має відбуватися протягом літніх місяців і має бути припинене до зими. Пацієнтам необхідно продовжувати профілактичне застосування антибактеріальних препаратів.
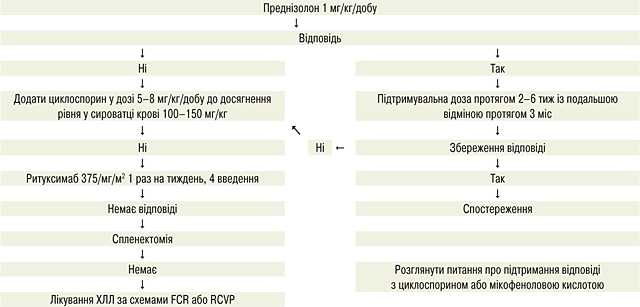
Лікування при аутоімунних ускладненнях у пацієнтів із ХЛЛ
Аутоімунні ускладнення поширені при ХЛЛ і виникають у 10–20% пацієнтів. Діагноз АІГА встановлюють за наявності ізольованого зниження гемоглобіну, що супроводжується позитивним прямим антиглобуліновим тестом (ПАТ), підвищенням рівнів ретикулоцитів, білірубіну і ЛДГ та зниженням гаптоглобіну в сироватці крові. Імунна тромбоцитопенія (ІТП) виникає рідше (2–5%), її перебіг можливий разом з АІГА (синдром Еванса). Немає точного діагностичного тесту, але зменшення кількості тромбоцитів без інших причин ІТП є тривожним симптомом. Ізольована аплазія червоних кров’яних тілець виникає рідко, але не завжди діагностується, характеризується зниженням гемоглобіну, ретикулоцитопенією і негативним ПAT. Важливо виключити вірусні інфекції (вірус Епштейна — Барр, цитомегаловірус, парвовірус В19) при цьому захворюванні. Для всіх аутоімунних цитопеній зазвичай необхідна повна оцінка аспірації кісткового мозку та трепанобіопсія.
Фактори ризику розвитку AIГA включають:
- позитивний тест ПAT;
- пізня стадія захворювання (стадія С за Binet та ІІІ–IV за Rai);
- велику кількість лімфоцитів;
- літній вік;
- чоловічу стать;
- несприятливі прогностичні маркери (високий рівень B2M, немутований статус важких ланцюгів імуноглобуліну (IGHV), ZAP70+, CD38+).
Застосування хіміо-імунотерапії рекомендуються для пацієнтів, у яких ХЛЛ потребує лікування і які мають позитивний ПAT або мали попередні імунні цитопенії, не пов’язані з лікуванням або після терапії із застосуванням алкілуючих препаратів/пуринових аналогів. Існує мало даних з приводу подальшого лікування пацієнтів, у яких імунна цитопенія розвинулася під час хіміо-імунотерапії. Варіанти зміни терапії включають перехід зі схеми FCR на BR.
Наявність аутоімунних цитопеній сама по собі не є показанням до лікування при ХЛЛ, хоча вона може виникнути у процесі прогресування захворювання і може не проходити без лікування ХЛЛ. Тим не менш, захворювання на стадії C, спричинені недостатністю кісткового мозку, мають набагато гірший прогноз, ніж АІГА та/чи ІТП, а успішне лікування імунної цитопенії часто переводить пацієнта з ХЛЛ до стадії А або В.
Для підтвердження діагнозу аутоімунної цитопенії зазвичай необхідно виконати аспірацію кісткового мозку.
Терапією першої лінії є преднізолон.
Лікування ХЛЛ може бути розпочато для контролю рецидивної чи резистентної АІГА/ITП. Схеми ПХТ, що містять ритуксимаб, рекомендують для пацієнтів, які не мають TP53-аномалій.
Якщо АІГА/ITП розвивається під час лікування ХЛЛ, цю ж схему слід використовувати знову з особливою обережністю лише за відсутності ефективної альтернативи.
При аутоімунній нейтропенії призначають гранулоцитарний колонієстимулювальний фактор (Г-КСФ).
Терапія супроводу при лікуванні пацієнтів із ХЛЛ
I. Ускладнення хіміотерапії (ХТ), які виникають часто:
1. Анемія.
2. Тромбоцитопенія.
3. Інфекції при нейтропенії.
4. Фебрильна нейтропенія.
5. Мукозит.
6. Диспептичний синдром.
7. Токсичний флебіт і екстравазація.
8. Синдром лізису пухлин (СЛП).
Профілактика та лікування анемії у пацієнтів із ХЛЛ, що розвинулася внаслідок ХТ
Обстеження пацієнтів з анемією має включати:
- Збір анамнезу життя (у тому числі, сімейний).
- З’ясування тривалості анемії, наявності кровотеч в анамнезі (статева система, ШКТ) та донорства.
- Збір даних щодо дієти пацієнта, застосування лікарських засобів.
- Гемограму з визначенням цитологічних параметрів, лейкоцитарної формули, тромбоцитів.
- Коагулограму.
- Біохімічний аналіз крові з визначенням білірубіну, креатиніну, альбуміну, заліза у сироватці крові, феритину, трансферину, ціанокобаламіну та фолієвої кислоти.
- За необхідності проводять аспірацію чи трепанобіопсію кісткового мозку.
- Фізикальне обстеження з метою виявлення симптомів власне анемії та порушень діяльності серцевої та легеневої системи внаслідок гіпоксії.
Лікування при анемії
Терапію еритропоетинами (ЕП) призначають пацієнтам із ХЛЛ при анемії, яка виникла внаслідок ХТ та не зумовлена іншими чинниками при зниженні рівня гемоглобіну <100 г/л. Хворі онкологічного профілю в термінальній стадії не підлягають терапії ЕП. Найефективнішим є застосування ЕП по 40 тис. ОД щотижня підшкірно, у разі неефективності терапії — через 4 тиж підвищити дозу до 60 тис. ОД щотижня. Альтернативний режим застосування: 150 ОД/кг 3 рази на тиждень, при неефективності терапії через 4 тиж підвищити дозу до 300 ОД/кг 3 рази на тиждень. При застосуванні дарбепоетину початкова доза становить 6,75 мкг/кг 1 раз на 3 тиж або 2,25 мкг/кг 1 раз на тиждень. Корекцію дози, тривалість терапії та відміну ЕП проводять згідно з інструкцією для медичного застосування препарату.
Трансфузія еритроцитарної маси має бути ретельно обґрунтованою, проводиться пацієнтам з анемією для підтримання рівня гемоглобіну у межах >70–90 г/л. У пацієнтів із симптомами гіпоксії, гострою крововтратою з ознаками гемодинамічної нестабільності рівень гемоглобіну має бути у межах >80–100 г/л, а при гострих коронарних синдромах — >100 г/л.
Терапію при абсолютному та функціональному дефіциті заліза проводять симптоматично згідно з відповідними медико-технологічними документами.
Якщо анемія спричинена мієлосупресивною дією протипухлинної терапії, може бути розглянута редукція ХТ у майбутньому.
Профілактика та лікування тромбоцитопенії у пацієнтів із ХЛЛ
Основним методом корекції тромбоцитопенії у пацієнтів з ХЛЛ є трансфузія донорського тромбоконцентрату. Абсолютним показанням для проведення трансфузії донорських тромбоцитів є рівень тромбоцитів у пацієнта <10·109/л (при гемобластозах — <20·109/л). Для проведення малих інвазивних втручань рівень тромбоцитів має бути >50·109/л, великих інвазивних втручань — >100·109/л. Наявність тяжких кровотеч або ризик виникнення фатальних кровотеч потребує досягнення рівня тромбоцитів >100·109/л.
За наявності геморагічного синдрому — трансфузія плазми крові свіжозамороженої.
Причини неефективності трансфузії тромбоцитів:
- підвищення температури тіла > 38,0 ˚C;
- застосування тромбоцитотоксичних медикаментів;
- спленомегалія та патологія печінки;
- інфекція;
- геморагія;
- синдром дисемінованого внутрішньосудинного згортання крові;
- тромботична мікроангіопатія;
- циркулюючі імунні комплекси.
Профілактика та лікування інфекції при нейтропенії у пацієнтів з ХЛЛ, що розвинулась внаслідок ХТ
У пацієнтів, які отримують ХТ, ризик виникнення нейтропенії значно вищий, ніж у пацієнтів, які отримують інші види протипухлинного лікування (променева терапія, хірургічне втручання). З метою запобігання контакту з екзогенними мікроорганізмами пацієнтів, у яких передбачається тривала нейтропенія, необхідно термічно обробляти їжу; пацієнтів ізолювати в окремі палати, а медичний персонал має працювати в масках, ліки краще вводити через постійний венозний катетер.
Медикаментозна профілактика інфекцій показана при кількості нейтрофілів <0,1/мкл (<0,1·109/л) або <1,0/мкл, при очікуваній тривалості нейтропенії >7 днів, а також при поширеному ураженні слизової оболонки або шкіри, бронхообструктивному синдромі, інфекціях, пов’язаних із нейтропенією, в анамнезі та інших факторах ризику.
Бажано встановити «мікробіологічний профіль» пацієнта до початку ХТ (зробити бактеріологічні посіви з поверхні шкіри, слизової оболонки ротоглотки, носових ходів, піхви/препуціального мішка, прямої кишки). Пацієнтам групи високого ризику профілактично призначають такі протимікробні лікарські засоби:
- антибактеріальна профілактика щодо грамнегативних бактерій (призначають ципрофлоксацин по 500 мг 2 рази на добу);
- профілактика інфекції, спричиненої грибами роду Candida, доцільна при інтенсивних та високодозових режимах ХТ, наявності мукозиту. Призначають флуконазол, ітраконазол, позаконазол, вориконазол, каспофунгін;
- профілактика інвазивного аспергільозу не рекомендована;
- противірусну профілактику проводять при терапії флударабіном, бортезомібом, під час нейтропенії та ще 30 днів після високодозової ХТ (ацикловір, валцикловір для HSV, VZV та ганцикловір для CMV);
- профілактика інфекції Pneumocystis carinii доцільна при тривалій терапії глюкокортикоїдами (>20 мг/добу протягом ≥4 тиж).
Для запобігання та боротьби з нейтропенією призначають Г-КСФ.
Лікування при фебрильній нейтропенії у пацієнтів з ХЛЛ
Фебрильна нейтропенія — одноразове підвищення температури тіла пацієнта >38,3 °С або тривала температура тіла 38,0 °С протягом >1 год при рівні абсолютної кількості нейтрофілів <0,5/мкл або <1,0/мкл, якщо очікується подальше їх зниження до <0,5/мкл). Швидкість розвитку інфекції у пацієнтів зі злоякісними новоутвореннями лімфатичної системи на тлі нейтропенії потребує негайних лікувальних заходів. Лікування при фебрильній нейтропенії у пацієнтів із ХЛЛ здійснюється згідно з відповідними медико-технологічними документами.
Діагностика, профілактика та лікування мукозиту як ускладнення ХТ у пацієнтів із ХЛЛ
Стоматит — це запалення, інфекція чи виразки в порожнині рота. Причинами розвитку стоматиту можуть бути проведена ХТ, променева терапія, неадекватна гігієна порожнини рота, недостатнє харчування, інфекція, деякі лікарські засоби. Основним клінічними проявами стоматиту є біль, утруднений прийом їжі та рідини, можлива зміна смаку, поява виразок, кровоточивості слизової оболонки.
Мукозит — синдром запалення слизової оболонки ШКТ, що веде до вторинного інфікування, больового синдрому, порушення слиновиділення, ентерального харчування та анорексії.
Найчастіше мукозит і стоматит виникає у пацієнтів, у яких внаслідок проведення ХТ розвивається нейтропенія.
Профілактика
Необхідно під час протипухлинного лікування щоденно дотримуватися гігієнічних правил догляду за ротовою порожниною. Для видалення зубного нальоту та підтримання вологості слизової оболонки рекомендується полоскання порожнини рота слабким розчином натрію гідрокарбонату (½ чайної ложки харчової соди на 1 склянку кип’яченої води), сольовим розчином (1 чайна ложка натрію хлориду на 1,0 л теплої води) або 0,12% розчином хлоргексидину 2–3 рази на день, розчинами хлорофіліпту, гексетидину, після полоскання не вживати їжі та напоїв протягом 30 хв. Слід уникати полоскань, які містять алкоголь чи фенол. Їжа має бути механічно, хімічно і термічно щадною.
Лікування
При виявленні збудника мукозиту, стоматиту або перидонтиту лікування проводять за загальними принципами терапії інфекцій. Якщо збудник не встановлено, рекомендовано полоскання розчином повідон-йоду. При кандидозі призначають флуконазол місцево впродовж 7–10 днів та 250 мг перорально 1 раз на день протягом 5 днів. Для симптоматичного зняття болю призначають полоскання ротової порожнини кожні 4 год знеболювальними розчинами. При вираженому болю призначаються системні анальгетики, включаючи опіоїдні препарати.
Діагностика, профілактика та лікування диспептичного синдрому як ускладнення ХТ у пацієнтів із ХЛЛ
Нудота та блювання — це найчастіші прояви диспептичного синдрому, якими супроводжується застосування ХТ.
1. Адекватну протиблювотну терапію обов’язково необхідно проводити профілактично та розпочинати у 1-й день застосування ХТ.
2. При високо- та середньоеметогенній ХТ обов’язкове призначення комбінації дексаметазону з метоклопрамідом або з антагоністами серотонінових рецепторів (ондансетрон, тропісетрон).
3. Для запобігання гострій та відстроченій нудоті та блюванню при високо- чи середньоеметогенній ХТ призначають апрепітант (у комбінації з іншими протиблювотними препаратами).
4. Для профілактики нудоти та блювання при низькоеметогенній ХТ призначають дексаметазон та/чи метоклопрамід.
Запор проявляється тривалим утрудненням дефекації, нерегулярним випорожненням, що супроводжується дискомфортом або/та болем унизу живота. Якщо запор був у пацієнта до початку ХТ, то хіміопрепарати (ХП) можуть його посилити. Найбільший ризик розвитку запору є у людей літнього віку та пацієнтів, які вживають мало рослинної їжі з багатим вмістом клітковини.
Профілактика
Добова норма рідини має становити не менше 8 склянок (1600 мл) за відсутності протипоказань (набряки, гіпертонія). Необхідно обмежити вживання жирів, жирного м’яса, сиру та солодощів, вживати страви з нежирної яловичини, птиці, риби, овочів, а також продукти, що містять немелені зерна злаків (наприклад «Геркулес»). Показані щоденні помірні фізичні навантаження.
Лікування
Симптоматично призначають проносні засоби: натрію пікосульфат, лактулозу, макрогол. Як ургентний засіб можуть бути призначені очисні клізми.
Діарея найчастіше виникає у вигляді цитотоксичного ентероколіту. Лікування здійснюється з урахуванням патогенезу діареї. Призначають препарати що пригнічують перистальтику кишечнику (лоперамід). При больовому синдромі призначають анальгетики та спазмолітики (дротаверин, платифілін, метамізол натрію тощо). При діареї, яка триває >48 год, призначають октреотид.
При поєднанні діареї з лихоманкою призначають антибіотики та проводять інфузійну терапію з метою компенсації електролітних порушень та запобігання гіповолемії та гіповолемічного шоку. Показаннями для проведення пероральної регідратації є початкові прояви діареї та помірне (І–ІІ ступеня) зневоднення. Показання для проведення парентеральної регідратації — тяжкі форми зневоднення (ІІІ ступеня) з ознаками гіповолемічного шоку, інфекційно-токсичний шок, поєднання ексикозу (будь-якого ступеня) з тяжкою інтоксикацією, олігурія чи анурія, які не зникають після першого етапу регідратації, нестримне блювання та низька ефективність пероральної регідратації впродовж 1 доби.
Дієтичне харчування має включати висококалорійну, механічно та хімічно щадну їжу з достатньою кількістю білків та вітамінів. Заборонено вживати соки та фрукти, що сприяють бродильним процесам (наприклад виноград, персики, абрикоси, груші, сливи). За відсутності протипоказань рекомендуються кисломолочні продукти (кефір, ацидофілін тощо), соки з чорної смородини, брусниці, чорноплідної горобини та їжа, збагачена крохмалем (наприклад банани, рис).
Діагностика, профілактика та лікування токсичного флебіту та екстравазації ХП як ускладнень ХТ у пацієнтів із ХЛЛ
Токсичні флебіти та екстравазації (вихід поза межі кров’яного русла) ХП є найбільш поширеними місцевими токсичними наслідками ХТ. Токсичний флебіт зумовлений дією препарату на стінку судини зсередини, екстравазація — дією ХП на прилеглі тканини при перфорації судини.
Фактори ризику розвитку токсичного флебіту та екстравазації ХП:
- пошкодження вени в анамнезі;
- застосування катетера неадекватної довжини та діаметра відносно вибраної вени;
- властивості застосованого ХП та його взаємодія із тканинами організму;
- висока концентрація та доза ХП;
- порушення судинного тонусу, яке сприяє надмірній кровотечі та поширенню пошкодження;
- супутні хвороби, що впливають на судини (лімфедема, цукровий діабет, захворювання периферичних судин, синдром верхньої порожнистої вени, гіпертензія тощо);
- ампутація кінцівки, що обмежує венозний доступ;
- пізні ускладнення променевої терапії , такі як індурації м’яких тканин;
- одночасне введення конкурентних медикаментів;
- порушення техніки введення ХП.
Екстравазація виникає під час в/в введення ХП внаслідок його потрапляння з вени або катетера у прилеглі тканини. Наслідком екстравазації можуть бути ускладнення різного ступеня тяжкості від короткотривалих та легких (дискомфорт, гіперемія) до утворення везикул або ерозій, послаблення венозного відтоку. При несвоєчасно розпочатому лікуванні екстравазації в подальшому може знадобитися хірургічне лікування. Тривалі пошкодження вени спричиняють розвиток стриктур суглобів, невропатію, деформацію та втрату функції органа, а також можуть навіть призвести до загибелі пацієнта.
Ступінь ускладнень екстравазації залежить від класу ХП. Група А — це група низького ризику, включає нейтральні, запальні ХП та ірританти, які призводять до короткотривалих м’яких подразнювальних пошкоджень тканин, що зникають самостійно. Групи В та С (ексфоліанти та везиканти) належать до ХП високого ризику, екстравазації яких призводять до тяжчих наслідків, що супроводжуються серйозними пошкодженнями прилеглих тканин.
Клінічні ознаки екстравазації ХП з периферичної вени: біль різної інтенсивності, зазвичай пекучий, почервоніння, набряк, виникнення пухирців біля входу катетера, пігментація шкіри; індурація, набряк, підтікання в місці встановлення катетера; відсутність зворотного кровотоку через катетер; ригідність поршня шприца під час болюсного введення ХП; відсутність самостійного кровотоку під час проведення інфузії. Рання поява щільної індурації з/без ущільненням у місці введення ХП є ознакою вірогідної екстравазації. Інколи виразки з’являються через 1–2 тиж, коли відторгнення струпу оголює типову поверхню виразки, вкриту жовтуватим фібрином та оточену обідком персистуючої еритеми. Важливо відрізняти екстравазацію ХП від місцевої алергічної реакції, що найчастіше відбувається при введенні антрациклінів. Зазвичай алергічна реакція має вигляд кропивниці чи гіперемії за ходом або навколо пошкодженої вени. Вона не завжди супроводжується болем, набряком та втратою зворотного кровотоку і зникає зазвичай через 30–60 хв після припинення введення ХП.
Клінічні ознаки екстравазації ХП із центральної вени: лихоманка, біль або дискомфорт у плечі та шиї, біль, печія та набряк грудної стінки, жорстокий біль у грудній клітці при диханні (токсичне пошкодження плеври), підтікання рідини з місця встановлення катетера, некроз шкіри та розширення тіні межистіння при рентгенографії. Найсерйознішими ускладненнями є індурація та рубцювання навколо сухожилків, нервів та суглобів, вторинна інфекція та формування абсцесу, контрактура та ампутація кінцівки.
Ступінь ускладнень екстравазації залежить від класу ХП. Група А — це група низького ризику, включає нейтральні ХП, які призводять до короткотривалих м’яких подразнювальних пошкоджень тканин, що зникають самостійно. Групи В та С належать до ХП високого ризику, екстравазації яких призводять до тяжких наслідків, що супроводжуються серйозними пошкодженнями прилеглих тканин. Розподіл цитотоксичних лікарських засобів, які застосовують для лікування пацієнтів із ХЛЛ, залежно від ефекту ушкоджувальної дії:
- Група А –циклофосфамід, флударабін, ритуксимаб, бендамустин;
- Група В — мітоксантрон;
- Група С — вінкристин.
Профілактика токсичного флебіту та екстравазації ХП
Перед початком інфузії необхідно попередити пацієнта про можливі ускладнення ХТ та повідомити, на що слід звертати увагу і в яких випадках необхідно звертатися за медичною допомогою.
Введення ХП має здійснюватися лише у закладах спеціалізованої допомоги досвідченим та кваліфікованим персоналом.
Застосування того чи іншого виду катетерів (периферичний або центральний венозний (ЦВК), артеріальний, імплантована інфузійна система венозного доступу — порт) має відповідати місцю їх встановлення.
Вибираючи судину для встановлення катетера, слід уникати згинів та рухливих місць. Місце встановлення катетера не має містити життєво важливих структур. Перевагу слід віддавати великій інтактній вені із задовільним кровотоком (оптимально — зона передпліччя).
Інфузійний розчин ХП необхідно готувати відповідно до правил, зазначених в інструкції для застосування ХП.
Швидкість інфузії вибирають адекватно пропускній здатності вени, загальному об’єму інфузії, особливо при одночасному введенні кількох ХП, а також відповідно до рекомендацій, зазначеним в інструкції для застосування ХП.
Якщо венозний доступ на периферичній вені недостатній або незадовільний, слід розглянути можливість встановлення ЦВК або порту.
Лікування токсичного флебіту
- Негайно зупинити введення ХП та зняти катетер.
- Оцінити місце пошкодження щодо наявності набряку, гіперемії, температури тіла, пружності шкіри, суб’єктивних відчуттів та провести диференційну діагностику ускладнення з алергічною реакцією.
- Маркувати місце пошкодження кульковою ручкою як відправну точку для подальшого моніторингу.
- За необхідності — призначити антигістамінні лікарські засоби.
- Симптоматичне лікування, спрямоване на місцеві прояви флебіту.
- Системно призначають антикоагулянти прямої дії.
- Симптоматичне лікування, спрямоване на больовий синдром за відсутності протипоказань.
- Щоденний огляд місця пошкодження.
Тривалість лікування — від 14 днів до 1–2 міс.
Лікування екстравазації ХП з периферичного венозного катетера
- Негайно зупинити введення ХП.
- Оцінити місце пошкодження судини щодо наявності набряку, гіперемії, температури тіла, пружності шкіри, суб’єктивних відчуттів, а саме болю, відсутності чутливості.
- Шприцем повільно видалити кров та залишкову рідину з місця екстравазації, не тиснучи на місце ураження та працюючи у захисних окулярах і гумових рукавичках.
- Видалити катетер та маркувати місце пошкодження кульковою ручкою як відправну точку для подальшого моніторингу.
- Накласти стерильну серветку на місце пошкодження.
- Привести кінцівку у підвищене положення.
- За наявності пухирів на кінцівці аспірувати їх вміст стерильною голкою;
- Місцево — холодний компрес, при екстравазації ХП алкалоїдів барвінку — теплий компрес.
- Антидот до екстравазованого ХП (за наявності).
- За необхідності — призначити знеболювальні та антигістамінні лікарські засоби.
- Щоденний огляд місця пошкодження.
Лікування при екстравазації ХП з ЦВК
- Негайно зупинити інфузію ХП.
- Оцінити площу пошкодження, об’єм та властивості екстравазованого ХП, місце пошкодження та необхідний обсяг медичної допомоги;
- Залишити (не видаляти) ЦВК на місці.
- Максимально аспірувати залишкову кількість ХП та кров через ЦВК (для зменшення площі пошкодження), працюючи у захисному обладнанні.
- Призначити антидот до екстравазованого ХП (за наявності).
- За необхідності — призначити знеболювальні та антигістамінні лікарські засоби.
- Обов’язково разом з анестезіологом вирішити питання щодо зміни венозного доступу.
- Щоденний огляд місця пошкодження.
- Симптоматичне лікування місцевих проявів.
При екстравазації ХП групи А лікування розпочинають із застосування холоду (тепла — лише для препаратів, що містять алкалоїди барвінку) по 20 хв 4 рази на добу протягом 3 днів, не допускаючи безпосереднього контакту зі шкірою; для ХП групи B за відсутності везикул — місцево аплікації диметилсульфоксиду (за наявності везикул диметилсульфоксид не застосовувати); для ХП групи С — підшкірно навколо пошкодження ввести гіалуронідазу загальною дозою 128 ОД впродовж 14 днів.
Подальше лікування залежить від перебігу екстравазації. При ознаках інфікування зробити бактеріальний посів із рани та розпочати емпіричну протимікробну терапію. Протипоказано застосовувати вологі водні, спиртові та напівспиртові компреси, тиснучі пов’язки. Хірургічне лікування показано за наявності некрозу усієї товщі дерми з/без виразок та невгамовного болю.
Діагностика та лікування СЛП у пацієнтів із ХЛЛ
СЛП — сукупність метаболічних порушень, що розвиваються внаслідок швидкого розпаду пухлинних клітин та виходу їх метаболітів до плазми крові. Частіше СЛП виникає при великій пухлинній масі, може бути спонтанним або індукованим ХТ і променевою терапією.
Діагностика
До початку ХТ або променевої терапії чи при госпіталізації пацієнта з підозрою на спонтанний СЛП необхідно:
1. Зібрати анамнестичні дані щодо судом та порушень діурезу.
2. Визначити масу тіла пацієнта.
3. Визначити рівень К+, Na+, Ca2+, Mg2+, Cl−, фосфору, сечовини, креатиніну, сечової кислоти у крові.
4. Визначити рН сечі та вміст кристалів в сечовому осаді.
5. Бажано визначити рН крові та стану буферних систем.
Будь-які патологічні зміни необхідно терміново коригувати до початку ХТ.
Лікування
Має бути призначена адекватна інфузійна терапія та забезпечено достатній діурез (100–250 мл/м2/год):
1. Інфузійна терапія в об’ємі 2000–3000 (до 5000) мл/м2/добу 5% розчином глюкози та 0,9% розчином натрію хлориду у співвідношенні 1:1–2:1. Калій у розчини на початку інфузії не додавати!
2. Підрахунок балансу рідини. Кількість сечі має дорівнювати введеній рідині перорально та в/в мінус витрати через перспірацію тощо. Паралельно визначають масу тіла пацієнта двічі на добу для швидкого виявлення затримки рідини (приріст маси тіла).
3. При недостатньому сечовиділенні вводять фуросемід одноразово 1 мг/кг (до 10 мг/кг/добу), за необхідності — 20% розчин манітолу, допаміну 3–5 мкг/кг/хв до отримання необхідного діурезу. При низькому значенні альбуміну вводять 10–20% розчин альбуміну людини до ліквідації його дефіциту.
4. Якщо рН сечі <6,5, проводять в/в інфузію натрію гідрокарбонату 60 ммоль/л інфузії (1 ммоль = 1 мл 7,5% розчину). Щільність сечі має бути <1010, а рН сечі слід утримувати в діапазоні 6,5–7,0, що підвищує розчинність сечової кислоти. Ці показники бажано вимірювати при кожному сечовиділенні, або принаймні кожні 3 год.
5. Для профілактики гіперурикемії призначається алопуринол 300 мг/м2/добу у 3 прийоми та інфузійна терапія 3000 мл/м2/добу. При виникненні гіперурикемії швидкість інфузії збільшити до 5000 мл/м2/добу.
Гіперкаліємія
Якщо К+ <6,0 ммоль/л, основним заходом є стимуляція діурезу. При К+ >6 ммоль/л або за наявності ознак порушень на ЕКГ необхідно підготувати та перевести пацієнта до відділення гемодіалізу. Як невідкладну терапію вводять 5% розчин глюкози + інсулін 0,3 Од/кг в/в за 30–60 хв, що зумовлює перерозподіл калію в організмі. При змінах на ЕКГ вводять 10% розчин кальцію глюконату 0,5–2,0 мл/кг + натрію гідрокарбонат 2,0 ммоль/кг в/в дуже повільно. При К+ >7 ммоль/л або ознаках порушень на ЕКГ терміново призначають гемодіаліз. За можливості рекомендується встановити трансвенозний водій серцевого ритму.
Показання до призначення гемодіалізу
- К+ >7 ммоль/л або підвищення його рівня >6 ммоль/л при достатній інфузійній терапії та прийомі діуретиків;
- фосфор >0,1мг/мл (>5 ммоль/л);
- виділення сечі <50 мл/м2/год, що не коригується введенням сечогінних препаратів (фуросемід 10 мг/кг/добу) та інфузійною терапією до 200 мл/м2/год;
- двобічна висока чи повна обструкція сечовивідних шляхів.
Гіпокальціємія — типовий прояв СЛП. Корекція необхідна, якщо рівень Ca2+ <0,4 ммоль/л або за наявності клінічних симптомів гіпокальціємії (судоми, позитивний симптом Трусо). Вводять 10% розчин кальцію глюконату 0,5–1,0 мг/кг в/в дуже повільно. У зв’язку із ризиком виникнення брадикардії необхідний контроль частоти серцевих скорочень. Бажане підключення до монітору серцевої діяльності.
Гіпомагніємія
При рівні Mg2+ <0,5 ммоль/л рекомендоване введення 25% розчину магнію сульфату 0,1–0,2 мл/кг/добу в/в подовженою інфузією чи з додаванням розчину до основної інфузії.
Оліго- та анурія — кількість виділеної сечі <50 мл/м2/год, що не коригується введенням сечогінних препаратів (фуросемід 10 мг/кг/добу) та інфузійною терапією до 200 мл/м2/год. При підозрі на анурію проводять УЗД нирок для виключення обструкції сечовивідних шляхів, інфільтратів у нирках, а також визначення К+, Ca2+, фосфору, сечової кислоти в сироватці крові та дослідження осаду сечі.
Подальше спостереження
1. Огляд пацієнта проводять декілька разів на добу. Оцінюють гемодинаміку, стан легень, наявність набряків та ін.
2. Баланс рідини підраховують кожні 6 год, при цьому спостерігають за погодинним діурезом. Затримка сечі може бути орієнтовно визначена при позитивному балансі рідини >200 мл/м2 за 6 год (введена рідина «+», виведена «−»). Проводять стимуляцію діурезу.
3. Визначення К+, Na+, Ca2+, Mg2+, Cl−, фосфору, сечовини, креатиніну, сечової кислоти, альбуміну мінімум 1 раз на добу.
Ускладнення ХТ, які виникають рідко:
- Гіперчутливість до препаратів.
- Шкірна токсичність.
- Панкреатит.
- Токсичний гепатит.
Профілактика та лікування гіперчутливості до ХП
Антинеопластичні засоби можуть спричиняти алергічні реакції. Найтиповішими проявами є бронхоспазм, біль у грудній клітці, висипання на шкірі та гіпотензія. Премедикацію дексаметазоном та антигістамінними лікарськими засобами призначають для профілактики алергічних реакцій. У разі розвитку алергічних реакцій тяжкого ступеня необхідно негайно розпочати лікування згідно з відповідними медико-технологічними документами. У разі реакцій легкого та середнього ступеня може бути достатньою тимчасова зупинка інфузії.
Профілактика та лікування шкірної токсичності
Розвиток шкірних реакцій можуть зумовити деякі ХП. Лікування симптоматичне, згідно з відповідними медико-технологічними документами.
Профілактика та лікування панкреатиту
Розвиток гострого панкреатиту можуть зумовити деякі ХП. Лікування симптоматичне згідно з відповідними медико-технологічними документами.
Токсичний гепатит
Розвиток токсичного гепатиту можуть зумовити такі препарати, як вінкристин. Під час проведення ХТ виконують лабораторний контроль печінкових проб, оскільки клінічні прояви токсичного гепатиту можуть бути відсутні. Лікування симптоматичне, згідно з відповідними медико-технологічними документами.
Променева терапія
Розглянути для пацієнтів, для яких хіміо-імунотерапія неефективна чи протипоказана.
Малі дози променевої терапії (разова вогнищева доза — 2 Гр, по 2 фракції на осередки патологічних лімфатичних вузлів) призначають при симптомах генералізованої/масивної лімфаденопатії.
Вищі дози (30 Гр із фракціонуванням 2–3 ГР) призначають при трансформованих агресивних формах хвороби чи пацієнтам із TP53-аномаліями.
Реабілітація
Реабілітація пацієнтів, які перенесли лікування з приводу ХЛЛ, спрямована на позбавлення медичних, соціальних, трудових проблем. Важливою є психосоціальна і трудова реабілітація, яка може бути реалізована як індивідуальна робота із психологом, так і шляхом участі пацієнтів у діяльності волонтерських організацій, пацієнтських організацій осіб із лімфопроліферативними захворюваннями.
Виписка з рекомендаціями після госпіталізації
При виписуванні пацієнту надається виписка з медичної карти стаціонарного хворого встановленої форми, яка містить інформацію про отримане лікування, особливості перебігу захворювання, рекомендації щодо подальшого лікування та спостереження.
Виписка пацієнта планується відповідно до критеріїв:
а) завершення запланованого обсягу терапії;
б) відсутність ускладнень, що потребують лікування у стаціонарі;
в) неможливість продовження спеціальної терапії у зв’язку з розвитком протипоказань.
Дії лікаря
1. Оформити Виписку із медичної карти амбулаторного (стаціонарного) хворого (форма № 027-1/о).
2. Надати пацієнтам, які перенесли спеціальне лікування, інформацію про можливі віддалені побічні ефекти лікування, необхідність проведення періодичних обстежень відповідно до плану диспансеризації.
3. Надати рекомендації щодо способу життя, режиму харчування та фізичних навантажень.
Диспансерне спостереження
У зв’язку з високою небезпекою виникнення рецидиву та/чи іншої пухлини пацієнти з ХЛЛ підлягають диспансеризації із плановими оглядами у спеціальному структурному підрозділі, в якому отримували лікування, або за місцем реєстрації.
Пацієнти з ХЛЛ підлягають диспансерному спостереженню пожиттєво.
Обстеження відповідно до плану диспансеризації сприяє ранньому виявленню рецидиву захворювання та/чи іншої пухлини.
Дії лікаря
Забезпечити ведення Реєстраційної карти хворого на злоякісне новоутворення (форма № 030-6/о) та відображення в ній заходів із диспансеризації.
Використана література
- Міністерство охорони здоров’я України (2016) Наказ МОЗ України від 12.05.2016 р. № 439 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при хронічному лімфоїдному лейкозі».





