и клинической фармакологии Государственного учреждения «Днепропетровская медицинская академия
Министерства здравоохранения Украины»
Боль представляет защитную реакцию организма и является одним из главных ощущений, помогающих сохранить здоровье и жизнь. В то же время, рассматривая различные аспекты боли, нельзя не согласиться со словами лауреата Нобелевской премии Альберта Швейцера: «Боль приносит человечеству больше зла, чем даже сама смерть».
Выделяют три типа боли:
- ноцицептивная (посттравматическая, воспалительная, висцеральная);
- нейропатическая (при алкогольной, диабетической полинейропатии, травмах нервных стволов, воспалении);
- смешанная («боль повреждения» у пациентов травматологического, хирургического профиля).
Согласно статистическим данным служб здравоохранения и ведущих специалистов по проблеме боли, распространенность болевого синдрома в мире достаточно высока. Только в США от хронической боли, являющейся чаще следствием некупированного острого болевого синдрома, страдают около 20 млн человек, для лечения которых ежегодно расходуется почти 90 млрд дол. США. Ежегодно в мире умирают свыше 4 млн больных онкологического профиля, не получивших адекватного обезболивания в последние недели жизни (Raj P.P. et al. (Eds.), 2008). В терминальной стадии заболевания от боли страдают 55–95% таких больных, при этом боль средней интенсивности испытывают 40–50%, очень сильную и невыносимую — 25–30% пациентов (Grond S. et al., 1996; Осипова Н.А. и соавт., 2007).
Боль — субъективное ощущение, близкое к страданию, возникающее в центральной нервной системе чаще в результате повреждения тканей. Безусловно, купирование боли следует начинать с выяснения причины болевого ощущения и понимания природы боли.
Выделяют три группы повреждений тканей, вызывающих болевые ощущения (рис. 1).
| Боль, обусловленная | ||||
| ↓ | ↓ | ↓ | ||
| воспалением | спазмом гладких мышц внутренних органов |
другими причинами (оперативное вмешательство, химическая или физическая травма тканей, опухоль) | ||
| ↑ | ↑ | ↑ | ||
| Противовоспалительные средства (глюкокортикостероиды, нестероидные противовоспалительные препараты — НПВП) | Спазмолитики, антиангинальные, антиспастические препараты и другие средства, устраняющие спазм и раздражение мышц | Наркотические анальгетики (опиаты, опиоиды), анестетики (местные и общие), препараты других групп (седативные средства, противосудорожные, антигистаминные средства, антидепрессанты) |
||
Возможные направления медикаментозной борьбы с болью
1. Боль в результате повреждения тканей, обусловленного воспалительным процессом (наиболее часто). Для купирования/уменьшения интенсивности болевых ощущений, вызванных повреждением тканей вследствие воспаления, применяют две базовые группы лекарственных препаратов:
- глюкокортикостероиды (не просто гормоны мозгового вещества надпочечников, но, прежде всего, эндогенные противовоспалительные средства);
- НПВП.
2. Спазм гладких мышц внутренних органов. Соответственно можно и следует при этом применять, прежде всего, препараты, обладающие спазмолитическими свойствами: спазмолитики, антиангинальные, антиспастические средства и др.
3. Другие причины: травматическое повреждение, операционное вмешательство, воздействие физических, химических факторов, опухоль и др. При боли, вызванной этими причинами, применяют лекарственные препараты самых разных групп: наркотические анальгетики (опиаты, опиоиды), общие и местные анестетики, седативные средства, антидепрессанты, противосудорожные, антигистаминные препараты и др. В указанном перечне лекарственных препаратов — те, при применении которых анальгезия является следствием, прежде всего, воздействия на центральную нервную систему, то есть на место возникновения боли как субъективное ощущение с — безусловно — объективными признаками. В этом случае причина повреждения тканей, в отличие от препаратов 1-й и 2-й групп, не имеет существенного значения.
Существует много представителей класса НПВП, при этом механизм действия у них один: угнетение циклооксигеназы (ЦОГ) — фермента, нарушающего метаболизм арахидоновой кислоты. Последняя высвобождается из фосфолипидов клеточных мембран (а фосфолипиды присутствуют в клеточных мембранах каждой клетки организма). Высвобождение арахидоновой кислоты необходимо для того, чтобы в последующем под влиянием ЦОГ образовывались так называемые местные тканевые клеточные гормоны — простагландины — с самыми различными биологическими свойствами. Угнетая ЦОГ, НПВП нарушают образование простагландинов, а значит — уменьшают образование медиаторов боли и гипертермии.
ЦОГ бывает двух типов: ЦОГ-1 и -2. На рис. 2 отображена ЦОГ с «боковым карманом», наличие которого позволяет препаратам последней из групп НПВП, так называемым коксибам, входить в этот карман и блокировать, прежде всего, ЦОГ-2.
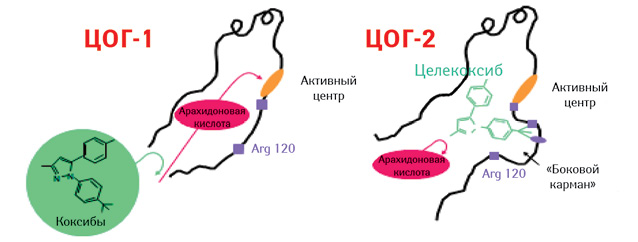
Именно на способности блокировать ЦОГ-1 и -2 построена современная классификация НПВП, предусматривающая их деление на три группы:
1. Неизбирательные ингибиторы ЦОГ:
- ацетилсалициловая кислота в дозе >300 мг;
- ибупрофен;
- индометацин;
- диклофенак;
- кетопрофен;
- пироксикам;
- кеторолак.
2. Преимущественные ингибиторы ЦОГ-2:
- мелоксикам;
- лорноксикам;
- нимесулид.
3. Селективные (высокоизбирательные) ингибиторы ЦОГ-2 (коксибы):
- целекоксиб;
- эторикоксиб;
- рофекоксиб;
- парекоксиб.
1-я группа НПВП является классической по времени разработки, активности, широте применения. Для препаратов этой группы характерна способность практически в равной степени блокировать как ЦОГ-1 (физиологическую, естественную), так и ЦОГ-2 (индуцибельную). Последнюю называют так потому, что она находится в неактивном состоянии, но в определенный момент начинает экспрессироваться. В результате активного образования ЦОГ-2 количество простагландинов — медиаторов воспаления, боли и гипертермии — увеличивается в тысячи, десятки тысяч раз.
2-я группа — ингибиторы преимущественно ЦОГ-1. Они не имеют в своей химической структуре остатка сульфаниламида и поэтому полностью заблокировать ЦОГ-2, в отличие от представителей 3-й группы, не могут.
3-ю группу НПВП (коксибы) называют современной VIP-группой поскольку она высокоселективно (высокоизбирательно) блокирует ЦОГ-2. Эту группу препаратов считают наиболее безопасной по сравнению с другими НПВП.
К слову, говоря о проблеме безопасности НПВП (а под токсичностью НПВП подразумевают, прежде всего, гастроинтестинальную и сердечно-сосудистую токсичность), уместно процитировать первого председателя Комитета по безопасности лекарственных препаратов Великобритании сера Дерика Даниэля: «Современные лекарства подобны атомной энергии. Они могут принести как огромную пользу, так и огромный вред».
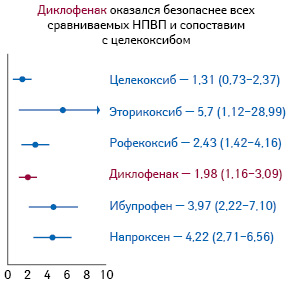
В метаанализе Кокрановского сотрудничества, включившем 280 исследований с участием значительного количества пациентов, изучен относительный риск гастроинтестинальных осложнений при применении отдельных НПВП. В частности, диклофенак занял достаточно скромное место в перечне препаратов с таким риском побочных эффектов (рис. 3) (Coxib and traditional NSAID Trialists’ (CNT) Collaboration et al., 2013).
Важно также, что при подавлении ЦОГ обоих типов происходит «переключение» с каскада арахидоновой кислоты, которая регулируется ЦОГ, на 5-липоксигеназный путь и увеличение синтеза провоспалительных лейкотриенов. Липооксигеназа — фермент, который, по сути, способствует образованию арахидоновой кислоты. Таким образом, становится больше медиаторов аллергии, увеличиваются интенсивность боли и воспаления (гипералгезия), ибо лейкотриены — сильнейшие спазмогены, вызывающие в бронхах — бронхоспазм, в сосудах — отеки, в желудочно-кишечном тракте — спазм гладких мышц внутренних органов. Липоксигеназа является точкой приложения действия, ферментом-мишенью для глюкокортикостероидов.
Среди осложнений, возникающих при применении высокоселективных ингибиторов ЦОГ-2, выделяют (Layton D.et al., 2003):
- сердечно-сосудистые (остановка сердца, неспецифическая кардиоваскулярная патология, инфаркт миокарда (ИМ));
- цереброваскулярные (афазия, цереброваскулярные катастрофы, дизартрия, дисфагия, дисфазия, церебральный эмболизм, мезентериальный эмболизм, гемианопсия, гемипарез, гемиплегия, гипестезия, парез лицевого нерва, псевдобульбарный парез, паралич глаза, парестезия, тромбоз артерии/вены сетчатки глаза, «смазанная» речь, церебральный тромбоз, транзиторные ишемические атаки, нарушения зрения);тромбоэмболия периферических вен (тромбоз глубоких вен, легочная эмболия, инфаркт легкого).
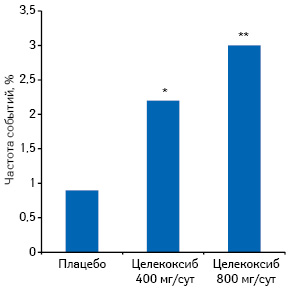
Установлено, что коксибы обладают протромботическим эффектом. В исследовании E.J. Topol (2005) в ходе изучения целекоксиба в разных дозах установлено повышение частоты таких событий, как сердечно-сосудистая смерть, ИМ, инсульт, в 2–3 раза по сравнению с плацебо (рис. 4).
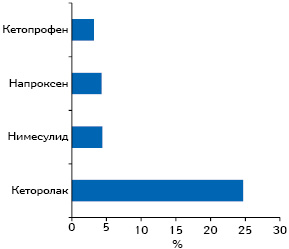
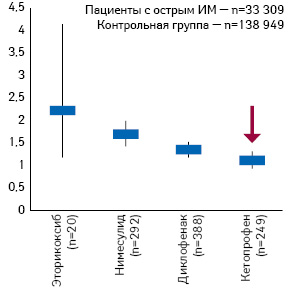
Говоря о таком представителе класса НПВП, как кетопрофен, отметим, что он характеризуется достоверно лучшим профилем гастроинтестинальной безопасности по сравнению с некоторыми НПВП, что обеспечивается не только за счет блокады ЦОГ-2, но и дополнительной блокады 5-липоксигеназы, а значит — синтеза лейкотриенов (рис. 5). В исследовании A. Helin-Salmivaara и соавторов (2006) при применении кетопрофена риск госпитализации пациентов с острым ИМ оказался ниже, чем в случаях применения некоторых других ингибиторов ЦОГ-2 (рис. 6).
Напомним, что молекула кетопрофена разработана в 1967 г., массово препарат начали применять в странах Европы с 1970 г. Несмотря на это сегодня у него — «новое рождение». Согласно базе данных PUBMED, количество исследований препарата — клинических, экспериментальных, изучения фармакологии — постоянно увеличивается. На фармацевтическом рынке Украины кетопрофен под торговым наименованием Кетонал® присутствует более 15 лет и нашел широкое применение.
Согласно данным метаанализа, около 350 исследований с высоким методологическим качеством (>45 тыс. пациентов, 38 препаратов, 46 схем анальгезии в разных дозах и комбинациях), кетопрофен — один из самых мощных анальгетиков (Moore R.A. et al., 2011).
Кетопрофен является рацематом, то есть содержит в равных количествах право- и левовращающий изомеры. Более того, показано, что S-изомер кетопрофена обладает свойствами, присущими рацемату кетопрофена. В результате ряда исследований создан S-кетопрофен (декскетопрофен).
«Два лучше, чем один», — заявляет компания «Сандоз», производитель препарата Кетонал®, поскольку наличие левовращающего изомера обеспечивает анальгезирующий эффект без блокады ЦОГ (как отмечено ранее, в этом случае подключается 5-липоксигеназный механизм), а правовращающий, или S-изомер, определяет противовоспалительное, анальгезирующее и жаропонижающее действие всего рацемата.
Отметим, что рацемический кетопрофен и его S-оптический изомер декскетопрофен нашли достаточно широкое клиническое применение. Так, в практике хирургической стоматологии при сравнении анальгезирующей и противовоспалительной активности кетопрофена (Кетонал®) и декскетопрофена показано, что NNТ (number needed to treat — количество больных, которых необходимо пролечить для снижения интенсивности боли) у рацемического кетопрофена в дозе 12,5–100 мг составляет в среднем 2,75, у декскетопрофена в дозе 10–12,5 и 20–25 мг — 3,4. Напомним: чем ниже показатель NNТ, тем выше эффективность, из чего можно сделать вывод: эффективность терапии рацемическим кетопрофеном в среднем в 1,24 раза выше, чем при применении его S-оптического изомера декскетопрофена.
Кетонал® зарекомендовал себя как мощный анальгетик с низким риском осложнений в отношении возможности длительного применения. Важно отметить, что препарат выпускается в форме пеллет двух видов: 40% —медленного и 60% — быстрого высвобождения. Такая технологическая особенность обосновывает кратность его применения: для препарата Кетонал® ДУО она составляет 1 капсулу в сутки. Доза кетопрофена в нем — 150 мг, но действует она не сразу, а постепенно.
Говоря о другом препарате компании «Сандоз» — Диклак® ID, отметим, что поскольку, согласно нынешнему законодательству, врач имеет право выписывать лекарственный препарат только в виде международного непатентованного наименования, без указания торгового коммерческого названия, то, назначая пациенту диклофенак в дозе 150 мг (доза, которая содержится в препарате Диклак® ID компании «Сандоз»), подразумевается именно этот препарат. Доза диклофенака 150 мг рассчитана для применения 1 раз в сутки благодаря наличию компонентов быстрого и медленного высвобождения. Противовоспалительное и анальгезирующее действие препарата начинается вскоре после приема, терапевтическая концентрация поддерживается в течение 24 ч.
Как свидетельствуют результаты исследований, посвященных изучению риска возникновения желудочно-кишечных осложнений, Диклак® ID достаточно оптимистично расположен в ряду напроксена, ибупрофена и эторикоксиба.
В заключение отметим, что фармакотерапия боли во врачебной практике — весьма сложный процесс. Тем не менее он может быть значительно облегчен наличием целой линейки перечисленных высокоэффективных препаратов с широкими возможностями применения для наилучшего контроля воспаления и боли.
Список использованной литературы
-
- Осипова Н.А., Прохоров Б.М., Вайсман М.А., Рудой С.В. (2007) Паллиативная помощь онкологическим больным. Медицина и качество жизни, 3: 39–50.
- Coxib and traditional NSAID Trialists’ (CNT) Collaboration; Bhala N., Emberson J., Merhi A. et al. (2013) Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet, 382(9894): 769–779.
- García Rodríguez L.A., Cattaruzzi C., Troncon M.G., Agostinis L. (1998) Risk of hospitalization for upper gastrointestinal tract bleeding associated with ketorolac, other nonsteroidal anti-inflammatory drugs, calcium antagonists, and other antihypertensive drugs. Arch. Intern. Med., 158(1): 33–39.
- Grond S., Zech D., Diefenbach C. et al. (1996) Assessment of cancer pain: a prospective evaluation in 2266 cancer patients referred to a pain service. Pain, 64(1): 107–114.
- Helin-Salmivaara A., Virtanen A., Vesalainen R. et al. (2006) NSAID use and the risk of hospitalization for first myocardial infarction in the general population: a nationwide case-control study from Finland. Eur. Heart J., 27(14): 1657–1663.
- Layton D., Heeley E., Hughes K., Shakir S.A. (2003) Comparison of the incidence rates of thromboembolic events reported for patients prescribed rofecoxib and meloxicam in general practice in England using prescription-event monitoring (PEM) data. Rheumatology (Oxford), 42(11): 1342–1353.
- Moore R.A., Derry S., McQuay H.J., Wiffen P.J. (2011) Single dose oral analgesics for acute postoperative pain in adults. Cochrane Database Syst. Rev., 9: CD008659.
- Raj P.P., Lou L., Erdine S. (Eds.) (2008) Interventional pain management: image-guided procedures, 2nd edn. Philadelphia, PA: Saunders Elsevier.
- Topol E.J. (2005) Arthritis medicines and cardiovascular events — «house of coxibs». JAMA, 293(3): 366–368.
Информация для профессиональной деятельности медицинских и фармацевтических работников





