Вступ
Враховуючи, що до основних ендогенних модифікованих факторів ризику цереброваскулярних подій відноситься цукровий діабет (ЦД) 2-го типу, артеріальна гіпертензія (АГ), ожиріння, дисліпідемія, їх поєднання в останні роки розглядається в рамках метаболічного синдрому (МС). Кожен із компонентів МС (КМС) у тій чи іншій мірі є самостійним фактором розвитку ішемічних порушень мозкового кровообігу, однак, за даними джерел наукової літератури, вони по-різному здійснюють безпосередній та непрямий вплив на їх розвиток і перебіг. Згідно з рекомендаціями Американської асоціації з вивчення інсульту (American Stroke Association), МС недостатньо вивчений, проте важливий модифікований фактор ризику розвитку інсульту (Writing Group Members et al., 2016). Результати масштабних клінічних досліджень деталізують загальне уявлення про роль МС як предиктора розвитку ішемічного інсульту, ризик якого на тлі МС підвищується до 2,1–2,5 раза, згідно з іншими джерелами — до 5,2 раза, а за даними одного з мексиканських досліджень — до 7 разів (Goldstein L.B. et al., 2011; Suh S. et al., 2014). У проспективному дослідженні японських учених, яке включало 24 477 осіб, серед когорти пацієнтів із МС ризик виникнення ішемічного інсульту підвищувався в 2 рази (95% довірчий інтервал (ДІ) 1,2–3,5), геморагічного — в 1,1 раза (95% ДІ 0,4–2,8). Результати дослідження також підтверджували наявність зв’язку між кількістю КМС і ризиком виникнення ішемічного інсульту (Chei C.L., et al., 2008; Rodriguez-Colon S.M., et al., 2009).
МС не лише підвищує ризик розвитку ішемічного інсульту, але і є фоновим станом, який зумовлює зниження швидкості та повноти зворотного розвитку неврологічного дефіциту, спричиненого вогнищем ішемії, що додатково підвищує ризик виникнення повторної церебральної катастрофи (Mizrahi E., 2010). Зокрема, результати дослідження польських науковців, яке охоплювало 90 пацієнтів віком 28–83 роки, свідчили, що при виписці зі стаціонару після ішемічного інсульту особи з МС мали достовірно нижчий рівень самообслуговування за рівнем індексу Бартела (ІБ) (Rykała J., Kwolek A., 2009). У корейському дослідженні, в якому брав участь 691 пацієнт, встановлено, що наявність МС зумовлює підвищення частоти несприятливих функціональних наслідків після ішемічного інсульту у 1,57 раза. До того ж, частота їх зростала зі збільшенням кількості КМС, незважаючи на вихідний рівень тяжкості захворювання у період госпіталізації пацієнтів (Oh M.Y. et al., 2014). Таким чином, наявність у пацієнта КМС підвищує ризик, з одного боку, виникнення мозкового інсульту, з іншого — негативного впливу на відновлення втрачених неврологічних функцій у постінсультний період. Тому актуальними залишаються питання визначення головних КМС як предикторів функціонального наслідку пацієнта після гострого первинного ішемічного інсульту на тлі МС. У вітчизняній літературі таких досліджень не виявлено, що і визначило мету поточної роботи.
Мета дослідження — визначити предиктори несприятливого функціонального наслідку пацієнтів із МС наприкінці гострого періоду ішемічного інсульту.
Об’єкт і методи дослідження
Усього до програми дослідження відібрано 102 пацієнти (68 (66,7%) чоловіків) віком 57–72 роки (середній вік — 64,4±9,4 року) із гострим первинним ішемічним інсультом на тлі МС. Усіх хворих наприкінці лікування у гострий період ішемічного інсульту, відповідно до ступеня відновлення неврологічних функцій за модифікованою шкалою Ренкіна (мШР), розподілено на дві групи: учасники 1-ї групи — 49 (48%) пацієнтів зі сприятливим функціональним наслідком (0–2 бали) та 2-ї — 53 (52%) хворих, які мали несприятливий функціональний наслідок (3–6 балів). У відібраних пацієнтів гострий первинний ішемічний інсульт виникав на тлі МС, визначення якого здійснювали згідно з оновленими «гармонізованими» рекомендаціями Міжнародної діабетичної федерації (International Diabetes Federation) (Alberti K.G. et al., 2009).
Критеріями включення пацієнтів до програми дослідження стали наявність перенесеного гострого первинного ішемічного інсульту, верифікованого клініко-неврологічними, лабораторними та нейровізуалізаційними методами на тлі МС та без такого. Критеріями виключення хворих із програми дослідження стали: кома, гострий інфаркт міокарда, гостра ниркова, печінкова та дихальна недостатності, епілепсія, пухлини головного мозку, геморагічний інсульт. Усі пацієнти госпіталізовані до клініки здебільшого у перші 12–24 год після виникнення гострої церебральної судинної події.
Об’єктивізацію оцінки загального неврологічного дефіциту проводили за Шкалою тяжкості інсульту Національних інститутів охорони здоров’я (National Institutes of Health Stroke Scale — NIHSS), ступінь інвалідизації оцінювали за мШР, функціональну спроможність пацієнта — за ІБ. Функціональний наслідок наприкінці гострого періоду після виникнення гострого ішемічного інсульту вважали сприятливим за умови результату за мШР 0–2 бали та несприятливим — при 3–5 балах.
Статистичну обробку отриманих результатів проводили на комп’ютері з використанням пакета статистичного аналізу Microsoft Excel 2014. Достовірності різниці між середніми кількісними значеннями двох вибірок визначали за коефіцієнтом Стьюдента. Для з’ясування характеру і ступеня взаємозв’язку між різними показниками визначали коефіцієнт кореляції, а також коефіцієнт кореляції рангів Спірмена. Непараметричний критерій Манна — Уїтні використовували для визначення достовірності різниці між середніми величинами двох неоднорідних вибірок. Для оцінки достовірності різниці декількох відносних величин, пов’язаних між собою, використовували показник відповідності χ2. Для оцінки прогностичних факторів несприятливого наслідку інсульту розраховували відносний ризик для окремих рівнів показників із визначенням прогностично значимих порогових рівнів оцінок для досліджуваних шкал (за результатами ROC-аналізу) з оцінкою адекватності представлених моделей (згідно з коефіцієнтом AUC) і визначенням чутливості, специфічності, прогностичної ефективності, точності моделі. Для всіх діагностичних характеристик визначали ДІ та проводили перевірку їх статистичної значимості на рівні ≥95%.
Обстеження та оцінювання даних пацієнта проводили при їх рандомізації, дані вносили до карти спостереження при надходженні пацієнта до клініки.
Результати та їх обговорення
Проаналізовано чинники, які впливають на функціональний наслідок пацієнтів з ішемічним інсультом на фоні МС. В обох групах проведено аналіз не лише окремих параметрів МС, але й основних чинників ризику розвитку ішемічного інсульту (табл. 1).
| Показник | Група | р | |
|---|---|---|---|
| 1-ша | 2-га | ||
| Середній вік, років | 63,47±10,14 | 65,33±5,62 | >0,05 |
| Чоловіки, n (%) | 31 (63,3) | 37 (69,8) | >0,05 |
| Жінки, n (%) | 18 (36,7) | 16 (30,2%) | >0,05 |
| Васкулярні фактори ризику, n (%) | |||
| АГ | 47 (95,9) | 52 (98,1) | >0,05 |
| ЦД | 11 (22,4) | 15 (28,3) | >0,05 |
| Транзиторна ішемічна атака в анамнезі | 9 (18,4) | 6 (11,3) | >0,05 |
| Церебральний судинний криз в анамнезі | 47 (95,9) | 47 (88,7) | >0,05 |
| Ішемічна хвороба серця | 13 (26,5) | 34 (64,2)* | <0,05 |
| Миготлива аритмія | 9 (18,4) | 24 (45,3)* | <0,01 |
| Тютюнопаління | 36 (73,5) | 34 (64,2) | >0,05 |
| Зловживання алкоголем | 11 (22,4) | 13 (24,5) | >0,05 |
| Гіподинамія | 39 (79,6) | 41 (77,3) | >0,05 |
| Додаткові фактори ризику, M±m | |||
| Комплекс інтими — медіа (КІМ) внутрішньої сонної артерії, мм | 1,03±0,02 | 1,2±0,02* | 0,001 |
| Індекс коморбідності Чарлсона | 4,4±0,2 | 4,3±0,2 | >0,05 |
| Основні характеристики ішемічного інсульту | |||
| Розмір вогнища ішемії на магнітно-резонансній томографії головного мозку, M±m, см3 | 20,7±2,89 | 52,9±4,7* | <0,001 |
| Каротидний басейн кровопостачання, n (%) | 36 (73,5) | 40 (75,5) | >0,05 |
| Вертебробазилярний басейн кровопостачання, n (%) | 13 (26,5) | 13 (24,5) | >0,05 |
| Атеротромботичний інсульт, n (%) | 10 (20,4) | 30 (56,6)* | <0,05 |
| Кардіоемболічний інсульт, n (%) | 6 (12,2) | 16 (30,2)* | <0,05 |
| Лакунарний інсульт, n (%) | 31 (63,3) | 7 (13,2)* | <0,05 |
| Остаточно невизначений підтип інсульту, n (%) | 2 (4,1) | – | >0,05 |
| Кількість компонентів МС, n (%) | |||
| 3 компоненти МС | 22 (44,9) | 10 (18,9)* | <0,05 |
| 4 компоненти МС | 18 (36,7) | 23 (43,4) | >0,05 |
| 5 компонентів МС | 9 (18,4) | 20 (37,7)* | <0,05 |
| Антропометричні показники, M±m | |||
| Маса тіла, кг | 91,7±1,4 | 94,4±1,3 | 0,154 |
| Індекс маси тіла (ІМТ), кг/м2 | 31,6±0,6 | 32,5±0,4 | 0,208 |
| Окружність талії, см | 108,1±1,4 | 110,9±1,5 | 0,179 |
| Гемодинамічні показники на момент госпіталізації, M±m | |||
| Систолічний артеріальний тиск (АТ), мм рт. ст. | 173,5±3,4 | 173,5±3,9 | 1,0 |
| Діастолічний АТ, мм рт. ст. | 103,7±1,2 | 102,2±1,8 | 0,469 |
| Пульсовий АТ, мм рт. ст. | 70,2±2,8 | 71,4±3,1 | 0,775 |
| Середній АТ, мм рт. ст. | 126,8±1,8 | 125,6±2,3 | 0,670 |
| Лабораторні показники, M±m | |||
| Кількість лейкоцитів, 109/л | 8,1±0,3 | 8,9±0,4 | 0,07 |
| Гематокрит, % | 41,6±0,7 | 41,4±0,7 | 0,837 |
| Швидкість осідання еритроцитів, мм/год | 9,0±1,2 | 11,9±1,6 | 0,153 |
| Протромбіновий індекс, % | 95,2±1,8 | 85,2±1,8 | 0,644 |
| Фібрин, мг | 13,4±0,7 | 16,2±1,1* | 0,036 |
| Фібриноген, г/л | 3,4±0,2 | 4,41±0,4* | 0,025 |
| Глюкоза в плазмі крові, ммоль/л | 6,54±0,3 | 7,55±0,3* | 0,01 |
| Глікозильований гемоглобін, % | 6,22±0,6 | 6,33±0,9 | 0,481 |
| Загальний холестерин, ммоль/л | 6,2±0,1 | 6,1±1,4 | 0,644 |
| Тригліцериди, ммоль/л | 1,99±0,13 | 1,82±0,1 | 0,272 |
| Ліпопротеїди високої щільності (ЛПВЩ), ммоль/л | 1,21±0,04 | 1,03±0,03* | 0,001 |
| Ліпопротеїди низької щільності, ммоль/л | 3,73±0,15 | 3,81±0,18 | 0,744 |
| Фоновий неврологічний статус, M±m | |||
| Стан свідомості за шкалою коми Глазго, бали | 13,9±0,08 | 13,2±0,16* | 0,001 |
| Неврологічний дефіцит за NIHSS, бали | 9,9±0,49 | 14,9±0,75* | 0,001 |
| Ступінь інвалідизації за ІБ, бали | 43,6±1,64 | 30,9±2,14* | 0,001 |
При порівнянні між собою базових характеристик обох груп достовірно встановлено значне потовщення КІМ внутрішньої сонної артерії у пацієнтів із несприятливими клінічними наслідками. Також у них вдвічі частіше реєстрували миготливу аритмію та ішемічну хворобу серця. Наявність церебрального судинного кризу в анамнезі однаково часто відзначали серед пацієнтів обох груп. Статистично достовірних відмінностей поширеності АГ, ЦД, транзиторної ішемічної атаки, шкідливих поведінкових факторів (тютюнопаління, зловживання алкоголем, гіподинамії) серед пацієнтів обох груп не виявлено (див. табл. 1).
Розмір вогнища ішемії, атеротромботичний та кардіоемболічний підтипи інсульту визначено незалежними предикторами несприятливого функціонального наслідку інсульту. Не виявлено достовірних відмінностей впливу фактора басейна кровопостачання, в якому відбулася ішемічна подія. Встановлено, що лакунарний підтип інсульту достовірно частіше відзначали у групі зі сприятливим функціональним наслідком.
Виявлено, що наявність у пацієнта п’яти КМС є незалежним предиктором несприятливого функціонального наслідку, і навпаки, наявність трьох КМС — прогностична ознака сприятливого наслідку (див. табл. 1). Маса тіла, ІМТ та окружність талії не впливали на функціональний наслідок пацієнта. Серед показників системної гемодинаміки достовірних предикторів функціонального наслідку пацієнта з ішемічним інсультом та МС також не виявлено.
Встановлено, що фібрин, фібриноген, глюкоза у плазмі крові та ЛПВЩ є незалежними предикторами несприятливого наслідку інсульту (див. табл. 1). Прогностичної цінності решти лабораторних показників не виявлено.
На момент госпіталізації стан свідомості у пацієнтів оцінювали за шкалою коми Глазго, а фоновий неврологічний дефіцит — за NIHSS та ІБ. Встановлено достовірні відмінності рівня свідомості та фонового неврологічного дефіциту у пацієнтів обох груп (див. табл. 1).
Отже, за результатами проведеного дослідження, до предикторів несприятливого функціонального наслідку ішемічного інсульту у пацієнтів із МС можна віднести: ступінь порушення стану свідомості та рівень неврологічного дефіциту, товщину КІМ внутрішньої сонної артерії, розмір вогнища ішемії, рівень ЛПВЩ, фібрину та фібриногену в крові, глюкози в плазмі крові, атеротромботичний та кардіоемболічний підтип інсульту, миготливу аритмію та ішемічну хворобу серця в анамнезі, наявність п’яти КМС.
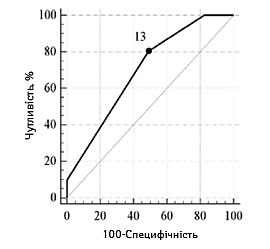
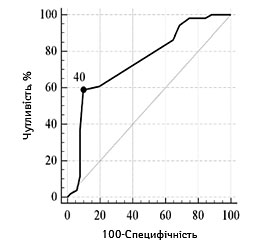
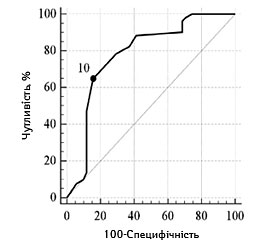
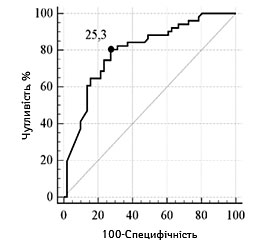
З метою прогнозування несприятливого функціонального наслідку з використанням мШР встановлено порогові рівні ступеня порушення свідомості та значень фонового неврологічного дефіциту. В табл. 2 та 3 представлено результати проведеного ROC-аналізу з визначенням порогових рівнів оцінки за шкалами, та адекватності представлених моделей (згідно з коефіцієнтом AUC).
отримані наприкінці гострого періоду після проведеного лікування
| Статистичні величини | Показники фонового стану | ||
|---|---|---|---|
| Фоновий неврологічний дефіцит | Рівень свідомості за шкалою коми Глазго | ||
| NIHSS | ІБ | ||
| Порогові значення, балів | ≥10 | ≤40 | ≤13 |
| Чутливість, % (95% ДІ) | 64,7 (50,1–77,6) | 58,8 (44,2–72,4) | 80,4 (66,9–90,2) |
| Специфічність, % (95% ДІ) | 84,3 (71,4–93,0) | 90,2 (78,6–96,7) | 51,0 (36,6–65,2) |
| Прогностична ефективність, % (95% ДІ) | 80,3 (70,4–83,0) | 88,2 (68,6–87,7) | 61,0 (46,6–69,2) |
| Оцінка адекватності моделі (AUC, p) | 0,78 (0,69–0,86), р<0,0001 | 0,75 (0,65–0,83), р<0,0001 | 0,70 (0,60–0,79),
р<0,001 |
| Статистичні величини | Показник | |
|---|---|---|
| Розмір вогнища | Глюкоза в плазмі крові | |
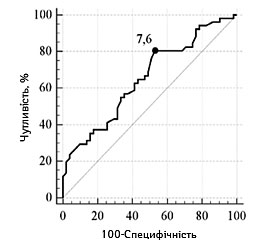
| Порогові значення | ≥25,3 см3 | ≥7,6 ммоль/л |
| Чутливість, % (95% ДІ) | 80,4 (66,9–90,2) | 80,4 (66,9–90,2) |
| Специфічність, % (95% ДІ) | 72,6 (58,3–84,1) | 47,1 (32,9–61,5) |
| Прогностична ефективність, % (95% ДІ) | 76,0 (66,2–81,2) | 76,2 (70,4–81,0) |
| Оцінка адекватності моделі (AUC, p) | 0,80 (0,71–0,87),
р<0,0001 |
0,65 (0,55–0,74),
р=0,0046 |
Залежно від наявності несприятливого наслідку інсульту графічна характеристика оцінки порогових рівнів основних достовірних показників відносно фактичного розподілу значень у групах представлена на рис.1 та 2.
 |
 |
 |
NIHSS |
ІБ |
Шкала коми Глазго |
 |
 |
Розмір вогнища ішемії, см3 |
Рівень глюкози в плазмі крові, ммоль/л |
Враховуючи отримані результати параметричних і непараметричних критеріїв для прогнозування наслідків ішемічного інсульту наприкінці гострого періоду, прораховано та проведено оцінку відносного ризику несприятливого наслідку для діапазонів показників: вище та нижче порогових значень (сприятливий та несприятливий діапазон). Статистично вірогідне підвищення ймовірності несприятливого наслідку ішемічного інсульту в пацієнтів із МС зумовлено фоновим неврологічним дефіцитом за NIHSS ≥10 балів (відносний ризик (ВР) 3,61; р<0,0001), за ІБ ≤40 балів (ВР 2,76; р<0,0001), вираженістю порушення рівня свідомості за шкалою коми Глазго ≤13 балів (ВР 3,61; р<0,0001), значним потовщенням КІМ внутрішньої сонної артерії (ВР 2,37; р<0,0001), розміром вогнища ішемії ≥25,3 см3 (ВР 3,09; р<0,0001), фоновим рівнем глюкози в плазмі крові ≥7,6 ммоль/л (ВР 2,4; р<0,006), рівнем фібрину (ВР 1,71; р<0,014), фібриногену (ВР 1,62; р<0,024), ЛПВЩ (ВР 2,37; р<0,0001), атеротромботичним (ВР 2,21; р<0,0001) і кардіоемболічним (ВР 2,41; р<0,0001) підтипами інсульту, миготливою аритмією (ВР 1,68; р<0,016), ішемічною хворобою серця (ВР 1,69; р<0,045), наявністю сумарно п’яти КМС (ВР 1,5; р<0,078).
Висновки
1. Детальний аналіз впливу окремих КМС та інших додаткових факторів виявив основні предиктори несприятливих функціональних наслідків інсульту наприкінці гострого періоду.
2. На несприятливий функціональний наслідок пацієнтів із МС впливають: вираженість порушення рівня свідомості за шкалою коми Глазго (≤13 балів) і фонового неврологічного дефіциту за NIHSS (≥10 балів) й ІБ (≤40 балів), значне потовщення КІМ внутрішньої сонної артерії, розмір вогнища ішемії (≥25,3 см3), фоновий рівень глюкози у плазмі крові (≥7,6 ммоль/л), рівні фібрину, фібриногену та ЛПВЩ, атеротромботичний та кардіоемболічний підтип інсульту, миготлива аритмія, ішемічна хвороба серця в анамнезі, наявність сумарно п’яти КМС.
Список використаної літератури
- Alberti K.G., Eckel R.H., Grundy S.M. et al.; International Diabetes Federation Task Force on Epidemiology and Prevention; Hational Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; International Association for the Study of Obesity (2009) Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation, 120(16): 1640–1645.
- Chei C.L., Yamagishi K., Tanigawa T. et al. (2008) Metabolic Syndrome and the Risk of Ischemic Heart Disease and Stroke among Middle-Aged Japanese. Hypertens. Res., 31(10): 1887–1894.
- Goldstein L.B., Bushnell C.D., Adams R.J. et al.; American Heart Association Stroke Council; Council on Cardiovascular Nursing; Council on Epidemiology and Prevention; Council for High Blood Pressure Research,; Council on Peripheral Vascular Disease, and Interdisciplinary Council on Quality of Care and Outcomes Research (2011) Guidelines for the primary prevention of stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke, 42(2): 517–584.
- Mizrahi E.H., Waitzman A., Blumstein T. et al. (2010) Diabetes mellitus predicts cognitive impairment in patients with ischemic stroke. Am. J. Alzheimers. Dis. Other Demen., 25(4): 362–366.
- Oh M.Y., Lee H., Kim M.J. et al. (2014) The Intriguing Metabolically Healthy but Obese Phenotype:Association With the Prognosis After Ischemic Stroke. In: International Stroke Conference Poster Abstracts. Session Title: Community/Risk Factors Posters II, 45: ATP140.
- Rodriguez-Colon S.M., Mo J., Duan Y. et al. (2009) Metabolic syndrome clusters and the risk of incident stroke: the atherosclerosis risk in communities (ARIC) study. Stroke, 40(1): 200–205.
- Rykała J., Kwolek A. (2009) Wpływ wybranych czynników na jakość życia oraz stan funkcjonalny pacjentów po udarze mózgu. Przegląd Medyczny Uniwersytetu Rzeszowskiego Rzeszów, 4: 384–391.
- Suh S., Baek J., Bae J.C. et al. (2014) Sex factors in the metabolic syndrome as a predictor of cardiovascular disease. Endocrinol Metab (Seoul), 29(4): 522–529.
- Writing Group Members, Mozaffarian D., Benjamin E.J. et al.; American Heart Association Statistics Committee; Stroke Statistics Subcommittee (2016) Heart Disease and Stroke Statistics-2016 Update: A Report From the American Heart Association. Circulation, 133(4): e38–e60.
Адреса для листування:
Бабенко Василь Васильович
02660, Київ, вул. Братиславська, 5 А
ДУ «Інститут серця Міністерства
охорони здоров’я України»
E-mail: [email protected]





