Вступ
Розшарування сонних артерій (РСА) — одна з основних причин гострих порушень мозкового кровообігу в молодому віці (Debette S., Leys D., 2009). Загалом ця патологія призводить до розвитку інсульту у 2% випадків, а її поширеність у загальній популяції становить 2–6 на 100 тис. населення на рік (Сhen J.et al., 2013). У 15–25% осіб віком <45 років зі встановленим інсультом виявляють РСА (Ferro J.M. et al., 2010). Цей показник залежить від діагностичних можливостей клініки, а також обізнаності та компетентності неврологів. Однак у багатьох випадках патологія залишається невстановленою навіть за наявності церебральної ішемічної симптоматики (Lucas C. et al.,1998).
Клінічний випадок
Пацієнт С., 46 років, планово госпіталізований 09.10.2014 р. до стаціонару Комунальної установи Львівської обласної ради «Львівський регіональний фтизіопульмонологічний центр» зі скаргами на малопродуктивний кашель із виділенням невеликої кількості слизистого мокротиння, біль у нижніх відділах грудної клітки справа, задишку при фізичному навантаженні, зниження апетиту і загальну слабкість. За даними анамнезу зазначені скарги турбували хворого протягом 2 міс, лікування не отримував. Протягом останніх днів стан пацієнта погіршився, температура тіла підвищилася до 37,8 °С. Звернувся за медичною допомогою до амбулаторії загальної практики — сімейної медицини, де після обстеження запідозрено туберкульоз легень і направлено до фтизіопульмонологічного центру.
Дані анамнезу життя: на обліку в протитуберкульозних закладах не перебував. Не працював, проживав у центрі для безхатченків міста Львова у відносно задовільних матеріально-побутових умовах. Розведений. Шкідливі звички: тютюнопаління до 1,5–2 пачок цигарок на день >20 років, зловживання алкоголем.
Об’єктивно: загальний стан хворого середньої тяжкості. Тілобудова гіпостенічна, стан живлення задовільний. Зріст — 164 см, маса тіла — 48 кг. Шкіра бліда, чиста. Периферичні лімфатичні вузли не збільшені. Слизова оболонка ротової порожнини суха. Язик чистий, сухий. Аускультативно: над легенями вислуховується жорстке дихання, у нижніх відділах справа — ослаблене. Серцеві тони чисті, ритмічні. Артеріальний тиск — 125/80 мм рт. ст., пульс — 110 уд./хв. Живіт при пальпації м’який, неболючий. Печінка пальпується по краю реберної дуги. Селезінка не збільшена. Фізіологічні відправлення в нормі. Неврологічний статус без особливостей. На оглядовій рентгенограмі органів грудної клітки справа від п’ятого міжребер’я до діафрагми: інтенсивне гомогенне затемнення з косим верхнім контуром за рахунок потовщення плеври з можливим вмістом, зліва у першому міжребер’ї: посилений легеневий малюнок із вогнищевими тінями, на решті легеневого поля він збагачений та деформований, корені неструктуровані, зліва діафрагми — нечітко контуровані.
За даними тесту легеневої функції визначено порушення функції зовнішнього дихання за обструктивно-рестриктивним типом середнього ступеня тяжкості.
Загальний аналіз крові на час госпіталізації: гемоглобін — 121 г/л, еритроцити — 3,63•1012/л, кольоровий показник — 1,0, лейкоцити — 8,9•109/л, швидкість осідання еритроцитів — 55 мм/год; лейкоцитарна формула: мієлоцити — 3%, паличкоядерні нейтрофільні гранулоцити — 13%, сегментоядерні нейтрофільні гранулоцити — 56%, еозинофіли — 1%, лімфоцити — 17%, моноцити — 10%.
Біохімічний аналіз крові: загальний білок — 72,0 г/л, глюкоза у плазмі крові натще — 6,3 ммоль/л, загальний білірубін — 12,66 мкмоль/л, тимолова проба — 2,0, сечовина — 4,8 ммоль/л, креатинін — 80,3 мкмоль/л.
Бактеріовиділення відсутнє (МБТ–)При проведенні бактеріоскопічного дослідження мокротиння від 15.10.2014 р. кислотостійких бактерій не виявлено (М–). При бактеріологічному посіві мокротиння ріст мікобактерій туберкульозу відсутній (К0).
Клінічний діагноз. Вперше діагностований туберкульоз (ВДТБ) (10.10.2014 р.) верхньої частки правої легені (інфільтративний), Дестр –, МБТ – М – К0, Резист0, Гіст0, Кат1, Ког4 (2014 р.). Правобічний ексудативний плеврит.
10.10.2014 р. призначено протитуберкульозне лікування препаратами 1-го ряду за 1-ю категорією (інтенсивна фаза) (Кат1): ізоніазид — 0,3 г/добу, рифампіцин — 0,45 г/добу, етамбутол — 1,2 г/добу, піразинамід — 1,5 г/добу. 13.10.2014 р. проведено пункцію правої плевральної порожнини по задньоаксилярній лінії у сьомому міжребер’ї, отримано 800 мл солом’яно-жовтої мутної рідини.
Протитуберкульозна терапія зумовила позитивний ефект: покращився загальний стан хворого, нормалізувалася температура тіла, відзначено позитивну рентгенологічну динаміку; пацієнт переносив лікування добре. 15.11.2014 р. стан раптово погіршився — розвинулася тотальна афазія та правобічна геміплегія.
Консультація невролога: гостре порушення мозкового кровообігу за ішемічним типом у басейні лівої середньомозкової артерії.
Протягом наступних днів, незважаючи на проведену інтенсивну терапію, стан хворого погіршувався, розвинулися розлади свідомості, мозкова кома. 21.11.2014 р. о 18:00 настала біологічна смерть.
Заключний клінічний діагноз. Гостре порушення мозкового кровообігу (15.11.2014 р.) за ішемічним типом у басейні лівої середньомозкової артерії, правобічна геміплегія, афазія. ВДТБ (10.10.2014 р.) верхньої частки правої легені (інфільтративний), Дестр –, МБТ – М – К0, Резист0, Гіст0, Кат1, Ког 4 (2014 р.). Правобічний ексудативний плеврит. Хронічне обструктивне захворювання легень ІІІ ст.
Під час патологоанатомічного розтину виявлено: ліва півкуля головного мозку збільшена в розмірах, структура на розрізі драглистої консистенції, представлена безструктурною кашоподібною сірою масою, яка по периметру оточена множинними точковими геморагіями.
Ліва внутрішня сонна артерія (ВСА): на 2 см вище біфуркації спостерігається лінійний розрив інтими інтрамурального розповсюдження довжиною близько 0,8 см, який займає задню та частково бокові стінки; порожнина розриву в дистальному напрямку веде у порожнину розшарування, вкриту незначними поодинокими згустками крові, у проксимальному напрямі розшарування розповсюджуються виключно по задній стінці аорти на довжину близько 7 см від місця проксимального розриву, у дистальному напрямі розшарування розповсюджується по задньобоковій стінці до рівня входу в череп, закінчуючись сліпо за 2 см до входу в нього. Просвіт артерії звужений до 80% за рахунок відшарованого та частково закрученого листка інтими. Периметр артерії в межах норми (0,55 см), товщина стінки судини — 0,2 см.
Інші прецеребральні, церебральні, коронарні, ниркові артерії, артерії верхніх і нижніх кінцівок: стінки тонкі, просвіти вільні. На інтимі аорти наявні поодинокі жовті плями.
При дослідженні органів грудної порожнини виявлено часткові спайки правої плевральної порожнини у ділянці верхівки правої легені, верхня частка правої легені ущільнена, сіро-жовта; бронхи: стінки потовщені, містять рідкий слиз.
Дані гістологічного дослідження: у легеневій тканині в ураженій ділянці наявні ознаки розсмоктування і часткової організації туберкульозного інфільтрату, хронічний обструктивний бронхіт, вогнищевий метатуберкульозний склероз і петрифікати бронхопульмональних лімфатичних вузлів. Проявів прогресування туберкульозного процесу, казеозних вогнищ, бронхогенної дисемінації не виявлено.
При дослідженні стінки лівої ВСА виявлено: інтима відшарована на значному протязі та вільно розташовується в просвіті судини (рис. 1); визначається циркулярна гіперплазія інтими нерівномірного характеру, товщина інтими досягає товщини медії. У гіперплазованій інтимі та субінтимальному шарі спостерігаються нерівномірні скупчення гладком’язових клітин (ГМК) та сполучнотканинна проліферація. ГМК дистрофічно змінені із вогнищевою вакуолізацією та перицелюлярним набряком (рис. 2). Для дослідження еластичних та колагенових волокон використано забарвлення резорцин-фуксином за Хартом і трихромний метод Масона. В інтимі та субінтимальному шарі визначається дифузна проліферація колагенових волокон із формування подушкоподібних утворень, ГМК із ознаками вакуольної дистрофії та вогнищ мукоїдизації (рис. 3, 4); еластичні волокна дистрофічно змінені із формуванням вогнищевих павукоподібних утворень, що складаються з різко гіпохромних, витончених та мультиплікованих волоконець, визначаються множинні щілиноподібні пустоти, дрібні вогнища еластолізису, що чергуються із гіперхромними та гіперплазованими еластичними волокнами (рис. 5, 6). Медіа та адвентиція практично не змінені. Патоморфологічні зміни лівої ВСА відповідають фібром’язовій дисплазії (ФМД), варіанту інтимальної фіброплазії (ІФ).
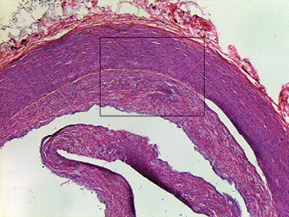
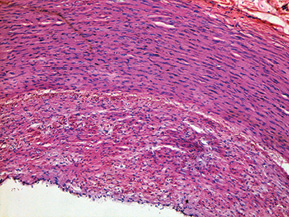
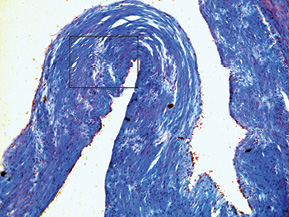
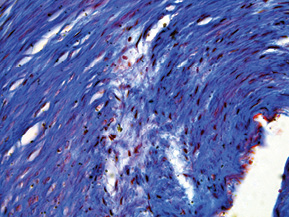
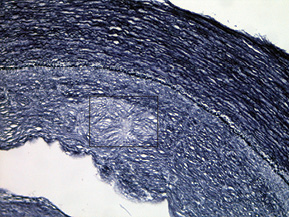
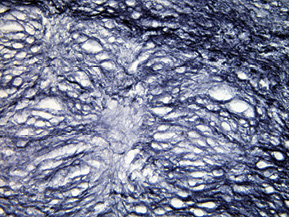
Патологоанатомічний діагноз: 1. Субтотальний ішемічний інфаркт лівої півкулі головного мозку внаслідок ізольованого спонтанного розшарування лівої ВСА. 2. Набряк головного мозку. 3. Інфільтративний туберкульоз верхньої частки правої легені, фаза розсмоктування; вогнищевий метатуберкульозний склероз, петрифікати бронхопульмональних лімфатичних вузлів. Хронічний обструктивний бронхіт.
Таким чином, у 46-річного пацієнта, який хворів на інфільтративний туберкульоз правої легені з розвитком правобічного ексудативного плевриту і отримував лікування в умовах спеціалізованого протитуберкульозного закладу, на 2-му місяці інтенсивної фази протитуберкульозної терапії виникло ізольоване спонтанне розшарування лівої ВСА із подальшим субтотальним ішемічним інфарктом лівої півкулі головного мозку, що став причиною смерті хворого.
Обговорення
Аналіз випадку демонструє, що РСА може виникати раптово та не має специфічної клінічної симптоматики. За даними літератури, у 67% РСА дебютує транзиторною ішемічною атакою чи ішемічним інсультом (Богданов Э.И., 2012). Типовими клінічними проявами розшарування ВСА є: ішемічний інсульт або транзиторне порушення мозкового кровообігу, головний або шийний біль і симптом Горнера (Chaves C. et al., 2002). Головний біль відзначають у 60–100% випадків (Rahme R.J. et al., 2013). У 20% пацієнтів він є єдиним проявом хвороби і не супроводжується симптомами транзиторної чи стійкої ішемії мозку (Thanvi B. et al., 2005). Головний біль при РСА не має специфічних рис, дебютує гостро чи поступово, є інтенсивним, пульсуючим, нагадує мігренозний або кластерний (Rist P.M. et al., 2011). Синдром Горнера пов’язаний зі швидким розширенням ВСА, що здавлює симпатичні нервові волокна, і спостерігається у 14–50% пацієнтів (Borgman C.J., 2012). Гострий, частіше однобічний, симптом Горнера в поєднанні з головним або шийним болем, а також іпсилатеральним ішемічним інсультом у каротидному басейні специфічний для РСА і потребує подальшого негайного дослідження шийних артерій (Debette S. et al., 2011). Черепні нерви уражаються рідше, у 7% спостережень; це зазвичай десятий, одинадцятий і дванадцятий нерви, анатомічно прилеглі до сонної артерії на шийному рівні. У 2% пацієнтів із РСА розвивається ретинальна ішемія (Покровский А.В. и соавт., 2005). Час від моменту появи локальної симптоматики до розвитку інсульту становить від декількох хвилин до 1 міс. Пацієнти, які мають лише локальні симптоми без ознак церебральної чи ретинальної ішемії, становлять <33%. У 6% випадків РСА асимптомне і може бути виявлене при проведенні рутинних досліджень (Schievnik W.I., 2001). Донедавна основним інструментальним методом, золотим стандартом у діагностиці РСА була ангіографія. Подальше удосконалення неінвазивних методів діагностики дало можливість застосовувати комплексну магнітно-резонансну ангіографію, рентгенівську комп’ютерну ангіографію, кольорове дуплексне сканування — методики, які в силу своїх великих можливостей поступово витісняють ангіографію на 2-ге місце. Магнітно-резонансна томографія дозволяє ідентифікувати не лише оклюзію, стеноз артерії, а й саму інтрамуральну гематому, визначити ступінь розширення стінки судини за рахунок гематоми (Lucas C. et al.,1998). Діагностична чутливість комп’ютерної ангіографії становить 92–100%, цьому методу слід віддавати перевагу під час діагностики дисекції хребетної артерії (Покровский А.В. и соавт., 2005). Інвазивну ангіографію використовують у тому разі, якщо неінвазивні методи дають неоднозначні результати або при плануванні ендоваскулярного втручання (Сhen J.et al., 2013).
У літературі описано випадки розвитку захворювання у осіб віком 11–79 років. Середній вік пацієнтів із РСА, за даними різних авторів, становить 35,5–45,8 року (Schievnik W.I. et al., 1993). Згідно з даними досліджень, проведених у США і Франції, частота РСА становить 2,5–3 на 100 тис. населення. РСА відзначають у чоловіків і жінок приблизно з однаковою частотою. Проте є деякі гендерні відмінності, залежно від ділянки локалізації розшарування артерій шиї. Так, розшарування в системі каротидних артерій частіше виявляють у чоловіків, а у вертебрально-базилярній системі — у жінок (Ferro J.M. et al., 2010).
Етіологія РСА залишається невідомою. Розшарування може бути спонтанним, травматичним і ятрогенним. Переважна більшість РСА є спонтанними. У 10–20% випадків розшарування ангіографічні дослідження виявляють ФМД (Schievnik W.I., 2001). В окремих випадках описують синдром Марфана, 4-й тип синдрому Елерса — Данлоса і кістозний медіанекроз (Покровский А.В. и cоавт., 2005; Nasser M. et al., 2013). За цих умов патоморфологічно виявляють типову картину ІФ. Останню, як патоморфологічний варіант ФМД, найчастіше відзначають у сонних артеріях. Ангіографічно вона проявляється фокальним концентричним стенозом із тривалим розповсюдженням, який подібний до змін артерій при гігантоклітинному васкуліті й артеріїті Такаясу. Гістологічно спостерігають субендотеліальні нерівномірні скупчення мезенхімальних клітин у межах матриксу фіброзної сполучної тканини. Внутрішня еластична мембрана часто фрагментована, але завжди наявна. Будова медії та адвентиції незмінена. Вважають, що саме ІФ частіше, ніж інші форми ФМД, призводить до РСА (Slovut D.P., Olin J.W., 2004).
Відзначено важливий вплив на виникнення РСА у пацієнта С. туберкульозу, оскільки інфекція може бути одним із факторів ризику РСА. Можливим способом її розвитку є механічне ушкодження при нападах кашлю, чхання чи задишки. Описані лише окремі випадки РСА при двобічній пневмонії, викликаній Chlamydia pneumoniae, респіраторно-вірусній інфекції верхніх дихальних шляхів. Інша гіпотеза: інфекційні агенти можуть ініціювати ушкодження судинної стінки та розвиток розшарування. Мікробні агенти і клітинна інфільтрація викликають активацію цитокінів і протеаз, що іноді спричиняє надмірну позаклітинну деградацію судинного матриксу і, таким чином, ослаблює стінку судини (Guillon B. et al., 2003). При дисемінованому запальному процесі описують васкуліт регіонарних до первинного септичного джерела судин. При прогресуючих і хіміорезистентних формах туберкульозу можливі ураження легеневих та бронхіальних артерій (Жукова Е.Н., Макаров И.Ю., 2012). РСА чи розшарування хребтових артерій при туберкульозі в літературі не описані. Оскільки досліджені лише окремі випадки РСА у поєднанні з інфекцією, встановити точну роль останньої в розвитку РСА неможливо.
Згідно з теорією про вплив ксенобіотиків на судинну стінку, важкі метали пошкоджують м’язово-еластичний каркас артерії і призводять до судинних захворювань (Зербино Д.Д., Соломенчук Т.Н., 2006). У розглянутому випадку у пацієнта С. був багаторічний стаж курця. Токсичні сполуки, що утворюються при тютюнопалінні, могли пошкоджувати судинну стінку та ініціювати розвиток ФМД.
Механізм формування розшарування залишається до кінця незрозумілим. Існує кілька концепцій РСА. Одна із них полягає в тому, що ініціюючим фактором процесу є надрив інтими, який під час пульсової хвилі поширюється в середину стінки, розшаровуючи медію із формуванням інтрамуральної гематоми та закінчується розшаруванням усієї стінки (Rist P.M. et al., 2011). Цей механізм характерний для захворювань із ураженням еластичного каркасу медії: синдрому Марфана, медіанекрозу, синдрому Елерса — Данлоса. При такому варіанті розшарування надрив інтими зазвичай поширюється частіше вздовж передньолатерального краю судини і має найбільшу гідродинамічну і торсійну сили. Розшарування відбувається в антеградному напрямі й часто уражає судину на значному протязі (Vilacosta I. et al., 1997). Альтернативною концепцією механізму розшарування є зміни vasa vasorum. Деякі автори вважають, що можливою причиною нетравматичних розшарувань та розривів артерії є зміни мікроциркуляторного русла — vasa vasorum, які виражаються у вигляді склерозу, гіпертрофії, вогнищевої проліферації інтими зі звуженням чи облітерацією просвіту, тромбозу. Розриви судин адвентиції призводять до інтрамуральних геморагій в медію, які надалі формують інтрамуральну чи інтрамедіальну гематому. Потім інтрамуральна гематома розшаровує стінку артерії та призводить до РСА (Debette S., Leys D., 2009). Водночас зміни vasa vasorum описані під час морфологічного дослідження сонних артерій лише в поодиноких випадках. Незважаючи на відсутність морфологічного підґрунтя, таку концепцію сьогодні підтримують багато провідних хірургічних центрів світу (Schievnik W.I., 2001).
На нашу думку, зміни vasa vasorum — вторинний процес — виконують адаптаційну роль та сприяють прогресуванню патологічних процесів у сонній артерії, але не є ініціюючим чинником в їх розвитку. Вірогідно, механізм РСА при ІФ ФМД має такий вигляд: надрив інтими внаслідок її фіброзної трансформації призводить до розвитку субінтимальної розшаровуючої гематоми. Оскільки медіа не уражена, то розшарування буде локальним — на незначному протязі, а ризик розриву — низький. Подібний механізм описують при атеросклеротичній аневризмі, коли надрив у ділянці атероматозної атеросклеротичної бляшки призводить до локальної розшаровуючої гематоми (Vilacosta I. et al., 1997).
Висновок
Розглянутий випадок РСА має ряд особливостей. Зокрема, розшарування пов’язане із типовими патоморфологічними змінами, характерними для варіанта ІФ при ФМД. Запропоновано можливий механізм розвитку розшарування: надрив інтими призвів до розшарування судинної стінки і розвитку масивного ішемічного інсульту. Залишається відкритим питання взаємозв’язку туберкульозу і РСА.
РСА — одна з основних причин інсульту в осіб молодого віку. Клінічні ознаки неспецифічні, тому за наявності інтенсивного головного болю у пацієнтів молодого віку має бути настороженість щодо можливості РСА. У таких випадках необхідне своєчасне проведення неінвазивних методів нейровізуалізації.
Питання етіології та патогенезу РСА потребує подальшого дослідження з метою своєчасної діагностики, лікування та профілактики.
Список використаної літератури
- Богданов Э.И. (2012) Ишемический инсульт у пациентов молодого возраста. Неврол. вестн., 2: 30–40.
- Жукова Е.Н., Макаров И.Ю. (2012) Эпидемиологические и патоморфологические особенности лекарственно-устойчивого туберкулеза легких в современных условиях. Дальневосточ. мед. журн., 1: 134–136.
- Зербино Д.Д., Соломенчук Т.Н. (2006) «Атеросклероз» — конкретная патология артерий или «унифицированное» групповое определение? Поиск причин артериосклероза: экологическая концепция. Архив патологии, 68(4): 49–54.
- Покровский А.В., Шубин А.А., Кунцевич Г.И. и др. (2005) Расслоение сонных артерий (обзор литературы и клиническое наблюдение. Ангиология и сосудистая хирургия, 4: 130–140.
- Borgman C.J. (2012) Horner syndrome secondary to internal carotid artery dissection after a short-distance endurance run: A case study and review. J. Optometry, 5(4): 209–216.
- Chaves C., Estol C., Esnaola M.M. et al. (2002) Spontaneous intracranial internal carotid artery dissection: report of 10 patients. Arch. Neurol., 59(6): 977–981.
- Chen J., Zhou X., Li C., Cheung B.M. (2013) Risk of stroke due to spontaneous cervical artery dissection. Intern. Med., 52(19): 2237–2240.
- Debette S., Leys D. (2009) Cervical-artery dissections: predisposing factors, diagnosis, and outcome. Lancet Neurol., 8(7): 668–678.
- Debette S., Metso T., Pezzini A. et al.; Cervical Artery Dissection and Ischemic Stroke Patients (CADISP) Group (2011) Association of vascular risk factors with cervical artery dissection and ischemic stroke in young adults. Circulation, 123(14): 1537–1544.
- Ferro J.M., Massaro A.R., Mas J.L. (2010) Aetiological diagnosis of ischaemic stroke in young adults. Lancet Neurol., 9(11): 1085–1096.
- Guillon B., Berthet K., Benslamia L. et al. (2003) Infection and the risk of spontaneous cervical artery dissection: a case-control study. Stroke, 34(7): e79–81.
- Lucas C., Moulin T., Deplanque D. et al. (1998) Stroke patterns of internal carotid artery dissection in 40 patients. Stroke, 29(12): 2646–2648.
- Nasser M., Vega M.B., Pivetta L.G.A. et al. (2013) Internal carotid artery dissection in a patient with Ehlers-Danlos syndrome type IV: diagnosis and management. J. Vasc. Bras., 12(2): 174–179.
- Rahme R.J., Aoun S.G., McClendon J.Jr. et al. (2013) Spontaneous cervical and cerebral arterial dissections: diagnosis and management. Neuroimaging Clin. N. Am., 23(4): 661–671.
- Rist P.M., Diener H.C., Kurth T., Schürks M. (2011) Migraine, migraine aura, and cervical artery dissection: a systematic review and meta-analysis. Cephalalgia, 31(8): 886–896.
- Schievink W.I. (2001) Spontaneous dissection of the carotid and vertebral arteries. N. Engl. J. Med., 344(12): 898–906.
- Schievink W.I., Mokri B., Whisnant J.P. (1993) Internal carotid artery dissection in a community. Rochester, Minnesota, 1987–1992. Stroke, 24(11): 1678–1680.
- Slovut D.P., Olin J.W. (2004) Fibromuscular dysplasia. N. Engl. J. Med., 350(18): 1862–1871.
- Thanvi B., Munshi S.K., Dawson S.L., Robinson T.G. (2005) Carotid and vertebral artery dissection syndromes. Postgrad. Med. J., 81(956): 383–388.
- Vilacosta I., San Román J.A., Ferreirós J. et al. (1997) Natural history and serial morphology of aortic intramural hematoma: a novel variant of aortic dissection. Am. Heart J., 134(3): 495–507.
Резюме. Проведен анализ случая спонтанного расслоения внутренней сонной артерии у 46-летнего мужчины с впервые диагностированным инфильтративным туберкулезом правого легкого. Причиной смерти больного во время интенсивной фазы противотуберкулезной терапии стало изолированное расслоение левой внутренней сонной артерии с последующим субтотальным ишемическим инфарктом левого полушария головного мозга. При патоморфологическом исследовании выявлена фибромышечная дисплазия, которая привела к расслоению.
Ключевые слова: спонтанное расслоение сонной артерии, сонные артерии, туберкулез легкого, фибромышечная дисплазия.
Summary. The analysis of the case of spontaneous internal carotid artery dissection of 46-year-old man with newly diagnosed infiltrative tuberculosis of the right lung was conducted. The cause of death of the patient during the intensive phase of antituberculosis therapy was isolated left internal carotid artery dissection with ischemic subtotal stroke of the left brain hemisphere. During pathomorphological study it was revealed the fibromuscular dysplasia, which led to the dissection.
Key words: spontaneous internal carotid dissection, carotid artery, pulmonary tuberculosis, fibromuscular dysplasia.
Адреса для листування:
Кузик Юлія Іванівна
79010, Львів, вул. Пекарська, 69
Львівський національний медичний
університет імені Данила Галицького,
кафедра патологічної анатомії
Е-mail: [email protected]





