Вступ
Розсіяний склероз (РС) — найбільш поширене демієлінізуюче захворювання центральної нервової системи, яке вражає осіб молодого працездатного віку та швидко призводить до інвалідизації (Волошина Н.П. и соавт., 2010). Це зумовлює важливість проблеми не лише в медичному, але й в соціально-економічному плані. Серед неврологічних захворювань центральної нервової системи за поширенням РС займає 4-те місце після гострих порушень мозкового кровообігу, епілепсії та паркінсонізму та 1-ше місце серед усіх причин інвалідизації осіб молодого віку (Гусев Е.И., Бойко А.Н., 2000; Столяров И.Д., Бойко А.Н. (ред.), 2008). Крім того, РС є найбільш високозатратним неврологічним захворюванням (Rudick R.A., Goodkin D.E. (Eds), 2000).
Незважаючи на більше ніж столітню історію вивчення проблеми РС, вона залишається однією з найактуальніших у неврології та нейроімунології (Волошина Н.П. и соавт., 2007). Точна причина, яка призводить до запуску патологічної автоімунної реакції, поки що не з’ясована (Завалишин І.А. и соавт., 1999). Ймовірно, виникнення та розвиток РС зумовлені взаємодією факторів вірусної інфекції та генетичної схильності до цього патологічного стану, про що свідчать різні показники захворюваності на РС у різних етнічних групах (Столяров И.Д., Бойко А.Н. (ред.), 2008).
Об’єкт і методи дослідження
У поточному дослідженні взяли участь 72 пацієнти з РС, діагностованим на основі одного з критеріїв С.М. Poser та співавторів (1983):
- наявність 2 загострень в анамнезі та клінічних ознак 2 вогнищ патологічного процесу;
- наявність 2 загострень в анамнезі, клінічних ознак 1 вогнища та параклінічних ознак 1 вогнища (зареєстрованих методом магнітно-резонансної томографії — МРТ).
Діагноз РС обов’язково підтверджували за допомогою МРТ за наявності на знімку:
- декількох вогнищ демієлінізації;
- вогнищ, що виникли в різний час;
- перивентрикулярної та субтенторіальної локалізації вогнищ (Barkhof F., 1997).
Усі хворі перебували на лікуванні у Центральному клінічному госпіталі Державної прикордонної служби України (Київ) в 2001–2014 рр. Середній вік учасників дослідження становив 36,5±2,3 року, середня тривалість захворювання — 7,8±0,9 року. У 34 пацієнтів діагностовано рецидивно-ремітивний, у 38 — прогредієнтний тип перебігу РС. Серед останніх переважали пацієнти із вторинно-прогредієнтним типом перебігу.
Для бальної оцінки ступеня інвалідизації використовували Розширену шкалу оцінки ступеня інвалідизації (Expanded Disability Status Scale — EDSS) (Kurtzke J.F., 1983).
Фазу загострення та ремісії визначали за критеріями С.М. Poser та співавторів (1983). Стабілізацією перебігу захворювання вважали відсутність загострень чи хронічного прогресування протягом ≥1 міс, під хронічним прогресуванням — збільшення вираженості симптомів захворювання протягом ≥2 міс без ознак стабілізації чи поліпшення.
Показанням до екстракорпоральної гемокорекції (ЕГ) стала наявність активного демієлінізуючого процесу, який визначали за клінічними, імунологічними та МРТ-ознаками (Szczepiorkowski Z.M. et al., 2010). Клінічно активний демієлінізуючий процес діагностували при гострому чи підгострому виникненні неврологічного порушення тривалістю >24 год, перед яким протягом 30 діб неврологічний стан не змінювався чи поліпшився, за відсутності лихоманки та інших ознак інфекційного процесу. При цьому на МРТ виявляли збільшення загальної площі демієлінізації та появу нових активних вогнищ.
До імунологічних ознак активної демієлінізації відносили автосенсибілізацію імунної системи до тканинних антигенів мозку (основного білка мієліну), яка включає реакції бласттрансформації лімфоцитів, підвищення продукції прозапальних та зниження продукції протизапальних цитокінів, збільшення концентрації антитіл до основного білка мієліну (Cortese I. et al., 2011). У більшості таких хворих відзначали неефективність традиційної медикаментозної терапії (зі збереженням неврологічного дефіциту в міжрецидивний період, частими рецидивами захворювання) або неможливість її проведення.
Враховуючи особливості розвитку різних форм РС, усіх хворих розподілили на дві групи (табл. 1).
| Критерій | Група | |
|---|---|---|
| 1-ша | 2-га | |
| Наявність ознак активного демієлінізуючого процесу (клінічних та/чи імунологічних та/чи МРТ-ознак) | + | + |
| Вік 18–60 років | + | + |
| Характерні ознаки РС на МРТ | + | + |
| Негативні результати досліджень на наявність збудників повільних нейроінфекцій: вірусу герпесу 6-го та 7-го типу, вірусу Епштейна — Барр, цитомегаловірусу, збудників кліщового бореліозу, Toxoplasma gondii | + | + |
| Відсутність супутніх автоімунних захворювань | + | + |
| Відсутність супутніх ендокринних захворювань | + | + |
| Відсутність органічного ураження судин мозку | + | + |
| Відсутність онкологічного захворювання | + | + |
| Відсутність зв’язку захворювання з гострою чи хронічною інтоксикацією | + | + |
| ≥2 загострень захворювання в анамнезі | + | + |
| Вираженість загострення (швидке наростання неврологічного дефіциту ≥1 бала за шкалою EDSS) та/чи недостатня ефективність традиційної медикаментозної терапії | + | + |
| Загострення >2 разів на рік | – | + |
| Критерій | 1-ша група | Підгрупа 2А (програмний плазмаферез) | Підгрупа 2Б (курсовий плазмаферез) |
|---|---|---|---|
| Кількість пацієнтів, n | 34 | 18 | 20 |
| Співвідношення чоловіків та жінок | 3,3:1 | 6:1 | 6:2 |
| Середній вік, років | 41,4 | 48,7 | 45,6 |
| Тяжкість стану за шкалою EDSS на початку спостереження, балів | 1,5–4,5 | 3,5–4,5 | 3,5–4,5 |
| Період спостереження, років | 3–5 | 3–5 | 3–5 |
До 1-ї групи увійшли 34 пацієнти з рецидивно-ремітивним типом перебігу РС (табл. 2). Показанням до ЕГ у них стала недостатня ефективність проведеної терапії (виражене загострення патологічного процесу з наростанням неврологічного дефіциту ≥1 бала за шкалою EDSS і неможливістю повного чи часткового купірування традиційною медикаментозною терапією із застосуванням глюкокортикостероїдів).
У пацієнтів 1-ї групи перевагу надавали курсовому режиму ЕГ у вигляді лікувального дискретного плазмаферезу на апараті «ОС-6М» (ОАО «ТНК Дастан», Киргизька Республіка). Зазвичай проводили 3–4 процедури із 2–3-денними перервами.
За допомогою ЕГ вдалося досягти зменшення вираженості патологічного процесу при його загостренні, а також усунути залишковий неврологічний дефіцит: у пацієнтів відзначали стійку ремісію захворювання. Тактику ЕГ вибирали з урахуванням існуючих можливостей та світового досвіду.
До 2-ї групи увійшли 38 пацієнтів із прогредієнтним типом перебігу РС (див. табл. 2). Їх, у свою чергу, розподілили на дві порівняно однорідні підгрупи, залежно від способу застосування ЕГ. У підгрупі 2А застосовували метод програмної ЕГ (1–2 процедури кожні 2–3 міс). Зазвичай лікування здійснювали в режимі денного стаціонару, але 1 раз на рік пацієнти проходили повноцінне стаціонарне обстеження. Цей підхід базувався на даних літератури щодо вищої ефективності пролонгованих курсів ЕГ у пацієнтів із прогредієнтним типом перебігу РС порівняно з короткими інтенсивними. Зазвичай такі хворі проходили 1–2 процедури ЕГ з частотою 1 раз на тиждень. Періодичність таких циклів становила 2–3 міс. У пацієнтів підгрупи 2Б ЕГ застосовували спорадично, у вигляді курсу в період чергової госпіталізації. Період спостереження становив 3–5 років.
Пацієнтам обох груп застосовували практично однакову за складом лікарських препаратів терапію, переважно симптоматичну, без систематичного застосування цитостатиків, препаратів імуноглобулінів, інтерферону чи індукторів інтерферону. У деяких осіб ці засоби застосовували протягом деякого періоду, але відмінили у зв’язку з неефективністю чи виникненням побічних ефектів.
Результати та їх обговорення
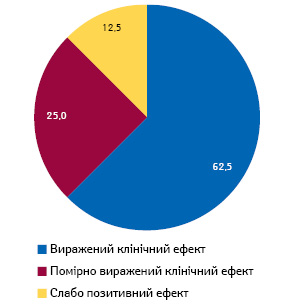
У результаті ЕГ у 45 (62,5%) пацієнтів досягнутий виражений клінічний ефект, у 18 (25,0%) він був помірним та у 9 (12,5%) — сумнівним (слабопозитивним) (рис. 1).
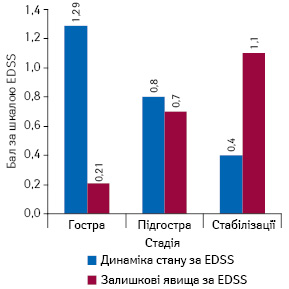
Середній показник тяжкості стану за шкалою EDSS знизився на 0,88±0,12 бала. Ефективність терапії ЕГ залежала від строків початку її проведення. Найкращих результатів лікування досягнуто при застосуванні ЕГ в перші 2 тиж від моменту загострення захворювання. У цьому разі спостерігали зниження неврологічного дефіциту в середньому на 1,3±0,1 бала за шкалою EDSS, що достовірно вище, ніж при застосуванні ЕГ в підгостру стадію захворювання (2–9 тиж від початку загострення). У всіх хворих, яким зазначене лікування проводили у віддалений період після виникнення загострення (>9 тиж від початку), відзначений ефект носив сумнівний характер.
Вираженість залишкового неврологічного дефіциту (хиткість при ходьбі, порушення дрібної моторики, епізодична диплопія) також залежала від моменту початку проведення ЕГ. Найкращі результати за шкалою EDSS (0,21±0,12) відзначали у пацієнтів із раннім початком застосування ЕГ (гостра стадія загострення, термін до 2 тиж) (рис. 2). При застосуванні ЕГ на пізніх строках відзначено достовірно більший залишковий неврологічний дефіцит.
Висновки
1. Застосування ЕГ у вигляді курсу плазмаферезу — ефективний засіб лікування пацієнтів із загостренням РС із рецидивно-ремітивним типом перебігу.
2. Найбільш виражений ефект при застосуванні ЕГ у терапії при РС досягли при її застосуванні в гостру фазу імунозапального процесу, що дозволило значно зменшити вираженість неврологічного дефіциту.
3. Відзначено сумнівний ефект від застосування ЕГ, якщо з моменту загострення пройшло понад 9 тиж й імунологічний процес знаходиться у стадії стабілізації.
Список використаної літератури
- Волошина Н.П., Грицай Н.Н., Дыкан И.Н. и др. (2007) Рассеянный склероз: актуальность проблемы в Украине, современные аспекты иммунопатогенеза, клиники, диагностики и лечения. Украинский междисциплинарный консенсус. Нов. мед. фармац., 215: 20–24.
- Волошина Н.П., Егоркина О.В., Черненко М.Е. (2010) Современные аспекты рассеянного склероза. Терапия, 2: 12–17.
- Гусев Е.И., Бойко А.Н. (2000) Современные подходы к использованию бета-интерферонов в лечении рассеянного склероза. Журн. невр. и психиатр. им. С.С. Корсакова, 100(11): 54–59.
- Завалишин И.А., Переседова А.В., Жученко Т.Д. (1999) От патогенеза к лечению рассеянного склероза. В кн.: Вопросы диагностики и лечения демиелинизирующих заболеваний нервной системы. Материалы к респ. раб. совещанию, Москва, с. 28–38.
- Столярова И.Д., Бойко А.Н. (ред.) (2008) Рассеянный склероз: диагностика, лечение, специалисты. ЭЛБИ-СПб., Санкт-Петербург, 320 с.
- Barkhof F. (1997) The role of magnetic resonance imaging in diagnosis of multiple sclerosis. Multiple Sclerosis: clinical challenges and controversies. Thompson A.J., Polman C., Hohlfeid R. (Eds) Martin Dunitz, London, New York, p. 43–64.
- Cortese I., Chaudhry V., So Y.T. et al. (2011) Evidence-based guideline update: Plasmapheresis in neurologic disorders: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 76(3): 294–300.
- Kurtzke J. (1983) Rating neurologic impairment in multiple sclerosis : an expanded disability status scale (EDSS). Neurology, 33(11): 1444–1452.
- Poser C.M., Paty D.W., Scheinberg L. et al. (1983) New diagnostic criteria for MS. Guidelines for research protocol. Ann. Neurol., 13(3): 227–231.
- Rudick R.A., Goodkin D.E. (Eds) (2000) Multiple Sclerosis Therapeutics. 2nd ed., London, 573 p.
- Szczepiorkowski Z.M., Winters J.L., Bandarenko N. et al.; Apheresis Applications Committee of the American Society for Apheresis (2010) Guidelines on the use of therapeutic apheresis in clinical practice-evidence-based approach from the Apheresis Applications Committee of the American Society for Apheresis. J. Clin. Apher., 25(3): 83–177.
Резюме. В работе проанализированы клинико-лабораторные аспекты лечебного дискретного плазмафереза в комплексной терапии рассеянного склероза. Показано, что экстракорпоральная гемокоррекция в виде курса плазмафереза является эффективным средством лечения обострений рассеянного склероза с рецидивирующе-ремиттирующим типом течения. Эффект наиболее выражен при применении плазмафереза в острую фазу иммуновоспалительного процесса.
Ключевые слова: рассеянный склероз, экстракорпоральная гемокоррекция, плазмаферез.
Summary. The clinical and laboratory aspects of therapeutic discrete plasmapheresis in the complex therapy of multiple sclerosis were analysed in the article. It was shown that extracorporeal hemocorrection as a course of the plasmapheresis is effective in treatment of acute exacerbations of relapsing-remitting multiple sclerosis. The effect is most pronounced using plasmapheresis in the acute phase of immune-inflammatory process.
Key words: multiple sclerosis, extracorporeal hemocorrection, plasmapheresis
Адреса для листування:
Марченко Ольга Миколаївна
01004, Київ, вул. Льва Толстого, 9
Київський медичний університет УАНМ,
кафедра неврології, психіатрії та
рефлексотерапії, ЛФК та мануальної терапії
E-mail: [email protected]





