Вступ
Дефіцит мієлопероксидази (ДМПО) — поширена імунодефіцитна хвороба людини, спричинена генетично детермінованою (первинна) чи набутою (вторинна) недостатністю гемвмісного мікробіцидного ферменту нейтрофілів, моноцитів та їх похідних, що каталізує процеси хлорзалежної оксидації патогенів. Розрізняють кількісний і якісний, тотальний і парціальний, симптомний і асимптомний ДМПО. Частота цього імунодефіциту в країнах Західної Європи і США коливається від 1:2000 до 1:4000 осіб, однак у деяких регіонах вона досягає 1:500 мешканців (Nauseef W.M., 2014). Якщо екстраполювати європейські дані, наразі в Україні проживає щонайменше 23 тис. осіб із цим захворюванням.
Дотепер описано кілька генетичних мутацій, які можуть спричиняти розвиток первинного ДМПО, причому найпоширеніша причина цієї хвороби — заміна аргініну на триптофан у кодоні 569 (R569W) (Nauseef W.M. et al., 1998). Основними причинами виникнення вторинного ДМПО є:
- тяжке отруєння свинцем на виробництві (Queiroz M.L. et al., 1994);
- мієлопроліферативні пухлини і синдроми (Lin C.K. et al., 1990);
- тяжкі мегалобластна та апластична анемії (Bizzaro N. et al., 1988);
- ідіопатичний мієлофіброз (Caenazzo A. et al., 1997);
- лімфома Ходжкіна (Wang K. et al., 2013);
- прелейкемія (Cech P. et al., 1983);
- карцинома з дисемінованими метастазами (Cech P. et al., 1982);
- гостра обструктивна жовтяниця (Arumugan G., Rajagopal R., 2004).
Як і при інших малих імунних дисфункціях, при ДМПО відзначають широку варіабельність перебігу і безпрецедентну гетерогенність клінічних проявів імунодефіциту навіть у межах однієї родини. Так, у одних пацієнтів клінічні симптоми хвороби не розвиваються, в той час, як у інших відзначають їх постійні рецидиви. Це ймовірно зумовлено впливом додаткових несприятливих чинників. Наразі відомо, що імунодефіцит має безсимптомний перебіг у 50% випадків, однак у половини пацієнтів призводить до погіршення якості життя і принаймні в 10% випадків — супроводжується загрозливими для життя симптомами.
Розрізняють інфекційні та неінфекційні прояви ДМПО фагоцитів людини. Ядро інфекційного синдрому цієї хвороби становлять рецидивні бактеріальні та грибкові інфекції, викликані умовно-патогенною мікрофлорою, особливо — тяжкий інвазивний кандидоз із тенденцією до генералізації (Kalinski T. et al., 2007). Серед неінфекційних проявів виділяють:
- доброякісні лімфопроліферативні ураження (Russo А.J. et al., 2009);
- псоріаз (Granel B. et al., 2000);
- вегетосудинну дистонію (Rudolph T.K. et al., 2012);
- порушення гемостазу (d’Onofrio G. et al., 1983);
- екстрапірамідні розлади (Казмирчук В.Е. и соавт., 2011);
- алергічні та автоімунні ускладнення.
У пацієнтів із первинним ДМПО описані випадки хронічного мієлоцитарного лейкозу (Ohno H., 2010) та солідних злоякісних і доброякісних пухлин (Lanza F. et al., 1988).
Для виявлення ДМПО фагоцитів застосовують такі лабораторні та інструментальні дослідження:
- автоматизовану гематографію;
- проточну лазерну цитофлуориметрію;
- біохімічні, цитохімічні та імуноцитохімічні тести;
- спектроскопію;
- імуноблотинг (Nauseef W.M., 2014).
Диференційну діагностику слід проводити із захворюваннями, при яких уражені різні фази фагоцитозу (Dinauer M.C., 2014):
- хронічною гранулематозною хворобою;
- дефіцитом специфічних гранул;
- глікогенозом 1-го типу;
- синдромом Джоба;
- хворобою Костмана;
- синдромом Чедіака — Хігасі;
- дефіцитом молекул адгезії;
- синдромом Швахмана.
Раніше ми повідомляли про інвазивний аспергільозний етмоїдит та викликаний вірусом герпесу 7-го типу лімбічний енцефаліт при парціальному ДМПО фагоцитів (Мальцев Д.В., Климчук В.В., 2011). Наразі наводимо опис історії хвороби пацієнтки з розгорнутою клінічною картиною цього імунодефіциту, що включала рецидивний мікотичний синусит, алергічні, автоімунні ускладнення та ряд інших симптомів.
Клінічний випадок
Пацієнтка Н., 37 років, звернулася до Інституту імунології та алергології Національно медичного університету імені О.О. Богомольця зі скаргами на рецидиви мікотичного синуситу, у зв’язку з чим неодноразово проходила хірургічні втручання на придаткових пазухах носа.
Із анамнезу відомо про епізоди піогенних бактеріальних інфекцій у ранньому дитинстві, з приводу яких хвора часто приймала антибактеріальні препарати. У віці 1 року перенесла тяжкий середній отит, також проходила лікування у стаціонарі щодо респіраторної інфекції. У віці 2–4 років зареєстрована серія лакунарних ангін, у 4 роки — бронхопневмонія. У 1983 р. пацієнтці виконали тонзилектомію у зв’язку з постійними рецидивами гострого тонзиліту. Хвора розповідає про тяжкий карієс молочних зубів, рецидиви тяжкого гінгівіту із гнійними виділеннями. Також у пацієнтки була персистуюча дисфункція кишечнику з частими диспептичними епізодами, діареєю, нудотою і блюванням. У подальшому у випорожненнях виділено Candida albicans із вираженим ростом колоній, що дозволило говорити про хронічний кандидозний ентероколіт.
У дитинстві хвора перенесла кір, вітряну віспу та епідемічний паротит зі звичайний перебігом. Однак зареєстровані аномально часті випадки гострих респіраторних вірусних інфекцій, які майже закономірно завершувалися бактеріальними ускладненнями.
Через 1 рік після тонзилектомії розвинувся лівобічний гнійний гайморит, що був першим із ряду синуситів (рис. 1а).

операційний матеріал, мазки з носової порожнини/зіву)
| 1998 р. | Citrobacter spp. |
| 18.06.2001 р. | S. epidermidis, Actinomyces |
| 22.06.2001 р. | Candida albicans, Candida krusei, Rhodotorula spp., Alternaria alternata |
| 29.08.2001 р. | Micrococcus luteas, S. epidermidis |
| 28.09.2001 р. | S. aureus, S. epidermidis |
| 12.12.2001 р. | Klebsiella pneumoniae |
| 27.02.2002 р. | S. haemolyticus, Str. pneumoniae, Bacteroides spp. |
| 14.03.2002 р. | Bacteroides spp |
| 10.06.2002 р. | Candida albicans, Alternaria spp., Rhodotorula spp. |
| 10.09.2002 р. | Penicillium spp., Trichoderma spp., Alternaria spp. |
| 19.05.2003 р. | Penicillium spp. |
| 08.09.2003 р. | Alternaria spp. |
| 14.10.2003 р. | Cladosporium spp. |
| 27.02.2004 р. | S. aureus (III ст. росту), Penicillium spp. |
| 06.07.2004 р. | Cladosporium spp. |
| 11.08.2004 р. | S. epidermidis (III ст. росту), S. aureus (III ст. росту), Cladosporium spp. |
| 17.01.2005 р. | Penicillium spp., Candida albicans |
| 03.02.2005 р. | S. aureus (IV ст. росту), Penicillium spp. |
| 10.02.2005 р. | Penicillium spp. |
| 24.03.2005 р. | Penicillium spp. |
| 07.03.2006 р. | Penicillium spp. |
| 13.04.2006 р. | Penicillium spp. |
| 31.05.2006 р. | Alternaria alternata, Aureobasidium pullulans, Penicillium spp. |
| 30.07.2006 р. | Enterobacter aerogenes (IV ст. росту), Aspergillus niger |
| 25.07.2006 р. | Enterobacter aerogenes (I ст. росту), Penicillium spp., Aspergillus nidulans |
| 14.08.2006 р. | Pseudomonas alcaligenes (IV ст. росту), Penicillium spp. |
| 02.10.2006 р. | S. haemoliticus (IV ст. росту), Alternaria alternata, Cladosporium cladosporioides, Aureobasidium pullulans |
| 19.12.2006 р. | S. haemoliticus (IV ст. росту), Absidia spp., Rhodotorula spp., Aspergillus spp. |
| 06.02.2007 р. | S. haemoliticus (II ст. росту), Aspergillus spp., Penicillium spp. |
| 30.03.2007 р. | Enterobacter aerogenes (IV ст. росту), S. haemoliticus (II ст. росту), Aspergillus terreus, Aureobasidium pullulans |
| 25.04.2007 р. | S. haemoliticus (IV ст. росту), Penicillium spp. |
| 22.06.2007 р. | Enterobacter aerogenes (IV ст. росту) |
| 25.08.2007 р. | S. haemoliticus (II ст. росту), Cladosporium cladosporioides |
| 10.09.2007 р. | Pseudomonas aeruginosa (IV ст. росту) |
| 25.09.2007 р. | Pseudomonas spp. (IV ст. росту) |
| 24.10.2007 р. | Pseudomonas aeruginosa, Alternaria alternata, Cladosporium cladosporioides, |
| 06.06.2008 р. | S. haemoliticus, Enterobacter aerogenes, Alternaria alternata, Cladosporium spp. |
| 16.09.2008 р. | S. haemoliticus, Enterobacter aerogenes, Alternaria alternata |
| 22.12.2008 р. | Klebsiella pneumoniae |
| 15.10.2009 р. | Enterobacter aerogenes (104 КУО/мл), Alternaria alternata, Cladosporium spp. |
| 04.03.2010 р. | Enterobacter cloacae, Absidia corymbifera |
| 30.04.2010 р. | Candida spp. (104 КУО/мл) |
| 03.11.2010 р. | Staphylococcus saprophyticus (104 КУО/мл), Enterobacter cloacae, Alternaria alternata |
| 30.11.2010 р. | Enterobacter aerogenes (105 КУО/мл) |
| 21.08.2013 р. | Klebsiella pneumoniae (105 КУО/мл), Candida albicans (103 КУО/мл) |
Пацієнтці неодноразово проводили мікробіологічні дослідження для з’ясування збудників рецидивного синуситу (табл. 1). Досліджували промивні води із придаткових пазух, отриманий інтраопераційно матеріал (ексудат, зразки слизової оболонки) та мазки зі слизової оболонки носової порожнини і задньої стінки глотки. Відзначали безпрецедентну гетерогенність ідентифікованих мікробних агентів. Виділяли умовно-патогенні, опортуністичні та сапрофітні мікроорганізми. Часто мала місце змішана бактеріально-грибкова інфекція. Серед бактеріальних агентів переважали Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Pseudomonas aeruginosa. Видно (див. табл. 1) поступову трансформацію етіологічних чинників синуситу протягом хвороби з подальшим переважанням грибкової мікрофлори і нозокоміальних бактерій. Серед кандидозних агентів виявляли Candida albicans та Candida krusei. Плісняві гриби представлені Penicillium spp., Aspergillus spp., Alternaria alternatа (рис. 2). Неодноразово виділяли Rhodotorula і Cladosporium spp., які, за даними літератури, рідко уражають здорових людей: здебільшого імуноскомпрометованих осіб. В анамнезі пацієнтки відзначено парадоксальні випадки поєднання антагоністів — Staphylococcus aureus і Penicillium spp., що характерно для стану імуносупресії.

яку отримувала пацієнтка Н.
| Час застосування | Препарат |
|---|---|
| Весна 1997 р. | Канаміцин внутрішньом’язово тривало |
| 1997–1998 рр. | Багато курсів сульфаметоксазолу/триметоприму і ампіциліну з приводу рецидивного гострого отиту (майже щомісяця) |
| Серпень 1998 р. | Внутрішньом’язово цефтріаксон 7 днів + ципрофлоксацин 5 днів; цефтріаксон — у пазухи |
| Грудень 1998 р.—січень 1999 р. | У пазухи: цефтріаксон, нетилміцин, метронідазол, діоксидин |
| Листопад 1999 р. | У пазухи: цефтріаксон, метронідазол, діоксидин |
| Лютий 2000 р. | Амоксицилін/клавуланова кислота, сульфаметоксазол/триметоприм 480 мг |
| 2000–2001 рр. | Періодичні промивання курсами гайморових пазух із введенням антибіотиків і гідрокортизону |
| Червень 2001 р. | Ітраконазол 21 день, у пазухи — флуконазол |
| Серпень 2001 р. | Ітраконазол 14 днів |
| Вересень 2001 р. | Ітраконазол 7 днів, відміна у зв’язку з тяжкою побічною дією |
| Жовтень 2001 р.–вересень 2002 р. | У пазухи: декаметоксин, метронідазол, мірамістин;пункції гайморових пазух — 2–3 рази на тиждень |
| Вересень 2002 р. | У пазухи: амфотерицин В 14 днів щоденно |
| Весна 2003 р.—вересень 2005 р. | У пазухи: мірамістин, натаміцин, амфотерицин В;пефлоксацин, ципрофлоксацин;пункції гайморових пазух — 2–3 рази на тиждень |
| Вересень — жовтень 2005 р. | У пазухи: амфотерицин В 30 днів щоденно |
| Березень 2006 р.—липень 2008 р. | У міжопераційний період: регулярні пункції 2–6 разів на тиждень із введенням пефлоксацину, амоксициліну/клавуланової кислоти, колоїдного срібла, амфотерицину В |
| 20.06.2006—04.10.2006 р. | Кетоконазол 200 мг per os |
| 11.12.2007—13.02.2007 р. | Кетоконазол 300 мг per os |
| 13.04.2007—13.06.2007 р. | Кетоконазол 300 мг per os |
| 14.08.2007—24.09.2007 р. | Кетоконазол 300 мг per os |
| 26.02.2008—09.04.2008 р. | Кетоконазол 300 мг per os |
| 01.07.2008—22.07.2008 р. | Амоксицилін/клавуланова кислота 600 мг внутрішньовенно перед операцією, потім — по 625 мг 2 рази на добу |
| 12.07.2008—28.07.2008 р.29.07.2008—08.10.2008 р. | Кетоконазол 200 мг per osКетоконазол 300 мг per os |
| Липень 2008—грудень 2009 р. | У пазухи: амоксицилін/клавуланова кислота, колоїдне срібло |
| Лютий 2009 р. | Амоксицилін/клавуланова кислота по 625 мг 2 рази на добу системно |
| Березень 2009 р. | Кетоконазол 300 мг per os |
| 15.10.2009—11.11.2009 р. | Кетоконазол 400 мг per os |
| Січень—лютий 2010 р. | Лінкоміцин у дозі 300 мг внутрішньом’язово протягом 11 днів; кліндаміцин у капсулах по 150 мг 2 рази на добу протягом 28 днів; флуконазол внутрішньовенно протягом 5 днів; флуконазол у капсулах по 150 мг 2 рази на добу протягом 24 днів |
| 12–24.04.2010 р. | Кетоконазол у дозі 400 мг per os, відмінено у зв’язку зі збільшенням вираженості ниркової недостатності |
| 17.08.2010—30.08.3010 рр. | Лінкоміцин внутрішньом’язово в дозі 300 мг; флуконазол per os |
| З 01.11.2010 р. | Лінкоміцин у дозі 300 мг внутрішньом’язово протягом 10 днів; флуконазол внутрішньовенно протягом 21 дня |
З приводу рецидивного синуситу хвора неодноразово проходила курси системної та місцевої антимікробної терапії без досягнення стійкої ремісії з боку патологічного процесу (табл. 2). Антимікробна терапія призводила до тимчасового покращення стану. Але після короткого періоду субкомпенсації закономірно відзначали рецидив, викликаний інфекційним агентом, стійким до лікування. До початку застосування імунотерапії задокументовано близько 35 пролонгованих курсів антимікробної терапії протягом останніх 10 років, однак, згідно з даними анамнезу, їх було набагато більше. Як наслідок застосування антимікробних хіміопрепаратів у пацієнтки неодноразово реєстрували побічні ефекти, що іноді становили загрозу для життя.
Нераціональне застосування антибактеріальних препаратів зумовило видиму трансформацію етіологічних чинників. Щоправда, вона також могла бути зумовлена професією хворої, яка тривалий час працювала з архівними бібліотечними матеріалами, які за зовнішніми ознаками були контаміновані пліснявими грибами — потенційним джерелом інфікування.
Протягом перших 15 років життя для евакуації гнійного ексудату пацієнтці виконано 5 пункцій придаткових пазух носа. Усього за період хвороби жінка перенесла понад 100 дренуючих інвазивних маніпуляцій з приводу рецидивного синуситу, спричинених бактеріальною і грибковою мікрофлорою, які погано піддавалися консервативному лікуванню. Неодноразово у хворої відзначали випадки продуктивного запалення в пазухах (див. рис. 1г), верифікувати яке дозволяло лише застосування рентгенографічного дослідження з контрастом (див. рис. 1в). Іноді рентгенограма не давала чіткої інформації про захворювання, хоча ознаки патологічного процесу із в’язким ексудатом виявляли під час діагностичної дренуючої маніпуляції (див. рис. 1б). Тому виникала потреба у проведенні комп’ютерної томографії (КТ) придаткових пазух носа, що демонструвала патологічне поглинання сигналу в ділянці ураження. Нерідко відзначали картину полісинуситу з одночасним залученням кількох пазух із різних боків (рис. 3). Всупереч поширеній думці, магнітно-резонансна томографія (МРТ) також була досить інформативною щодо виявлення ознак синуситу у пацієнтки — виявлено гіперінтенсивний сигнал у зоні ураження (рис. 4). У деяких випадках спостерігали змішану картину запалення придаткової пазухи носа з одночасним продуктивним ураженням та ексудатом, що було зумовлено бактеріально-грибковою мікст-інфекцією (рис. 5).



Гістологічне дослідження слизової оболонки ураженої пазухи (патогістологічна лабораторія ДУ «Інституту отоларингології імені професора О.С. Коломійченка НАМН України», № 951, зразки 2889–2892, 07.07.2004 р.) показало ознаки хронічного запалення з поліпознозміненою слизовою оболонкою, інфільтрованою еозинофілами, лімфо-плазмоцитарними клітинами, порушенням мікроциркуляції з крововиливами, плазморагією, лізисом кістки.
КТ лицьового черепа демонструвала ознаки остеопорозу і стоншення кісток у ділянці синусів, що парадоксально поєднувалися з гіперостозом. На нашу думку, це було зумовлено хронічним запальним процесом у придаткових пазухах носа. Протягом хвороби відзначалося неодноразове ураження верхньощелепних, решітчастих, лобних і основної пазух в різній послідовності та комбінації. Багато разів мали місце епізоди полісинуситу. Після приєднання плісняви гнійне ексудативне запалення змінилося на продуктивне, гранулематозне ураження з вираженим потовщенням слизової оболонки, формуванням запальних поліпів і кіст, виділенням великої кількості в’язкого ексудату. Неодноразово синусит супроводжувався набряком обличчя з боку ураження, що могло свідчити про поширення інфекційного процесу за межі синуса.
| 14.06.1983 р. | Тонзилектомія, аденотомія, поліпотомія носа зліва |
| 1990 р. | Поліпотомія носа зліва |
| 1991 р. | Поліпотомія носа зліва |
| 1992 р. | Поліпотомія носа зліва |
| 02.07.1999 р. | Підслизова резекція носової перегородки |
| 09.07.1999 р. | Гайморотомія зліва, видалена кіста і 2 поліпи |
| 29.02.2000 р. | Гайморотомія справа, видалена кіста; поліпотомія носа зліва |
| 16.06.2002 р. | Двобічна нижня конхотомія |
| 18.07.2002 р. | Двобічна гайморотомія, етмоїдектомія, сфенотомія |
| 03.07.2003 р. | Лівобічна гайморотомія, трепанопункція правої лобної пазухи, правобічна сфенотомія (реоперація), етмоїдектомія. Видалена кіста з лівої гайморової пазухи, поліпи з середнього носового ходу |
| 06.07.2004 р. | Двобічна гайморотомія, видалена поліпозно змінена слизова оболонка |
| 03.02.2005 р. | Лівобічна гайморотомія, етмоїдектомія зліва, трепанопункція правої лобної пазухи. Видалено поліпи з верхньощелепної пазухи та задніх комірок решітчастого лабіринту |
| 25.07.2006 р. | Двобічна поліпоетмоїдектомія, гайморотомія справа |
| 01.07.2008 р. | Двобічна ендоскопічна ревізія лобних кишень, резекція носової перегородки (реоперація). Розширено природні співотвори лобних пазух |
З приводу тяжкого інвазивного синуситу хвора отримала 10 серйозних хірургічних втручань на придаткових пазухах носа в ДУ «Інститут отоларингології імені професора О.С. Коломійченка НАМН України» (табл. 3). Проте рецидиви захворювання не припинялися: пацієнтку часто госпіталізовували до отоларингологічних стаціонарів для отримання місцевої терапії та виконання дренуючих інвазивних маніпуляцій.
Отже, у пацієнтки можна виділити такі особливості синуситу:
- поліетіологічність;
- схильність до мікст-інфекцій;
- знижена резистентність до умовно-патогенних мікробів;
- часті рецидиви;
- політопічність;
- пролонгованість;
- торпідність;
- інвазивність;
- резистентність до консервативного антимікробного лікування.
Також у пацієнтки переважали умовнопатогенні, опортуністичні й навіть сапрофітні мікроорганізми, що є безпечними для людини за звичайних умов. Ці ознаки красномовно свідчать про стан імуноскомпрометованості пацієнтки.
Рецидиви синуситу були не єдиною ознакою хвороби у пацієнтки.
Так, у віці 8 років з’явилися пароксизмальні неврологічні симптоми у вигляді головного болю, тимчасової втрати зору на правому оці, оніміння руки, дизартрії, затримки мислення та порушення письма. Ці розлади спочатку помилково розцінювали як прояви мігрені. Відзначали рідкі рецидиви: ≤1 разу на півроку. У віці 16 і 21 років мали місце два епізоди тяжкої цефалгії, що тривали >2 тиж, не купірувались анальгетиками і зумовлювали втрату працездатності.
За даними МРТ головного мозку, у пацієнтки відзначено розширення шлуночків та конвекситальних просторів мозку, а також поглиблення борозен і звуження звивин, що свідчить про внутрішньочерепну гіпертензію. Ацетазоламід значною мірою допомагав в усуненні неврологічних феноменів, однак не вирішував проблеми. Також має місце виражена деформація шлуночкової системи мозку та реактивний гліоз навколо неї, що, на нашу думку, свідчить про перенесений у минулому вентрикулоенцефаліт. На дифузійно-зваженому магнітно-резонансному знімку візуалізовані ознаки двобічного ураження гіпокампа, з чим можна було пов’язати розлади функції короткочасної пам’яті, які відзначали у хворої (рис. 6).


Електроенцефалограма, отримана в період чергового загострення пароксизмальних станів, дозволила локалізувати патологічну біоелектричну активність у скроневій частці (рис. 7), що узгоджується з виявленими ознаками білатерального гіпокампального склерозу. За результатами полімеразної ланцюгової реакції сироватки крові у хворої неодноразово відзначалася хронічна реактивована інфекція, викликана вірусом герпесу 7-го типу (Human herpesvirus (HHV)-7), з приводу якої вона декілька разів приймала противірусне лікування з досягненням часткового покращення щодо неврологічних симптомів. Цей вірус відомий як причина склерозу гіпокампа і пов’язаної з цим скроневої медіанної епілепсії у людей (Li J.M. et al., 2013). Рідше визначали реактивовану інфекцію, викликану вірусом герпесу 4-го типу (вірус Епштейна — Барр). Ми вважаємо, що саме герпесвірусна інфекція була причиною клініко-інструментальних ознак ураження нервової системи у пацієнтки.
У віці 19 років у пацієнтки дебютували прояви алергічного синдрому у вигляді риніту, кон’юнктивіту, до яких згодом приєднався бронхообструктивний синдром. Особливо тяжким був перебіг бронхіальної астми у 2005–2010 рр., у зв’язку з чим пацієнтка систематично приймала кромоглікат натрію інгаляційно для профілактики нападів, оскільки топічні стероїди призводили до різкого погіршення синуситу. За результатами шкірних проб встановлено, що провокаторами бронхообструкцій були гриби роду Botrytis і Cladosporium.
У хворої спостерігали прояви медикаментозної алергії при тривалому застосуванні лікарських засобів. Наприклад, непереносимість цефтріаксону, декаметоксину, фурациліну зумовлювала виникнення кропив’янки і навіть набряку Квінке. Застосування поліміксину спричиняло анафілактоїдні реакції.
Хвора тяжко переносила медикаментозну терапію загалом. Так, вітамін С зумовлював різке погіршення загального стану, флуконазол — шлуночкову екстрасистолію серця, ітраконазол — гостру ниркову недостатність із генералізованими набряками та анурією. Після застосування фторхінолонів і цефалоспоринів закономірно розвивався кандидозний вульвовагініт, ентероколіт і/або синусит, про що є відповідні записи в медичній документації.
У ранньому підлітковому віці у пацієнтки дебютували прояви псоріазу. Типові висипання з’явилися на шкірі волосяної поверхні голови, згодом — на інших ділянках тіла. Однак псоріатичні ураження не були тяжкими і рецидивували зрідка. Відзначено зв’язок між загостренням синуситу і псоріатичними ураженнями шкіри. Купірування чергових проявів інфекційного синдрому зазвичай супроводжувала ремісія з боку псоріазу.
У 1998 р. дебютував автоімунний тиреоїдит у вигляді симптомів гіпертиреозу. Відзначали різке підвищення титру аутоантитіл до тиреоглобуліну при незначній елевації рівня імуноглобулінів до тиреопероксидази. Проте пацієнтка не отримувала замісної гормональної терапії, оскільки перебувала у стані еутиреозу.
Також мали місце гемостатичні порушення, причина яких тривалий час була нез’ясована. Так, вже у віці 18 років відзначався розвиток тромбофлебіту вен нижніх кінцівок, який рецидивував у подальшому. Один із найтяжчих рецидивів пацієнтка перенесла 4 роки тому. Поряд зі схильністю до тромбозу парадоксально відзначалася підвищена кровоточивість, що давалося взнаки після хірургічних втручань. Застосування кровоспинних засобів не зумовило очікуваної відповіді на терапію щодо геморагічного синдрому, про що свідчили значні крововтрати∗ .
Крім того, у пацієнтки відзначали стійкі ознаки вираженої вегетосудинної дистонії з частими періодами різкого зниження артеріального тиску із синкопальними станами і запамороченнями, що погіршувало якість життя і працездатність.
У 2013 р. пацієнтка перенесла артрит правого кульшового суглоба неуточненого генезу, з приводу якого приймала протизапальну терапію.
При оцінці імунного статусу виявлені ознаки ДМПО фагоцитів, хоча всі інші вивчені показники імунітету були незмінені. Імунологічне дослідження включало вивчення показників загального аналізу крові, субпопуляційного складу лімфоцитів із застосуванням лазерної проточної цитофлуориметрії (цитофлуориметр «Epics Xl», США) і методу непрямої імунофлуоресценції з моноклональними антитілами до CD-маркерів з двома або трьома мітками (Т- лімфоцити: CD3+, Т- хелпери: CD3+CD4+, Т- цитотоксичні: CD3+CD8+, В-клітини: CD3–CD19+, ПК- клітини: CD3–CD16+CD56+, ПКТ- клітини: CD3+CD16+CD56+) (реактиви «Beckman Coulter», США). Фагоцитоз оцінювали за даними латекс-тесту з визначенням показника фагоцитозу, фагоцитарного індексу, кількості активних фагоцитів і фагоцитарної ємності крові. Концентрації імуноглобулінів основних класів (IgМ, IgG, IgА) у сироватці крові визначали за результатами простої радіальної імунодифузії за Манчині. Концентрацію IgE, IgD та субкласів IgG (IgG1, IgG2, IgG3, IgG4) у сироватці крові вимірювали за допомогою імуноферментного аналізу («Вектор-БЕСТ», Росія). НСТ-тест неодноразово виконували як в Інституті мікробіології і вірусології імені Д.К. Заболотного, так і в лабораторії нейроімунології Інституту нейрохірургії імені А.П. Ромоданова НАМН України. Отримували нормальні значення, що важливо для диференційної діагностики із хронічною гранулематозною хворобою.
У загальному аналізі крові хворої не відзначено особливостей, крім періодів персистуючої еозинофілії, з приводу яких пацієнтці неодноразово пропонували протиалергічну та антигельмінтну терапію. Слід враховувати, що еозинофілія може бути асоційована безпосередньо з ДМПО фагоцитів. Цей лабораторний феномен розвивається при реалізації механізму компенсації фагоцитарної недостатності за рахунок еозинофільної пероксидази, що кодується іншим геном, однак виконує деякі суміжні функції з пероксидазою мієлоцитів.
ДМПО верифікували як кількісним методом за допомогою проточної лазерної цитофлуориметрії (18,4 із 100%) (рис. 8, перша стрілка), так і якісним (біохімічне дослідження; 7,44 із 18 ум. од.) (рис. 9, перша стрілка). У подальшому пацієнтка неодноразово проходила відповідні лабораторні дослідження, які давали подібні результати. У матері хворої також виявлене зменшення кількості мієлопероксидази, однак менш виражене.


Пацієнтці запропонована терапія рекомбінантним інтерфероном гамма, який вже продемонстрував ефективність при іншому фагоцитарному імунодефіциті — хронічній гранулематозній хворобі (Fernandez-Boyanapalli R. et al., 2011). Перший курс імунотерапії в дозі 500 тис. МО 1 раз на 3 дні внутрішньом’язово протягом 4 міс (див. рис. 9, перша стрілка) привів до позитивної динаміки, але досягти повного контролю над проявами інфекційного синдрому не вдалося. Тому в подальшому курс терапії повторили (див. рис. 8, перша стрілка; рис. 9, друга стрілка). Оскільки після короткочасного підвищення активність мієлопероксидази почала знижуватися, дозу препарату підвищили вдвічі — до 1 млн МО 1 раз на 3 доби внутрішньом’язово протягом 7 міс поспіль (див. рис. 8, друга стрілка; рис. 9, третя стрілка; ), що привело до суттєвого покращення з боку кількісного і якісного показників. Кількість і активність мієлопероксидази фагоцитів поволі зростали під час імунотерапії, досягнувши рівня 84,6% (див. рис. 8) і 17,45 ум. од. відповідно (див. рис. 9), що свідчило про досягнення індукованої клініко-лабораторної ремісії хвороби. Крім того, призначили профілактичну терапію пролонгованим бензилпеніциліном у дозі 2,4 млн МО внутрішньом’язово 1 раз на 2 тиж для профілактики бактеріальних епізодів. За допомогою такої терапії вдалося встановити контроль над проявами інфекційного синдрому.
Хвора більше не потребувала виконання хірургічних втручань, дренуючих маніпуляцій на придаткових пазухах носа, госпіталізації, застосування численних антибактеріальних препаратів. Покращилася якість життя пацієнтки, вдалося уникнути тяжких ускладнень, пов’язаних із застосуванням антимікробної терапії. Також значно зменшилися прояви алергічного синдрому. Хвора наразі не потребує застосування лікарських засобів для профілактики бронхообструкцій.
Через 1 рік після першого курсу терапії хвора знову була вимушена приймати рекомбінантний інтерферон гамма у зв’язку з рецидивом інфекційного синдрому, який щоправда, виявився коротшим. Препарат застосовували протягом 2 міс поспіль у дозі 500 тис. МО внутрішньом’язово 1 раз на 3 дні, однак знову виникла потреба у підвищенні дози до 1 млн МО внутрішньом’язово 1 раз на 3 дні протягом наступних 2 міс. Результатом такого лікування стало досягнення субкомпенсації патологічного процесу, що дозволило застосовувати лише бензилпеніцилін для профілактики бактеріальних інфекцій. Кількість і активність мієлопероксидази фагоцитів під впливом імунотерапії зросли, що в цілому корелювало з позитивною клінічною динамікою.
Ще однією особливістю імунного статусу пацієнтки була низька концентрація цитокіну інтерферону гамма плазми крові, яка не перевищувала 10 пг/мл. Вміст цього цитокіну вимірювали за допомогою імуноферментного методу. Інтерферон гамма відомий як модулятор фагоцитозу, що посилює мікробіцидність фагоцитарних клітин. Ряд авторів говорять про необхідність впливу додаткових несприятливих чинників для клінічної маніфестації ДМПО. Можливо, у цієї пацієнтки саме поєднання фагоцитарного імунодефіциту з низькою продукцією інтерферону гамма визначило тяжкий клінічний перебіг хвороби, так само як і високу чутливість до дії препарату рекомбінантного інтерферону гамма людини, який ми застосували у ролі імунотерапевтичного агента. Однак в інших пацієнтів із ДМПО, про яких ми повідомляли у попередніх публікаціях, не зареєстровано стійкого зниження концентрації цього цитокіну в плазмі крові. Проте у них також розвивалися тяжкі прояви хвороби і відзначалася висока чутливість до препарату інтерферону гамма.
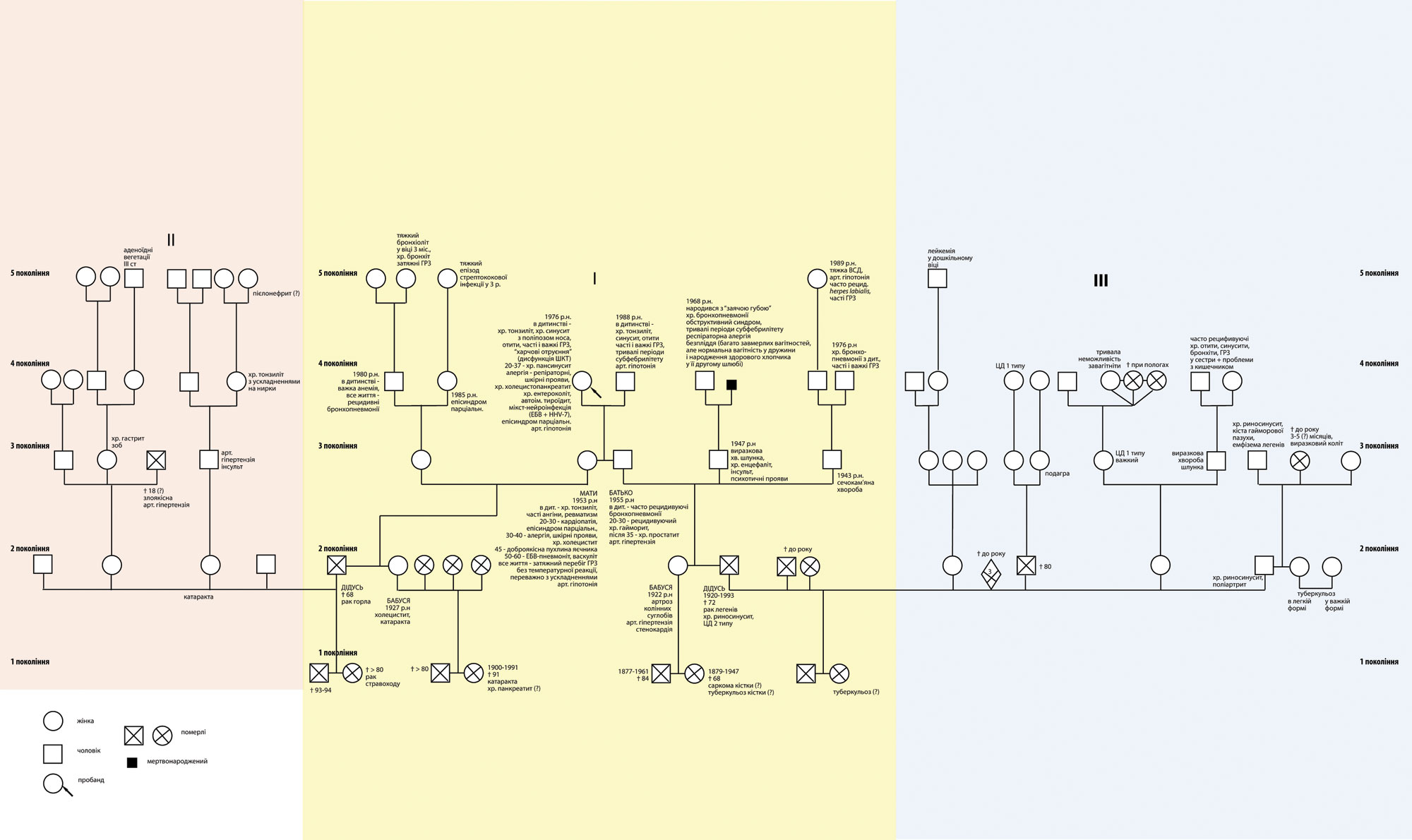
Проведений нами генеалогічний аналіз доступних клінічних даних щодо стану здоров’я родичів пацієнтки Н. різного ступеня спорідненості у п’яти суміжних поколіннях дозволив розподілити їх на такі групи (рис. 10):
І. Найближчі родичі хворої, у яких реєструють подібні симптоми, що можуть бути проявом імунної дисфункції.
ІІ. Практично здорові особи, за винятком окремих випадків.
ІІІ. Представники гілки родоводу, які мають м’який фенотип імунозалежної патології.
_______________________________________________________________________________
∗Зв’язок між гемостатичними порушеннями та імунодефіцитом описаний у нашій попередній публікації: Мальцев Д.В. (2014) Дефіцит мієлопероксидази фагоцитів. Укр. мед. часопис, 4(102): 94–105 (http://www.umj.com.ua/article/78340).
Обговорення
У публікації наведено опис розгорнутої клінічної картини ДМПО фагоцитів пацієнтки молодого віку. Відзначалися рецидиви бактеріальної та кандидозної інфекції з переважним ураженням верхніх дихальних шляхів і придаткових пазух носа, про що також зазначали інші дослідники ДМПО.
Загалом можна виділити три стадії розвитку хвороби:
Стадія рецидивів піогенних бактеріальних інфекцій, які усували за допомогою антибактеріальної терапії (від народження до 20 років).
Розвиток мікст-інфекцій — бактеріально-грибкових асоціацій. Для цієї стадії характерний хронічний синусит та погана чутливість до антимікробних хіміопрепаратів. З’явилися прояви додаткових синдромів, у тому числі алергічного й автоімунного.
Стадія імунотерапії. За рахунок неї вдалося купірувати бактеріальні, грибкові інфекції та прояви алергічного синдрому. У цей час на перший план у клінічній картині вийшли герпесвірусні інфекції.
Виявлено такі особливості перебігу інфекційного синдрому у хворої:
1. Розвиток рецидивних інфекцій, спричинених пліснявими грибами. Раніше таку асоціацію зазначали переважно в контексті хронічної гранулематозної хвороби. Хоча подібна картина і описувалася нами в попередній публікації, присвяченій випадку тяжкого інвазивного аспергільозного етмоїдиту в пацієнтки із ДМПО.
2. Рецидивні реактивовані інфекції, зумовлені вірусами герпесу 4-го і 7-го типу, верифіковані за результатами полімеразної ланцюгової реакції плазми крові хворої.
За даними МРТ головного мозку, у пацієнтки виявлені ознаки перенесеного вентрикулоенцефаліту неуточненої етіології поряд із симптомами хронічної HHV7-нейроінфекції. Раніше ми повідомляли про розвиток лейкоенцефалітів, викликаних вірусом герпесу 6-го типу (Мальцев Д.В., 2012), та лімбічного енцефаліту HHV7- етіології (Мальцев Д.В., Климчук В.В., 2011) при ДМПО фагоцитів. Експериментальні дослідження продемонстрували віруцидні властивості мієлопероксидази щодо вірусу імунодефіциту людини 1-го типу (Chochola J. et al., 1994) та цитомегаловірусу (El Messaoudi K. et al., 2002). Найбільш імовірно, віруцидна активність цього ферменту поширюється й на інші вірусні агенти, зокрема — віруси герпесу 4-, 6- і 7-го типу. Мікроглія мозку — це похідна моноцитів крові, що містить мієлопероксидазу. Вважаємо, що дефіцит цього мікробіцидного ферменту зумовлює послаблення противірусної активності мікроглії головного мозку, знижуючи резистентність до герпесвірусів.
Серед типових неінфекційних проявів імунодефіциту, які мали місце у пацієнтки, слід відзначити алергічні ускладнення, автоімунний тиреоїдит, псоріаз, тяжку вегетосудинну дистонію, гемостатичні порушення. Алергічні ускладнення здебільшого є проявом псевдоалергії, що розвивається за гістамінопектичним механізмом, оскільки мієлопероксидаза виконує функції гістамінази (Fabian I., Aronson M., 1975). Також цей фермент задіяний у механізмах детоксикації та біотрансформації ліків, з чим можна пов’язати несприятливий профіль переносимості антимікробних препаратів, що відзначали у пацієнтки. Як показали A.J. Kettle, C.C. Winterbourn (1994), нейтрофіли з ДМПО гідроксилюють саліцилати лише на рівні 13% порівняно зі здоровими клітинами.
Серед автоімунних ускладнень імунодефіциту відомі ревматизм (Patıroğlu Т. et al., 2013), ревматоїдний артрит (Bell A.L. et al., 1993) і розсіяний склероз (Ramsaransing G. et al., 2003). Наразі повідомляють про розвиток іншої автоімунної хвороби — тиреоїдиту Хашимото, причому це ускладнення ми виявляли і в деяких інших пацієнтів із цією імунодефіцитною хворобою. Загалом, розвиток аутоімунних уражень є характерною ознакою багатьох імунодефіцитів людини.
Як встановлено нещодавно, вазомоторні порушення при ДМПО зумовлені участю цього ензиму в обміні оксиду азоту, що є потужним дилататором судин (Rudolph T.K. et al., 2012), з чим можна пов’язати прояви вегетосудинної дистонії у пацієнтки.
Таким чином, у пацієнтки відзначалася розгорнута клінічна картина імунодефіциту з вираженим інфекційним синдромом, на тлі якого розвинулися алергічні, автоімунні, вегетативні й гемостатичні ускладнення. Поєднання інфекційних, алергічних і автоімунних уражень є характерною ознакою імунодефіцитів в цілому. У пацієнтки не було певних унікальних симптомів хвороби, оскільки синусит, герпесвірусна нейроінфекція, псоріаз, алергічні й автоімунні ускладнення трапляються порівняно часто у клінічній практиці. Специфічним для імуноскомпрометованого стану було саме поєднання цих проявів у одного пацієнта, а також тяжкий, невпинно рецидивний, прогностично несприятливий перебіг інфекцій, викликаних умовно-патогенною мікрофлорою.
Цей клінічний випадок переконливо демонструє необхідність ранньої діагностики імунних дисфункцій у пацієнтів із частими рецидивами інфекцій, викликаними слабовірулентними умовно-патогенними мікроорганізмами, і очевидну користь від застосування обґрунтованих імунотерапевтичних втручань. У разі своєчасного виявлення ДМПО і застосування адекватної терапії хвора могла уникнути проведення численних травматичних хірургічних операцій, діагностичних і дренувальних інвазивних маніпуляцій, тривалих госпіталізацій, недостатньо ефективних курсів антимікробних препаратів. На момент звернення у пацієнтки відзначали ознаки інвалідності, які вдалося усунути завдяки раціональній імунотерапії. Ми і раніше інформували про користь від застосування препаратів інтерферону гамма при ДМПО. Ця стаття є ще одним підтвердженням доцільності такої стратегії. Раніше рекомбінантний інтерферон гамма пройшов успішні випробування при інших фагоцитарних порушеннях — хронічній гранулематозній хворобі, природженому остеопетрозі, дефектах шляху інтерлейкіну-12/інтерлейкіну-23 (Fernandez-Boyanapalli R. et al., 2010). Наразі в Інституті імунології та алергології Національного медичного університету імені О.О. Богомольця триває дослідження ефективності препарату цього цитокіну при ДМПО фагоцитів, попередні результати обнадіюють. Нещодавно в кількох контрольованих випробуваннях продемонстрували очевидну користь від застосування інтерферону гамма при тяжкому мікозі в імуноскомпрометованих пацієнтів (Armstrong-James D. et al., 2010; Jarvis J.N. et al., 2012).
Монотерапія антимікробними лікарськими засобами виявилася не лише недостатньо ефективною, а часом і шкідливою у пацієнтки Н. Нагадаємо, що саме із протимікробними препаратами були пов’язані загрозливі для життя симптоми, такі як набряк Квінке при застосуванні цефалоспоринів та гостра ниркова недостатність після прийому антимікотиків.
Не слід недооцінювати цю імунну дисфункцію, оскільки вже неодноразово повідомляли про її катастрофічні наслідки. Так, T. Kalinski та співавтори (2007) засвідчили летальний кандидозний сепсис у вагітної з ДМПО. В.Є. Казмірчук (2005) повідомила про розвиток тяжкого сепсису, викликаного S. epіdermіdis, у пацієнтки з такою імунною дисфункцією, що також страждала від кандидозного артриту та пневмококової пневмонії. Застосування у неї 13 сучасних антимікробних лікарських засобів різних фармакологічних груп не привело до позитивної динаміки з боку патологічного процесу. М. Domingues-Ferreira та співавтори (2009) також повідомляли про розвиток дисемінованого паракокцидіоїдомікозу і туберкульозу при ДМПО фагоцитів.
Враховуючи високу поширеність хвороби, ДМПО — не рідкість у клінічній практиці. Тому лікарі різних спеціальностей мають бути добре поінформовані щодо цієї імунної дисфункції, а імунологічні лабораторії повинні включити вивчення кількості й активності цього ферменту в перелік показників рутинної імунограми. Генетичні тести для диференціації первинних і вторинних форм ДМПО мають стати доступними. Не слід забувати і про інші «малі» імунодефіцитні хвороби людини, що трапляються часто і чинять сукупний виражений негативний вплив на стан здоров’я популяції, включаючи:
- сімейну доброякісну нейтропенію;
- дефіцити:
- IgE;
- субкласів IgG;
- деяких компонентів системи комплементу;
- манозозв’язуючого протеїну;
- природних кілерів;
- природних кілерних Т-клітин;
- молекул CD8 та CD19.
Наразі ситуація з виявленням ДМПО фагоцитів та інших «малих» імунних дисфункцій в Україні залишається незадовільною. Тільки завдяки розумному поєднанню зусиль різних медичних спеціалістів можна досягти істотного прогресу у діагностиці й лікуванні цієї поширеної хвороби імунної системи, яка чинить виражений негативний вплив на стан здоров’я людини, незважаючи на велику кількість асимптомних форм.
Список використаної літератури
- Казмирчук В.Е., Мальцев Д.В., Слободин Т.Н., Головченко Ю.И. (2011) Синдром паркинсонизма у молодых женщин, страдающих дефицитом миелопероксидазы фагоцитов. Междунар. невр. журн., 1(39): 15–24.
- Казмірчук В.Є. (2005) Імунологія в клінічних випадках. ПоліграфПлюс, Київ 147 с.
- Мальцев Д.В. (2012) Прогресуюча мультифокальна лейкоенцефалопатія, асоційована з вірусом герпесу людини 6-го типу. Укр. мед. часопис, 1(87): 136–142 (http://www.umj.com.ua/article/20513).
- Мальцев Д.В., Климчук В.В. (2011) Випадок ятрогенного аспергільозу ретробульбарної клітковини і лімбічного герпесвірусного енцефаліту у пацієнтки з дефіцитом мієлопероксидази фагоцитів. Укр. мед. часопис, 1(81): 118–120 (http://www.umj.com.ua/article/9136).
- Armstrong-James D., Teo I.A., Shrivastava S. et al. (2010) Exogenous interferon-gamma immunotherapy for invasive fungal infections in kidney transplant patients. Am. J. Transplant., 10(8): 1796–803.
- Arumugan G., Rajagopal R. (2004) Evaluation of neutrophil functions in obstructive jaundice patients. Turk. J. Hematol., 21: 189–196.
- Bell A.L., Markey G.M., Alexander H.D. et al. (1993) Myeloperoxidase deficiency in a patient with rheumatoid arthritis: oxygenation and radical activity by phagocytic cells. Br. J. Rheumatol., 32(2): 162–165.
- Bizzaro N., Briani G., Boccato P. (1988) Acquired myeloperoxidase deficiency of neutrophils in a patient with aplastic anemia (idiopathic marrow aplasia). Acta Haematol., 80(2): 71–73.
- Caenazzo A., Piva E., Sartori D., Stefani P.M. (1997) Idiopathic myelofibrosis with neutrophil myeloperoxidase deficiency: a case report. Haematologica, 82(4): 465–467.
- Cech P., Markert M., Perrin L.H. (1983) Partial myeloperoxidase deficiency in preleukemia. Blut., 47(1): 21–30.
- Cech P., Schneider P., Bachmann F. (1982) Partial myeloperoxidase deficiency. Acta Haematol., 67(3): 180–184.
- Chochola J., Yamaguchi Y., Moguilevsky N. et al. (1994) Virucidal effect of myeloperoxidase on human immunodeficiency virus type 1-infected T-cells. Antimicrob. Agents Chemother., 38(5): 969–972.
- Dinauer M.C. (2014) Disorders of neutrophil function: an overview. Methods Mol. Biol., 1124: 501–515.
- Domingues-Ferreira M., Pereira A., Duarte A.J., Moraes-Vasconcelos D. (2009) Disseminated paracoccidiodomycosis and tuberculosis in myeloperoxidase deficiency. Clin. Immun., 131: S149–S150.
- d’Onofrio G., Mancini R., Vallone R. et al. (1983) Acquired neutrophil myeloperoxidase deficiency: an indicator of subclinical activation of blood coagulation? Blood Cells, 9(3): 455–466.
- El Messaoudi K., Verheyden A.M., Thiry L. et al. (2002) Human recombinant myeloperoxidase antiviral activity on cytomegalovirus. J. Med. Virol., 66(2): 218–223.
- Fabian I., Aronson M. (1975) Deamination of histamine by peroxidase of neutrophils and eosinophils. J. Reticuloendothel. Soc., 17(3): 141–145.
- Fernandez-Boyanapalli R., McPhillips K.A., Frasch S.C. et al. (2010) Impaired phagocytosis of apoptotic cells by macrophages in chronic granulomatous disease is reversed by IFN-γ in a nitric oxide-dependent manner. J. Immunol., 185(7): 4030–4041.
- Granel B., Serratrice J., Fossat C. et al. (2000) Psoriasis and myeloperoxidase deficiency. Dermatology, 201(1): 74.
- Jarvis J.N., Meintjes G., Rebe K. et al. (2012) Adjunctive interferon-γ immunotherapy for the treatment of HIV-associated cryptococcal meningitis: a randomized controlled trial. AIDS, 26(9): 1105–1113.
- Kalinski T., Jentsch-Ullrich K., Fill S. et al. (2007) Lethal candida sepsis associated with myeloperoxidase deficiency and pre-eclampsia. APMIS, 115(7): 875–880.
- Kettle A.J., Winterbourn C.C. (1994) Superoxide-dependent hydroxylation by myeloperoxidase. J. Biol. Chem., 269(25): 17146–17151.
- Lanza F., Giuliani A.L., Amelotti F. et al. (1988) Depressed neutrophil-mediated tumor cell cytotoxicity in subjects affected by hereditary myeloperoxidase deficiency and secondary neoplasia. Haematologica, 73(5): 355–358.
- Li J.M., Huang C., Wang W. et al. (2013) Human Herpesvirus-7 (HHV-7) in brain tissue from adults with intractable epilepsy: a pathological role in some cases of hippocampal sclerosis? 10th Asian & Oceanian epilepsy congress, 7–10 August 2014, Singapore, 94 p.
- Lin C.K., Liang R., Ma L. et al. (1990) Myelodysplastic syndrome presenting with generalized cutaneous granulocytic sarcomas. Acta Haematol., 83(2): 89–93.
- Nauseef W.M. (2014) Diagnostic assays for myeloperoxidase and myeloperoxidase deficiency. Methods Mol. Biol., 1124: 537–546.
- Nauseef W.M., Cogley M., Bock S., Petrides P.E. (1998) Pattern of inheritance in hereditary myeloperoxidase deficiency associated with the R569W missense mutation. J. Leukoc. Biol., 63(2): 264–269.
- Ohno H. (2010) Association of primary myeloperoxidase deficiency and myeloproliferative neoplasm. Intern. Med., 49(22): 2527–2528.
- Patıroğlu T., Güngör H.E., Belohradsky J.S. et al. (2013) Myeloperoxidase deficiency: the secret under the flag of unstained cell. Turk. J. Haematol., 30(2): 232–233.
- Queiroz M.L., Costa F.F., Bincoletto C. et al. (1994) Engulfment and killing capabilities of neutrophils and phagocytic splenic function in persons occupationally exposed to lead. Int. J. Immunopharmacol., 16(3): 239–244.
- Ramsaransing G., Teelken A., Prokopenko V.M. et al. (2003) Low leucocyte myeloperoxidase activity in patients with multiple sclerosis. J. Neurol. Neurosurg. Psychiatry, 74(7): 953–955.
- Rudolph T.K., Wipper S., Reiter B. et al. (2012) Myeloperoxidase deficiency preserves vasomotor function in humans. Eur. Heart. J., 33(13): 1625–1634.
- Russo A.J., Krigsman A., Jepson B., Wakefield A. (2009) Low serum myeloperoxidase in autistic children with gastrointestinal disease. Clin. Exp. Gastroenterol., 2: 85–94.
- Wang K., Lin B., Lin J., Lan X. (2013) A novel mutation in the myeloperoxidase gene in a Chinese female with complete myeloperoxidase deficiency: the role of nonsense-mediated mRNA decay. Gene, 515(1): 205–207.
Резюме. В статье приведено описание истории болезни пациентки с дефицитом миелопероксидазы фагоцитов. Основой клинической картины болезни стал рецидивирующий синусит, вызванный условно-патогенными микроорганизмами, в том числе пиогенными бактериями, грибами рода Сandida и плесневыми грибами, по поводу которых она получила многочисленные курсы антимикробной терапии, более 100 диагностических и лечебных инвазивных манипуляций и 10 сложных хирургических вмешательств. Кроме того, имели место рецидивирующая HHV7-инфекция, аллергические проявления, аутоиммунный тиреоидит, псориаз, гемостатические нарушения и неудовлетворительный профиль переносимости лекарственных средств — что можно расценивать как дополнительные симптомы болезни. Показана польза от применения рекомбинантного интерферона гамма в качестве базисной иммунотерапии для профилактики инфекционных эпизодов.
Ключевые слова: дефицит миелопероксидазы, интерферон гамма.
Summary. This article provides a description of the patient’s medical history with myeloperoxidase deficiency of phagocytes. The basis of clinical picture of the disease has become constantly relapsing sinusitis caused by conditionally pathogenic microorganisms, including pyogenic bacteria, candida and molds about she has received numerous antimicrobial drugs courses, more than 100 invasive diagnostic procedure and therapeutic manipulations and 10 surgical operations. In addition, there have been recurrent HHV7-infection, allergic reactions, autoimmune thyroiditis, psoriasis, hemostatic disturbances and poor tolerability profile of medications that can be regarded as additional symptoms. Shown benefit from the use of recombinant interferon-gamma as a baseline for immunotherapy of infectious episodes.
Key words: myeloperoxidase deficiency, interferon gamma.
Адреса для листування:
Мальцев Дмитро Валерійович 04080,
Київ, вул. Туровська, 26 Інститут
імунології та алергології Національного
медичного університету імені О.О. Богомольця
Е-mail: [email protected]