ВВЕДЕНИЕ
Содержание гомоцистеина (ГЦ) — один из важных и независимых факторов риска развития ишемической болезни сердца (ИБС). По данным Фремингемского исследования повышение уровня ГЦ в плазме крови свыше 12 мкмоль/л приводит к развитию заболеваний сердечно-сосудистой системы (Homocysteine Lowering Trialist’s Collaboration, 1998).
ГЦ представляет собой продукт деметилирования метионина. В плазме крови ГЦ содержится в нескольких формах, комбинацию всех возможных форм принято обозначать термином «плазменный гомоцистеин» (Kluijtmans L.A. et al., 1996; Nygard O. et al., 1997).
Метаболизм ГЦ осуществляется под влиянием цистатионин-β-синтетазы, коферментом которой является пиридоксин (витамин B6), и метионинсинтетазы, кофермент которого — цианокобаламин (витамин B12) (Rozen R., 1997; Brattstrom L. et al., 1998; D’Angelo A. et al., 2000).
Выделяют наследственные и приобретенные нарушения метаболизма ГЦ (Gudnanson V. et al., 1998). Причиной наследственной гипергомоцистеинемии (ГГЦ) является мутация гена метилентетрагидрофолатредуктазы. Вследствие этого образуется термолабильный вариант фермента, активность которого в 2 раза ниже по сравнению с нормальным типом (Kluijtmans L.A. et al., 1996; Gudnanson V. et. al., 1998; D’Angelo A. et al., 2000). Гомозиготный вариант (ТТ-генотип), который выявляют у 10–13% представителей белой расы, обусловливает повышение уровня ГЦ на 50%, особенно при недостаточном содержании фолата в пище (Boushey C.J. et. al., 1995; Robinson K. et al., 1998).
Среди причин приобретенной ГГЦ выделяют недостаточное потребление продуктов, богатых тиамином, пиридоксином, цианокобаламином и фолиевой кислотой (Андрушко І.І., Сєркова В.К., 2003). Около 70% случаев ГГЦ связаны с дефицитом одного или нескольких названных витаминов, так как концентрация ГЦ в плазме крови обратно пропорциональна концентрации кофакторов реакций, в которых участвует ГЦ (Boushey C.J. et. al., 1995; Folsom A.R. et al., 1998).
По данным мультицентровых исследований, проведенных в Европе, у больных с ГГЦ риск развития сердечно-сосудистых заболеваний повышается на 50% из-за дефицита фолиевой кислоты и в 2 раза — вследствие недостаточности пиридоксина (Nygard O. et al., 1997; Folsom A.R. et al., 1998; Robinson K. et al., 1998).
Цель нашей работы — оптимизация лечения пациентов с ИБС путем контроля гомоцистеинемии в ходе комплексной терапии с использованием комбинированного препарата Кардонат производства «Сперко Украина», который содержит коэнзимы витаминов В1 (кокарбоксилазу), В6 (пиридоксаль-5-фосфат), В12 (кобамамид), а также карнитин и лизин.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
В исследование были включены 49 пациентов в возрасте от 40 до 65 лет (в среднем — 51±3,7 года) с ИБС I–IV функционального класса (ФК) стенокардии напряжения. Мужчин — 28 (57,1%), женщин — 21(42,9%). Диагноз ИБС был верифицирован по данным клинического обследования, электрокардиографии (ЭКГ) и эхокардиографии (эхоКГ). У всех больных также были проведены пробы с физическими нагрузками (велоэргометрия, ЭКГ с дозированной физической нагрузкой).
С целью изучения влияния витаминов группы В на уровень гомоцистеинемии пациенты с ИБС были распределены на 2 группы — основную (25 пациентов) и контрольную (24 пациента). Пациенты обеих групп получали стандартное лечение ИБС в зависимости от клинической ситуации (блокаторы β-адренорецепторов, нитраты, ингибиторы ангиотензинпревращающего фермента, статины, диуретики). Пациентам основной группы в дополнение к стандартной терапии назначали препарат Кардонат в дозе 1 капсула 3 раза в сутки в течение 14 дней. Таким образом, пациенты основной группы принимали кобамамид в дозе 3 мг/сут, кокарбоксилазу — 150 мг/сут и пиридоксаль-5-фосфат — 150 мг/сут.
У всех больных определяли уровень общего ГЦ до начала и на 14-й день лечения. Уровень общего ГЦ в плазме крови определяли после 12-часового голодания методом иммуноферментного анализа (ИФА). Для ИФА использовали тест-системы фирмы Axis Biochemicals ASA (Осло, Норвегия). Концентрацию ГЦ определяли в иммуноферментном анализаторе STAT-Fax 2100 после того, как связанный с белком ГЦ был восстановлен до свободного ГЦ и превращен S-аденозил-L-гомоцистеин ферментативным путем по специальной процедуре, предшествующей ИФА (Frantzen F. et al., 1998).
Обработку полученного материала проводили с помощью Excel 5.0. Для оценки межгрупповых различий использовали параметрический t-критерий Стьюдента. Достоверным считали различие при р<0,05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
У 15 (30,6%) пациентов ИБС сочеталась с артериальной гипертензией (АГ); у 12 (24,5%) пациентов с ИБС в анамнезе по данным ЭКГ и эхоКГ был подтвержден постинфарктный кардиосклероз (ПИКС). ИБС с ПИКС в сочетании с АГ обнаружена у 12 (24,5%) больных, у 10 (20,4%) пациентов ИБС со стенокардией напряжения АГ и ПИКС не установлены (рис. 1).
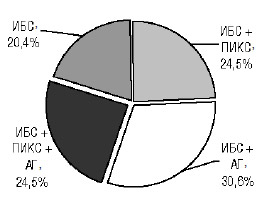
Рис. 1. Распределение пациентов с ИБС по наличию осложнений и сопутствующей патологии
При обследовании больных этих подгрупп выявлено, что у пациентов с ПИКС концентрация ГЦ в плазме крови самая высокая и составляет 15,6± 2,6 мкмоль/л, а самая низкая у пациентов с ИБС со стенокардией напряжения без АГ и ПИКС — 11,9± 0,8 мкмоль/л. У пациентов с ИБС в сочетании с АГ уровень ГЦ составил 12,8±0,8 мкмоль/л, с ПИКС в сочетании с АГ — 12,9±0,8 мкмоль/л (рис. 2).
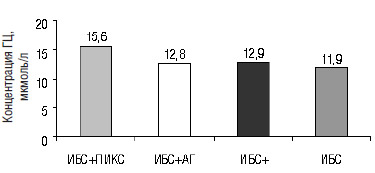
Рис. 2. Уровень общего ГЦ в плазме крови у пациентов с ИБС в зависимости от наличия осложнений и сопутствующей патологии
Начальная концентрация ГЦ у пациентов основной группы составила 15,4±1,3 мкмоль/л, контрольной — 12,4±0,6 мкмоль/л. После 14-дневнего лечения уровень ГЦ в плазме крови у этих больных составил: в основной группе — 12,2±0,9 мкмоль/л, в контрольной группе — 14,7±0,9 мкмоль/л. Достоверность различий составила р<0,05 (рис. 3).
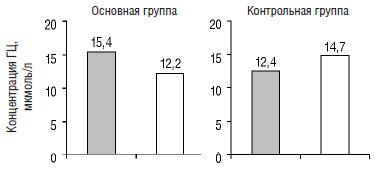
Рис. 3. Изменение концентрации общего ГЦ в плазме крови у пациентов с ИБС основной и контрольной группы (р<0,05)
Анализ этих данных свидетельствует, что у больных контрольной группы, которым проводили только стандартное лечение ИБС, уровень общего ГЦ повысился в 1,2 раза по сравнению с исходным, тогда как у больных основной группы, получавших Кардонат, концентрация ГЦ снизилась в 1,3 раза. Полученные нами результаты свидетельствуют о благоприятном влиянии витаминов В1, В6, В12 на уровень ГЦ в плазме крови, что согласуется с данными литературы (Boushey C.J. et al., 1995; Kluijtmans L.A. et al., 1996; Folsom A.R. et al., 1998). Для более детального анализа больных распределили на подгруппы в зависимости от ФК стенокардии напряжения (см. таблицу).
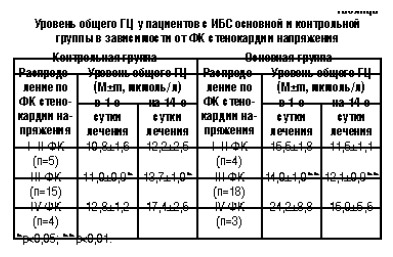
Полученные данные свидетельствуют о том, что уровень ГЦ зависит от ФК стенокардии напряжения. Дополнительный прием витаминов группы В способствует существенному снижению уровня ГЦ в плазме крови у пациентов с ИБС.
Таким образом, гомоцистеинемия достаточно выражена у пациентов с ИБС, особенно у больных, перенесших инфаркт миокарда. Поскольку ГЦ приводит к повреждению эндотелия сосудов, усилению тромбогенеза, прогрессированию атеросклероза, дестабилизации атеросклеротических образований, пациентов с ИБС и повышенным уровнем ГЦ следует относить к группе высокого риска. Дополнительный прием коэнзимов витаминов группы В в составе комбинированного препарата Кардонат позволяет значительно снизить концентрацию ГЦ в плазме крови и улучшить течение ИБС.
ВЫВОДЫ
1. Выраженность нарушения обмена ГЦ закономерно увеличивается с прогрессированием ИБС и повышением ФК стенокардии напряжения, а также у больных с ПИКС.
2. Дополнительный прием комбинированного препарата Кардонат, содержащего коэнзимы витаминов В1, В6 и В12, статистически достоверно снижает уровень общего ГЦ в 1,3 раза по сравнению с исходной концентрацией.
ЛИТЕРАТУРА
- Андрушко І.І., Сєркова В.К. (2003) Зв’язок рівня гомоцистеїну та ліпідів із забезпеченістю організму вітамінами В2, В6, В12 у пацієнтів з гіпертонічною хворобою. Укр. кардіол. журн., 4: 51–55.
- Boushey C.J., Beresford S.A., Omenn G.S., Motulsky A.G. (1995) A quantitative assessment of plasma homocysteine as a risk factor for vascular disease. Probable benefits of increasing folic acid intakes. JAMA, 274(13): 1049–1057.
- Brattstrom L., Wilcken D.E., Ohrvik J., Brudin L. (1998) Common methylenetetrahydrofolate reductase. Circulation, 98(23): 2520–2526.
- D’Angelo A., Coppola A., Madonna P., Fermo I., Pagano A., Mazzola G., Galli L., Cerbone A.M. (2000) The role of vitamin B12 in fasting hyperhomocysteinemia and its interaction with the homozygous C677T mutation of the methylenetetrahydrofolate reductase (MTHFR) gene. A case-control study of patients with early-onset thrombotic events. Thromb. Haemost., 83(4): 563–570.
- Folsom A.R., Nieto F.J., McGovern P.G., Tsai M.Y., Malinow M.R., Eckfeldt J.H., Hess D.L., Davis C.E. (1998) Prospective study of coronary heart disease incidence in relation to fasting total homocysteine, related genetic polymorphisms, and B vitamins: the Atherosclerosis Risk in Communities (ARIC) study. Circulation, 98(3): 204–210.
- Frantzen F., Faaren A.L., Alfheim I., Nordhei A.K. (1998) Enzyme conversion immunoassay for determining total homocysteine in plasma or serum. Clin. Chem., 44(2): 311–316.
- Gudnason V., Stansbie D., Scott J., Bowron A., Nicaud V., Humphries S. (1998) C677T (thermolabile alanine/valine) polymorphism in methylenetetrahydrofolate reductase (MTHFR): its frequency and impact on plasma homocysteine concentration in different European populations. EARS group. Atherosclerosis, 136(2): 347–354.
- Homocysteine Lowering Trialist’s Collaboration (1998) Lowering blood homocysteine with folic acid based supplements: meta-analysis of randomised trials. BMJ, 316(7135): 894–898.
- Kluijtmans L.A., van den Heuvel L.P., Boers G.H., Frosst P., Stevens E.M., van Oost B.A., den Heijer M., Trijbels F.J., Rozen R., Blom H.J. (1996) Molecular genetic analysis in mild hyperhomocysteinemia: a common mutation in the methylenetetrahydrofolate reductase gene is a genetic risk factor for cardiovascular disease. Am. J. Hum. Genet., 58(1): 35–41.
- Nygard O., Nordrehaug J.E., Refsum H., Ueland P.M., Farstad M., Vollset S.E. (1997) Plasma homocysteine levels and mortality in patients with coronary artery disease. N. Engl. J. Med., 337(4): 230–236.
- Robinson K., Arheart K., Refsum H., Brattstrom L., Boers G., Ueland P., Rubba P., Palma-Reis R., Meleady R., Daly L., Witteman J., Graham I. (1998) Low circulating folate and vitamin B6 concentrations: risk factors for stroke, peripheral vascular disease, and coronary artery disease. European COMAC Group. Circulation, 97(5): 437–443.
- Rozen R. (1997) Genetic predisposition to hyperhomocysteinemia: deficiency of methylenetetrahydrofolate reductase (MTHFR). Thromb. Haemost., 78(1): 523–526.
Резюме. Мета дослідження — оптимізація лікування пацієнтів з ішемічною хворобою серця (ІХС) з допомогою контролю гомоцистеїнемії в комплексній терапії з використанням комбінованого препарату Кардонат. У 25 пацієнтів з ІХС, крім стандартної терапії, додатково застосовували Кардонат, що містить коензими вітамінів B1, B6, B12, а також карнітин та лізин (основна група). Контрольну групу становили 24 пацієнти з ІСХ, які не одержували Кардонат. Тривалість прийому препарату Кардонат становила 14 днів. У всіх хворих методом імуноферментного аналізу рівень гомоцистеїну визначали до і на 14-й день лікування. Застосування препарату Кардонат сприяло зниженню концентрації гомоцистеїну в 1,3 разу, в той час як у контрольній групі рівень гомоцистеїну підвищився в 1,2 разу порівняно з початковим. Отримані результати дозволяють рекомендувати додатковий прийом комбінованого препарату Кардонат при лікуванні ІХС з метою зменшення вмісту гомоцистеїну в плазмі крові.
Ключові слова:ішемічна хвороба серця, гомоцистеїн, Кардонат, вітаміни групи В, тіамін, піридоксин, ціанокобаламін
Summary. The aim of the study was to optimize the management of patients with coronary artery disease (CAD) on the basis of homocysteinemia control during complex treatment with application of the composite preparation Cardonat. Besides standard therapy, 25 patients with CAD additionally received Cardonat, which contains coenzymes of B1, B6 and B12 vitamins as well as carnitine and lysine (main group). Control group was formed from 24 patients with CAD whom Cardonat was not administered. The duration of the treatment with Cardonat was 14 days. In all the patients, plasma homocysteine level was determined by immune-enzyme assay before treatment and 14 days after. Application of Cardonat was favorable towards the decrease of homocysteine concentration in 1,3 times; at the same time in control group the homocysteine level had increased in 1,2 times in comparison with baseline data. Obtained results allow to recommend the additional application of Cardonat during the treatment of patients with CAD purposely to decrease plasma homocysteine level.
Key words: coronary artery disease, homocysteine, Cardonat, B-group vitamins, thiamine, pyridoxine, cyanocobalamin





