ВВЕДЕНИЕ
Хронический лимфолейкоз (ХЛЛ) — наиболее распространенный вид лейкоза у лиц старше 50 лет (составляет около 30% в структуре гемобластозов). Хотя у части больных течение заболевания доброкачественное и общая выживаемость не отличается от таковой в популяции, при проявлениях прогрессирования заболевания длительность жизни больных сокращается до 1,5–4 лет (Binet J.L. et al., 1981; Baccarani M. et al., 1982; Rozman C. et al., 1982).
Результаты терапии пациентов с ХЛЛ в настоящее время неудовлетворительные. Традиционная терапия такими алкилирующими агентами, как хлорамбуцил, циклофосфамид, является паллиативной и не приводит к достижению достаточной частоты полной ремиссии (ПР) у значительного числа больных и улучшению выживаемости. Комбинированная химиотерапия дает возможность достичь клинического эффекта приблизительно у 50% больных, при этом ПР можно достигнуть лишь у незначительной части пациентов.
Появление пуриновых аналогов открыло новые возможности в терапии пациентов с ХЛЛ. В настоящее время среди препаратов данной группы наиболее широко известными являются флударабин (применяют при ХЛЛ) и кладрибин (при волосатоклеточной лейкемии). С внедрением в лечебную практику флударабина впервые стало возможным у значительной части больных с ХЛЛ достигнуть ПР, при этом ее длительность также существенно выше, чем при традиционной терапии. Данный препарат наиболее эффективен у больных, которые ранее не получали лечение. При использовании флударабина в качестве терапии первой линии возможно достижение ремиссии у 65–100% больных, в том числе у 20–47% пациентов — ПР (Keating M.J., 1996; Clavio M. et al., 1998; Keating M.J. et al., 1998; Spriano M. et al., 1998; Rai K.R. et al., 2000).
Эффективность терапии несколько ниже у больных, у которых отмечена рефрактерность к проводимому ранее лечению или при рецидиве заболевания (Keating M. et al., 2002).
Комбинация флударабина с другими цитостатиками способствует повышению эффективности терапии как у первичных больных, так у больных, которые ранее получали терапию.
Цель настоящего исследования — оценка эффективности и токсичности флударабина (препарат Флудара производства компании «Schering», Германия), а также комбинированного применения Флудары и циклофосфамида у больных с ХЛЛ.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
В данной работе представлены результаты многоцентрового нерандомизированного исследования, проведенного на базе 28 гематологических отделений научно-исследовательских институтов, городских, областных больниц и онкологических диспансеров Украины.
В исследование включали больных с диагнозом В-клеточный ХЛЛ (В-ХЛЛ), который устанавливали согласно стандартным критериям (Cheson B.D. et al., 1996) в С(III) и С(IV) стадии заболевания или А(I), А(II), В(I), В(II) стадии заболевания при наличии признаков активности процесса, а именно: уменьшение массы тела более чем на 10% за последние 6 мес; период удвоения количества лейкоцитов (ПУЛ) менее 6 мес; выраженная слабость; массивная или прогрессирующая лимфаденопатия; массивная или прогрессирующая гепатоспленомегалия; повышение температуры тела выше 38 °С без признаков наличия очагов инфекции; частые эпизоды инфекционных осложнений; аутоиммунная анемия и/или тромбоцитопения. Стадии ХЛЛ определялись согласно критериям международной рабочей группы по ХЛЛ (International Workshop on Chronic Lymphocytic Leukemia, 1989).
В исследование включали первичных больных, пациентов с рефрактерностью к проводимому лечению. Критериями включения были также возраст до 80 лет, количество лейкоцитов более 2·109/л, тромбоцитов более 50·109/л, отсутствие у больных сопутствующей тяжелой терапевтической патологии, а именно: серьезных аллергических реакций в анамнезе, инфаркта миокарда, перенесенного в течение последних 2 лет, сердечной недостаточности II–III стадии, хронических неспецифических заболеваний легких с выраженной дыхательной недостаточностью, обострения язвенной болезни желудка или двенадцатиперстной кишки; туберкулеза; активного гепатита; нарушения функции печени (уровень билирубина выше 35 мкмоль/л, аланинаминотрансферазы (АлАТ) или аспартатаминотрансферазы (АсАТ) более чем в 2 раза); сахарного диабета; хронической почечной недостаточности (уровень креатинина более 200 мкмоль/л, клиренс креатинина ниже 50 мл/ч).
Критериями исключения служили психические заболевания (в том числе компенсированные), беременность, неспособность пациентов в силу различных причин соблюдать предложенную схему лечения, индекс Карновского менее 60%.
Эффективность терапии оценивали согласно критериям Национального института рака США (Cheson B.D. et al., 1996) по следующим параметрам: ПР, частичная ремиссия (ЧР), стабилизация состояния (СС), прогрессирование заболевания (ПЗ). Общую эффективность (ОЭ) терапии определяли как сумму ПР и ЧР.
ПР устанавливали при отсутствии лимфаденопатии и спленомегалии, «общих симптомов» (уменьшение массы тела, профузное ночное потоотделение), нормализации показателей крови, а именно: количество гранулоцитов ≥1,5·109/л, количество тромбоцитов ≥100·109/л, количество лимфоцитов ≤4·109/л, содержание гемоглобина ≥110 г/л. Количество лимфоцитов в миелограмме должно быть менее 30%. Все изложенные критерии были действительны, если они сохранялись в течение 2 мес после окончания терапии.
ЧР определяли при снижении лимфоцитоза периферической крови ≥50%, уменьшении размеров лимфатических узлов ≥50%, уменьшении размеров селезенки и/или печени ≥50% и при наличии одного из нижеуказанных критериев в случае, если он сохранялся в течение 2 мес: количество гранулоцитов ≥1,5·109/л (относительно этой величины допускался 50% разброс), количество тромбоцитов ≥100·109/л (относительно этой величины допускался 50% разброс), содержание гемоглобина ≥110·109/л (относительно этой величины допускался 50% разброс). Для установления ЧР не было необходимости выполнять подсчет миелограммы.
ПЗ характеризовалось одним из нижеперечисленных критериев: увеличение диаметра >50% хотя бы 2 лимфоузлов, отмечаемое при 2 последних осмотрах с интервалом в 2 нед. Диаметр по крайней мере одного лимфоузла должен составлять >2 см; обнаружение новых пальпируемых лимфоузлов, увеличение размеров печени и/или селезенки >50%; гепато- и спленомегалия (ранее не отмечаемые), выявленные при пальпации; увеличение >50% абсолютного числа циркулирующих лимфоцитов; трансформация ХЛЛ в более агрессивные неопластические формы (синдром Рихтера, пролимфоцитарная лейкемия).
СС определяли как состояние, которое не соответствовало критериям ПР, ЧР и ПЗ.
Кроме этого, оценивали среднюю продолжительность ответа на терапию (среднюю длительность ремиссии), общую выживаемость.
Продолжительность ответа (медиана длительности ремиссии) на терапию рассчитывали как время от достижения полного или частичного ответа до ПЗ, начала другой терапии или смерти больного.
Общая выживаемость — время от начала лечения до последней даты наблюдения.
Безопасность и токсичность терапии оценивали согласно критериям токсичности Национального института рака США (табл. 1) (NCI Common Toxicity Criteria, 1998).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
С октября 2001 по июнь 2004 г. в исследование включено 159 (131 мужчина и 28 женщин) больных с В-ХЛЛ. Клинико-гематологические характеристики больных представлены в табл. 2.
Средняя длительность заболевания у всех пациентов от момента установления диагноза до начала терапии составила от 1 до 238 мес (в среднем — 33,65±3,2 мес).
Перед началом терапии проводили комплекс исследований, а именно: изучение анамнеза с указанием стадии заболевания на момент установления диагноза, стадии заболевания на момент включения в протокол, длительности заболевания, описанием предшествующего лечения (схем терапии), сопутствующих заболеваний; физикальное исследование с указанием размеров периферических лимфоузлов, печени и селезенки, клинического статуса (индекс Карновского); клинический анализ крови с определением уровня тромбоцитов, лейкоцитарной формулы; биохимическое исследование крови с определением общего билирубина, прямого, непрямого билирубина, АлАТ, АсАТ, мочевины, креатинина); гемолитические пробы; общий анализ мочи с указанием удельного веса; электрокардиографию, рентгенографию легких, ультразвуковое исследование органов брюшной полости с определением размеров абдоминальных лимфатических узлов; морфологический подсчет миелограммы, оценку клеточности, иммунофенотипирование мононуклеаров периферической крови и/или костного мозга с определением экспрессии антигенов CD5, CD19, CD20, CD22, CD23. Все исследования проводили не позднее чем за 1 мес до начала терапии. После обследования больные получали терапию согласно представленному дизайну (схема).
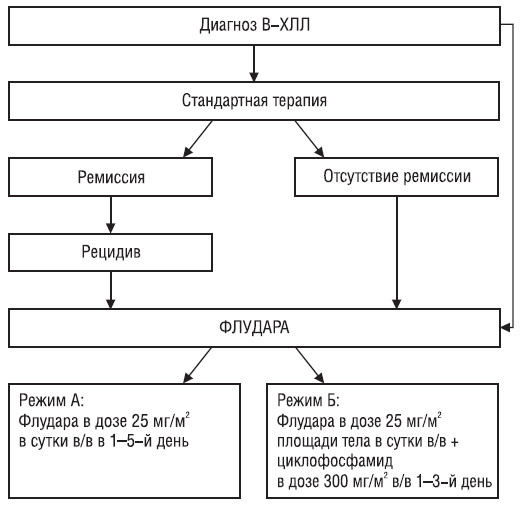
Больные получали терапию Флударой в монорежиме (режим А) или в комбинации с циклофосфамидом (режим Б). Стандартная доза препарата в режиме А составляла 25 мг/м2 в сутки внутривенно капельно в 1–5-й день. В режиме Б больные получали Флудару в дозе 25 мг/м2 внутривенно капельно и циклофосфамид в дозе 300 мг/м2 внутривенно капельно в 1–3-й день. При режимах А и Б курсы лечения повторяли каждые 28 дней. Следующий курс терапии начинали при количестве лейкоцитов более 2·109/л, тромбоцитов более — 80·109/л. При несоответствии данным критериям лечение откладывали до восстановления показателей (приблизительно до 6 нед). Количество циклов зависело от достижения ПР или ЧР (но не более 6 курсов индукции). При установлении ПР проводили 2 курса консолидации по той же схеме. Планируемая длительность терапии составляла в среднем 6 курсов, максимальное количество курсов — 8.
Всем больным для профилактики пневмоцистной пневмонии назначали ко-тримоксазол в дозе 480 мг (триметоприм 80 мг+сульфаметоксазол 400 мг) 2 раза в сутки 3 раза в неделю с 1-го дня терапии и в течение 2 мес после завершения лечения. При снижении уровня гранулоцитов ниже 0,5·109/л для профилактики бактериальных инфекций назначали ципрофлоксацин в дозе 500 мг 1 раз в сутки до восстановления уровня гранулоцитов выше 1,0·109/л.
В ходе терапии всем больным выполняликлинический анализ крови с определением уровня тромбоцитов 2 раза в неделю, биохимическое исследование крови 2 раза в неделю, общий анализ мочи — 1 раз в неделю.
Обследование в полном объеме осуществляли перед началом терапии, а также после ее завершения. Наблюдение за основными проявлениями заболевания и динамическая оценка их состояния осуществлялась перед каждым курсом лечения.
Эффективность лечения оценивали у всех больных, получивших полный курс терапии (достижение ПР и ее консолидация), а также всем больным после завершения 6 курсов лечения. При достижении ПР или ЧР (завершение лечения) рестадирование заболевания проводили каждые 3 мес в течение первых 12 мес, а также при первых проявлениях ПЗ, аспирацию костного мозга с подсчетом миелограммы — каждые 6 мес.
Основанием для прекращения лечения являлись: ПЗ (увеличение массы опухоли более чем на 50% и/или появление новых признаков заболевания) в течение первых 2 курсов, отсутствие эффекта после проведения 2 курсов лечения, достижение ЧР в результате проведения 6 курсов терапии, степень токсичности 4 и выше к началу следующего курса лечения.
Результаты терапии
На момент завершения протокола пациентам провели 631 курс лечения с включением Флудары. Распределение больных в зависимости от количества курсов лечения представлено на рис. 1.
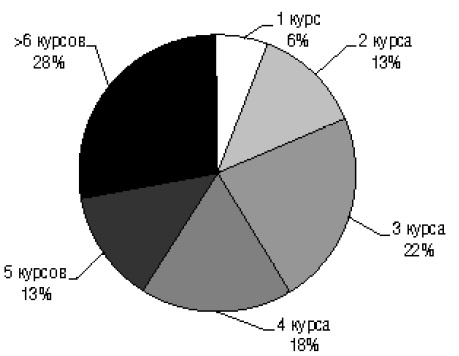
Рис. 1. Распределение больных в зависимости от количества курсов
Эффективность терапии анализировали только у тех больных, которые получили не менее чем 3 курса химиотерапии. Таким образом, из группы наблюдения были исключены 30 больных. Последующий анализ результативности лечения больных с ХЛЛ с включением Флудары был проведен у 129 больных. За период наблюдения эти пациенты получили 602 курса лечения с включением Флудары (в среднем — 4,66 курса). В последующем все больные были распределены на 2 группы: 34 пациента с вновь установленным диагнозом (первичные, 1-я группа) и 95 — которым ранее проводили терапию, но не зафиксирован ответ на нее (с рефрактерностью к лечению, 2-я группа).
У большинства больных 2-й группы ранее применяли алкилирующие препараты в монорежиме (хлорамбуцил, циклофосфамид) или полихимиотерапию на основании алкилирующих препаратов (СОР, СНОР). 13 больных из данной группы ранее получали Флудару. Количество линий терапии у рефрактерных больных составляло от 1 до 7 (в среднем — 2,2).
ОЭ терапии у группы больных в целом составила 82,17%, при этом у 50 (38,76%) больных была достигнута ПР, у 56 (43,41%) — ЧР, у 21 (16,28%) — СС, у 2 (1,55%) — ПП. Результаты терапии представлены на рис. 2.
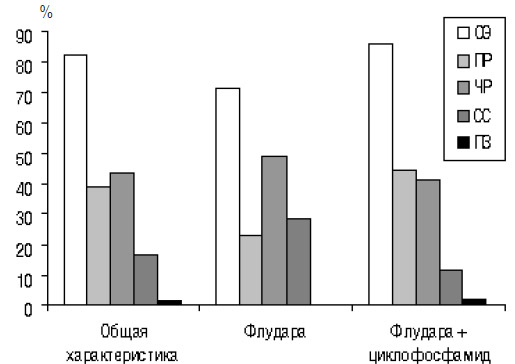
Рис. 2. Эффективность терапии больных с ХЛЛ с включением Флудары
Результаты сравнительного анализа эффективности терапии у больных, которые получали моно- и комбинированную терапию с включением Флудары, свидетельствуют, что оба режима являются высокоэффективными при лечении пациентов с ХЛЛ. Частота положительного ответа на терапию у больных, получавших монотерапию, и у тех, которым проводили комбинированную терапию, отличалась (ОЭ — 70,59 и 86,32% соответственно, χ2=4,23, p<0,05). ПР была достигнута у значительно большего числа пациентов, которые получали Флудару в комбинации с циклофосфамидом, по сравнению с теми больными, которые получали монотерапию Флударой (45,26 и 20,59% соответственно, χ2=5,02, p<0,05).
ОЭ лечения пациентов с ХЛЛ с включением Флудары в зависимости от статуса (1-я или 2-я группа) составила 88,24 и 80% соответственно (р>0,05), (ПР — 50 и 34,74%, р>0,05; ЧР — 38,24 и 45,26% соответственно, р>0,05).
Комплексный анализ эффективности лечения в зависимости от статуса пациентов и вида лечения (моно- или комбинированная терапия) представлены в табл. 3.
В результате анализа эффективности терапии в зависимости от статуса больных было установлено, что в 1-й группе результативность терапии существенно не отличалась от таковой у больных, которые получали терапию по поводу основного заболевания до назначения Флудары. Так, ОЭ составила 88,24% у первичных больных и 80% — у больных, которые получали лечение ранее (p>0,05).
Во 2-й группе больных результативность терапии была выше при использовании комбинированного лечебного режима (ОЭ — 61,9 против 85,14% соответственно, χ2=5,52, p<0,05) преимущественно за счет ПР — 14,29 и 40,54% соответственно (χ2=4,97; p<0,05). В то же время у первичных больных эффективность лечения в зависимости от вида терапии (моно- или комбинированная) имела несущественные отличия. Возможно, это можно объяснить меньшей выборкой в данной группе больных.
Оценивали ассоциативные связи результативности лечения больных с ХЛЛ с включением Флудары и ряда клинических параметров. Выявлены тесные корреляционные связи между эффективностью лечения и количеством линий терапии, которые больные получали ранее (во 2-й группе рефрактерных), стадией заболевания, количеством курсов лечения с включением Флудары. Результаты корреляционного анализа эффективности терапии свидетельствуют, что уровень положительного ответа на проводимое лечение не зависит от возраста и пола больных, а также от того, получали ли они лечение ранее (табл. 4).
Результативность лечения зависела от количества линий терапии до включения в протокол: ОЭ терапии была ниже у пациентов, которым назначали большее количество линий терапии до включения в протокол. Корреляционный анализ подтвердил правильность выборки для оценки эффективности терапии с включением Флудары установлена четкая корреляционная связь между эффективностью терапии и количеством курсов лечения — ≥3 или <3 (у больных, которые принимали менее 3 курсов терапии, ОЭ не превышала 50% (ПР— у 2 из 20, ЧР — у 4 из 20), в то время как у остальных больных выявлено либо СС (у 13 из 20), либо ПЗ (у 1 из 20)).
Различия в достижении позитивного ответа на терапию Флударой отмечены в зависимости от стадии заболевания. Установлено, что эффективность лечения выше у пациентов с ХЛЛ ранних стадий: ОЭ терапии была достоверно выше у больных с ХЛЛ стадии В по сравнению с таковой у больных со стадией С (χ2=5,94, p<0,01).
Обнаружена связь эффективности терапии (положительного ответа на лечение) с некоторыми клиническими симптомами ХЛЛ. Так, результативность лечения была ниже у больных с более выраженным лейкоцитозом (r=0,19; p=0,03), лимфоцитозом периферической крови (r=0,26; p=0,03), костного мозга (r=0,26; p=0,01), гепатомегалией (r=0,26; p=0,004) и выраженной лимфаденопатией (r=0,185; p=0,04).
Оценка отдаленных результатов лечения
Оценка длительности позитивного ответа на лечение Флударой проведена в группе больных с ХЛЛ, у которых была достигнута ПР или ЧР. Медиана ремиссии для группы в целом составила 19 (от 1 до 45) мес. Установлено, что длительность ремиссии зависела от глубины ответа (r=3,82; p=0,0001) и была существенно больше в группе больных, у которых была достигнута ПР (24 мес) по сравнению с теми, у кого был получен частичный ответ на терапию (15,8 мес).
Анализ выживаемости больных с ХЛЛ, которым проводили терапию с включением Флудары, свидетельствует, что за период наблюдения 60 мес этот показатель составляет 66,6%, а медиана общей выживаемости — 38,4 мес (рис. 3).
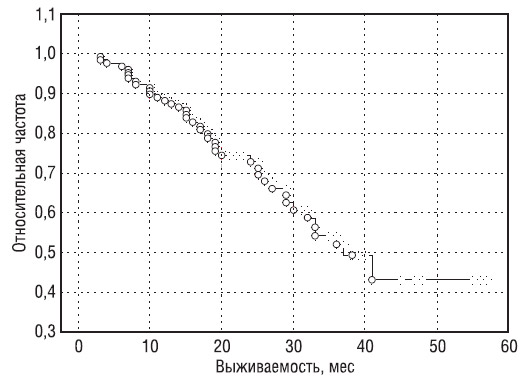
Рис. 3. Кривая выживаемости Каплана — Мейера в группе больных, находящихся под наблюдением
Выявлены существенные различия общей выживаемости у больных, у которых зафиксирован ответ на лечение, по сравнению с теми, у кого ответ на терапию не был получен (рис. 4).
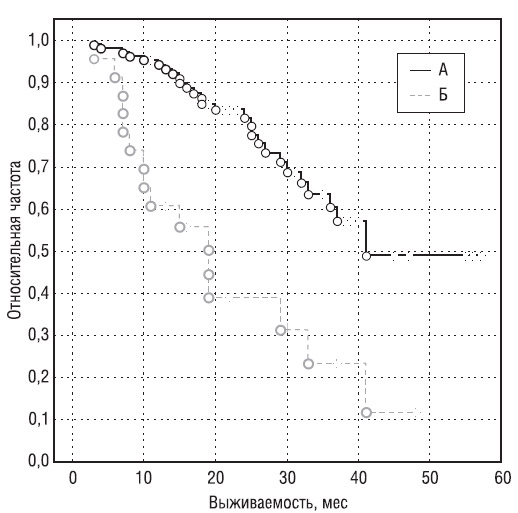
Рис. 4. Кривая выживаемости Каплана — Мейера у больных, находящихся под наблюдением, в зависимости от ответа на терапию: А — больные,
у которых получен ответ на лечение в виде ПР или ЧР; Б — больные, у которых не был получен ответ на лечение (СС или ПЗ).
Установлено, что выживаемость в группе больных с ХЛЛ, которые получали лечение с включением Флудары, зависит от ответа на терапию и выше у больных, у которых была достигнута ПР или ЧР (медиана — 40,5 мес) по сравнению с теми, у кого не был получен ответ на лечение (медиана — 19 мес).
Токсичность терапии
Общая токсичность лечения Флударой была умеренной. Основные проявления токсичности — миелосупрессия, а также инфекционные осложнения. У большинства пациентов отмечали гематологическую токсичность преимущественно легкой степени: у 73,6% — нейтропению (из них у 17,8% — III–IV степени), у 68,2% больных — тромбоцитопению (в том числе у 19,4% — III–IV степени), у 48% — анемию (в том числе у 6,9% — тяжелой степени).
Наиболее частыми осложнениями были инфекции, которые развились у 54,3% пациентов, при этом тяжелые инфекции — у 9,3% больных.
Достоверных отличий в отношении токсичности монотерапии и комбинированной терапии Флударой не выявлено.
В результате проведенного лечения у большинства пациентов выявлено улучшение общего состояния, что способствовало улучшению качества их жизни. Динамика общего состояния больных (индекс Карновского) представлена в табл. 5.
ВЫВОДЫ
Флудара является эффективным средством терапии больных с ХЛЛ (ОЭ у группы больных в целом составила 82,17%).
Эффективность комбинированного режима Флудара+циклофосфамид выше по сравнению с монотерапией Флударой преимущественно за счет достижения ПР (45,26 и 20,59% соответственно, p<0,05).
Флудара эффективна как у первичных больных, так и при рефрактерности к стандартной терапии. Результативность терапии коррелирует с количеством проведенных курсов лечения. Необходимым условием достижения оптимального ответа на лечение Флударой является проведение не менее 3 курсов лечения.
Терапия больных с ХЛЛ с включением Флудары более эффективна при ХЛЛ ранних стадий независимо от возраста и пола больных, а также длительности заболевания до применения Флудары.
Эффективность терапии в группе больных с рефрактерностью к проводимому ранее лечению зависит от количества линий предшествующей терапии и выше у тех пациентов, которые ранее получили химиотерапию в меньшем объеме.
Последующее течение заболевания зависит от получения позитивного ответа на терапию. Медиана выживаемости значительно и достоверно выше у больных, у которых зафиксирован ответ на терапию по сравнению с теми, у кого результат на лечение не получен.
Последующее течение заболевания не зависит от вида лечения Флударой (моно- или комбинированная терапия), на который достигнут ответ.
Токсичность монотерапии и комбинированной терапии Флударой достоверно не отличается.
Терапия Флударой способствует значительному улучшению качества жизни больных с ХЛЛ.
ВЫРАЖЕНИЕ ПРИЗНАТЕЛЬНОСТИ
Выражаем признательность за активную работу всем сотрудникам гематологических клиник Украины — участников протокола: Научный центр радиационной медицины АМН Украины, Киев (зав. отделением З.В. Радчук); Киевский центр трансплантации костного мозга (зав. отделением Н.И. Костюкова); НИИ гематологии и трансфузиологии АМН Украины, Киев (зав. отделом проф. Н.Н. Третяк); Киевская городская клиническая больница № 9 (зав. отделением В.Н. Зинченко;зав. отделением Т.Б. Зубрицкая); Киевская медицинская академия последипломного образования им. П.Л. Шупика МЗ Украины (зав. кафедрой гематологии проф. С.Н. Гайдукова); Киевская областная клиническая больница № 2 (врач В.М. Мачило); Черкасский областной онкологический диспансер (зав. отделением Г.В. Пилипенко); Институт патологии крови и трансфузионной медицины АМН Украины, Львов (проф. Я.И. Выговская; зав. отделением З.В. Масляк); Львовская городская клиническая больница № 5 (зав. отделением И.Л. Гумен); Львовская областная клиническая больница (В.Г. Орел); Полтавская областная клиническая больница (зав. отделением Е.Д. Кудрявцев); Крымский республиканский онкологический диспансер, Симферополь (зав. отделением М.И. Касич); Кировоградская областная клиническая больница (зав. отделением Т.К. Гришина); Ивано-Франковская областная клиническая больница (зав. отделением Г.И. Михайлова); Днепропетровская городская многопрофильная клиническая больница № 4 (зав. отделением П.Е. Каплан); Луганская областная клиническая больница (зав. отделением Е.Т. Дробот); Волынская областная клиническая больница (зав. отделением О.М. Богдан); Институт неотложной и восстановительной хирургии, Донецк (зав. отделением Б.Г. Островская); Хмельницкая областная клиническая больница (зав. отделением Л.П. Мороз); Больница скорой медицинской помощи, Черновцы (зав. отделением Л.В. Аджигитова); Ровенская областная клиническая больница (зав. отделением Л.А. Карпюк); Николаевская областная клиническая больница (зав. отделением С.В. Никулин); Одесская областная клиническая больница (зав. отделением В.П. Козлов); Черниговский областной онкологический диспансер (зав. отделением Д.И. Дворак); Херсонская областная клиническая больница (зав. отделением М.Г. Гаркуша); Винницкая областная клиническая больница им. Н.И. Пирогова (зав. отделением А.А. Олейник); Житомирская областная клиническая больница (зав. отделением Т.И. Лысая); Больница № 9, Днепродзержинск (зав. отделением К.Б. Лозинский).
ЛИТЕРАТУРА
-
- Baccarani M., Cavo M., Gobbi M., Lauria F., Tura S. (1982) Staging of chronic lymphocytic leukemia. Blood, 59(6): 1191–1196.
- Binet J.L., Auquier A., Dighiero G. et al. (1981) A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer, 48: 198–206.
- Cheson B.D., Bennett J.M., Grever M. et al. (1996) National Cancer Institute-sponsored working group guidelines for chronic lymphocytic leukemia: revised guidelines for diagnosis and treatment. Blood, 87: 4990–4997.
- Clavio M., Miglino M., Spriano M. et al. (1998) First line fludarabine treatment of symptomatic chronic lymphoproliferative diseases: clinical results and molecular analysis of minimal residual disease. Eur. J. Haematol., 61: 197–203.
- International Workshop on Chronic Lymphocytic Leukemia (1989) Chronic lymphocytic leukemia: recommendations for diagnosis, staging, and response criteria. Ann. Intern. Med., 110: 236–238.
- Keating M., O’Brien S., Kontoyiannis D. (2002) Results of first salvage therapy for patients refractory to a fludarabine regimen in chronic lymphocytic leukemia. Leuk. Lymph., 43: 1755.
- Keating M.J. (1996) The use of fludarabine in chronic lymphocytic leukemia and malignant lymphomas. In: W. Hiddemann, T. Buchner, B. Wоrmann et al. (Eds.) Acute Leukemias V. Experimental approaches and management of refractory diseases. Heidelberg: Springer-Verlag, Berlin, р. 572–577.
- Keating M.J., O’Brien S., Lerner S., Koller C., Beran M., Robertson L.E., Freireich E.J., Estey E., Kantarjian H. (1998) Long-term follow-up of patients with chronic lymphocytic leukemia (CLL) receiving fludarabine regimens as initial therapy. Blood, 92: 1165–1171.
- NCI Common Toxicity Criteria (1998) Version 2, 47 p.
- Rai K.R., Peterson B.L., Appelbaum F.R. et al. (2000) Fludarabine compared with chlorambucil as primary therapy for chronic lymphocytic leukemia. N. Engl. J. Med., 343: 1750–1757.
- Rozman C., Montserrat E., Feliu E. et al. (1982) Prognosis of lymphocytic leukemia: A multivariate analysis of 150 cases. Blood, 59: 1001–1005.
- Spriano M., Chiurazzi F., Cassibba V. et al. (1998) Multicentric prospective randomised trial fludarabine versus chlorambucil and prednisonein previously untreated patients with active B-chronic lympocytic leukaemia (B-CLL): First interim report. Br. J. Haematol., 102: 191.
ЕФЕКТИВНІСТЬ І ТОКСИЧНІСТЬ ФЛУДАРИ, КОМБІНАЦІЇ ФЛУДАРИ І ЦИКЛОФОСФАМІДУ У ХВОРИХ НА ХРОНІЧНИЙ ЛІМФОЛЕЙКОЗ. РЕЗУЛЬТАТИ БАГАТОЦЕНТРОВОГО ДОСЛІДЖЕННЯ
Резюме. Наведено результати вивчення ефективності й токсичності флударабіну (препарату Флудара), поєднаного застосування Флудари та циклофосфаміду в межах нерандомізованого багатоцентрового дослідження, виконаного в 28 гематологічних клініках України. В дослідження включили 159 хворих на хронічний лімфолейкоз (ХЛЛ) із вперше встановленим діагнозом або рефрактерністю до терапії, яку проводили раніше. Хворим призначали Флудару в монорежимі в дозі 25 мг/м2 площі тіла внутрішньовенно в 1-5-й день (режим А) чи комбінацію Флудари в дозі 25 мг/м2 внутрішньовенно в 1-3-й день та циклофосфаміду в дозі 300 мг/м2 внутрішньовенно в 1-3-й день (режим Б). Курси повторювали кожні 28 днів. Ефективність терапії оцінювали згідно з критеріями Національного інституту раку США за такими параметрами: повна ремісія (ПР), часткова ремісія (ЧР), стабілізація стану, прогресування захворювання, а безпеку і токсичність – згідно з критеріями токсичності. Ефекти лікування оцінювали у 129 хворих. Загальна ефективність терапії у всіх хворих становила 82,17%, при цьому у 50 (38,76%) хворих була досягнута ПР, а у 56 (43,41%) хворих – ЧР. Ефективність комбінованого режиму Флудара+циклофосфамід вища порівняно з такою монотерапії Флударою (позитивну відповідь на терапію отримано відповідно у 86,32 та 70,59% хворих) переважно за рахунок досягнення ПР (45,26 та 20,59% відповідно, p
Ключові слова:хронічний лімфолейкоз, флударабін, Флудара, циклофосфамід, ефективність, токсичність
Summary. A prospective, non-randomized multicenter study was conducted at 28 hematology clinic of Ukraine to assess the efficacy and safety of intravenous (i.v.) fludarabine (preparation Fludara) as well as i.v. Fludara and i.v. cyclophosphamide combination. 129 of 159 patients with treatment-naive (34 patients) or previously treated (95 patients) chronic lymphocytic leukemia (CLL) received i.v. Fludara 25 mg/m2 on days 1 through 5 (regimen A) or i.v. Fludara 25 mg/m2 plus i.v. cyclophosphamide 300 mg/m2 on days 1 through 3 (regimen B), repeated every 28 days. Efficacy was assessed using the National Cancer Institute (NCI) criteria for complete remission (CR), partial remission (PR), stable disease or disease progression. Safety monitoring included NCI toxicity grading for all adverse events. Overall remission rate was 82,17% (CR — in 50 (38,76%) patients and PR — in 56 (43,41%) patients. Positive response was higher in patients who received Fludara plus cyclophosphamide combination versus fludarabine monotherapy: overall remission rate — 86,32% and 70,59% respectively (p
Key words: chronic lymphocytic leukemia, fludarabine, Fludara, cyclophosphamide, efficacy, toxicity





