ВСТУП
Безплідний шлюб — одна з найактуальніших медичних і соціальних загальнодержавних проблем як у нашій країні, так і за кордоном. За даними Всесвітньої організації охорони здоров’я його частка становить 10–15% від числа подружніх пар. Лікування безпліддя традиційними методами — процес тривалий і майже безрезультатний (Аржанова О.Н. и соавт., 1999).
Невисока ефективність методів відновлення природної фертильності людини стимулювала розвиток допоміжних репродуктивних технологій (ДРТ), зокрема — стандартної процедури екстракорпорального запліднення (ЕКЗ) з наступним перенесенням ембріонів у матку (ПЕ) [in vitro fertilization and embryo transfer — IVF/ET]. Частота настання вагітності за даними Європейського товариства з репродукції людини (European Society for Human Reproduction & Embryology/ESHRE; http://www.eshre.com) становить 30–40% на цикл ЕКЗ ПЕ (Кулаков В.И., Леонов Б.В., 2000).
Збільшення кількості випадків медикаментозно індукованої вагітності зумовлює актуальну проблему — спостереження за перебігом і завершенням вагітності. За даними Всесвітнього звіту з методів допоміжної репродукції результатом тільки близько 70% випадків клінічної вагітності після ЕКЗ є живонародження, а 19,5–37,6% випадків — передчасні пологи (Lancaster P.A., 1996; Кузьмичев Л.Н. и соавт., 2001).
Нині для оцінки ефективності ЕКЗ, окрім частоти настання вагітності, використовують показник частоти народження живих дітей, виписаних з пологового будинку після лікування безпліддя у матері, — «take baby home», що звичайно не перевищує 6–19% з розрахунку на перенесення ембріона і 56–78% на число випадків клінічної вагітності, що настала (Goldfarb J.M. et al., 1996; Hardy K. et al., 2002).
Перебіг вагітності, яка настала в результаті лікування безпліддя за допомогою ЕКЗ, має істотні відмінності від такого при фізіологічному настанні вагітності. Внаслідок методичних і медикаментозних особливостей проведення циклів ЕКЗ жінки, що їх пройшли, становлять групу високого ризику невиношування вагітності, виникнення різноманітних ускладнень вагітності й пологів (Аржанова О.Н. и соавт., 1999).
Одним з ускладнень індукованої вагітності, що виникає найчастіше, є невиношування. Існує ризик переривання 75% випадків вагітності після ЕКЗ. Частота спонтанних викиднів у І–ІІ триместрі вагітності досягає 11–44%. Основна частка випадків переривання вагітності (75–80%) як в популяції, так і після ЕКЗ припадає на І триместр (Лысая Т.Н. и соавт., 2002).
Невиношування вагітності — універсальна, інтегрована відповідь жіночого організму на будь-яку виражену патологію у вагітної чи плода, пов’язану з перенесеними інфекціями, ендокринною патологією та іншими несприятливими внутрішніми чи зовнішніми факторами (Грищенко В.И., Щербина Н.А., 1997; Коханевич Є.В. та співавт., 2001; Писарева С.П., 2001).
Сьогодні відсутня єдність у поглядах на пускові, патогенетичні механізми спонтанного аборту. Основні труднощі, пов’язані з вивченням проблеми невиношування вагітності, зокрема після ЕКЗ, зумовлені поліетіологічністю та поліпатогенетичністю цієї патології (Писарева С.П., 1996).
Перебіг вагітності, що настала внаслідок лікування безпліддя методами ДРТ, має істотні відмінності від такого при спонтанному настанні вагітності через особливості методики проведення ЕКЗ з використанням великої кількості специфічних гормональних препаратів і вкрай обтяжений акушерсько-гінекологічний анамнез жінок, що завагітніли за допомогою методів ДРТ (Коломнина Е.А., 2002).
Повідомлення дослідників, які займаються проблемами вагітності після ЕКЗ, містять велику кількість розбіжностей у поглядах на тактику ведення таких пацієнток і методи родорозрішення. Проте погляди вчених збігаються у тому, що пацієнтки, які успішно закінчили програму ЕКЗ, належать до групи ризику за ускладненим перебігом вагітності й пологів, найбільш поширеним з яких є невиношування вагітності (Сидельникова В.М. и соавт., 2000).
Проаналізувавши велику кількість матеріалів із зазначеної проблеми, ми прийшли до висновку, що на сьогодні етіопатогенетичні механізми невиношування індукованої вагітності, особливості її перебігу й адаптаційні механізми на фоні попереднього специфічного лікування з’ясовані недостатньо.
В літературі окремо розглядаються чинники, що можуть бути прогностично несприятливими щодо подальшого перебігу індукованої вагітності. Ми проаналізували їх значущість для оцінки перебігу вагітностей.
При фізіологічній вагітності основна роль в регулюванні її нормального розвитку належить хоріону і трофобласту, які продукують хоріонічний гонадотропін людини (ХГЛ), що, в свою чергу, сприяє адаптаційним реакціям організму матері до вагітності. Визначення рівня ХГЛ в крові жінки через 14–16 днів після запліднення характеризує результативність лікувальних циклів ЕКЗ. Саме показник ХГЛ, за даними багатьох авторів, є прогностичним маркером подальшого перебігу вагітності й розвитку можливих ускладнень (Alam V. et al., 1999).
Одним із найважливіших аспектів, що сприяють зниженню репродуктивних втрат після настання вагітності після проведення ЕКЗ, є призначення підтримувальної гормональної терапії в лютеїнову фазу індукованого циклу і ранні терміни вагітності. У зв’язку з цим в літературі широко обговорюються питання, присвячені доцільності й термінам призначення гормональної терапії, а також прогностичному значенню рівня і динаміці змін основних статевих гормонів у крові. Деякі автори вважають за доцільне введення гестагенів у високих дозах при недостатності функціонування жовтого тіла і відносній гіперестрогенемії у лікувальних циклах ЕКЗ, інші пропонують обмежувати призначення препаратів після закінчення лютеїнової фази індукованого циклу через негативний вплив прогестерону у високих концентраціях на репродуктивну систему плода (Лысая Т.Н. и соавт., 2002).
Нормальний розвиток плода забезпечується перебудовою материнського організму, що супроводжується морфологічними і функціональними змінами в імунній системі вагітної. При нормальному перебігу вагітності, в тому числі після ЕКЗ, відбувається активація системи природного імунітету. Для сприятливого перебігу вагітності мають значення як системні, так і локальні імунологічні фактори. На ранніх термінах вагітності на системному рівні відбувається стимуляція клітин, що беруть учать в імунній відповіді, і формування особливої локальної імунної відповіді, яка зумовлює створення сприятливого імунного фону для імплантації зародка, росту і дозрівання плаценти, гісто- й органогенезу (Hardy K. et al., 2002).
В генезі індукції загрози переривання вагітності встановлена виражена імунологічна реактивність. В основі невиношування вагітності лежать імунні реакції на клітинному і гуморальному рівнях. Причому саме неадекватна імунна відповідь організму матері на вагітність призводить до порушень в інших органах і системах жінки, зокрема в гормональній і коагуляційній, що спричиняє розвиток клінічної картини загрози переривання вагітності (Steck T., 2001).
Важливе значення для нормального перебігу вагітності в ранні терміни, зокрема після ЕКЗ, має наявність чи відсутність аутоімунних процесів в організмі матері. Лікувальний цикл ЕКЗ — тригерний механізм для активації аутоімунних процесів і тромбофілічних станів, які порушують нормальний розвиток плода і призводять до переривання вагітності вже в ранні терміни. Класичним прикладом такого процесу є наявність антифосфоліпідних антитіл (АФАТ). Ці антитіла можуть лежати в основі патогенезу невиношування вагітності, зокрема після ЕКЗ (Kutteh W.H. et al., 1997; Клюквина Н.Г., 2002).
Серед аутоімунних процесів, що мають значення для сприятливого перебігу вагітності, є здатність В-клітин, активованих перебудовою імунної системи, виробляти аутоантитіла, зокрема до β-частини хоріонічного гонадотропіну (β-ХГ). Наявність таких антитіл часто є характерною для вагітних після ЕКЗ. Аутоімунізація до ХГЛ зумовлена несприятливим акушерсько-гінекологічним анамнезом і використанням гонадотропінів у програмі стимуляції яєчників циклу ЕКЗ (Кирющенков П.А., 2003).
Наявність аутоантитіл до ХГЛ має значення в генезі мимовільних репродуктивних втрат, що виражається в загибелі ембріона. Патологічний ефект цих антитіл залежить від їх вмісту. При підвищенні рівня антитіл до ХГЛ відбувається порушення імплантації, ранній розвиток хронічної форми синдрому дисемінованого внутрішньосудинного згортання (ДВЗ-синдрому) і плацентарної недостатності, що є причиною переривання вагітності (Кирющенков П.А. и соавт., 1996).
Одним з основних і найбільш інформативних методів оцінки перебігу вагітності та розвитку плода є ультразвукова фето- і плацентометрія. Елементи пренатальної діагностики дозволяють завчасно попередити можливі вади і захворювання у новонароджених. При проведенні ультразвукового дослідження (УЗД) через 4 тижні після запліднення не тільки підтверджується наявність плідного яйця в матці, а й ідентифікується наявність ембріона, його головного і каудального кінців, реєструється серцева діяльність, визначаються характеристики жовчного міхура. Саме УЗД в цей термін є найбільш інформативним і прогностичним щодо подальшого перебігу вагітності й можливого ризику невиношування (Choong S. et al., 2003).
Взагалі, питання ведення пацієнток з індукованою вагітністю є дуже актуальним і недостатньо вивченим. Ризик несприятливого результату й ускладнень вагітності після застосування методів ДРТ зумовлений як сукупністю чинників, що визначають стан здоров’я пацієнток, етіологію і патогенез безпліддя, так і розширенням використовуваних технологій і перенесенням кількох ембріонів з метою підвищення ефективності лікування (Тишкевич О.Л. и соавт., 1998; Чечнева М.А. и соавт., 1998).
Більшість досліджень, присвячених перебігу і результатам індукованої вагітності, містять багато суперечливих даних. Не існує чітко обгрунтованого алгоритму комплексного обстеження, необхідного для спостереження за пацієнтками з такою вагітністю і визначення можливих змін вже в доклінічну стадію для своєчасної й адекватної корекції лабораторно-інструментальних показників з метою попередження виникнення загрози переривання вагітності після ЕКЗ.
Мета нашої роботи — розробити і вдосконалити комплексне обстеження в ранні терміни вагітності після ЕКЗ для визначення групи ризику невиношування вагітності, попередження розвитку можливих ускладнень і корекції виявлених порушень вже в доклінічну стадію загрози переривання вагітності з урахуванням усіх лабораторно-інструментальних показників.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
У дослідження було включено 80 вагітних, що перебували на обліку в жіночій консультації клініки «Ісіда–IVF» після проходження лікування з приводу безпліддя за програмою ЕКЗ. До контрольної групи увійшли 40 вагітних, у яких вагітність настала фізіологічним шляхом. Проаналізовано вікові показники, акушерсько-гінекологічний анамнез, частоту і структуру екстрагенітальної патології. За цими параметрами статистично значущих відмінностей між групами не виявлено, що дозволило порівнювати групи між собою.
Вагітні після ЕКЗ були рандомізовані на 2 групи по 40 осіб. В основній групі жінок проводили обстеження на виявлення чинників, найбільш прогностично значущих щодо подальшого перебігу вагітності, з метою створення алгоритму діагностики ризику невиношування вагітності після ЕКЗ та своєчасного попередження її переривання. В групі порівняння жінкам проводили стандартні дослідження та застосовували стандартні схеми ведення. Результати проведених досліджень ми порівнювали з результатами в групі контролю.
Спостереження за жінками після ЕКЗ проводили з моменту біохімічного встановлення факту вагітності. В ході дослідження ми порівнювали ефективність 2 методів ведення вагітних після ЕКЗ — стандартного і запропонованого нами — індивідуалізованого.
Так, пацієнткам основної та контрольної групи ми проводили гормональні дослідження: (рівень ХГЛ, естрадіолу, прогестерону), УЗД, імунологічні дослідження (імунограма, наявність в крові антитіл до ХГ, АФАТ), жінкам групи порівняння — УЗД, гормональні дослідження (рівень ХГЛ, естрадіолу, прогестерону).
Гормональні дослідження
— ХГЛ — через 16 днів після запліднення методом ЕКЗ для біохімічного встановлення факту вагітності; при необхідності (у жінок групи ризику) повторювали через 3 доби;
— (Е2, Р4) естрадіол, прогестерон — починаючи з 4–6-го тижня вагітності (мінімально — через 14 днів після біохімічного встановлення вагітності) в динаміці з інтервалом 2–4 тиж відповідно до рівня гормонів за строком гестації.
Гормональні дослідження виконували імунофлюоресцентним методом за допомогою стандартних наборів системи «DELFIA» на багатофункціональному аналізаторі «1420 Victor 2» фірми «Perken Elmer» (США) та програми «WIACALC» для інтерпретації результатів і кількісного визначення гормонів у сироватці крові.
Імунологічні дослідження
Наявність антитіл до ХГЛ в сироватці крові визначали на 6–8-му тижні вагітності методом імуноферментного аналізу з використанням високоочищеного препарату ХГЛ, який сорбували на планшети high-binding фірми «Granier» на імуноферментному аналізаторі «Multiscan» фірми «LabSystem» (Фінляндія).
Вагітним після ЕКЗ імунограму виконували відповідно до запропонованого нами комплексу обстеження на 6–8-му тижні. Застосовували метод триколірної проточної цитометрії з використанням моноклональних антитіл на проточному цитофлуориметрі «FACScan» фірми «Becton-Dickinson» (США) з використанням програмного забезпечення FACScan Research Software («Becton-Dickinson», США).
Оцінювали характеристики таких показників імунограми: наявність і активність різних видів імунних клітин (CD — Cluster of Differentiation), їх абсолютну кількість і співвідношення різних субпопуляцій — лейкоцитів, циркулюючих моноцитів і гранулоцитів з маркерами активації, лімфоцитів (абсолютну і відносну кількість), Т-лімфоцитів (CD3+, CD5+), В-лімфоцитів (CD19+ CD5+), Т‑лімфоцитів-хелперів (CD3+ CD4+), Т-лімфоцитів-цитотоксичних супресорів (CD3+ CD8+) (цитотоксиків), імунорегуляторний індекс (immuno-regulative index/IRI, CD4+/CD8+), співвідношення продукції цитокінів лімфоцитами-хелперами — CxCR3+/CxCR4+ (Th1/Th2), природних кілерів (NK (Natural Killer)-клітин) — (CD3– CD56+), експресію KIR-рецепторів (CD3– CD56+158а+) та HLA-DR (CD3– CD56+ HLA-DR+), загальну активність NK-клітин, частку лізису й активність однієї NK-клітини, реакцію бласттрансформації лімфоцитів (РБТЛ), імпульси, співвідношення фракцій імуноглобулінів крові (IgG, IgM, IgA) тощо.
Наявність АФАТ визначали у вагітних одночасно з імунограмами на 6–8-му тижні вагітності. Антикардіоліпінові, антифосфатидилсеринові та антифосфатидилетаноламінові антитіла визначали прямим твердофазовим імуноферментним методом ELISA. Значення АФАТ в одиницях GPL (IgG phospholipid units) підраховували відповідно до стандартів Antiphospholipid Standardization Laboratory.
УЗД
Усім учасницям протягом вагітності проводили УЗД. Через 2 тиж після біохімічного встановлення вагітності (4 тиж після запліднення — вагітність 6 тиж) підтверджували наявність маткової вагітності, оцінювали розташування плідного яйця, його відповідність терміну вагітності, наявність ембріона, його куприково-тім’яний розмір (КТР), наявність серцебиття, частоту серцевих скорочень, характеристики жовткового мішка, наявність змін хоріона, стан міометрію, внутрішнього зіву, довжину шийки матки. УЗД виконувались жінкам в горизонтальному положенні на спині за допомогою УЗ-приладу «ATL-15000» (фірми «ATL», Нідерланди) із застосуванням піхвового датчика на 5 МГц С5‑9 у І триместрі та УЗ-приладу «Sonoace-8000 EX» (фірми «Medison», США) із застосуванням піхвового датчика на 5 МГц VD5-8B у І триместрі.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Всіх вагітних основної групи, що мали початковий рівень ХГЛ в крові нижчий 100 МО/л (рис. 1), ми відносили до групи ризику невиношування вагітності, що потребують подальшого поглибленого обстеження і корекції. Ведення пацієнток групи порівняння незалежно від початкового рівня ХГЛ здійснювали за стандартною методикою. Таким чином, вже на етапі підтвердження факту настання вагітності ми визначили жінок, що потенційно входили до групи ризику подальших ускладнень, зокрема невиношування вагітності.
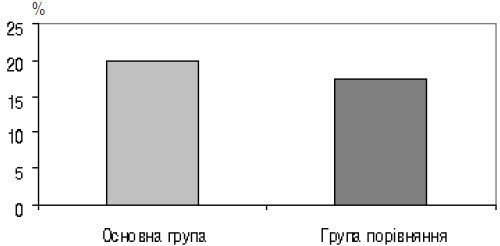
Рис. 1. Частка вагітних з початковим рівнем ХГЛ нижче 100 МО/л
Наступним етапом нашого комплексного обстеження було підтвердження маткової вагітності шляхом УЗД. При цьому ми виявили в основній групі у 13 (32,5%) пацієнток ознаки клінічної картини загрози невиношування вагітності, у 12 (30%) жінок — доклінічної картини загрози невиношування вагітності, що дало нам можливість віднести цих жінок до групи ризику невиношуванням, що потребувало відповідного втручання. У групі порівняння клінічна картина загрози переривання вагітності зафіксована у 19 (47,5%) жінок, в контрольній групі — у 4 (10%) (рис. 2). Доклінічну стадію загрози переривання вагітності в контрольній групі та групі порівняння ми не визначали, оскільки це не входило до комплексу нашого обстеження. Слід зазначити, що вже в цей термін в групі порівняння зафіксовано більшу кількість випадків клінічної картини загрози переривання вагітності, ніж в основній групі, що можна пояснити більш ретельним спостереженням жінок основної групи і корекцією вищезазначених показників в ранні терміни.
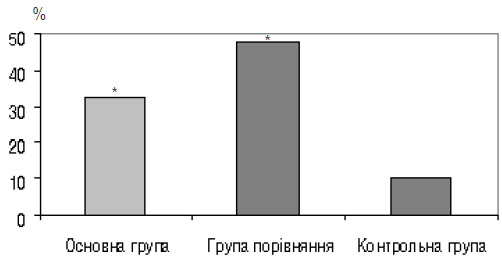
Рис. 2. Частка вагітних, у яких виявлено клінічну картину загрози переривання вагітності за даними УЗД (*p<0,05 порівняно з контролем)
Ми проаналізували особливості динаміки гормональних параметрів, що характеризують перебіг I триместру індукованої вагітності, а також спробували систематизувати ці дані для визначення групи ризику невиношування вагітності за змінами гормональних показників, що потребують відповідної своєчасної корекції.
Так, у 22 (55%) пацієнток основної групи і 24 (60%) жінок групи порівняння при первинному гормональному обстеженні на 4–6-му тижні виявлено достовірно знижені рівні Е2 та/або Р4 в крові (рис. 3), що характеризувало недостатність гравідарного жовтого тіла і плаценти, яка формується, внаслідок попередньої гіперестрогенної стимуляції в лікувальному циклі ЕКЗ. Частіше і більш виражено гормональні зрушення проявлялися у пацієнток групи порівняння.
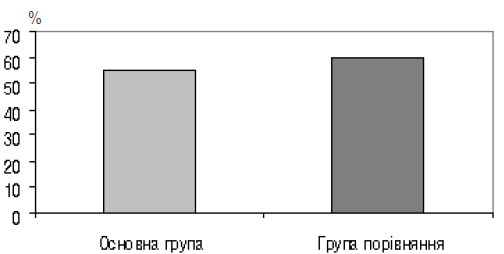
Рис 3. Частка пацієнток з гормональними зрушеннями
У разі виявлення недостатнього рівня статевих гормонів вагітних основної групи після ЕКЗ при первинному обстеженні ми відносили до групи ризику невиношування вагітності за гормональними параметрами і оцінювали їх стан як доклінічну стадію загрози переривання вагітності, що потребує негайної корекції зазначених показників і поглибленого визначення інших параметрів для попередження клінічних проявів загрози переривання вагітності. Вели ретельне спостереження за жінками з виявленими порушеннями і при перших ознаках загрози переривання вагітності проводили лікування за загальноприйнятою схемою.
Наступним етапом у комплексі досліджень було імунологічне. При загальному аналізі показників імунограм у 18 (45%) жінок основної групи і лише у 6 (15%) жінок контрольної групи ми виявили зміни імунітету (рис. 4), що характеризують неадекватну реакцію материнського організму на розвиток плода вже в ранні терміни вагітності і дають можливість виокремити цей контингент у групу ризику за імунологічними показниками (доклінічна стадія загрози переривання вагітності).
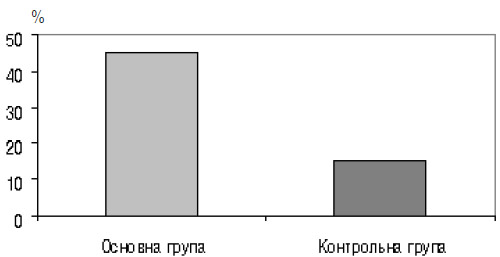
Рис. 4. Частка вагітних з імунологічними зрушеннями (p<0,05)
Слід зазначити, що особливості імунної відповіді у вагітних після ЕКЗ у вигляді неадекватної і/або запізнілої імуносупресії ми виявляли паралельно з клінічними проявами загрози переривання вагітності (більш виражені комплексні порушення). Часто такі зміни (менш виражені, у ранні терміни вагітності — 5–7 тиж) передували клінічній картині загрози переривання вагітності, що дало можливість виокремити групу ризику — 14 (35% жінок) — невиношування вагітності за імунологічними показниками, яка потребувала адекватного втручання. Картину імунологічних змін у виділеній групі ризику ми розглядали як доклінічну стадію загрози переривання вагітності, яка потребує негайного втручання для попередження клінічної картини загрози переривання вагітності, а також поглибленого комплексного визначення інших показників, що також можуть впливати на несприятливий прогноз невиношування вагітності.
Подальше обстеження в нашому комплексі для визначення ризику невиношування вагітності включало дослідження крові на наявність АФАТ і антитіл до ХГЛ. Антикардіоліпінові антитіла зафіксовано у 5 (12,5%) пацієнток основної групи, у 2 (5%) — контрольної групи, антифосфатидилсеринові — у 3 (7,5%) і 1 (2,5%) відповідно, анти-ДНК антитіла — тільки у 3 (7,5%) жінок основної групи, антинуклеарні — у 4 (10%) і 1 (2,5%) відповідно, антитіла до ХГЛ — у 8 (20%) жінок основної групи і лише у 2 (5%) — контрольної (рис. 5, 6). Дослідження зазначених показників в групі порівняння не проводили, оскільки стандартна методика не передбачає визначення або корекції доклінічної стадії загрози переривання вагітності. Наявність АФАТ і/або антитіл до ХГЛ разом з іншими лабораторними змінами, зокрема з показниками імунограм і гормональних досліджень, ми розцінювали як доклінічну стадію загрози переривання вагітності.
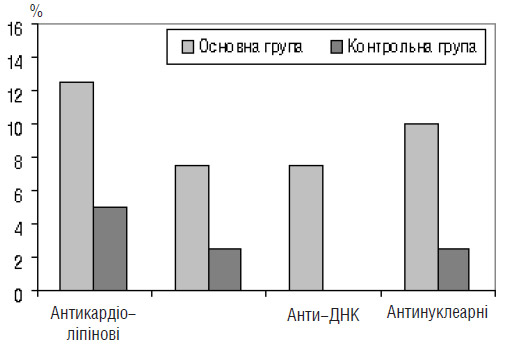
Рис. 5. Частка вагітних, у яких виявлено АФАТ
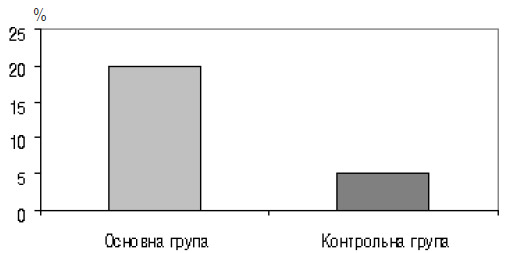
Рис. 6. Частка вагітних, у яких виявлено антитіла до ХГЛ (p<0,05)
У групі порівняння відзначали гірші показники, оскільки за стандартною методикою корекцію проводили лише у разі наявності клінічної картини загрози переривання вагітності, частота якої була достовірно вищою.
Під час проведення нашого дослідження ми запропонували індивідуалізоване комплексне обстеження вагітних після ЕКЗ з метою визначення групи ризику невиношування вагітності вже в доклінічну стадію загрози переривання і своєчасне втручання з приводу виявлених порушень.
При порівнянні отриманих результатів виявили, що в основній групі до кінця І триместру 32 (80%) жінки були віднесені нами до групи ризику невиношування вагітності за різними показниками. При наявності відхилень за одним показником ми оцінювали ризик загрози переривання вагітності як незначний, двома — як середній, трьома і більше — як високий. Зрушення трьома і більше показниками відзначено у 10 (25%) жінок основної групи, двома показниками — у 14 (35%), одним — у 8 (20%).
Таким чином, за допомогою запропонованого нами комплексу обстеження вагітних після ЕКЗ в І триместрі вже з ранніх термінів вагітності вдалося виділити групу ризику невиношування і прогнозувати можливість загрози переривання вагітності. За визначенням відхилень гормональних, імунологічних, біофізичних і біохімічних параметрів ми констатували наявність доклінічної стадії загрози переривання вагітності, що потребувало негайного втручання для попередження розвитку клінічної картини загрози переривання вагітності й інших ускладнень.
Групу ризику визначали за параметрами: низький початковий рівень ХГЛ, Е2, Р4, Mg2+ в крові й невідповідність його терміну вагітності, наявність антитіл до ХГЛ, АФАТ, порушення в імунограмі, гемостазіограмі і при УЗД. Для корекції відповідних показників ми використовували препарати прогестерону (масляний розчин в комбінації з мікронізованим прогестероном (Утрожестан, «Lab. Besins International», Франція) і похідні прогестерону — дидрогестерон (Дуфастон, «Solvay Pharmaceuticals», Нідерланди), ХГЛ (Профазі, «Serono International», Швейцарія) в індивідуальних дозах строго під контролем гормонів крові 1 раз на тиждень; препарати магнію у формі таблеток (Магне-В6, «Sanofi Winthrop Industrie», Франція) під контролем рівня Mg2+ 1 раз на 2 тиж і біофізичних параметрів при УЗД; нестероїдні протизапальні препарати — ацетилсаліцилову кислоту (Аспірин, «Bayer», Німеччина), кортикостероїди — метилпреднізолон (Метипред, «Orion Pharma», Фінляндія), антикоагулянти — надропарин кальцій (Фраксипарин, «Sanofi Winthrop Industrie», Франція), імуноглобулін людський в індивідуально підібраних дозах під контролем показників імунограми, гемостазіограми, титрів антитіл до ХГЛ і АФАТ 1 раз на 2 тижні.
Ми розробили алгоритм-схему для запобігання ризику невиношування вагітності за зазначеними показниками, попередження розвитку можливих ускладнень і корекції виявлених порушень вже в доклінічну стадію загрози переривання вагітності.
Для корекції рівня гормонів використовували:
— препарати прогестерону — прогестерон (масляний розчин 2,5% — 1,0–2,0 мл внутрішньом’язово вранці у поєднанні з мікронізованим прогестероном (Утрожестаном) — від 3 до 6 капсул (1 капсула — 100 мг) на добу або з дидрогестероном (Дуфастоном) — 4–6 таблеток на добу (1 таблетка — 10 мг) перорально під контролем рівня прогестерону в крові 1 раз на тиждень відповідно до терміну вагітності;
— препарати ХГЛ (Профазі) 5000 МО 1–2 рази на тиждень під контролем рівня статевих гормонів у крові 1 раз на тиждень відповідно до терміну вагітності;
— для зниження тонусу міометрію, рівня психоемоційного напруження і покращання роботи кальцій-магнієвого насоса в міоцитах матки використовували препарати магнію у формі таблеток в індивідуально підібраних дозах (Магне-В6): 1-ша, 2‑га доба — 2 таблетки 4 рази на добу перорально, з 3-ї доби — по 2 таблетки 3 рази на добу перорально; курс 10–14–28 днів під контролем рівня магнію в крові, нормалізації стану міометрію та покращання психоемоційного стану;
— у разі наявності зрушень в імунограмах, зокрема при переважанні Th1-імунної відповіді, для підвищення активності PIBF (progesterone induced blocking factor) і сприяння фізіологічного зрушення у бік Th2 — препарати прогестерону у зазначених вище дозах під контролем показників імунограми 1 раз на 2 тиж;
— у разі наявності антитіл до ХГ, АФАТ, порушення співвідношень показників імунограми (Т-хелперів, Т-супресорів, Th1/Th2, циркулюючих імунних комплексів, рівнів імуноглобулінів) залежно від вираженості процесу використовували:
• нестероїдні протизапальні засоби — ацетилсаліцилову кислоту (Аспірин) — 100 мг на добу перорально;
• кортикостероїди — метилпреднізолон (Метипред) — від 4 до 12 мг на добу перорально, розділених на прийоми;
• надропарин кальцій (Фраксипарин) — по 0,3 мл в/м 1 раз на 2–3–4 доби під контролем показників згортання крові;
• імуноглобулін людський — 25 мл в/в крапельно при масі тіла жінки до 80 кг та 50 мл в/в крапельно — при масі тіла понад 80 кг.
Всі препарати призначали в індивідуальних дозах в комплексі чи окремо, під контролем показників 1 раз на 1–2 тиж до зниження титрів відповідних антитіл чи нормалізації зазначених співвідношень.
У групі порівняння ведення вагітних здійснювали за стандартною методикою з підтримкою лютеїнової фази лікувального циклу ЕКЗ і ранніх термінів вагітності масляним розчином прогестерону та/або мікронізованим прогестероном до 300 мг на добу.
За наявності клінічної картини загрози переривання вагітності у І триместрі використовували спазмолітичні засоби (папаверин, дротаверин) — в/м чи супозиторії ректально, гемостатики (етамзилат) — в/м; у ІІ–ІІІ триместрі — токолітики (магнію сульфат) в/в, з подальшим переходом на таблетовані форми (Магне-В6), симпатоміметики (гексопреналін) — перорально чи в/в крапельно.
В результаті проведеного нами обстеження і своєчасної корекції показників клінічну картину загрози переривання вагітності протягом періоду гестації відзначено лише у 14 (35%) пацієнток, тоді як у групі порівняння — у 34 (85%) жінок (що можна пояснити недостатністю стандартного обстеження і методики ведення за традиційною схемою для попередження можливих ускладнень), а в контрольній групі — у 8 (20%) жінок (таблиця).
Про ефективність запропонованої нами схеми свідчить також нижча частота загрози передчасних пологів в основній групі (27,5%) на відміну від такої у групі порівняння (52,5%). Крім того, в основній групі вдалося знизити загальну частоту ускладнень вагітності (89 випадків) порівняно з такою у групі порівняння (166) саме завдяки проведенню запропонованого нами комплексу обстежень і корекції доклінічних змін. Щодо аналізу частоти ускладнень за нозологічними одиницями, то в основній групі вона була достовірно нижчою, ніж у групі порівняння, а прояви окремих порушень в основній групі були значно менше виражені, ніж у групі порівняння.
ВИСНОВКИ
Перебіг вагітності, яка настала в результаті лікування безпліддя за допомогою ЕКЗ, має істотні відмінності від такого при фізіологічному настанні вагітності. У зв’язку з методичними і медикаментозними особливостями проведення циклів ЕКЗ жінки, що їх пройшли, становлять групу високого ризику невиношування вагітності, виникнення різних ускладнень вагітності й пологів.
Стимуляція суперовуляції в рамках програми ЕКЗ з використанням масивної гормонотерапії на фоні несприятливого акушерсько-гінекологічного анамнезу призводить до активації/змін в імунній, нейроендокринній, гемокоагуляційній системах, що є пусковим механізмом несприятливого перебігу індукованої вагітності, розвитку ускладнень, насамперед — загрози переривання вагітності.
Нами розроблено алгоритм комплексного обстеження вагітних у ранні терміни вагітності після ЕКЗ, за результатами якого можна виділити групу ризику невиношування вагітності після ЕКЗ, а також здійснювати корекцію виявлених порушень у доклінічну стадію загрози переривання вагітності.
1. Аналіз крові на ХГЛ через 16 днів після запліднення: при рівні ХГЛ від 5 до 100 МО/л — повторний аналіз крові на ХГЛ через 3 доби.
2. УЗД через 2 тиж після позитивного тесту на ХГЛ (4 тиж після запліднення).
3. Аналіз крові на Е2 і Р4 в день проведення УЗД (термін вагітності — 6 тиж).
4. Імунологічні дослідження крові (розгорнута імунограма) в день проведення УЗД (термін вагітності — 6 тиж).
5. Дослідження крові на наявність антитіл до ХГЛ, АФАТ в день проведення УЗД (термін вагітності — 6 тиж).
Таким чином, чітко обгрунтований алгоритм комплексного обстеження, необхідного для спостереження за перебігом вагітності у жінок після ЕКЗ, дає можливість визначити групу ризику невиношування вагітності та своєчасно коригувати показники в доклінічну стадію загрози переривання вагітності для попередження можливих ускладнень, зокрема невиношування вагітності.
ЛІТЕРАТУРА
-
- Аржанова О.Н., Корсак В.С., Орлова О.О., Пайкачева Ю.М. (1999) Течение и исход беременности у женщин с бесплодием в анамнезе. Пробл. репродукции, 3: 54–58.
- Грищенко В.И., Щербина Н.А. (1997) Этиологические и патогенетические аспекты невынашивания беременности. Междунар. мед. журн., 4: 17–20.
- Кирющенков П.А. (2003) Особенности ведения женщин с аутосенсибилизацией к хорионическому гонадотропину человека. Гинекология, 5: 222–224.
- Кирющенков П.А., Сухих Г.Т., Ванько Л.В., Поноварева И.В. (1996) Клинико-иммунологическое значение аутоантител к хорионическому гонадотропину при невынашивании. Акуш. и гин., 4: 14–16.
- Клюквина Н.Г. (2002) Антифосфолипидный синдром: клинические аспекты. Рус. мед. журн., 22: 992–996.
- Коломнина Е.А. (2002) Особенности течения беременности после экстракорпорального оплодотворения. Вопр. гинекологии, акушерства и перинатологии, 1: 8–11.
- Коханевич Є.В. (уклад.) та співавт. (2001) Сучасна профілактика, діагностика та лікування невиношування вагітності (Метод. рекомендації). Київська медична академія післядипломної освіти ім. П.Л. Шупика МОЗ України, Київ, 22 с.
- Кузьмичев Л.Н., Кулаков В.И., Леонов Б.В. (2001) Экстракорпоральное оплодотворение, отбор, подготовка и тактика ведения больных. Мир, Москва, 165 с.
- Кулаков В.И., Леонов Б.В. (ред.) (2000) Экстракорпоральное оплодотворение и его новые направления в лечении женского и мужского бесплодия: теоретические и практические подходы. Руководство. Медицинское информационное агентство, Москва, 782 с.
- Лысая Т.Н., Назаренко Т.А., Дуринян Э.Р., Кочиева М.Л. (2002) Анализ течения I триместра индуцированных беременностей. Проблемы репродукции, 3: 92–94.
- Писарева С.П. (1996) Диагностика и лечение невынашивания беременности. Журн. практического врача, 3: 19–24.
- Писарева С.П. (2001) Новые аспекты диагностики и терапии при невынашивании беременности. Doctor, 3(7): 20–22.
- Сидельникова В.М., Леонов Б.В., Ходжаева З.С., Стрельченко М.Б. (2000) Особенности гестационного процесса после ЭКО+ПЕ. Пробл. беременности, 2: 26–27.
- Тишкевич О.Л., Жуковская С.В., Шелег С.Б., Илькевич Н.Е., Малышева Е.В., Семенов А.В., Каменецкая Ю.К., Игнатьева Т.В. (1998) Невынашивание беременности после ЭКО И ЭКО/ИКСИ. Пробл. репродукции, 6: 34–36.
- Чечнева М.А., Логутова Л.С., Левашова И.И. (1998) Особенности течения индуцированной беременности и родоразрешения женщин с бесплодием в анамнезе. Вестн. Рос. ассоциации акушеров-гинекологов, 3: 5–8.
- Alam V., Altieri E., Zegers-Hochschild F. (1999) Preliminary results on the role of embryonic human chorionic gonadotrophin in corpus luteum rescue during early pregnancy and the relationship to abortion and ectopic pregnancy. Hum. Reprod., 14(9): 2375–2378.
- Choong S., Rombauts L., Ugoni A., Meagher S. (2003) Ultrasound prediction of risk of spontaneous miscarriage in live embryos from assisted conceptions. Ultrasound Obstet. Gynecol., 22(6): 571–577.
- Goldfarb J.M., Austin C., Lisbona H., Peskin B., Clapp M. (1996) Cost-effectiveness of in vitro fertilization. Obstet. Gynecol. 87(1): 18–21.
- Hardy K., Wright C., Rice S., Tachataki M., Roberts R., Morgan D., Spanos S., Taylor D. (2002) Future developments in assisted reproduction in humans. Reproduction, 123(2): 171–183.
- Kutteh W.H., Yetman D.L., Chantilis S.J., Crain J. (1997) Effect of antiphospholipid antibodies in women undergoing in vitro fertilization: role of heparin and aspirin. Hum. Reprod., 12(6): 1171–1175.
- Lancaster P.A. (1996) Registers of in vitro fertilization and assisted conception. Hum. Reprod., 11 (Suppl. 4): 89–104.
- Steck T. (2001) Immunotherapy for prevention of abortion and for improving implantation in extracorporeal fertilization. Zentralbl. Gynakol., 123(6): 357–360.
КОМПЛЕКСНАЯ ДИАГНОСТИКА РИСКА И ПРЕДУПРЕЖДЕНИЕ УГРОЗЫ ПРЕРЫВАНИЯ БЕРЕМЕННОСТИ У ЖЕНЩИН ПОСЛЕ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ
Резюме. Статья посвящена проблеме невынашивания беременности после экстракорпорального оплодотворения (ЭКО). Цель исследования — разработка комплексного обследования в ранние сроки беременности после ЭКО для предупреждения развития осложнений и коррекции обнаруженных нарушений. После комплексного обследования 80 женщин после ЭКО было своевременно предупреждено угрозу прерывания беременности в ранние сроки. Изложены преимущества клинического применения предложенного комплексного алгоритма диагностики риска и предупреждения угрозы прерывания беременности у женщин после ЭКО.
Ключевые слова: невынашивание беременности, экстракорпоральное оплодотворение, диагностика, лечение
Summary. Article dedicated to the problem on miscarriage after in vitro fertilization (IVF). The aim of the study was to develop a complex of investigations in early pregnancy after IVF with the purpose to prevent the development of complications and to correct the revealed disorders. Based on the results of the complex examination of 80 women after IVF, an appropriate correction of threatening miscarriage was performed in early pregnancy. The advantages are stated on the clinical application of the offered complex algorithm of diagnostics of a risk and prevention of the threatening miscarriage in women after IVF.
Key words: miscarriage, in vitro fertilization, diagnostics, treatment





