ВСТУП
Незважаючи на численні дослідження проблем судинних захворювань нервової системи, особливо інсультів, багато їх аспектів залишаються недостатньо вивченими. До них належать метаболічні фактори ризику — рівень загального холестерину (ЗХС), холестерину ліпопротеїнів високої (ХС ЛПВЩ) та низької (ЛПНЩ) щільності, тригліцеридів (ТГ), забезпеченість вітамінами групи В, вміст С-реактивного білка (СРБ) та інтерлейкінів (ІЛ) (Волошин П.В., Тайцлин В.И., 1991; Віничук С.М., 1996; Boden W.E., 2000; Goldstein L.B., 2000; Мищенко Т.С., 2001; 2003; Передерий В.Г. и соавт., 2001; Leys D. et al., 2002; VITATOPS Trial Study Group, 2002; Czeizel E., Kalina A., 2003; Lindsberg P.J., Grau A.J., 2003; Яворская В.А. и соавт., 2004; Lentz S.R., Haynes W.G., 2004).
Так, у багатьох дослідженнях визначено тісний зв’язок між високим рівнем ХС ЛПНЩ та, навіть більшою мірою, між низьким рівнем ХС ЛПВЩ — з одного боку, і зростанням ризику церебрального інфаркту — з іншого (Tanne D. et al., 1997; Sacco R.L. et al., 2001; Denti L. et al., 2003; Soyama Y. et al., 2003). Встановлено, що предиктором ішемічного інсульту є гіпертригліцеридемія (Laloux P. et al., 2004). Досліджено роль маркерів запалення (СРБ) та вмісту запальних цитокінів (фактора некрозу пухлини (ФНП)-альфа, ІЛ-1, ІЛ-6) в розвитку ішемічного інсульту (Lindsberg P.J., Grau A.J., 2003).
На сьогодні з метаболічних факторів ризику цереброваскулярних захворювань найменш вивченою є гіпергомоцистеїнемія (ГГЦ), хоча раніше було встановлено, що підвищення вмісту гомоцистеїну (ГЦ) у сироватці крові пов’язано зі зростанням ризику серцево-судинної патології (Reis R.P. et al., 1996; den Heijer M. et al., 1998; Yang F. et al., 2005).
Мета нашого дослідження — вивчити роль метаболічних факторів ризику у хворих з ішемічним інсультом з відсутністю або наявністю в анамнезі транзиторних ішемічних атак (ТІА) чи інсульту.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Під нашим спостереженням перебували 153 (чоловіків — 70 (45,8%), жінок — 83 (54,2%); вік хворих — від 36 до 54 років) хворих з ішемічним інсультом: первинним (n=88), повторним (n=24), а також з наявністю в анамнезі ТІА (n=41). При розподілі хворих за віком і статтю в цих групах не виявлено статистично значущих відмінностей.
Всім хворим було проведено всебічне загальносоматичне, неврологічне, клініко-інструментальне, офтальмологічне та лабораторне дослідження (загальний аналіз крові, загальний аналіз сечі, коагулограма, сечовина та креатинін, гематокрит, електроліти сироватки крові, цукор крові, ліпідний спектр крові, ГЦ, СРБ та ІЛ-6). Для візуалізації уражень судин використовували комп’ютерну томографію, магнітно-резонансну томографію, транскраніальну ультразвукову допплєрографію. Діагноз встановлювали за класифікацією судинних захворювань головного мозку, адаптованою до сучасної МКХ-10 (Одинак М.М. и соавт., 1997).
Вміст ЗХС, ХС ЛПВЩ, ХС ЛПНЩ та ТГ в сироватці крові визначали за уніфікованими методами (Меньшиков В.В., 1987).
Вміст ГЦ визначали за методом високоефективної рідинної хроматографії на апараті «Hewlett Packard» (США) після відновлення дисульфідів ГЦ трибутилфосфіном та подальшою їх дериватизацією з парахлормеркурібензоатом (Ільченко О.В. та співавт., 2002).
Забезпеченість вітаміном В12 (ціанокобаламіном) оцінювали за рівнем екскреції метилмалонової кислоти (ММК), яку визначали в сечі шляхом діазотування з пара-нітроаніліном (Снегирева Л.В., Арешкина Л.Я., 1972; Спиричев В.Б., 1984; Ільченко О.В. та співавт., 2002).
Забезпеченість вітаміном В6 (піридоксином) визначали за активністю аспартатамінотрансферази (АсАТ) еритроцитів (піридоксинзалежний фермент) та підвищенням його активності при додаванні піридоксальфосфату (ПАЛФ), тобто ПАЛФ-ефектом (Ільченко О.В. та співавт., 2002).
Забезпеченість вітаміном В2 (рибофлавіном) визначали за активністю глутатіонредуктази еритроцитів та підвищенням його активності при додаванні коферменту флавінаденіндинуклеотиду (ФАД), тобто ФАД-ефектом (Спиричев В.Б., 1984; Ільченко О.В. та співавт., 2002).
Вміст СРБ та ІЛ-6 у крові визначали за імуноферментним методом з використанням стандартних наборів «Diagnostic Automation Inc.» (США) та «Diaclone» (Франція).
Статистичний аналіз результатів проводили за допомогою стандартних методів варіаційного аналізу із застосуванням пакета прикладних програм Statistica 6.0 for Windows 98. Для оцінки статистичної значущості різниці показників між групами застосовували параметричний критерій Стьюдента, при порівнянні частот — критерій Фішера.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
За результатами наших досліджень, вміст ЗХС у хворих з первинним інсультом становив 5,93± 0,11 ммоль/л, що можна пояснювати превалюванням осіб з нормальним та субнормальним рівнем цього показника (60%) над особами з гіперхолестеринемією (40%). У групах пацієнтів з повторним інсультом і у хворих, які в анамнезі мали ТІА, більшість становили особи з гіперхолестеринемією. Так, у 68% хворих з ТІА та у 75% хворих з повторним інсультом рівень ЗХС перевищував 6,3 ммоль/л. Середній рівень ЗХС в цих групах статистично значущо перевищувався відповідно на 11,5 та 17,8% порівняно з таким у хворих із первинним інсультом. Однак ранжування за рівнем ЗХС не виявило статистично значущих відмінностей між хворими з ТІА та хворими з повторним інсультом.
Встановлено, що у хворих з інсультом ТІА повторювалися на фоні поглибленого дефіциту ЛПВЩ. Так, у хворих з ТІА вміст ХС ЛПВЩ був нижчим на 18,2%, а у хворих з повторним інсультом — на 15,7%, ніж у хворих з первинним інсультом. Крім того, кількість осіб з нормальним вмістом ЛПВЩ серед хворих з первинним інсультом була в 2 рази більшою, ніж серед хворих з ТІА, та в 4 рази більшою, ніж серед хворих з повторним інсультом. У пацієнтів з повторним інсультом статистично значущо переважав субнормальний та низький рівень ЛПВЩ порівняно з групою хворих із первинним інсультом. Однак ми не виявили статистично значущих відмінностей за цим показником (як за абсолютним числом, так і за розподілом пацієнтів залежно від рангу змін ЛПВЩ) залежно від того, чи були ТІА в анамнезі зворотними, чи призвели до інфаркту мозку.
За результатами наших досліджень повторний інсульт виникав на фоні значно підвищеного рівня ЛПНЩ. У 36% хворих з первинним інсультом реєстрували нормальний рівень ЛПНЩ, у 64% — субнормальний та підвищений. Водночас цей показник у нормі зафіксовано лише у 7% хворих з ТІА в анамнезі та у 4% — з повторним інсультом, а частка осіб лише з високим рівнем ЛПНЩ збільшувалася до 76 та 79%. В середньому рівень ХС ЛПНЩ у хворих з ТІА в анамнезі та у хворих з повторним інсультом зростав відповідно на 17,6 та 23,5% порівняно з таким у хворих з первинним інсультом. Зауважимо, що за цим показником нами не виявлено статистично значущої різниці між хворими з ТІА в анамнезі та хворими з повторним інсультом ні за середніми величинами, ні при ранжуванні.
Проводили порівняльну оцінку вмісту ТГ у хворих з первинним та повторним інсультом чи ТІА в анамнезі. Так, у хворих з первинним інсультом нормальні та субнормальні рівні ТГ виявляли у 83% осіб, помірну гіпертригліцеридемію — у 17%, тяжкої гіпертригліцеридемії не виявлено в жодного хворого. Порівняно з цією групою у хворих з ТІА кількість осіб з нормотригліцеридемією дещо зменшувалась, а кількість осіб з гіпертригліцеридемією зростала, що зумовило незначне підвищення середнього рівня ТГ (на 12,2%). Однак виявлені зміни не сягали межі статистичної значущості. У хворих з повторним інсультом середній рівень ТГ статистично значущо перевищував такий у хворих з первинним інсультом на 30,4%. Нормальний рівень ТГ виявлено всього у 25% осіб, а гіпертригліцеридемію — у 37%. У хворих з повторним інсультом рівень ТГ був вищим, ніж у хворих з ТІА, а частка осіб з нормальним та субнормальним рівнем цього показника дещо менша, хоча виявлені відмінності не були статистично значущими.
Ми провели порівняльне дослідження вмісту ГЦ у хворих з первинним інсультом та у хворих зі зворотними та незворотними ТІА в анамнезі (табл. 1). Встановлено, що у хворих з первинним інсультом порушення обміну ГЦ були менш вираженими, ніж у хворих з повторними судинними катастрофами. Так, рівень ГЦ у хворих з первинним інсультом в середньому становив 14,7±0,51 мкмоль/л, що на 15% менше, ніж у хворих з ТІА, і на 45% менше, ніж у хворих з повторним інсультом. Частка осіб з нормальним рівнем ГЦ серед хворих з первинним інсультом становила 25%, а серед хворих з ТІА — лише 7%. Проте кількість осіб з ГГЦ серед хворих з ТІА була в 1,5 разу більшою, ніж серед хворих з первинним інсультом (64% порівняно з 42%). Серед хворих з повторним інсультом не виявлено жодної особи з нормальним і навіть «високим нормальним» рівнем ГЦ, в той час як легка ГГЦ виявлена у 71% хворих, а середня і тяжка ГГЦ — у 29%. Зауважимо, що порушення обміну ГЦ у хворих з повторним інсультом були більш глибокими, ніж у хворих з ТІА в анамнезі. Зокрема середній рівень ГЦ в останніх був статистично значущо нижчим (на 26%), ніж у хворих із повторним інсультом, що може пояснюватись істотно меншою (в 1,6 раза) кількістю осіб з ГГЦ.
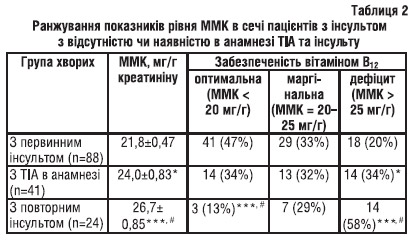
За результатами дослідження забезпеченості вітаміном В12 пацієнтів з ішемічним інсультом (табл. 2) виявлено, що у хворих з ТІА в анамнезі та у хворих з повторним інсультом статистично значущо зростає рівень екскреції ММК (на 10,1 та 22,4% відповідно) порівняно з таким у хворих з первинним інсультом. Виявилось, що оптимальну забезпеченість вітаміном В12 реєстрували у 47% осіб з первинним інсультом, у 34% — з ТІА в анамнезі і лише у 13% осіб з повторним інсультом. Частка осіб з дефіцитом вітаміну В12 серед пацієнтів з повторним інсультом становила 58%, тобто була статистично значущо більшою, ніж у групах хворих з ТІА в анамнезі та первинним інсультом в 1,7 та 2,9 раза відповідно. Крім того, у хворих з повторним інсультом середній рівень екскреції ММК статистично значущо перевищував (на 11,3%) такий у хворих з ТІА в анамнезі.
Порівняльна оцінка статусу забезпеченості вітаміном В6 засвідчила, що у хворих з ТІА та повторним інсультом знижувалася активність АсАТ еритроцитів (на 3,4 та 5,5% відповідно) і підвищувався ПАЛФ-ефект (на 4,6 та 15,9% відповідно) порівняно з хворими з первинним інсультом. На основі ранжування за ПАЛФ-ефектом встановлено, що частка осіб з оптимальною забезпеченістю вітаміном В6 серед хворих з первинним інсультом була значущо більшою (в 1,6 та 8,8 раза відповідно), ніж серед пацієнтів з ТІА в анамнезі і, особливо, з повторним інсультом. У більшості хворих з повторним інсультом виявлено дефіцит вітаміну В6 (63%), як і у пацієнтів з ТІА в анамнезі (51%), а от за кількістю осіб з оптимальною забезпеченістю вітаміном В6 ці групи істотно відрізнялись: серед хворих з повторним інсультом їх було менше в 5,5 раза. Частка осіб з маргінальною забезпеченістю піридоксином в усіх вищеназваних групах була майже однаковою.
Забезпеченість вітаміном В2 у хворих з первинним інсультом і у хворих з ТІА в анамнезі була кращою, ніж у хворих з повторним інсультом. Так, нами не виявлено статистично значущої різниці між показниками середньої активності глутатіонредуктази еритроцитів та вираженістю ФАД-ефекту хворих перших двох груп, а також за розподілом хворих за вітамінним статусом. Однак у пацієнтів з повторним інсультом активність глутатіонредуктази еритроцитів була статистично значущо нижчою (на 5,9%), а ФАД-ефект — більшим (на 18–20%), ніж у хворих з первинним інсультом з ТІА в анамнезі. Дефіцит вітаміну В2 виявляли у 71% пацієнтів з повторним інсультом, тобто у 2 рази частіше, ніж серед хворих з первинним інсультом або ТІА в анамнезі. У цій групі також статистично значущо зменшувалась частка осіб з оптимальною і навіть маргінальною забезпеченістю вітаміном В2.
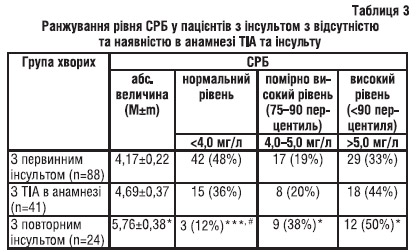
У результаті порівняльної оцінки наявності маркерів запального процесу встановлено майже у 50% хворих з первинним інсультом нормальний рівень СРБ (табл. 3), тоді як серед хворих з ТІА в анамнезі частка таких осіб зменшується до 36%, а серед хворих з повторним інсультом — навіть до 12% (в 4 рази менше порівняно з першою групою). Отже, серед хворих з повторним інсультом превалюють пацієнти з високим (50%) або з «високим нормальним» (38%) рівнем СРБ, що зумовлює підвищення цього показника в середньому по групі на 38,1% порівняно з таким у хворих з первинним інсультом.
Аналогічну картину відзначали і щодо рівня ІЛ-6 у хворих з інсультом з відсутністю або наявністю ТІА в анамнезі. Нормальний рівень ІЛ-6 реєстрували у 40% хворих з первинним інсультом і лише у 17% — з повторним інсультом. Істотне переважання серед хворих з повторним інсультом осіб з високим рівнем ІЛ-6 (63%) зумовило статистично значуще підвищення цього показника на 30,3% порівняно з таким у хворих з первинним інсультом. Серед хворих із ТІА в анамнезі частка осіб з високим рівнем ІЛ-6 також була дещо більшою, ніж серед хворих з первинним інсультом, але виявлені зміни не були статистично значущими.
ВИСНОВКИ
Результати проведених досліджень свідчать, що у хворих з первинним інсультом ліпідний обмін порушується меншою мірою, ніж у пацієнтів з інсультом та ТІА в анамнезі. Це підтверджується більшою часткою пацієнтів з нормальним рівнем ЗХС, ЛПВЩ, ЛПНЩ та ТГ в зазначеній групі. Ішемічний інсульт частіше розвивається повторно у пацієнтів з гіперхолестеринемією, гіпертригліцеридемією, істотним зростанням вмісту ЛПНЩ та зниженням вмісту ЛПВЩ.
У хворих з повторним інсультом відзначено істотне порушення обміну ГЦ та погіршення забезпеченості вітамінами В12, В6, В2, які беруть участь у цьому процесі. Це підтверджується більшою часткою осіб з ГГЦ та дефіцитом вітамінів В12, В6, В2 серед пацієнтів з повторним інсультом порівняно з такою у пацієнтів з первинним інсультом або з інсультом та ТІА в анамнезі. У хворих з інсультом та ТІА в анамнезі вираженість порушення обміну ГЦ та названих вітамінів (за винятком рибофлавіну) також є більшою, ніж у хворих з необтяженим анамнезом, що свідчить про поглиблення метаболічних уражень і є передумовою судинної катастрофи.
Високий рівень СРБ та ІЛ-6 є незаперечним фактором ризику церебральних судинних катастроф, що підтверджується домінуючою кількістю саме таких хворих з повторним інсультом, і меншою мірою — з ТІА в анамнезі.
ЛІТЕРАТУРА
- Віничук С.М. (1996) Судинні захворювання головного та спинного мозку. Наука, Київ, 112 с.
- Волошин П.В., Тайцлин В.И. (1991) Лечение сосудистых заболеваний головного и спинного мозга. Здоров’я, Київ, 406 с.
- Ільченко О.В., Пентюк О.О., Розгонюк В.Л. та ін. (2002) Спосіб визначення концентрації тіолів в біологічній рідині. Деклараційний патент на винахід № 47645 А. 7.А61В5/145, Україна.
- Меньшиков В.В. (ред.) (1987) Лабораторные методы исследования в клинике. Справочник. Медицина, Москва, 368 с.
- Мищенко Т.С. (2001) Вторичная профилактика ишемического мозгового инсульта. Укр. мед. часопис, 5(25): 9–18.
- Мищенко Т.С. (2003) Вторичная профилактика мозгового инсульта: Метод. рекомендации. Харьков, 20 с.
- Одинак М.М., Михайленко А.А., Иванов Ю.С., Семин Г.Ф. (1997) Сосудистые заболевания головного мозга. Гиппократ, Санкт-Петербург, 156 с.
- Передерий В.Г., Швец Н.И., Безюк Н.Н. (2001) Первичная профилактика ишемического инсульта. Современные подходы к профилактике первого инсульта. Укр. мед. часопис, 2(22): 5–15.
- Снегирева Л.В., Арешкина Л.Я. (1972) Метод определения метилмалоновой кислоты. Прикладная биохимия и микробиология, 8(3): 363–366.
- Спиричев В.Б. (ред.) (1984) Методы оценки и контроля витаминной обеспеченности населения. Наука, Москва, 170 с.
- Яворская В.А., Фломин Ю.В., Дьолог Н.В., Гребенюк А.В. (2004) Профилактика инсульта с позиций доказательной медицины: АВС. Укр. мед. часопис, 4(42): 49–59.
- Boden W.E. (2000) High-density lipoprotein cholesterol as an independent risk factor in cardiovascular disease: assessing the data from Framingham to the Veterans Affairs High-Density Lipoprotein Intervention Trial. Am. J. Cardiol., 86(12A): 19L–22L.
- Czeizel E., Kalina A. (2003) Public health control of hyperhomocysteinemia and its consequences. Orv. Hetil., 144(40): 1981–1989.
- Denti L., Cecchetti A., Annoni V., Merli M.F., Ablondi F., Valenti G. (2003) The role of lipid profile in determining the risk of ischemic stroke in the elderly: a case-control study. Arch. Gerontol. Geriatr., 37(1): 51–62.
- Goldstein L.B. (2000) Novel risk factors for stroke: homocysteine, inflammation, and infection. Curr. Atheroscler. Rep., 2(2): 110–1104.
- den Heijer M., Rosendaal F.R., Blom H.J., Gerrits W.B., Bos G.M. (1998) Hyperhomocysteinemia and venous thrombosis: a meta-analysis. Thromb. Haemost., 80(6): 874–877.
- Laloux P., Galanti L., Jamart J. (2004) Lipids in ischemic stroke subtypes. Acta Neurol. Belg., 104(1): 13–19.
- Lentz S.R., Haynes W.G. (2004) Homocysteine: is it a clinically important cardiovascular risk factor? Cleve Clin. J. Med., 71(9): 729–734.
- Leys D., Deplanque D., Lucas C., Bordet R. (2002) Hypolipemic agents for stroke prevention. Clin. Exp. Hypertens., 24(7–8): 573–594.
- Lindsberg P.J., Grau A.J. (2003) Inflammation and infections as risk factors for ischemic stroke. Stroke, 34(10): 2518–2532.
- Reis R.P., Azinheira J., Reis H.P., Pereira M., Baptista A., Crepo M., Pina J.E., Ferreira N.C., Luis A.S. (1996) Homocysteinemia as a risk factor for cerebrovascular disorders. The role of age and homocysteine levels. Acta Med. Port., 9(1): 15–20.
- Sacco R.L., Benson R.T., Kargman D.E., Boden-Albala B., Tuck C., Lin I.F., Cheng J.F., Paik M.C., Shea S., Berglund L. (2001) High-density lipoprotein cholesterol and ischemic stroke in the elderly: the Northern Manhattan Stroke Study. JAMA, 285(21): 2729–2735.
- Soyama Y., Miura K., Morikawa Y., Nishijo M., Nakanishi Y., Naruse Y., Kagamimori S., Nakagawa H.; Oyabe Study (2003) High-density lipoprotein cholesterol and risk of stroke in Japanese men and women: the Oyabe Study. Stroke, 34(4): 863–868.
- Tanne D., Yaari S., Goldbourt U. (1997) High-density lipoprotein cholesterol and risk of ischemic stroke mortality. A 21-year follow-up of 8586 men from the Israeli Ischemic Heart Disease Study. Stroke, 28(1): 83–87.
- VITATOPS Trial Study Group (2002) The VITATOPS (Vitamins to Prevent Stroke) Trial: rationale and design of an international, large, simple, randomised trial of homocysteine-lowering multivitamin therapy in patients with recent transient ischaemic attack or stroke. Cerebrovasc. Dis., 13(2): 120–126.
- Yang F., Tan H.M., Wang H. (2005) Hyperhomocysteinemia and atherosclerosis. Sheng Li Xue Bao, 57(2): 103–114.
>МЕТАБОЛИЧЕСКИЕ ФАКТОРЫ РИСКА У БОЛЬНЫХ С ИШЕМИЧЕСКИМ ИНСУЛЬТОМ
Резюме. Приведены данные собственных исследований о роли уровня общего холестерина, холестерина липопротеинов высокой и низкой плотности, триглицеридов, гомоцистеина, витаминов группы В и маркеров воспаления у больных с ишемическим инсультом с отсутствием или наличием в анамнезе транзиторных ишемических атак или инсульта.
Ключевые слова: транзиторная ишемическая атака, первичный инсульт, повторный инсульт, холестерин, липопротеины, гомоцистеин, витамины группы В, маркеры воспаления
Summary. Article represents the original study data on the significance of total cholesterol, high- and low-density lipoprotein cholesterol, triglycerides, homocysteine, vitamins of the group B and inflammation markers in patients with ischemic stroke with or without anamnesis of transient ischemic attacks or strokes.
Key words: transient ischemic attack, primary stroke, second stroke, cholesterol, lipoproteins, homocysteine, vitamins of the group B, inflammation markers





