ПЕРЕДМОВА
Мета настанов і документів консенсусу експертів — представити всі наявні дані з конкретного питання для того, щоб допомогти лікарям оцінити користь і ризик проведення певної діагностичної чи лікувальної процедури. Ці документи мають допомогти при прийнятті рішень у повсякденній клінічній практиці.
Європейське кардіологічне товариство (European Society of Cardiology — ESC), різні організації та інші аналогічні товариства в останні роки опублікували багато настанов і документів консенсусу експертів. Така велика кількість документів може поставити під сумнів ступінь їх авторитетності й обґрунтованості, останні можуть бути гарантовані лише у тому разі, якщо документи розроблялися шляхом незаперечного процесу прийняття рішень. Це є однією із причин, чому ESC та інші учасники опублікували рекомендації з розробки та публікації настанов і документів консенсусу експертів.
Незважаючи на той факт, що прийнято чіткі стандарти для публікації настанов і документів консенсусу експертів належної якості, результати останніх досліджень настанов і документів консенсусу експертів, опублікованих у рецензованих журналах з 1985 р. по 1998 р., доводять, що в більшості випадків не були дотримані методологічні стандарти. Тому дуже важливо, щоб настанови й рекомендації були наведені у формі, яка б не ускладнювала їх інтерпретацію. Звідси випливає, що й програми щодо їх реалізації також потребують правильного виконання. Були спроби встановити, чи сприяють настанови підвищенню якості клінічної практики й раціональному використанню ресурсів охорони здоров’я.
Комітет ESC із практичних настанов (CPG) контролює та координує роботу з підготовки нових настанов і документів консенсусу експертів, які готують робочі, експертні групи чи комісії з консенсусу. Експертів, обраних до складу таких груп з розробки документів, просять писати заяву про розголошення всіх зв’язків, які можна трактувати як конфлікт інтересів. Форми таких заяв про розголошення конфлікту інтересів зберігають у документації Європейського дому серця (European Heart House), штаб-квартири ESC. CPG відповідає і за затвердження зазначених настанов і документів або заяв консенсусу експертів.
Робоча група також розробила класифікацію та рейтингову оцінку корисності чи ефективності рекомендованої процедури і/або методу лікування, а також рівня доказовості, як зазначено нижче:
| Категорія рекомендацій | |
| I | Є докази та/чи досягнуто спільної думки щодо того, що ця діагностична процедура/метод лікування є вигідною, корисною й ефективною |
| II | Є суперечливі дані та/чи в експертів немає єдності у розумінні корисності/ефективності методу лікування |
| IIa | Наявні дані/думки свідчать про корисність/ефективність |
| IIb | Дані/думки слабше підтверджують корисність/ефективність |
| III* | Є дані або досягнуто загальної думки про те, що метод лікування не є корисним/ефективним, а в деяких випадках може бути шкідливим |
*ESC не рекомендує використовувати категорію III.
| Рівень доказовості | |
| А | Дані отримані в результаті проведення великої кількості рандомізованих клінічних випробувань або метааналізів |
| В | Дані отримані в результаті проведення одного рандомізованого клінічного випробування або великих нерандомізованих досліджень |
| С | Є єдина думка експертів і/чи результати невеликих досліджень, ретроспективних досліджень або реєстрів |
ДІАГНОСТИКА ХРОНІЧНОЇ СЕРЦЕВОЇ НЕДОСТАТНОСТІ
ВступМетодологія
Ця настанова базується на посібниках з діагностики й лікування, опублікованих в 1995, 1997 і переглянутих у 2001 р. [1–3], які цього разу були об’єднані в один документ. У випадках, коли була нова інформація, проводили оновлення даних, тоді як інші частини документа залишилися незмінними або коригувалися лише в обмеженому обсязі.
Мета цієї настанови — надати оновлений практичний посібник з діагностики, оцінки й лікування при серцевій недостатності для використання у клінічній практиці, а також для проведення епідеміологічних досліджень і клінічних випробувань. У цій версії особливу увагу приділено діастолічній функції та серцевій недостатності зі збереженою фракцією викиду лівого шлуночка (ЗФВЛШ). Ідея полягала в об’єднанні попередньої доповіді Робочої групи [4] із цією версією.
Настанова призначена як посібник для практикуючих лікарів та інших працівників системи охорони здоров’я, що стосуються ведення пацієнтів із серцевою недостатністю, а також як рекомендації по веденню таких пацієнтів, у тому числі рекомендації з направлення їх до відповідних фахівців. Основою цієї настанови є документально підтверджені й опубліковані дані з питань діагностики, ефективності й безпеки втручань. Настанова ESC призначена для 49 держав з різною економікою, тому при її укладанні прагнули в цілому уникати рекомендацій щодо ефективності витрат. Національна політика у сфері охорони здоров’я, як і клінічна оцінка, може визначати порядок черговості в реалізації положень настанови. Загальновизнано, що в деяких країнах певні втручання недоступні для всіх пацієнтів, яким вони показані, через їх високу вартість. Тому рекомендації в цій настанові завжди необхідно розглядати з урахуванням національної політики й місцевих регуляторних вимог щодо призначення будь-яких діагностичних процедур, застосування лікарських засобів або медичних пристроїв.
Проект цієї настанови був підготовлений Групою з укладання настанови в складі Робочої групи (див. титульну сторінку), призначеної CPG ESC. У членів Робочої групи були зібрані заяви про розголошення зв’язків, які можна трактувати як конфлікт інтересів. Ці документи зберігаються в штаб-квартирі ESC. Проект настанови було направлено в CPG, а також рецензентам (див. титульну сторінку). Після внесення виправлень і перегляду документ було затверджено для опублікування. Резюме базується на повному тексті настанови, яка містить більшу кількість загальних положень та літературних джерел. Цей документ доступний на сайті ESC (http://www.escardio.org). Повний текст настанови слід використовувати у разі невизначеності щодо певного положення або за необхідності отримання більш детальної інформації. При оцінюванні застосовували підхід на основі доказів, у тому числі класифікували докази для відповідних рекомендацій. Однак для цілей діагностики доказові дані є неповними й в основному базуються на консенсусі думок експертів. Уже при укладанні версії 2001 р. було вирішено не використовувати класифікацію доказів у цій частині настанови. Такий же підхід використаний і в цьому документі.
Найбільш важливі висновки й рекомендації відзначені в настанові чорним кружком.
Епідеміологія
• Сьогодні чимало відомо про епідеміологію серцевої недостатності в Європі, однак клінічна картина й етіологія досить різноманітні, а про відмінності між ними в різних країнах відомо менше.
У країнах, що входять в ESC, загальна чисельність населення перевищує 900 млн осіб, тому можна припустити, що в цих країнах є не менше 10 млн хворих із серцевою недостатністю. Також є пацієнти із систолічною дисфункцією міокарда без симптомів серцевої недостатності, для яких характерна приблизно подібна поширеність [5–7]. При серцевій недостатності прогноз однаково несприятливий у разі, коли неможливо усунути причину, що лежить в основі захворювання. У половини пацієнтів з діагнозом «серцева недостатність» летальний кінець настає протягом 4 років, а в більше ніж 50% пацієнтів з тяжкою серцевою недостатністю смерть настає протягом 1 року після встановлення діагнозу [8, 9]. У багатьох пацієнтів із серцевою недостатністю визначають симптоми за наявності ЗФВЛШ [10].
За даними проведених досліджень точність діагностики з використанням винятково клінічної оцінки часто неадекватна [11, 12], особливо у жінок, осіб літнього віку чи людей із ожирінням. З метою правильного вивчення епідеміології та прогнозу, а також для оптимізації лікування при серцевій недостатності необхідно звести до мінімуму або повністю виключити ймовірність невизначеності щодо діагнозу.
Описові терміни при серцевій недостатності Порівняння гострої та хронічної серцевої недостатності
Термін «гостра серцева недостатність» (ГСН) часто використовують винятково для позначення нового випадку розвитку гострої (ГСН de novo) чи декомпенсованої хронічної серцевої недостатності (ХСН), що характеризується ознаками легеневого застою, включаючи набряк легень. До інших форм ГСН належать: гіпертензивна ГСН, набряк легень, кардіогенний шок, недостатність із високим серцевим викидом і правошлуночкова серцева недостатність (див. Настанову з діагностики й терапії гострої серцевої недостатності [13]).
ХСН, перебіг якої характеризується частими загостреннями, є найпоширенішою формою серцевої недостатності. Визначення ХСН наведено нижче.
У цьому документі основну увагу приділено синдрому ХСН, тому упущені аспекти, що стосуються ГСН [13]. Таким чином, у цьому документі серцевою недостатністю вважається хронічний стан, якщо не зазначено інакше.
Порівняння систолічної та діастолічної серцевої недостатності
Більшість випадків серцевої недостатності супроводжується ознаками систолічної дисфункції лівого шлуночка; проте дуже часто, якщо не в кожному випадку, вони супроводжуються порушенням діастолічної функції у спокої. В більшості випадків не слід розглядати діастолічну й систолічну серцеву недостатність як окремі патофізіологічні стани. Діастолічну серцеву недостатність часто діагностують тоді, коли симптоми й ознаки серцевої недостатності виявляють при наявності ЗФВЛШ (нормальної фракції викиду) у спокої. У пацієнтів молодого віку переважання діастолічної дисфункції виявляють відносно рідко, але вона набуває більшого значення в осіб літнього віку. ЗФВЛШ частіше відзначають у жінок, в яких порушення функції серця спричиняють систолічна гіпертензія та гіпертрофія міокарда з фіброзом [10, 14].
Інші описові терміни при серцевій недостатності
Право- та лівошлуночкова серцева недостатність належать до синдромів, у клінічній картині яких переважають явища системного чи легеневого венозного застою. Ці терміни не обов’язково свідчать про те, в якого зі шлуночків більш тяжкий ступінь ураження. Усе ще продовжують нерегулярно використовувати такі терміни, як серцева недостатність із високим і низьким викидом, пряма і зворотна, клінічно виражена, пролікована й застійна, а також інші описові терміни; у клінічній практиці ці терміни застосовують з описовою метою, вони не містять інформації про етіологію, тому їх не застосовують для визначення сучасної тактики лікування при серцевій недостатності.
Такі терміни, як слабко, помірно виражена й тяжка серцева недостатність, застосовують як клінічний опис симптомів, при цьому термін «слабко виражена» застосовують щодо пацієнтів, які можуть рухатися без будь-яких істотних обмежень у зв’язку із задишкою чи стомлюваністю, «тяжка» — щодо пацієнтів, у яких відзначають виражену симптоматику і яким необхідне часте спостереження лікаря, і «помірна» — щодо решти груп таких пацієнтів.
Визначення ХСН
• Діагноз серцева недостатність завжди має супроводжуватися додатковими визначеннями.
Є багато визначень ХСН [15–18], однак у них підкреслюються тільки окремі особливості цього складного синдрому. Діагностика серцевої недостатності ґрунтується на клінічній оцінці, що формується на базі анамнезу, фізикального обстеження і проведення відповідних досліджень.
Серцева недостатність є синдромом, при якому в пацієнтів виявляють такі характерні ознаки: симптоми серцевої недостатності, як правило, задишка чи стомлюваність у спокої чи при фізичному навантаженні або ж набряк щиколоток і об’єктивні докази дисфункції серця у спокої (табл. 1). Різниця між дисфункцією серця, стійкою серцевою недостатністю і серцевою недостатністю, що перейшла в безсимптомну форму в результаті проведення лікування, а також тимчасовою серцевою недостатністю, наведені на рис. 1. Однієї позитивної реакції на лікування при серцевій недостатності для встановлення діагнозу недостатньо, хоча звичайно у пацієнта мають відзначати ослаблення симптомів і/або ознак захворювання у відповідь на лікування, при проведенні якого ймовірне швидке поліпшення стану (наприклад, при застосуванні діуретиків або нітратів).
Таблиця 1
Визначення серцевої недостатності
| IIIIII | Симптоми серцевої недостатності (у спокої та при фізичних навантаженнях) таОб’єктивні підтвердження (бажано за даними ехокардіографії) дисфункції серця (систолічної та/чи діастолічної) у спокої та у разі, коли виникає сумнів щодо діагнозу Реакція організму на лікування при серцевій недостатності |
|---|
У всіх випадках обов’язкова відповідність критеріям I та II.
Безсимптомну систолічну дисфункцію лівого шлуночка (БСДЛШ) вважають попередником симптоматичної ХСН, і сама вона асоційована з високими показниками смертності [19]. Є методи лікування, які можуть поліпшити показники наслідків при БСДЛШ, тому цей стан включений у настанову.
Патофізіологічні аспекти симптомів
серцевої недостатності, що стосуються
її діагностики
Генез симптомів серцевої недостатності повністю не встановлений. Безсумнівно, що підвищення тиску в легеневих капілярах деякою мірою зумовлює розвиток набряку легень, однак результати досліджень, проведених під час фізичних навантажень у пацієнтів із ХСН, установили наявність лише слабкого зв’язку між тиском в капілярах і толерантністю до фізичних навантажень [20, 21]. Це дозволяє припустити, що підвищення тиску в легеневих капілярах не єдиний чинник, що спричиняє задишку при фізичному навантаженні, або ж наявні методи вимірювання тиску в легеневих капілярах можуть бути неадекватними. Зміна ступеня динамічної мітральної регургітації також може вплинути на вираженість задишки.
Можливі методи діагностики серцевої недостатності у клінічній практиці Роль симптомів і ознак у діагностиці серцевої недостатності
• Симптоми й ознаки відіграють важливу роль, оскільки вони свідчать про можливість наявності серцевої недостатності. Підозру на серцеву недостатність, що ґрунтується на клінічній картині, необхідно підтвердити результатами більш об’єктивних досліджень, зокрема призначених для оцінки функції серця (рис. 2).
Задишка, набряки щиколоток і стомлюваність — характерні симптоми й ознаки серцевої недостатності, однак можуть виникнути труднощі в їх інтерпретації, особливо у пацієнтів літнього віку, осіб з ожирінням і жінок. Інтерпретація зазначених симптомів потребує уваги й оцінки різних особливостей (наприклад, їх розвиток при фізичному навантаженні, у нічний час).
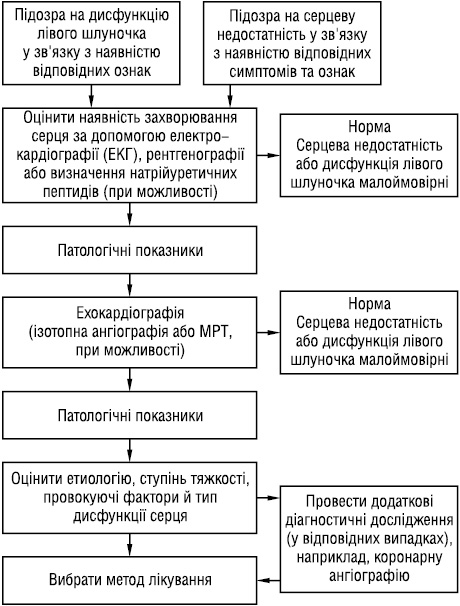 Рис. 2. Алгоритм діагностики серцевої недостатності або дисфункції лівого шлуночка
Рис. 2. Алгоритм діагностики серцевої недостатності або дисфункції лівого шлуночка
Стомлюваність також є важливим симптомом серцевої недостатності. Причини стомлюваності — комплексні, до них належать низький серцевий викид, периферична гіпоперфузія, а також детренованість скелетних м’язів, крім того, складно зробити кількісну оцінку зазначеного симптому.
Периферичні набряки, підвищення венозного тиску й гепатомегалія — характерні ознаки системного венозного застою [22, 23]. Клінічні ознаки серцевої недостатності слід оцінювати в ході ретельного клінічного обстеження, включаючи огляд, пальпацію й аускультацію пацієнта.
Симптоми та ступінь тяжкості серцевої недостатності
• Є слабкий зв’язок між симптомами й ступенем тяжкості дисфункції серця [10, 24]. Однак симптоми можуть бути пов’язані з прогнозом, особливо якщо вони зберігаються після проведення лікування [25].
Після того як діагноз «серцева недостатність» вже встановлений, оцінку симптомів можна використати для класифікації ступеня тяжкості серцевої недостатності, а також — для моніторингу ефективності лікування. Однак, як зазначено нижче, симптоми не можуть бути орієнтиром для оптимальної титрації дози блокаторів, що використовуються при активації нейрогормональної системи. Широко застосовується класифікація Нью-Йоркської кардіологічної асоціації (New York Heart Association/NYHA) (табл. 2). В інших ситуаціях застосовують класифікацію симптомів: слабко, помірно виражені й тяжкі. Для того щоб діагноз відповідав базовому визначенню серцевої недостатності, у пацієнтів з I функціональним класом (ФК) за NYHA мають бути об’єктивні докази дисфункції серця, наявність в анамнезі симптомів серцевої недостатності, а також їм має проводитися терапія з приводу серцевої недостатності.
При гострому інфаркті міокарда для опису симптомів і ознак [27] використовують класифікацію, розроблену Killip [26]. Важливо визнати, що часто відзначають дисоціацію між симптомами та дисфункцією серця. Симптоми також подібні у пацієнтів з різною величиною фракції викиду [28]. Не слід ототожнювати слабко виражені симптоми зі слабким ступенем дисфункції серця.
Таблиця 2
Класифікація серцевої недостатності Нью-Йоркської кардіологічної асоціації
| I ФК | Обмеження відсутні: виконання звичайних фізичних вправ не викликає підвищеної стомлюваності, задишки чи серцебиття |
| II ФК | Легке обмеження фізичної активності: у стані спокою симптоми відсутні, але при звичайній фізичній активності відзначають стомлюваність, серцебиття чи задишку |
| III ФК | Виражене обмеження фізичної активності: у стані спокою симптоми відсутні, але навіть при слабкій фізичній активності відзначають зазначені симптоми |
| IV ФК | Неможливість виконання будь-якого фізичного навантаження без відчуття дискомфорту: симптоми серцевої недостатності відзначають навіть у стані спокою, з підвищенням вираженості при будь-якій фізичній активності |
Електрокардіограма
• Нормальні показники електрокардіограми (ЕКГ) свідчать про необхідність ретельного перегляду діагнозу ХСН.
Порушення на ЕКГ часто відзначають у пацієнтів з підозрою на серцеву недостатність, незалежно від правильності встановлення діагнозу. Тому відхилення на ЕКГ є поганими предикторами наявності серцевої недостатності. З іншого боку, якщо ЕКГ в нормі, то серцева недостатність (особливо внаслідок систолічної дисфункції лівого шлуночка) малоймовірна. Наявність патологічного зубця Q може підтверджувати інфаркт міокарда як причину дисфункції серця. Ширина комплексу QRS>120 мс свідчить про можливість порушення синхронності електричної активності серця, що може потребувати терапії.
Рентгенографія грудної клітки
• Рентгенографія грудної клітки має бути частиною початкового комплексу діагностичних досліджень при серцевій недостатності.Проведення дослідження доцільне для визначення кардіомегалії та наявності легеневого застою, однак має прогностичну цінність лише в контексті типових клінічних ознак і симптомів, а також при порушеннях на ЕКГ.
Гематологічні та біохімічні дослідження
Стандартне діагностичне обстеження пацієнтів із ХСН включає: повний клінічний аналіз крові (визначення гемоглобіну, кількості лейкоцитів і тромбоцитів), визначення в сироватці крові електролітів, креатиніну, глюкози, печінкових ферментів і проведення загального аналізу сечі. Необхідність проведення додаткових досліджень функції щитовидної залози слід розглядати з урахуванням клінічних ознак. При різкому погіршенні стану необхідно виключити гострий інфаркт міокарда за допомогою визначення біомаркерів ураження міокарда.
Натрійуретичні пептиди
• Визначення в плазмі крові концентрацій певних натрійуретичних пептидів або їх попередників, особливо мозкового натрійуретичного пептиду (МНП) і N-кінцевого попередника мозкового натрійуретичного пептиду (N-проМНП), допомагає в діагностиці серцевої недостатності.
• Низька чи нормальна концентрація пептидів у непролікованого пацієнта свідчить про малоймовірність серцевої недостатності як причини виявлених симптомів.
• МНП і N-проМНП мають значну прогностичну цінність, хоча необхідне проведення подальших досліджень для оцінки їх ролі в моніторингу ефективності лікування.
Незважаючи на те що діагностичний потенціал визначення натрійуретичних пептидів менш певний при нормальній систолічній функції, накопичуються докази того, що підвищення їх концентрації може свідчити про наявність діастолічної дисфункції [29, 30]. До інших поширених захворювань серця, які можуть спричинювати підвищення рівня натрійуретичних пептидів, належать: гіпертрофія лівого шлуночка, захворювання клапанів серця, гостра чи хронічна ішемія міокарда, артеріальна гіпертензія [31] і тромбоемболія легеневої артерії [32].
При розгляді питання про використання результатів досліджень МНП і N-проМНП як допоміжних діагностичних даних варто підкреслити, що встановлення нормальних значень не дозволяє повністю виключити захворювання серця, однак наявність нормальної чи низької концентрації цих пептидів у непролікованих пацієнтів свідчить про низьку ймовірність того, що серцева недостатність стала причиною розвитку спостережуваних симптомів.
МНП і N-проМНП займають у сучасній клінічній практиці місце тестів, призначених для виключення важливого захворювання серця. На етапі первинної, а також вторинної медичної допомоги (наприклад, відділень невідкладної медичної допомоги й лікарень) з огляду на співвідношення вартість/ефективність цих тестів одержання нормального результату має виключити необхідність проведення подальших кардіологічних досліджень, перш за все таких як ехокардіографія, а також більш затратних досліджень [33].
Ехокардіографія
• З метою реєстрації дисфункції серця у спокої найкраще використати метод ехокардіографії.
• Найбільш важливим параметром функції шлуночків є фракція викиду лівого шлуночка (ФВЛШ), що дозволяє відрізняти пацієнтів із систолічною дисфункцією серця від пацієнтів зі збереженою систолічною функцією.
Рекомендується направляти пацієнтів для проведення ехокардіографії з метою діагностики серцевої недостатності. Трансторакальна допплєрівська ехокардіографія (ТДЕ) є швидким, безпечним і поширеним методом діагностики.
Оцінка діастолічної функції лівого шлуночка
Оцінка діастолічної функції може бути інформативною у клінічному відношенні та використана для: 1) виявлення порушень діастолічної функції у пацієнтів із ХСН і нормальною ФВЛШ; 2) оцінки прогнозу у пацієнтів із серцевою недостатністю; 3) визначення діастолічного тиску в лівому шлуночку неінвазивним методом; 4) діагностики констриктивного перикардиту й рестриктивної кардіоміопатії.
Діагностичні критерії діастолічної дисфункції
Діагноз первинної діастолічної серцевої недостатності має одночасно відповідати трьом критеріям: 1) наявність ознак або симптомів ХСН; 2) наявність нормальної систолічної функції лівого шлуночка чи слабкого ступеня її порушення (ФВЛШ ≥45–50%) та 3) наявність доказів порушення релаксації лівого шлуночка, діастолічної розтяжності або діастолічної жорсткості [34]. Більше того, важливо виключити захворювання легень [35].
На ранній стадії діастолічної дисфункції відзначають характерний тип порушення релаксації міокарда зі зниженням пікової трансмітральної Е-швидкості, компенсаторне підвищення пікової швидкості пізнього наповнення, зумовленої скороченням передсердь (А), а також у зв’язку із цим зменшення відношення Е/А.
У пацієнтів із прогресуючим захворюванням серця можливий тип «рестриктивного наповнення» з підвищенням піка Е-швидкості, зменшенням часу зниження Е-швидкості та значним збільшенням відношення Е/А. Підвищення пікової Е-швидкості зумовлене підвищенням тиску в лівому передсерді, що викликає збільшення раннього діастолічного трансмітрального градієнта тиску [36].
У пацієнтів з типом наповнення, що займає проміжне місце між порушенням релаксації міокарда й рестриктивним наповненням, відношення Е/А і час зниження швидкості можуть мати нормальні значення — це «псевдонормальний тип наповнення». Цей тип наповнення можна відрізнити від нормального типу наповнення шлуночка за допомогою виявлення з використанням тканинного допплєрівського режиму (ТДР) зниження пікової Е´-швидкості [37].
Три описаних типи наповнення — «порушеної релаксації», «псевдонормального наповнення» і «рестриктивного наповнення» — відповідають слабко, помірно вираженому і тяжкому ступеню діастолічної дисфункції [37] (рис. 3). Таким чином, за допомогою комплексної оцінки швидкостей трансмітрального кровотоку й швидкостей руху мітрального кільця можна визначити стадію діастолічної дисфункції під час рутинного ехокардіографічного дослідження. Усе ще недостатньо проспективних досліджень, присвячених вивченню питання, чи може оцінка діастолічної дисфункції за допомогою зазначених критеріїв зумовити поліпшення лікування пацієнтів із серцевою недостатністю.
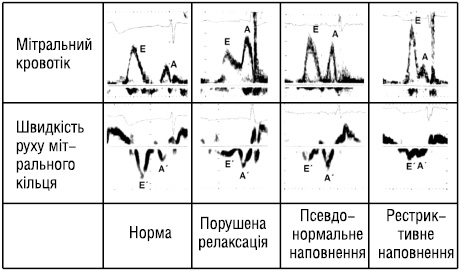 Рис. 3. Три типи наповнення лівого шлуночка — «порушена релаксація», «псевдонормальне наповнення» і «рестриктивне наповнення» — відповідають слабко, помірно вираженому і тяжкому ступеню діастолічної дисфункції [37].
Рис. 3. Три типи наповнення лівого шлуночка — «порушена релаксація», «псевдонормальне наповнення» і «рестриктивне наповнення» — відповідають слабко, помірно вираженому і тяжкому ступеню діастолічної дисфункції [37].
Черезстравохідну ехокардіографію не рекомендують як рутинне дослідження; її проведення можна рекомендувати тільки пацієнтам з наявністю неадекватного ехокардіографічного «вікна», пацієнтам з ускладненнями з боку клапанів серця, хворим з підозрою на дисфункцію механічного штучного мітрального клапана або ж у разі якщо необхідно виявити або виключити наявність тромбу у вушку передсердя.
При подальшому спостереженні пацієнтів із серцевою недостатністю повторне проведення ехокардіографії можна рекомендувати тільки у випадках, коли відзначають важливу зміну клінічного стану, що свідчить про значне поліпшення чи погіршення функції серця.
Рекомендації до проведення додаткових неінвазивних методів дослідження
У пацієнтів, у яких ехокардіографія в спокої виявилася недостатньо інформативною, а також у пацієнтів з ішемічною хворобою серця (наприклад, при наявності тяжкої чи рефрактерної форми ХСН та ішемічної хвороби серця) до додаткових неінвазивних методів візуалізації можуть належати такі методики: стрес-ехокардіографія, радіоізотопні методи, магнітно-резонансна томографія серця (МРТС).
Магнітно-резонансна томографія серця
• МРТС — універсальний, високоточний і відтворюваний метод візуалізації для оцінки обсягів лівого й правого шлуночків, глобальної функції, регіонального руху стінки, товщини міокарда, потовщення структур серця, маси міокарда і клапанів серця [38, 39]. Цей метод добре підходить для виявлення вроджених вад, об’ємних процесів і новоутворень, а також захворювань клапанного апарата серця й перикарда.
Оцінка функції легень
• Показники функції легенів відіграють незначну роль у діагностиці ХСН. Однак їх визначення доцільне для виключення легеневого генезу задишки. Проведення спірометрії може бути корисним для оцінки ступеня тяжкості обструктивної хвороби легенів, що належить до поширеної супутньої патології в пацієнтів із серцевою недостатністю.
Проби з фізичним навантаженням
• У клінічній практиці проби з фізичним навантаженням мають обмежену цінність у діагностиці серцевої недостатності. Однак нормальні показники проб із фізичним навантаженням у пацієнта, якому не проводять лікування з приводу серцевої недостатності, дозволяють виключити діагноз серцевої недостатності. Основне застосування досліджень із фізичним навантаженням при ХСН більше сфокусоване на оцінці функціонального статусу й ефективності лікування, а також на прогностичній стратифікації пацієнтів.
Інвазивні методи дослідження
• Визначення наявності ХСН зазвичай не потребує проведення інвазивних методів дослідження, але вони можуть мати значення при встановленні причини захворювання чи для одержання інформації про його прогноз.
Катетеризація серця
Проведення коронарної ангіографії може бути доцільним у пацієнтів із загостренням і раптовою декомпенсацією ХСН, а також у пацієнтів з тяжкою серцевою недостатністю (при шоку чи гострому набряку легенів), у яких не відзначають поліпшення внаслідок проведення початкового етапу лікування. Також необхідно розглянути можливість проведення коронарної ангіографії у пацієнтів зі стенокардією чи будь-якими іншими ознаками ішемії міокарда у разі, коли в них не відзначають реакції на проведення адекватної терапії антиішемічними засобами. У контрольованих клінічних випробуваннях не встановлено, що реваскуляризація при серцевій недостатності поліпшує результати лікування. Тому у разі відсутності ішемічної хвороби серця, резистентної до лікування, проведення коронарної артеріографії не показане. Проведення коронарної ангіографії також показане у пацієнтів з рефрактерною серцевою недостатністю невстановленої етіології та у пацієнтів з ознаками тяжкої форми мітральної регургітації чи патології аортального клапана.
Моніторинг гемодинамічних параметрів за допомогою катетеризації легеневої артерії показаний у пацієнтів, госпіталізованих із приводу кардіогенного шоку, або з метою корекції терапії пацієнтів із ХСН, у яких не вдалося досягти швидкого ефекту після проведення адекватної початкової терапії. Не рекомендується застосування рутинної катетеризації правих відділів серця з метою корекції довгострокової терапії.
Дослідження для оцінки функції нейроендокринної системи за винятком визначення натрійуретичних пептидів
• Не рекомендується проведення в діагностичних або прогностичних цілях досліджень для визначення активації нейроендокринної системи в окремих пацієнтів.
Холтерівський ЕКГ-моніторинг: амбулаторний ЕКГ-моніторинг і тривала реєстрація ЕКГ
• Стандартне холтерівське моніторування не має будь-якої цінності в діагностиці ХСН, однак з його допомогою можна визначати й кількісно оцінювати характер, частоту і тривалість передсердних і шлуночкових аритмій, які можуть спричинити або підсилювати симптоми серцевої недостатності. Проведення тривалої реєстрації ЕКГ (ТР-ЕКГ) має бути обмежене тільки пацієнтами із ХСН і симптомами, що свідчать про наявність аритмії.
Вимоги до встановлення діагнозу «серцева недостатність» у клінічній практиці
• Діагноз «серцева недостатність» можна встановити тільки при наявності симптомів серцевої недостатності й об’єктивних даних щодо дисфункції серця (див. табл. 1). Оцінка функції серця за допомогою одних лише клінічних критеріїв є незадовільною. Дисфункцію серця необхідно оцінювати на підставі об’єктивних даних.
Ехокардіографія — єдиний найбільш ефективний метод, широко застосовуваний у клінічній практиці. Необхідно виключити інші патологічні стани, які можуть мати подібні симптоми й ознаки, характерні для серцевої недостатності, або підсилювати їх (табл. 3). Для встановлення діагнозу в пацієнтів з підозрою на серцеву недостатність необхідно в плановому порядку використовувати підхід (див. рис. 2) до діагностики серцевої недостатності в пацієнтів із симптомами цього захворювання. Необхідно також проводити додаткові дослідження (табл. 4) або переглядати їх результати, якщо виникають сумніви щодо точності діагнозу або коли особливості клінічного стану свідчать про оборотний характер причини, що викликала серцеву недостатність.
На рис. 2 наведено спрощений план оцінки стану пацієнта з наявністю симптомів, характерних для серцевої недостатності, чи ознак, що припускають наявність систолічної дисфункції лівого шлуночка. Табл. 5 містить коротку схему ведення пацієнта, що зв’язує розділ цієї настанови з діагностики з розділом щодо лікування.
Таблиця 5
Коротка схема ведення пацієнта
| Переконатися в наявності у пацієнта серцевої недостатності (відповідно до визначення, наведеного у розділі «Діагностика хронічної серцевої недостатності»)Виявити характерні риси захворювання: набряк легенів, задишку при фізичному навантаженні, підвищену стомлюваність, периферичні набрякиОцінити ступінь тяжкості симптомівВизначити етіологію серцевої недостатностіВиявити фактори, що провокують захворювання чи погіршують його перебігВиявити супутні захворювання, що стосуються серцевої недостатності та її лікуванняОцінити прогнозОцінити фактори, що ускладнюють перебіг захворювання (наприклад, порушення функції нирок, артрит)Дати рекомендації пацієнту та його близькимВибрати відповідне лікуванняСпостерігати за перебігом захворювання й проводити відповідну корекцію лікування |
Оцінка прогнозу
• Проблема оцінки прогнозу при серцевій недостатності досить складна з багатьох причин: етіологія захворювання може бути різною, часто відзначають супутні захворювання, можливості дослідження паракринних патофізіологічних механізмів обмежені, відзначають індивідуальну варіабельність в особливостях прогресування захворювання, його наслідках (наприклад, раптова смерть і смерть у результаті прогресування серцевої недостатності) та в ефективності лікування. Більше того, ряд методологічних обмежень знижує інформативність багатьох прогностичних досліджень. У табл. 6 наведено змінні, які дослідники з вищим ступенем сталості вважають незалежними предикторами наслідку захворювання.
Таблиця 6
Стратифікація ризику при ХСН із урахуванням предикторів
| Предиктори | |||||
| Демографічні й анамнестичні |
Клінічні | Електрофізіологічні | Функціональних/навантажувальних тестів | Досліджень крові | Оцінки центральної гемодинаміки |
| Літній вік* [123–125] | Висока ЧСС [149] | Широкий комплекс QRS [95, 127] | VO2max* (мл/кг/хв < 10–14) [128–130] | Високий рівень МНП у сироватці крові* [31, 131] | Низька ФВЛШ* [124, 132–134] |
| Коронарна етіологія порушень [123, 135] | Стійкий низький АТ* [123] | Низька варіабельність ЧСС [136, 137] | Велике відношення VE/VCO2 [138] | Високий рівень норепінефрину у сироватці крові [139, 140] |
Збільшення об’єму лівого шлуночка [141, 142] |
| Цукровий діабет [143] | III–IV ФК за NYHA* [123, 124, 144] | Складні порушення шлуночкового ритму [110, 139] | Низька здатність переносити пробу з 6‑хвилинною ходьбою [145, 146] | Низький рівень натрію у сироватці крові* [123, 147] | Низький серцевий індекс [123] |
| Реанімація при раптовій смерті* [110] | Ненавмисне зменшення маси тіла [148] | Альтернація Т‑хвилі [134] | Високий рівень креатиніну у сироватці крові* [123, 147, 150] |
Високий тиск наповнення лівого шлуночка [123, 124] | |
| Расові особливості [126] | Порушення ритму й частоти дихання [151, 152] | Високий рівень білірубіну у сироватці крові* [147] | Рестриктивний тип наповнення лівого шлуночка (мітральний кровотік) [153, 154] | ||
| Анемія [155] | Порушення функції правого шлуночка* [156, 157] | ||||
| Високий рівень тропоніну у сироватці крові [158] | Кардіоторакальний індекс [139, 159] | ||||
| Високий рівень сечової кислоти в сироватці крові [160] | |||||
ЛІКУВАННЯ ПРИ СЕРЦЕВІЙ НЕДОСТАТНОСТІ
Цілі лікування при серцевій недостатності
1) Профілактика — основна ціль:
а) запобігання і/чи контроль захворювання, що призводить до розвитку дисфункції серця і серцевої недостатності;
б) запобігання прогресуванню серцевої недостатності відразу ж після виявлення дисфункції серця.
2) Збереження чи підвищення якості життя.
3) Збільшення тривалості життя.
Профілактика серцевої недостатності
• Розвиток дисфункції шлуночка та серцевої недостатності можна сповільнити або запобігти йому за допомогою лікування станів, що спричинюють серцеву недостатність, зокрема у пацієнтів групи високого ризику з артеріальною гіпертензією і/чи ішемічною хворобою серця (Рекомендація категорії I, рівень доказовості А) [40].
• Профілактика серцевої недостатності завжди має бути основною метою лікування.
У разі, якщо наявна дисфункція міокарда, перша мета лікування полягає в усуненні при можливості причини дисфункції шлуночка (наприклад, ішемії міокарда, захворювання щитовидної залози, впливу токсичних речовин, алкоголю, лікарських засобів). Друга мета сучасної терапії полягає в запобіганні прогресування захворювання від безсимптомної дисфункції шлуночка до серцевої недостатності.
Методи запобігання випадків прогресування від безсимптомної дисфункції лівого шлуночка до серцевої недостатності зазначені нижче, у розділі «Вибір медикаментозної терапії та часу її проведення», «Безсимптомна систолічна дисфункція лівого шлуночка».
Ведення пацієнтів із хронічною серцевою недостатністю
Терапевтичний підхід при ХСН, зумовленій систолічною дисфункцією серця, складається з рекомендацій загального характеру, немедикаментозного лікування, медикаментозної терапії, застосування механічних пристроїв і проведення оперативних втручань. Сучасні підходи до лікування захворювання наведено в табл. 5 та 7.
Таблиця 7
Рекомендації та заходи загального характеру, фізичні вправи, медикаментозна терапія, механічні пристрої та оперативні втручання
| Немедикаментозне лікування:Рекомендації та заходи загального характеруФізичні тренуванняМедикаментозна терапія:Інгібітори АПФДіуретики Блокатори бета-адренорецепторівАнтагоністи рецепторів до альдостеронуАнтагоністи рецепторів до ангіотензину IIСерцеві глікозидиВазодилататори (нітрати/гідралазин)Засоби з позитивним інотропним ефектомАнтикоагулянтиАнтиаритмічні засобиОксигенотерапіяМеханічні пристрої та оперативні втручання:Реваскуляризація (за допомогою катетеризації чи хірургічних втручань)Інші види хірургічних втручань (відновлення мітрального клапана)Бівентрикулярна стимуляція (електрична ресинхронізація роботи серця)Імплантований кардіовертер-дефібриляторТрансплантація серця, шлуночкові допоміжні пристрої, штучне серцеУльтрафільтрація, гемодіаліз |
Немедикаментозне лікування Рекомендації та заходи загального
характеру
(Рекомендація категорії I, рівень доказовості C — для немедикаментозного лікування, якщо не зазначено інакше)
Навчання пацієнтів і близьких
Пацієнтам із ХСН та їх близьким необхідно дати загальні рекомендації.
Контроль маси тіла
Пацієнтам рекомендують регулярно самостійно вимірювати масу тіла з метою контролю щодо її збільшення (бажано це робити як складову регулярної щоденної процедури, наприклад після здійснення ранкового туалету) і у разі несподіваного різкого збільшення маси тіла (>2 кг протягом 3 днів) сповістити про це лікареві чи скоригувати відповідним чином дозу діуретика, що приймається (наприклад, при стійкому збільшенні маси тіла підвищити дозу).
Дієтичні рекомендації
Натрій. При тяжких формах серцевої недостатності контроль за споживанням з їжею кухонної солі має більше значення, ніж при легкому ступені захворювання.
Рідина. Пацієнтів із прогресуючою серцевою недостатністю та з гіпонатріємією і без неї необхідно проінструктувати щодо обмеження споживання рідини. Однак на сьогодні точно не встановлено необхідний ступінь обмеження споживання рідини. На практиці при прогресуючій серцевій недостатності рекомендують обмежувати споживання рідини 1,5–2 л/добу.
Алкоголь. Допускається помірне вживання алкогольних напоїв (1 склянка пива або 1–2 склянки вина на добу). Однак вживання алкоголю слід заборонити при алкогольній кардіоміопатії.
Ожиріння
У пацієнтів з ожирінням лікування при ХСН має включати заходи, спрямовані на зменшення маси тіла.
Патологічне зменшення маси тіла
Клінічні або субклінічні ознаки недостатності живлення відзначають приблизно у 50% пацієнтів із ХСН. Зменшення загальної маси жирової тканини й безжирової маси тіла, якими супроводжується зменшення загальної маси тіла, називають серцевою кахексією. Серцева кахексія – важливий предиктор зниження виживаності [41].
Тютюнопаління
У всіх випадках слід рекомендувати пацієнтам відмовитися від тютюнопаління. Слід активно пропагувати засоби, що полегшують відвикання від тютюнопаління, до яких можна віднести препарати для замісної нікотинової терапії.
Подорожі
Необхідно застерегти пацієнта від перебування у високогірних місцях, а також у районах із жарким або вологим кліматом. У цілому нетривалі повітряні перельоти краще тривалих подорожей іншими засобами транспорту.
Сексуальна активність
Неможливо надати чіткі рекомендації щодо сексуальної активності. Рекомендації дають для того, щоб заспокоїти не осіб з тяжкими порушеннями, а пацієнта, стурбованого щодо впливу сексуальної активності на здоров’я, а також щоб заспокоїти партнера, який найчастіше ще більше стурбований, і, можливо, для направлення пари на консультацію до фахівця. Сьогодні недостатньо добре вивчено питання впливу на сексуальну функцію лікарських засобів, застосовуваних у терапії при серцевій недостатності.
Рекомендації з імунізації
Відсутні будь-які документальні свідчення про ефекти імунізації в пацієнтів із серцевою недостатністю. У таких пацієнтів широко застосовують вакцинацію проти вірусу грипу.
Рекомендації пацієнтам з прийому лікарських засобів
Слід заохочувати пацієнтів до самостійної корекції (якщо це виправдано з практичної точки зору) дози діуретика на підставі зміни симптомів і водного балансу. Пацієнти здатні коригувати дозу прийнятих діуретиків у межах, які попередньо встановлені лікарем на основі індивідуального підходу.
Лікарські засоби, які не рекомендуються для застосування, чи при прийомі яких слід дотримуватися обережності
Нижченаведені лікарські засоби необхідно застосовувати з обережністю у разі, якщо їх призначають одночасно з будь-яким видом медикаментозної терапії з приводу серцевої недостатності:
1) нестероїдні протизапальні препарати (НПЗП) та коксиби;
2) антиаритмічні засоби I класу (див. нижче);
3) антагоністи кальцію (верапаміл, дилтіазем, похідні дигідропіридину короткої дії) (див. нижче);
4) трициклічні антидепресанти;
5) кортикостероїди;
6) препарати літію.
Спокій, фізичні навантаження та освоєння фізичних вправСпокій
При ГСН або дестабілізації стану при ХСН необхідний спокій чи постільний режим.
Фізичні вправи та тренування
Фізичні вправи покращують функцію скелетних м’язів, а отже — загальні функціональні можливості. Пацієнтові слід пояснити користь вправ і розповісти, як необхідно виконувати щоденні фізичні вправи й активно проводити вільний час без ризику розвитку симптомів захворювання. Рекомендується проведення програм з фізичних тренувань у пацієнтів зі стабільним станом і серцевою недостатністю II–III ФК за NYHA. ESC було опубліковано стандартизовані рекомендації з фізичних тренувань пацієнтів із серцевою недостатністю [42].
Медикаментозна терапіяІнгібітори ангіотензинперетворювального ферменту (АПФ)
• Інгібітори АПФ рекомендують як терапію першої лінії пацієнтам, у яких знижена систолічна функція лівого шлуночка, тобто якщо величина ФВЛШ <40–45% (див. інформацію щодо неінвазивних методів візуалізації в розділі «Діагностика хронічної серцевої недостатності»), з наявністю симптомів серцевої недостатності або без них (Рекомендація категорії I, рівень доказовості А).
• Дозу інгібіторів АПФ необхідно підвищувати поступово до рівнів доз, ефективність яких було доведено у великих контрольованих клінічних випробуваннях (Рекомендація категорії I, рівень доказовості А), і не рекомендують титрацію дози лише залежно від поліпшення симптоматики (Рекомендація категорії I, рівень доказовості С).
Інгібітори АПФ при асимптоматичній дисфункції лівого шлуночка
• Пацієнтам із безсимптомною, але документально підтвердженою систолічною дисфункцією лівого шлуночка слід призначати інгібітори АПФ з метою затримки чи попередження розвитку серцевої недостатності. Інгібітори АПФ також сприяють зниженню ризику виникнення інфаркту міокарда та раптової смерті (Рекомендація категорії I, рівень доказовості А) [43–46].
Інгібітори АПФ при симптоматичній серцевій недостатності
• Усі пацієнти з симптоматичною серцевою недостатністю, спричиненою систолічною дисфункцією лівого шлуночка, мають отримувати інгібітор АПФ (Рекомендація категорії I, рівень доказовості А) [47].
• У пацієнтів із серцевою недостатністю середнього і тяжкого ступеня, а також із систолічною дисфункцією лівого шлуночка терапія інгібіторами АПФ підвищує виживаність, зменшує вираженість симптомів захворювання, поліпшує функціональний стан, а також зменшує кількість випадків госпіталізації.
• Інгібітори АПФ необхідно призначати як початкову терапію при відсутності затримки рідини в організмі. У пацієнтів з наявністю затримки рідини в організмі інгібітори АПФ необхідно призначати в комбінації з діуретиками (Рекомендація категорії I, рівень доказовості B) [47, 48].
• Лікування інгібіторами АПФ слід починати у пацієнтів із симптомами й ознаками серцевої недостатності (навіть яка має транзиторний характер), а також після гострого періоду інфаркту міокарда (навіть у разі, якщо симптоми мають тимчасовий характер) з метою підвищення виживаності, зниження частоти випадків розвитку повторного інфаркту міокарда та госпіталізації з приводу серцевої недостатності (Рекомендація категорії I, рівень доказовості A) [44, 45, 49].
• Тривала терапія інгібіторами АПФ ефективна у пацієнтів з безсимптомною, але документально підтвердженою систолічною дисфункцією лівого шлуночка (Рекомендація категорії I, рівень доказовості А)[43–46].
• До важливих побічних ефектів, виявлених при терапії інгібіторами АПФ, належать кашель, артеріальна гіпотензія, ниркова недостатність, гіперкаліємія, синкопальний стан і ангіоневротичний набряк. У пацієнтів, у яких при застосуванні інгібіторів АПФ виникає кашель або ангіоневротичний набряк, ефективною альтернативою може бути застосовуння антагоністів рецепторів до ангіотензину II (АРА II) (Рекомендація категорії I, рівень доказовості А). У пацієнтів з нормальним рівнем артеріального тиску зміни систолічного й діастолічного артеріального тиску, а також підвищення рівня креатиніну в сироватці крові зазвичай незначні.
• Терапія інгібіторами АПФ протипоказана при наявності двостороннього стенозу ниркових артерій і розвитку ангіоневротичного набряку під час раніше проведеної терапії інгібіторами АПФ (Рекомендація категорії III, рівень доказовос ті А).
Діапазони цільових підтримувальних доз інгібіторів АПФ, ефективність яких підтверджена в різних клінічних дослідженнях, наведені в табл. 8. Рекомендовані початкові й підтримувальні дози інгібіторів АПФ, ефективність яких при серцевій недостатності була доведена при застосуванні в країнах Європи, наведені в табл. 9.
Терапію інгібіторами АПФ завжди необхідно починати з низької дози, а потім підвищувати її до цільового рівня. Процедури, рекомендовані для початку проведення терапії інгібіторами АПФ, наведені в табл. 10.
Таблиця 8
Дози інгібіторів АПФ, ефективність яких доведена при серцевій недостатності чи дисфункції лівого шлуночка у великих контрольованих дослідженнях
| Дослідження смертності | Лікарський засіб | Цільова доза | Середня добова доза, мг |
| Дослідження ХСН: | |||
| CONSENSUS Trial Study Group, 1987 [48] | Еналаприл | 20 мг 2 рази на добу |
18,4 |
| V-HeFT II, 1991 [161] | Еналаприл | 10 мг 2 рази на добу |
15,0 |
| The SOLVD Investigators, 1991 [162] | Еналаприл | 10 мг 2 рази на добу |
16,6 |
| ATLAS, 1999 [163] | Лізиноприл | Висока Низька | 32,5–352,5–5 |
| Дослідження дисфункції ЛШ після ІМ з наявністю СН або без неї: | |||
| SAVE, 1992 [44] | Каптоприл | 50 мг 3 рази на добу |
127 |
| AIRE, 1993 [49] | Раміприл | 5 мг 2 рази на добу |
Дані відсутні |
| TRACE, 1995 [45] | Трандолаприл | 4 мг/добу | Дані відсутні |
Примітки: ЛШ — лівий шлуночок, ІМ — інфаркт міокарда; СН — серцева недостатність.Таблиця 9 Рекомендований діапазон підтримувальних доз деяких інгібіторів АПФ, зареєстрованих для лікування при серцевій недостатності
у країнах Європи*
| Лікарський засіб | Початкова доза | Підтримувальна доза |
| Зареєстрований вплив на зниження показників смертності/госпіталізації | ||
| Каптоприл | 6,25 мг 3 рази на добу | 25–50 мг 3 рази на добу |
| Еналаприл | 2,5 мг/добу | 10 мг 2 рази на добу |
| Лізиноприл | 2,5 мг/добу | 5–20 мг/добу |
| Раміприл | 1,25–2,5 мг/добу | 2,5–5 мг 2 рази на добу |
| Трандолаприл | 1 мг/добу | 4 мг/добу |
*Рекомендації фірм-виробників або регуляторних органів.
Таблиця 10
Рекомендована процедура для початку терапії інгібіторами АПФ або антагоністами рецепторів до ангіотензину II
| Перевірити ще раз доцільність застосування діуретиків і вазодилататорів у використовуваних дозах.Не допускати надмірно високого діурезу перед терапією інгібіторами АПФ. Якщо пацієнт приймає діуретики, розглянути доцільність зниження їх дози або відміни на 24 год.Можливо, з метою мінімізації потенційного негативного ефекту на артеріальний тиск доцільніше починати терапію ввечері, при горизонтальному положенні пацієнта, хоча відсутні дані досліджень при серцевій недостатності, що підтверджують таке твердження. При початку терапії вранці у пацієнтів групи ризику з порушенням функції нирок або низьким артеріальним тиском рекомендують здійснювати контроль рівня артеріального тиску протягом декількох годин.Починати з низької дози (див. табл. 13) і поступово підвищувати дозу до величин підтримувальних доз, ефективність яких було доведено у великих клінічних дослідженнях (див. табл. 12).При значному погіршенні функції нирок призупинити лікування. На початковому етапі терапії не рекомендується застосування калійзберігаючих діуретиків.Не рекомендується застосування НПЗП або коксибів.Перевіряти рівень артеріального тиску, функцію нирок і рівень електролітів через 1–2 тиж після кожного підвищення дози, потім — через 3 міс, після чого проводити регулярний контроль через кожні 6 міс.На консультацію до фахівця необхідно направляти пацієнтів, у яких:- не встановлена причина розвитку серцевої недостатності- систолічний артеріальний тиск <100 мм рт. ст.- креатинін сироватки крові >150 мкмоль/л- рівень натрію у сироватці крові <135 ммоль/л- тяжка серцева недостатність- основна причина — хвороба клапана серця |
Рекомендують регулярно контролювати функцію нирок: 1) перед початком терапії, через 1–2 тиж після кожного підвищення дози й потім з інтервалами в 3–6 міс; 2) у разі підвищення дози інгібітора АПФ або призначення додатково інших лікарських засобів, які можуть вплинути на функцію нирок, наприклад, антагоністів альдостерону або АРА II; 3) у пацієнтів з наявністю в анамнезі чи в даний момент порушень функції нирок або електролітного балансу необхідно частіше визначати величину показників функції нирок; або 4) під час кожної госпіталізації пацієнта.
ДіуретикиПетльові, тіазидні діуретики й метолазон
• Діуретики відіграють важливу роль у симптоматичному лікуванні при наявності перевантаження рідиною, що проявляється легеневим застоєм або периферичними набряками. Застосування діуретиків зумовлює швидке зменшення вираженості задишки й підвищення толерантності до фізичного навантаження (Рекомендація категорії I, рівень доказовості A) [50, 51].
• Відсутні контрольовані рандомізовані випробування, у яких оцінювали ефект зазначених лікарських засобів щодо симптомів захворювання або виживаності. Діуретики завжди необхідно застосовувати в комбінації з інгібіторами АПФ і блокаторами бета-адренорецепторів за умови їх переносимості (Рекомендація категорії I, рівень доказовості С).
В табл. 11 та 12 наведено докладні рекомендації та основні побічні ефекти діуретиків.
Калійзберігаючі діуретики
• Калійзберігаючі діуретики варто призначати тільки при гіпокаліємії, яка зберігається незважаючи на терапію інгібіторами АПФ, або при тяжкій серцевій недостатності, незважаючи на терапію інгібіторами АПФ у комбінації з низькими дозами спіронолактону (Рекомендація категорії I, рівень доказовості С). У пацієнтів, які не переносять антагоністи альдостерону навіть у низьких дозах у зв’язку з гіперкаліємією чи дисфункцією нирок, можна застосовувати амілорид або тріамтерен (Рекомендація категорії IIb, рівень доказовості С).
• Додаткове застосування калієвмісних препаратів у цій ситуації, як правило, неефективне (Рекомендація категорії III, рівень доказовості C).
• Застосування будь-яких калійзберігаючих діуретиків необхідно контролювати за допомогою періодичного визначення рівня креатиніну й калію в сироватці крові. Практично обґрунтованим підходом є контроль рівня креатиніну й калію в крові через кожні 5–7 днів після початку терапії, аж до стабілізації їх значень. Після цього такий контроль можна проводити через кожні 3–6 міс.
Блокатори бета-адренорецепторів
• Застосування блокаторів бета-адренорецепторів рекомендують (при відсутності протипоказань) для терапії у всіх пацієнтів зі стабільним станом і з легким, помірним або тяжким ступенем серцевої недостатності (II–IV ФК за NYHA) у результаті ішемічної та неішемічної кардіоміопатії і зі зниженою ФВЛШ при проведенні стандартної терапії, в тому числі діуретиками й інгібіторами АПФ (Рекомендація категорії I, рівень доказовості A) [52–58].
• Терапія блокаторами бета-адренорецепторів знижує частоту випадків госпіталізації (з усіх причин — з приводу серцево-судинних захворювань у цілому та з приводу серцевої недостатності), поліпшує стан (зміна ФК за NYHA) і знижує тяжкість перебігу серцевої недостатності. Такий позитивний ефект постійно відзначали у підгрупах пацієнтів різного віку, статі, ФК , ФВЛШ, а також при ішемічній або неішемічній етіології серцевої недостатності (Рекомендація категорії I, рівень доказовості А).
• Пацієнтам із систолічною дисфункцією лівого шлуночка, які перенесли гострий інфаркт міокарда, для зниження смертності рекомендують (незалежно від наявності або відсутності симптомів серцевої недостатності) тривалу блокаду бета-адренорецепторів додатково до інгібування АПФ (Рекомендація категорії I, рівень доказовості B) [59].
• У пацієнтів із серцевою недостатністю можливі відмінності у клінічних ефектах різних блокаторів бета-адренорецепторів [60, 61]. Тому можна рекомендувати застосування лише бізопрололу, карведилолу, метопрололу сукцинату й небівололу (Рекомендація категорії I, рівень доказовості A).
Початкова терапія
Початкова доза має бути низькою, з часом її повільно й поетапно підвищують до рівня цільової дози, яку використовували в великих клінічних випробуваннях. При поступовому підвищенні дози слід застосовувати індивідуальний підхід.
Блокатори бета-адренорецепторів можуть спричиняти надмірне зниження частоти серцевих скорочень (ЧСС), тимчасово пригнічувати функцію міокарда й погіршувати перебіг серцевої недостатності. У табл. 13 наведено рекомендовану процедуру і протипоказання для застосування блокаторів бета-адренорецепторів у клінічній практиці. У табл. 14 — схему титрації дози лікарських засобів, застосовуваних у найбільш значимих дослідженнях.
Таблиця 13
Рекомендована процедура для початку терапії блокаторами бета-адренорецепторів
| I Лікування пацієнта необхідно починати на фоні проведення терапії інгібіторами АПФ, якщо вона не протипоказана |
| II Стан пацієнта має бути відносно стабільним, не потребувати внутрішньовенного введення інотропних засобів і без ознак вираженої затримки рідини в організмі |
| III Починати терапію з блокаторів бета-адренорецепторів у низьких дозах (див. табл. 18), а потім підвищувати дозу до рівня підтримувальних, ефективність яких було доведено у великих клінічних дослідженнях. Дозу можна подвоювати через кожні 1–2 тиж при хорошій переносимості попередньої дози. Більшість пацієнтів можна лікувати амбулаторно |
| IV Під час періоду титрації дози або через якийсь час після нього можливе тимчасове погіршення перебігу серцевої недостатності, розвиток артеріальної гіпотензії чи брадикардії:а) здійснювати регулярне спостереження за пацієнтом щодо розвитку симптомів серцевої недостатності, затримки рідини, артеріальної гіпотензії та симптоматичної брадикардіїб) при посиленні симптомів спочатку необхідно підвищити дозу діуретика чи інгібітора АПФ; при необхідності — тимчасово знизити дозу блокатора бета-адренорецепторівв) при розвитку артеріальної гіпотензії спочатку знизити дозу вазодилататорів; при необхідності — знизити дозу блокатора бета-адренорецепторівг) при наявності брадикардії знизити дозу або відмінити лікарські засоби, які можуть знизити ЧСС; при необхідності — знизити дозу блокатора бета-адренорецепторів, однак відмінити його застосування тільки у разі явної необхідностід) при відновленні стабільного стану в пацієнта завжди рекомендують оцінити можливість поновлення терапії блокатором бета-адренорецепторів або підвищення його дози |
| V При необхідності інотропної підтримки для терапії пацієнта в стані декомпенсації, якого лікують блокатором бета-адренорецепторів, краще застосовувати інгібітори фосфодіестерази у зв’язку з відсутністю антагонізму між їх гемодинамічними ефектами й ефектами блокаторів бета-адренорецепторівНа лікування до фахівця належить направляти пацієнтів, у яких:а) тяжка серцева недостатність III/IV ФК за NYHAб) серцева недостатність невідомої етіологіїв) є відносні протипоказання: безсимптомна брадикардія та/чи низький артеріальний тискг) непереносимість блокаторів бета-адренорецепторів у низьких дозахд) раніше проведене лікування блокаторами бета-адренорецепторів було відмінено у зв’язку з розвитком відповідних симптомів е) є підозра на наявність бронхіальної астми чи тяжкого захворювання легенівПротипоказання до застосування блокаторів бета-адренорецепторів у пацієнтів із серцевою недостатністю:ж) бронхіальна астмаз) тяжка патологія бронхіви) симптоматична брадикардія чи артеріальна гіпотензія |
Таблиця 14
Початкова, цільова доза й схема титрації дози блокаторів бета-адренорецепторів відповідно до тих, які застосовували в недавно проведених великих контрольованих дослідженнях
| Блокатор бета-адренорецепторів | Початкова доза, мг | Підвищення доз при титрації, мг/добу |
Цільова доза, мг/добу |
Період титрації дози |
| Бізопролол [164] | 1,25 | 2,5; 3,75; 5; 7,5; 10 | 10 | Тижні–місяць |
| Метопрололу ацетат [165] | 12,5/25 | 25; 50; 100; 200 | 200 | |
| Карведилол [54] | 3,125 | 6,25; 12,5; 25; 50 | 50 | |
| Небіволол [58] | 1,25 | 2,5; 5; 10 | 10 |
Примітка. Кратність добового прийому відповідає тій, яку застосовували у наведених випробуваннях.Антагоністи рецепторів до альдостерону
• Антагоністи рецепторів до альдостерону рекомендують застосовувати додатково до терапії інгібіторами АПФ, блокаторами бета-адренорецепторів і діуретиками на пізніх стадіях розвитку серцевої недостатності (III–IV ФК за NYHA) з метою підвищення виживаності й зниження захворюваності (Рекомендація категорії I, рівень доказовості B) [62].
• Антагоністи рецепторів до альдостерону рекомендують призначати з метою зниження смертності додатково до терапії інгібіторами АПФ і блокаторами бета-адренорецепторів при серцевій недостатності після інфаркту міокарда з наявністю систолічної дисфункції лівого шлуночка й ознак серцевої недостатності чи цукрового діабету (Рекомендація категорії I, рівень доказовості B) [63].
У табл. 15 наведено рекомендації щодо застосування і схеми дозування антагоністів альдостерону.
Таблиця 15
Рекомендації щодо застосування і схеми дозування антагоністів альдостерону (спіронолактону, еплеренону)
| • Оцінити, чи у пацієнта серцева недостатність тяжкої форми (III–IV ФК за NYHA), незважаючи на терапію інгібіторами АПФ/діуретиками• Перевірити рівень калію (<5,0 ммоль/л) і креатиніну (<250 мкмоль/л) у сироватці крові• Додати прийом антагоністів альдостерону у низькій добовій дозі (спіронолактон — 12,5–25 мг, еплеренон — 25 мг)• Перевірити через 4–6 днів рівень калію та креатиніну в сироватці крові• Якщо рівень калію в сироватці крові становить 5–5,5 ммоль/л, знизити дозу препарату на 50%. Відмінити препарат, якщо рівень калію >5,5 ммоль/л• Якщо через 1 міс після терапії антагоністами альдостерону симптоми зберігаються й рівень калію в межах норми, підвищити дозу препарату до 50 мг/добу. Перевірити через 1 тиж рівень калію/креатиніну в сироватці крові |
Антагоністи рецепторів до ангіотензину II (АРА II)
Для пацієнтів із систолічною дисфункцією лівого шлуночка:
• АРА II можна застосовувати як альтернативу інгібіторам АПФ у пацієнтів із симптомами непереносимості інгібіторів АПФ з метою зниження смертності й захворюваності (Рекомендація категорії I, рівень доказовості B) [64–67].
• АРА II й інгібітори АПФ, очевидно, однаково ефективні при ХСН щодо зниження смертності й захворюваності (Рекомендація категорії IIa, рівень доказовості B). При гострому інфаркті міокарда з ознаками серцевої недостатності чи дисфункції лівого шлуночка АРА II й інгібітори АПФ подібною чи однаковою мірою знижують смертність (Рекомендація категорії I, рівень доказовості А) [68].
• Пацієнтам, у яких зберігаються симптоми захворювання, можна призначити АРА II в комбінації з інгібіторами АПФ з метою зниження смертності (Рекомендація категорії IIa, рівень доказовості B) і зменшення кількості випадків госпіталізації з приводу серцевої недостатності (Рекомендація категорії I, рівень доказовості А) [65, 69–71, 170].
Щодо пацієнтів із серцевою недостатністю III ФК за NYHA, у яких зберігаються симптоми захворювання, незважаючи на терапію діуретиками, інгібіторами АПФ і блокаторами бета-адренорецепторів, відсутні конкретні докази, що свідчать про те, чи може призначення АРА II чи антагоністів альдостерону зумовити подальше зменшення кількості випадків госпіталізації з приводу серцевої недостатності чи зниження смертності.
Побоювання щодо можливої негативної взаємодії АРА II і блокаторів бета-адренорецепторів, які висловлювалися після проведення початкових клінічних досліджень, не підтверджені результатами недавно проведених клінічних досліджень у пацієнтів у постінфарктний період або із серцевою недостатністю (Рекомендація категорії I, рівень доказовості А) [65, 68].
Дозування
Рекомендації для початку терапії АРА II і моніторингу в ході її проведення подібні з такими, що рекомендують для терапії інгібіторами АПФ (див. табл. 10). Наявні на сьогодні АРА II та їх рекомендовані дози наведені в табл. 16.
Таблиця 16
Наявні на сьогодні АРА II
| Лікарський засіб | Добова доза, мг |
| Засоби з документально підтвердженим впливом на захворюваність/смертність: |
|
| Кандесартан [65] | 4–32 |
| Вальзартан [67] | 80–320 |
| Також є: | |
| Епрозартан [165] | 400–800 |
| Лозартан [166, 167] | 50–100 |
| Ірбесартан [168] | 150–300 |
| Тельмізартан [169] | 40–80 |
Серцеві глікозиди
• Застосування серцевих глікозидів показано при фібриляції передсердь і будь-якому ступені симптоматичної серцевої недостатності, незалежно від наявності чи відсутності дисфункції лівого шлуночка як причини. Серцеві глікозиди знижують частоту скорочень лівого шлуночка, що поліпшує його функції й ослаблює симптоми захворювання (Рекомендація категорії I, рівень доказовості B) [72].
• У пацієнтів з фібриляцією передсердь комбінація препаратів дигоксину й блокаторів бета-адренорецепторів, очевидно, ефективніша від кожного з лікарських засобів окремо (Рекомендація категорії IIa, рівень доказовості B) [73].
• Дигоксин не зумовлює ніякого впливу на смертність, однак може зменшувати кількість випадків госпіталізації й, особливо, випадків госпіталізації з приводу погіршення перебігу серцевої недостатності, зумовленого систолічною дисфункцією лівого шлуночка й синусовим ритмом, у пацієнтів, яким проводили терапію інгібіторами АПФ, блокаторами бета-адренорецепторів, діуретиками й при тяжкій серцевій недостатності — спіронолактоном (Рекомендація категорії IIa, рівень доказовості А).
• Протипоказання до застосування серцевих глікозидів включають брадикардію, AV-блокаду II й III ступеня, синдром слабості синусного вузла, синдром каротидного синусу, синдром Вольфа — Паркінсона — Уайта, обструктивну гіпертрофічну кардіоміопатію, гіпокаліємію, а також гіперкаліємію.
Дигоксин
Звичайна добова доза препаратів дигоксину для прийому всередину становить 0,125–0,25 мг, у разі, якщо рівень креатиніну в сироватці крові знаходиться в діапазоні нормальних значень (у літніх осіб доза дигоксину становить 0,0625–0,125 мг, іноді — 0,25 мг).
Вазодилататори при хронічній серцевій недостатності
• Відсутні спеціальні показання до застосування вазодилататорів прямої дії при ХСН (Рекомендація категорії III, рівень доказовості A), хоча їх можна застосовувати як допоміжну терапію при стенокардії або супутній артеріальній гіпертензії (Рекомендація категорії I, рівень доказовості A).
Комбінація гідралазину й ізосорбіду динітрату
• У разі непереносимості інгібіторів АПФ або АРА II можна призначити комбінацію гідралазину та нітратів з метою зниження смертності й захворюваності, а також покращання якості життя пацієнтів (Рекомендація категорії IIa, рівень доказовості B) [74].
Нітрати
• Препарати нітратів можна застосовувати як допоміжну терапію при стенокардії чи для усунення задишки (Рекомендація категорії IIa, рівень доказовості С). Відсутні докази того, що препарати нітратів для перорального застосування зменшують вираженість симптомів серцевої недостатності при тривалому застосуванні або при загостренні захворювання.
Блокатори альфа-адренорецепторів
• Відсутні дані на користь доцільності застосування блокаторів альфа-адренорецепторів при серцевій недостатності (Рекомендація категорії III, рівень доказовості B) [75].
Антагоністи кальцію
• Антагоністи кальцію не рекомендують застосовувати при серцевій недостатності, зумовленій систолічною дисфункцією. Особливо не рекомендують застосовувати при серцевій недостатності, зумовленій систолічною дисфункцією, антагоністи кальцію типу дилтіазему й верапамілу; а також протипоказане їх застосування додатково до терапії блокаторами бета-адренорецепторів (Рекомендація категорії III, рівень доказовості C) [76, 77].
• Застосування антагоністів кальцію, розроблених пізніше (фелодипіну й амлодипіну), додатково до базової терапії, що включає інгібітори АПФ і діуретики, не підвищує виживаність порівняно із плацебо (Рекомендація категорії III, рівень доказовості A) [76, 77].
Оскільки дані тривалих досліджень щодо безпеки фелодипіну й амлодипіну свідчать про відсутність їх впливу на виживаність, можна розглянути питання про застосування цих засобів як допоміжної терапії при супутній артеріальній гіпертензії чи стенокардії, що не контролюється препаратами нітратів або блокаторами бета-адренорецепторів.
Незиритид
Незиритид є рекомбінантним людським мозковим натрійуретичним пептидом (або натрійуретичним пептидом В-типу). Доведено, що цей лікарський засіб ефективний щодо поліпшення показників, які визначають за бальною шкалою суб’єктивної оцінки диспное, а також спричиняє значне розширення судин при внутрішньовенному введенні пацієнтам з гострою серцевою недостатністю. Досі досвід клінічного застосування незиритиду обмежений. Незиритид може спричиняти розвиток артеріальної гіпотензії, крім того, у деяких пацієнтів може бути відсутня реакція на лікування препаратом.
Засоби з позитивною інотропною дією
• Повторні курси й тривала терапія інотропними засобами для перорального застосування призводять до підвищення смертності, тому їх застосування при ХСН не рекомендується (Рекомендація категорії III, рівень доказовості A).
• Внутрішньовенне введення інотропних засобів широко застосовують у пацієнтів з тяжкою серцевою недостатністю за наявністю ознак як легеневого застою, так і периферичної гіпоперфузії. Однак можливі ускладнення, зумовлені проведенням терапії, та їх вплив на прогноз точно не встановлено; рівень доказовості й сила рекомендацій варіюють залежно від конкретного інотропного засобу [13].
• Попередні результати свідчать про позитивний ефект деяких сенситизаторів кальцію (наприклад левосимендану) відносно симптомів захворювання та функції органів-мішеней, а також їх безпеку [78].
Антитромботичні засоби
• Застосування антикоагулянтів особливо показане при ХСН, асоційованою з фібриляцією передсердь, раніше перенесеною тромбоемболічною подією або рухомим тромбом у лівому шлуночку (Рекомендація категорії I, рівень доказовості А) [79].
• Недостатньо даних, які свідчать про те, що антитромботична терапія знижує ризик смерті або частоту судинних ускладнень у пацієнтів із серцевою недостатністю.
• Застосування ацетилсаліцилової кислоти чи інших пероральних антикоагулянтів рекомендують у пацієнтів після перенесеного інфаркту міокарда як засобу вторинної профілактики (Рекомендація категорії IIa, рівень доказовості C) [80].
• Застосування ацетилсаліцилової кислоти не рекомендують у пацієнтів із повторною госпіталізацією з приводу погіршення перебігу серцевої недостатності (Рекомендація категорії IIb, рівень доказовості B). У зв’язку з можливістю розвитку таких ускладнень, як кровотечі, антикоагулянтну терапію слід призначати у найбільш контрольованих умовах, плануючи моніторинг у спеціалізованих клініках, організованих належним чином.
У пацієнтів із ХСН високий ризик тромбоемболічних ускладнень. До факторів, що спричиняють розвиток тромбоемболії, належать наявність низького серцевого викиду з відносним стазом крові в розширених камерах серця, низькою скоротністю міокарда, регіонарними порушеннями руху серцевої стінки й фібриляцією передсердь. Недостатньо даних, які свідчать на користь застосування супутнього лікування ацетилсаліциловою кислотою в терапії інгібіторами АПФ при серцевій недостатності [81–83].
Частота випадків тромбоемболічних ускладнень при серцевій недостатності досить низька, що обмежує оцінку всіх потенційних позитивних ефектів терапії антикоагулянтами/антиагрегантами у цих пацієнтів.
Антиаритмічні засоби
Застосування антиаритмічних засобів, за винятком блокаторів бета-адренорецепторів, як правило, не показане у пацієнтів із ХСН. Терапія антиаритмічними засобами може бути показана пацієнтам з фібриляцією (зрідка — із тріпотінням) передсердь або зі стійкою чи нестійкою шлуночковою тахікардією.
Антиаритмічні засоби I класу
• Застосування антиаритмічних засобів I класу не рекомендують, оскільки вони можуть провокувати розвиток фатальних шлуночкових аритмій, негативно впливати на гемодинаміку і знижувати виживаність при серцевій недостатності (Рекомендація категорії III, рівень доказовості B) [84].
Антиаритмічні засоби II класу
• Блокатори бета-адренорецепторів знижують частоту випадків раптової смерті при серцевій недостатності (Рекомендація категорії I, рівень доказовості А) [85] (також див. вище «Блокатори бета-адренорецепторів»). Застосування блокаторів бета-адренорецепторів у монотерапії чи в комбінації з аміодароном або в поєднанні з немедикаментозною терапією також може бути показане при лікуванні пацієнтів зі стійкою чи нестійкою шлуночковою тахіаритмією (Рекомендація категорії IIa, рівень доказовості C) [86]
Антиаритмічні засоби III класу
• Аміодарон ефективний при більшості надшлуночкових або шлуночкових аритмій (Рекомендація категорії I, рівень доказовості А). Він може відновлювати й підтримувати синусовий ритм у пацієнтів із серцевою недостатністю і фібриляцією передсердь (навіть при збільшенні лівого передсердя) або підвищувати ефективність електричної кардіоверсії. У цьому разі бажано проводити терапію аміодароном [87, 88]. Аміодарон — єдиний антиаритмічний засіб, що не зумовлює клінічно значимих негативних інотропних ефектів.
• Рутинне застосування аміодарону в пацієнтів із серцевою недостатністю не обґрунтоване (Рекомендація категорії III, рівень доказовості A) [89, 90].
Оксигенотерапія
• Кисень застосовують у лікуванні пацієнтів із ГСН, але, як правило, оксигенотерапію не застосовують при ХСН (Рекомендація категорії III, рівень доказовості C).
Хірургічне лікування та медичні пристроїПроцедури реваскуляризації, хірургічне втручання на мітральному клапані та хірургічне відновлення форми й розмірів шлуночків серця
• При клінічних симптомах серцевої недостатності завжди слід враховувати наявність патології, що піддається хірургічній корекції (Рекомендація категорії I, рівень доказовості С).
Реваскуляризація
• Відсутні будь-які дані багатоцентрових клінічних досліджень, що свідчать на користь застосування реваскуляризації для зменшення вираженості симптомів серцевої недостатності. Результати одноцентрових обсерваційних досліджень при серцевій недостатності ішемічної етіології дозволяють припустити, що реваскуляризація може зумовити поліпшення симптоматики (Рекомендація категорії IIb, рівень доказовості C).
• До одержання результатів рандомізованих досліджень не рекомендують проводити реваскуляризацію (шляхом хірургічного втручання, зокрема за допомогою черезшкірного доступу) як рутинне лікування пацієнтів із серцевою недостатністю й патологією коронарних судин (Рекомендація категорії III, рівень доказовості C).
Втручання на мітральному клапані
• Хірургічні втручання на мітральному клапані у пацієнтів із тяжкою систолічною дисфункцією лівого шлуночка й тяжкою недостатністю мітрального клапана через дилатацію шлуночка можуть зумовлювати симптоматичне поліпшення в окремих пацієнтів із серцевою недостатністю (Рекомендація категорії IIb, рівень доказовості C). Це також справедливо й щодо вторинної мітральної недостатності внаслідок дилатації лівого шлуночка.
Хірургічне відновлення форми і розмірів лівого шлуночка Аневризмектомія лівого шлуночка
• Аневризмектомія лівого шлуночка показана пацієнтам з великими, відособленими аневризмами лівого шлуночка, у яких розвилася серцева недостатність (Рекомендація категорії I, рівень доказовості C).
Кардіоміопластика
• На сьогодні кардіоміопластику не рекомендують для лікування при серцевій недостатност (Рекомендація категорії III, рівень доказовості C).
• Кардіоміопластику не слід розглядати як реальну альтернативу трансплантації серця (Рекомендація категорії III, рівень доказовості C).
Часткова лівостороння вентрикулектомія (операція Батісти)
• Виконання часткової вентрикулектомії для лікування при серцевій недостатності не рекомендують (Рекомендація категорії I, рівень доказовості C). Крім того, операцію Батісти не слід розглядати як альтернативу трансплантації серця (Рекомендація категорії III, рівень доказовості C).
Екстракардіальне відновлення форми й розмірів шлуночка
• На сьогодні не рекомендують втручання щодо екстракардіального відновлення форми й розмірів шлуночка для лікування пацієнтів із серцевою недостатністю. Попередні результати свідчать про сприятливий ефект застосування деяких пристроїв для відновлення розмірів лівого шлуночка й зміни ФК за NYHA (Рекомендація категорії IIb, рівень доказовості C).
Водії ритму серця
• Водії ритму застосовували у пацієнтів із серцевою недостатністю для усунення брадикардії при наявності традиційних показань до застосування. Електрокардіостимуляція тільки правого шлуночка у пацієнтів із систолічною дисфункцією може спричиняти порушення синхронності шлуночкової активності й призвести до збільшення вираженості симптомів (Рекомендація категорії III, рівень доказовості A).
• У пацієнтів зі зниженою фракцією викиду й порушенням синхронності шлуночкової активності (ширина QRS ≥120 мс), у яких, незважаючи на проведення оптимального лікування, зберігаються симптоми серцевої недостатності (III–IV ФК за NYHA), можна розглянути питання про застосування електричної ресинхронізації серця з використанням бівентрикулярної кардіостимуляції (БКС) з метою зменшення вираженості симптомів (Рекомендація категорії I, рівень доказовості А), показників госпіталізації (Рекомендація категорії I, рівень доказовості А) і смертності (Рекомендація категорії I, рівень доказовості B) .
БКС зменшує вираженість симптомів, підвищує толерантність до фізичного навантаження і знижує частоту госпіталізації [91–94]. Недавно продемонстрований сприятливий ефект цього методу щодо зниження сумарного показника віддаленої смертності чи показника госпіталізації з усіх причин, а також значного зниження смертності [171].
Імплантовані кардіовертери-дефібрилятори
• Установка імплантованого кардіовертера-дефібрилятора (ІКД) у поєднанні з БКС може бути доцільна в пацієнтів, у яких зберігаються симптоми тяжкої серцевої недостатності, III–IV ФК за NYHA, із ФВЛШ ≤35% і тривалістю QRS >120 мс, з метою зниження смертності й захворюваності (Рекомендація категорії IIa, рівень доказовості В) [93].
• Лікування з використанням ІКД рекомендують для підвищення виживаності у пацієнтів, які перенесли зупинку серця або в яких є стійка шлуночкова тахікардія, що тяжко переноситься пацієнтами чи супроводжується зниженням систолічної функції лівого шлуночка (Рекомендація категорії I, рівень доказовості A) [95].
• Імплантація ІКД доцільна для зниження ризику раптової смерті в окремих пацієнтів з наявністю симптомів і ФВЛШ <30–35%, але не протягом 40 днів після інфаркту міокарда, яким проводять оптимальну базову терапію, в тому числі інгібіторами АПФ, АРА II, блокаторами бета-адренорецепторів й антагоністами альдостерону (у відповідних випадках) (Рекомендація категорії I, рівень доказовості A) [90, 96, 97].
У пацієнтів із діагностованою стійкою шлуночковою тахікардією чи фібриляцією шлуночків ІКД є високоефективним методом лікування у разі рецидивів цих аритмій завдяки антиаритмічній електрокардіостимуляції чи кардіоверсії-дефібриляції, що зумовлює зниження захворюваності й необхідності повторних госпіталізацій. Використовувані критерії відбору, обмежений період (20 міс) подальшого спостереження в дослідженні MADIT II, підвищена захворюваність у групі пацієнтів з установленим ІКД і низька ефективність витрат не дозволяють екстраполювати отримані результати на загальну популяцію пацієнтів із ХСН. У дослідженні COMPANION, у яке було включено пацієнтів із систолічною дисфункцією лівого шлуночка, широким комплексом QRS, що свідчить про порушення синхронності шлуночкової активності, встановлено, що імплантація ІКД у поєднанні з електричною ресинхронізацією серця у пацієнтів з тяжкою серцевою недостатністю знижували смертність і захворюваність (див. «Електрична ресинхронізація серця») [93]. Однак БКС з імплантацією кардіовертера-дефібрилятора (БКС-ІКД) виявилася не більш ефективною, ніж БКС щодо зниження смертності, тому лікування, що асоціюється з більш низькою захворюваністю й фінансовими витратами, може мати переваги для більшості пацієнтів. Лікування методом БКС-ІКД слід використати як резервне для пацієнтів з дуже високим ризиком раптової смерті, незважаючи на проведення медикаментозної терапії чи лише БКС. Однак необхідно підтвердити економічну ефективність цього методу лікування [98]. У дослідженні SCD-HeFT 2521 пацієнта розподілили методом рандомізації за групами, у яких пацієнти приймали плацебо, аміодарон або їм виконували ІКД із одним відведенням. Після закінчення середнього періоду спостереження, що становив 45,5 міс, відзначали значне зниження смертності у групі пацієнтів з ІКД: відносний ризик становив 0,77 (97,5% ДІ: 0,62–0,96; р=0,007) [90]. У виживаності у групах пацієнтів, які приймали аміодарон або плацебо, не виявлено відмінностей.
У декількох метааналізах, проведених в останні роки, оцінювали ефект імплантації ІКД на загальну смертність у пацієнтів зі зниженою фракцією викиду [83, 99, 100]. Оскільки ефективність ІКД залежить від часу [101], передбачувана тривалість лікування має велике значення для визначення ефективності витрат. Відповідно також слід враховувати вік пацієнтів і наявність супутніх захворювань. Недостатньо добре вивчена ефективність лікування пацієнтів із серцевою недостатністю IV ФК за NYHA, за винятком лікування в поєднанні з БКС при порушенні синхронності шлуночкової активності. Відсутні докази того, що користь цього методу лікування у пацієнтів з дилатаційною кардіоміопатією менша, але оскільки прогноз у цій групі звичайно кращий, то в абсолютному вираженні користь від лікування менша [83].
Втручання щодо заміщення функції серця: трансплантація серця, шлуночкові допоміжні пристрої та штучне серцеТрансплантація серця
• Трансплантація серця — прийнятний метод лікування термінальної стадії серцевої недостатності. Хоча ніколи не проводили контрольованих клінічних досліджень цього методу, однак вважають, що порівняно із традиційними методами лікування він значно підвищує виживаність, толерантність до фізичного навантаження, збільшує кількість випадків повернення до роботи й підвищує якість життя за умови застосування правильних критеріїв відбору пацієнтів (Рекомендація категорії I, рівень доказовості C).
Кандидатами на трансплантацію серця можна вважати пацієнтів з тяжкою серцевою недостатністю, для яких неможливе застосування будь-яких альтернативних методів лікування. При цьому необхідно враховувати наявність предикторів низької виживаності. Однак впровадження у клінічну практику нових методів лікування, очевидно, зумовило зміну прогностичної значимості змінних, які традиційно використовували для виявлення кандидатів на трансплантацію, наприклад, показник пікового споживання кисню (див. вище «Оцінка прогнозу»). Такий пацієнт має хотіти й бути здатним пройти курс інтенсивної медикаментозної терапії, а також бути емоційно врівноваженим для того, щоб витримати стан невизначеності, який, імовірно, не раз може виникати як перед, так і після трансплантації серця. Протипоказання для трансплантації серця наведено в табл. 17.
Крім недостатньої кількості донорських сердець, актуальною проблемою при трансплантації серця є відторгнення алотрансплантата, що спричиняє значну частку випадків смерті протягом першого року після оперативного втручання. Віддалені результати лікування обмежуються переважно наслідками розвитку імуносупресії (інфекції, артеріальна гіпертензія, ниркова недостатність, злоякісні новоутворення й хвороба коронарних судин трансплантата) [102].
Таблиця 17
Протипоказання для трансплантації серця
| • Зловживання алкоголем і/або наркотичними засобами• Відсутність взаємодії• Тяжке психічне захворювання, яке неможливо контролювати належним чином • Стан ремісії після лікування з приводу злоякісного новоутворення, якщо період спостереження становить <5 років• Системне захворювання з поліорганним ураженням• Неконтрольоване інфекційне захворювання• Тяжка ниркова недостатність (кліренс креатиніну <50 мл/хв) або рівень креатиніну в сироватці крові >250 мкмоль/л• Стійкий високий легеневий судинний опір• Недавно перенесене тромбоемболічне ускладнення• Незагойна пептична виразка• Ознаки значного порушення функції печінки• Інші захворювання з несприятливим прогнозом |
Шлуночкові допоміжні пристрої та штучне серце
• Сьогодні показаннями до імплантації шлуночкових допоміжних пристроїв і штучного серця є: забезпечення підготовчого етапу до трансплантації серця, тяжкий гострий міокардит і (у деяких випадках) забезпечення постійної гемодинамічної підтримки (Рекомендація категорії IIa, рівень доказовості C).
• Імплантацію лівошлуночкових допоміжних пристроїв застосовують як засіб забезпечення підготовчого етапу до трансплантації. Незважаючи на накопичення досвіду тривалої терапії із використання цих пристроїв, рутинно застосувати їх протягом тривалого часу не рекомендують (Рекомендація категорії IIb, рівень доказовості B) [103].
Ультрафільтрація
• Ультрафільтрацію можна застосовувати при наявності перевантаження рідиною (у пацієнтів з набряком легенів або з периферичними набряками), рефрактерного до дії діуретиків [104]. Однак у більшості пацієнтів з тяжкою формою захворювання застосування методу зумовлює тимчасове полегшення [105].
Вибір медикаментозної терапії та часу її проведення
Вибір медикаментозної терапії на різних стадіях розвитку серцевої недостатності, зумовленої систолічною дисфункцією, наведено у табл. 18. Перед початком терапії необхідно встановити правильний діагноз і врахувати аспекти, що містяться в «Короткій схемі ведення пацієнтів» (див. табл. 5).
Безсимптомна систолічна дисфункція лівого шлуночка
У цілому чим нижча фракція викиду, тим вищий ризик розвитку серцевої недостатності. Терапію інгібіторами АПФ рекомендують пацієнтам зі зниженою систолічною функцією, яку встановлюють за значним зниженням ФВЛШ (див. інформацію щодо ехокардіографії в розділі «Діагностика хронічної серцевої недостатності»).
Додавання блокаторів бета-адренорецепторів необхідне при лікуванні пацієнтів із безсимптомною дисфункцією лівого шлуночка після гострого інфаркту міокарда (див. вище рекомендації щодо застосування блокаторів бета-адренорецепторів).
Симптоматична систолічна дисфункція лівого шлуночка: серцева недостатність II ФК за NYHA (рис. 4)Систолічна дисфункція з відсутністю ознак затримки рідини
Призначають інгібітори АПФ (див. вище рекомендації щодо інгібіторів АПФ). Титрують до цільової дози, що застосовували у великих клінічних дослідженнях (див. табл. 8). Додають блокатори бета-адренорецепторів (див. рекомендації щодо застосування блокаторів бета-адренорецепторів) і титрують до цільових доз, які застосовували у великих клінічних дослідженнях (див. табл. 14).
Систолічна дисфункція з ознаками затримки рідини
Призначають діуретики в комбінації з інгібітором АПФ, з подальшим призначенням блокатора бета-адренорецепторів. Перш за все слід застосовувати діуретики й інгібітори АПФ. Після зменшення вираженості симптомів (тобто після усунення затримки рідини) необхідно підтримувати оптимальну дозу інгібітора АПФ з подальшим призначенням блокаторів бета-адренорецепторів. Можлива корекція дози діуретика залежно від стабільності стану пацієнта. З метою запобігання гіперкаліємії перед призначенням інгібітора АПФ необхідно виключити калійзберігаючі діуретики із числа застосовуваних діуретичних засобів. Однак у разі збереження гіпокаліємії можна додатково призначити антагоніст альдостерону. Потім додають блокатор бета-адренорецепторів і титрують до цільової дози, яку застосовували у великих клінічних дослідженнях (див. табл. 13). Пацієнтам з наявністю синусового ритму, які приймають серцеві глікозиди і стан яких поліпшився від серцевої недостатності тяжкого ступеня до легкої, необхідно продовжувати терапію серцевими глікозидами (див. вище рекомендації щодо застосування серцевих глікозидів). Щодо пацієнтів, у яких зберігаються симптоми захворювання або стан яких погіршився, слід оцінити доцільність добавлення АРА II (див. вище рекомендації щодо застосування АРА II).
Погіршення перебігу серцевої недостатності (див. рис. 4)
Найчастіші причини погіршення перебігу серцевої недостатності наведено в табл. 19. Пацієнтам, які протягом попередніх 6 міс перейшли із групи IV ФК у групу III ФК за NYHA, або пацієнтам із IV ФК за NYHA слід призначити спіронолактон у низьких дозах (12,5–50 мг/добу — див. вище рекомендації щодо застосування спіронолактону). Часто додають серцеві глікозиди. Можна підвищити дозу петльових діуретиків, також часто ефективні комбінації діуретиків (петльових і тіазидних діуретиків). Доцільність проведення ресинхронізації серця слід розглядати у разі порушення синхронності активності лівого шлуночка. Трансплантація серця, коронарна реваскуляризація, аневризмектомія чи операції на серцевих клапанах можуть відігравати обмежену роль.
Термінальна стадія серцевої недостатності (пацієнти зі стійким IV ФК за NYHA, незважаючи на оптимальне лікування і правильно встановлений діагноз) (див. рис. 4)
Необхідно розглянути (або переглянути) питання про доцільність трансплантації серця. При термінальній стадії серцевої недостатності додатково до вищеописаної медикаментозної терапії можна застосувати тимчасову інотропну підтримку (внутрішньовенне введення симпатоміметиків, допамінергічних агоністів і/або інгібіторів фосфодіестерази), однак цю терапію завжди слід розглядати як перехідний етап до подальшого лікування, що принесе пацієнтові відчутну користь.
Хворим, включеним у список кандидатів на трансплантацію серця, і які у майбутньому будуть проходити процедури підготовчого етапу, може іноді знадобитися циркуляторна підтримка з використанням внутрішньоаортального балонного насоса чи шлуночкових допоміжних пристроїв, гемофільтрації чи діалізу. Ці методи слід застосовувати лише в рамках стратегічного плану тривалого лікування пацієнта.
Завжди необхідно розглядати можливість паліативного лікування пацієнтів з термінальною стадією захворювання, з можливим додаванням опіатів для зменшення вираженості симптомів.
Ведення пацієнтів із серцевою недостатністю при збереженій фракції викиду лівого шлуночка
Хоча результати недавно проведених епідеміологічних досліджень свідчать про те, що серед осіб літнього віку частка пацієнтів, госпіталізованих із приводу симптомів, характерних для серцевої недостатності, і ЗФВЛШ може досягати 35–45%, залишається невстановленим ступінь поширеності діастолічної дисфункції серед пацієнтів із симптомами серцевої недостатності й нормальною систолічною функцією серед населення в цілому. Даних клінічних випробувань або обсерваційних досліджень щодо лікування при серцевій недостатності зі ЗФВЛШ все ще недостатньо.
Серцева недостатність із ЗФВЛШ і серцева недостатність, зумовлена діастолічною дисфункцією, не є синонімами. Перший діагноз означає наявність даних, що свідчать про збережену ФВЛШ, а не доказів діастолічної дисфункції лівого шлуночка.
Діагноз «ізольована діастолічна серцева недостатність» також потребує доказів порушення діастолічної функції, оцінка якої може бути утруднена. Необхідно ідентифікувати й усунути фактори, що погіршують перебіг захворювання, зокрема проводити профілактику тахіаритмії і при будь-якій можливості відновити синусовий ритм. Важливо контролювати ЧСС. Терапевтичні підходи подібні з такими щодо пацієнтів без серцевої недостатності [106].
Медикаментозна терапія серцевої недостатності із ЗФВЛШ або діастолічною дисфункцією
Наведені нижче рекомендації багато в чому мають гіпотетичний характер, оскільки поки що накопичено недостатньо даних про пацієнтів із ЗФВЛШ або діастолічною дисфункцією (загалом Рекомендація категорії IIa, рівень доказовості C)
На сьогодні у нас немає точних доказів того, що у пацієнтів із первинною діастолічною серцевою недостатністю корисна якась спеціальна схема медикаментозної терапії.
1. Інгібітори АПФ можуть безпосередньо поліпшувати релаксацію і розтяжність серцевого м’яза, а також зумовлювати тривалий ефект за допомогою антигіпертензивної дії та зменшення гіпертрофії міокарда й розвитку фіброзу.
2. Діуретики можуть бути необхідні при наявності епізодів перевантаження рідиною, однак їх варто застосовувати з обережністю для того, щоб уникнути надмірного зниження переднавантаження і відповідно — ударного обсягу й серцевого викиду.
3. Блокатори бета-адренорецепторів можна призначити для зниження ЧСС і збільшення періоду діастолічного наповнення.
4. Антагоністи кальцію типу верапамілу можна застосовувати з аналогічною метою [107]. У деяких дослідженнях установлено, що використання верапамілу поліпшує функціональний стан пацієнтів із гіпертрофічною кардіоміопатією [108].
5. Високі дози АРА II можуть знизити частоту госпіталізації [109].
Лікування пацієнтів літнього віку з серцевою недостатністю
Серцеву недостатність переважно виявляють у пацієнтів літнього віку (згідно з даними проведених досліджень середній вік становив близько 75 років). Старіння організму часто супроводжується розвитком супутніх захворювань. До таких захворювань, які часто діагностують, належать артеріальна гіпертензія, ниркова недостатність, обструктивна хвороба легенів, цукровий діабет, інсульт, артрит і анемія. Ці пацієнти приймають чимало лікарських засобів, що спричиняє ризик небажаних лікарських взаємодій і може знижувати ступінь дотримання режиму лікування. Загалом цих пацієнтів виключали з рандомізованих клінічних випробувань. Полегшення симптомів захворювання може бути більш важливою метою лікування багатьох пацієнтів літнього віку, ніж подовження життя.
Інгібітори АПФ і АРА II
Загалом інгібітори АПФ і АРА II ефективні й добре переносяться пацієнтами літнього віку.
Діуретична терапія
В осіб літнього віку тіазидні діуретики часто неефективні у зв’язку зі зниженням швидкості клубочкової фільтрації. У пацієнтів літнього віку частіше відзначають гіперкаліємію при комбінації антагоністів альдостерону та інгібіторів АПФ або НПЗП і коксибів.
Блокатори бета-адренорецепторів
Блокатори бета-адренорецепторів дуже добре переносять особи літнього віку, за винятком пацієнтів з наявністю таких протипоказань, як порушення функції синусно-передсердного вузла, AV-блокада й обструктивна хвороба легенів. Не слід відмовлятися від застосування блокаторів бета-адренорецепторів лише на підставі літнього віку пацієнта.
Серцеві глікозиди
Пацієнти літнього віку більш чутливі до побічних ефектів дигоксину. На початковому етапі терапії рекомендується призначати препарат у низьких дозах пацієнтам з підвищеним рівнем креатиніну в сироватці крові.
Вазодилататори
Необхідно дотримуватися обережності при призначенні засобів, що розширюють венозні судини, наприклад, нітратів, а також гідралазину, що розширює артеріальні судини, та їх комбінацій у зв’язку з ризиком розвитку артеріальної гіпотензії.
Аритмія
• Важливо виявити й усунути фактори, що спричиняють аритмію, необхідно поліпшити функцію серця і знизити ступінь активації нейроендокринної системи за допомогою застосування блокаторів бета-адренорецепторів, інгібіторів АПФ й, можливо, антагоністів рецепторів до альдостерону (Рекомендація категорії I, рівень доказовості C).
Шлуночкова аритмія
• Застосування антиаритмічних засобів у пацієнтів зі шлуночковими аритміями виправдано лише при наявності тяжких симптоматичних шлуночкових тахікардій, при цьому краще призначати аміодарон (Рекомендація категорії IIa, рівень доказовості B) [87, 89].
• Імплантація ІКД показана пацієнтам із серцевою недостатністю й шлуночковою аритмією, що загрожують життю (тобто з фібриляцією шлуночків або стійкою шлуночковою тахікардією), а також окремим пацієнтам з високим ризиком раптової смерті (Рекомендація категорії I, рівень доказовості А) [95, 96, 110–112].
Фібриляція передсердь
• При постійній (не припиняється спонтанно) формі фібриляції передсердь можна розглянути питання про застосування електричної кардіоверсії, хоча ступінь її ефективності може залежати від тривалості фібриляції передсердь і розмірів лівого передсердя (Рекомендація категорії IIa, рівень доказовості B).
• У пацієнтів з фібриляцією передсердь і серцевою недостатністю і/або погіршенням функції лівого шлуночка проведення антиаритмічної терапії для підтримки синусового ритму має бути обмежене аміодароном (Рекомендація категорії I, рівень доказовості С) і дофетилідом (при його доступності) (Рекомендація категорії IIa, рівень доказовості B) [113].
• У безсимптомних пацієнтів можна розглянути доцільність застосування блокаторів бета-адренорецепторів, глікозидів наперстянки чи їх комбінації з метою контролю частоти скорочень шлуночків (Рекомендація категорії I, рівень доказовості B). У пацієнтів із систолічною дисфункцією і наявністю симптомів глікозиди наперстянки є препаратами першого вибору (Рекомендація категорії IIa, рівень доказовості C). При ЗФВЛШ можна розглянути питання про призначення верапамілу (Рекомендація категорії IIa, рівень доказовості C).
• При постійній формі фібриляції передсердь завжди слід оцінювати доцільність проведення антикоагулянтної терапії варфарином при відсутності протипоказань (Рекомендація категорії I, рівень доказовості С).
• Лікування при гострій фібриляції передсердь не залежить від наявності чи відсутності серцевої недостатності. Тактика лікування залежить від наявності симптомів і стабільності гемодинаміки у пацієнта [106].
Симптоматична систолічна дисфункція лівого шлуночка й супутня стенокардія чи артеріальна гіпертензія
Спеціальні рекомендації додатково до загальних принципів лікування пацієнтів із серцевою недостатністю, зумовленою систолічною дисфункцією лівого шлуночка.
При наявності стенокардії:
1) оптимізувати терапію, наприклад, дозу блокаторів бета-адренорецепторів;
2) додатково застосувати нітрати тривалої дії;
3) при відсутності ефекту добавити амлодипін або фелодипін;
4) розглянути питання про доцільність коронарної реваскуляризації.
При наявності артеріальної гіпертензії:
1) оптимізувати дозу інгібіторів АПФ, блокаторів бета-адренорецепторів і діуретиків [40];
2) добавити спіронолактон або АРА II, якщо їх ще не застосовують;
3) при відсутності ефекту спробувати провести терапію похідними дигідропіридину другого покоління.
Догляд і подальше спостереження пацієнтів (табл. 20)
• Результатом організованої системи спеціального лікування пацієнтів із серцевою недостатністю є зменшення вираженості симптомів захворювання і зниження частоти госпіталізації (Рекомендація категорії I, рівень доказовості А) і смертності (Рекомендація категорії IIa, рівень доказовості B) у пацієнтів із серцевою недостатністю [71, 114–118].
• Очевидно, що оптимальність моделі залежатиме від місцевих умов і ресурсів, а також від того, чи вона розроблена для специфічних підгруп пацієнтів (наприклад, залежно від тяжкості серцевої недостатності, віку, супутніх захворювань, а також наявності систолічної дисфункції лівого шлуночка), чи для популяції пацієнтів із серцевою недостатністю загалом (Рекомендація категорії I, рівень доказовості C) [119–122].
Таблиця 20
Рекомендовані компоненти програм з надання допомоги й подальшого спостереження (Рекомендація категорії I, рівень доказовості С)
| • Використання багатопрофільних бригад• Ретельне спостереження, перше спостереження протягом 10 днів після виписки з стаціонару• Планування виписки зі стаціонару• Полегшення доступу пацієнта до одержання медичної допомоги• Оптимізація медикаментозної терапії за допомогою розробки настанов• Швидке реагування на появу ознак і симптомів (наприклад, телемоніторинг)• Гнучка схема призначення діуретиків• Інтенсифікація навчання і консультування пацієнтів• Стаціонарне й амбулаторне (вдома) лікування• Увага стосовно тактики щодо зміни звичок і способу життя• Увага до проблем, що перешкоджають дотриманню режиму лікування |
ЛІТЕРАТУРА
- 1. The Task Force on Heart Failure of the European Society of Cardiology (1995) Guidelines for the diagnosis of heart failure. Eur. Heart J., 16: 741–751.
- 2. The Task Force of the Working Group on Heart Failure of the European Society of Cardiology (1997) The treatment of heart failure. Eur. Heart J., 18: 736–753.
- 3. Remme W.J., Swedberg K. (2001) Guidelines for the diagnosis and treatment of chronic heart failure. Eur. Heart J., 22: 1527–1560.
- 4. Working Group Report (1998) How to diagnose diastolic heart failure? European Study Group on Diastolic Heart Failure. Eur. Heart J., 19: 990–1003.
- 5. Mosterd A., Hoes A.W., de Bruyne M.C. et al. (1999) Prevalence of heart failure and left ventricular dysfunction in the general population. Eur. Heart J., 20: 447–455.
- 6. McDonagh T.A., Morrison C.E., Lawrence A. et al. (1997) Symptomatic and asymptomatic left-ventricular systolic dysfunction in an urban population. Lancet, 350: 829–833.
- 7. Cleland J.G., Khand A., Clark A. (2001) The heart failure epidemic: exactly how big is it? Eur. Heart J., 22: 623–626.
- 8. McMurray J., McDonagh T., Morrison C.E. et al. (1993) Trends in hospitalization for heart failure in Scotland 1980–1990. Eur. Heart J., 14: 1158–1162.
- 9. Cleland J.G., Gemmell I., Khand A. et al. (1999) Is the prognosis of heart failure improving? Eur. J. Heart Fail., 1: 229–241.
- 10. Cleland J.G., Swedberg K., Follath F. et al. (2003) The EuroHeart Failure survey programme — a survey on the quality of care among patients with heart failure in Europe. Part 1: patient characteristics and diagnosis. Eur. Heart J., 24: 442–463.
- 11. Wheeldon N.M., MacDonald T.M., Flucker C.J. et al. (1993) Echocardiography in chronic heart failure in the community. Q. J. Med., 86: 17–23.
- 12. Remes J., Miettinen H., Reunanen A. et al. (1991) Validity of clinical diagnosis of heart failure in primary health care. Eur. Heart J., 12: 315–321.
- 13. Task Force on Acute Heart Failure (2005) Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: The Task Force on Acute Heart Failure of the European Society of Cardiology. Eur. Heart J., 26: 384–416.
- 14. McMurray J., Swedberg K., Hogg K. (2004) Heart failure with preserved left ventricular systolic function. J. Am. Coll. Cardiol., 43: 317–327.
- 15. Wood P. (1950) Heart Failure. In: P. Wood (Ed.) Diseases of the Heart and Circulation. Eyre and Spottiswoode, London.
- 16. Braunwald E. (1977) Heart failure: An overview: In: A.P. Fishma (Ed.) Heart Failure. McGraw-Hill, New York.
- 17. Denolin H., Kuhn H., Krayenbuehl H.P. et al. (1983) The definition of heart failure. Eur. Heart J., 4: 445–448.
- 18. Poole-Wilson P.A. (1989) Chronic heart failure causes pathophysiology, prognosis, clinical manifestations, investigation. In: D.G. Julian, A.J. Camm, K.M. Fox et al. (Eds.) Diseases of the Heart. Bailliere-Tindall, London, p. 48.
- 19. Wang T.J., Evans J.C., Benjamin E.J. et al. (2003) Natural history of asymptomatic left ventricular systolic dysfunction in the community. Circulation, 108: 977–982.
- 20. Lipkin D.P., Canepa-Anson R., Stephens M.R. et al. (1986) Factors determining symptoms in heart failure: comparison of fast and slow exercise tests. Br. Heart J., 55: 439–445.
- 21. Puri S., Baker B.L., Oakley C.M. et al. (1994) Increased alveolar/capillary membrane resistance to gas transfer in patients with chronic heart failure. Br. Heart J., 72: 140–144.
- 22. Butman S.M., Ewy G.A., Standen J.R. et al. (1993) Bedside cardiovascular examination in patients with severe chronic heart failure: importance of rest or inducible jugular venous distension. J. Am. Coll. Cardiol., 22: 968–974.
- 23. Stevenson L.W., Perloff J.K. (1989) The limited reliability of physical signs for estimating haemodynamics in chronic heart failure. JAMA, 10: 884–888.
- 24. Marantz P.R., Tobin J.N., Wassertheil-Smoller S. et al. (1988) The relationship between left ventricular systolic function and congestive heart failure diagnosed by clinical criteria. Circulation, 77: 607–612.
- 25. Adams K.F., Zannad F. (1998) Clinical definition and epidemiology of advanced heart failure. Am. Heart J., 135: S204–S215.
- 26. Killip T., Kimball J.T. (1967) Treatment of myocardial infarction in a coronary care unit. A two year experience with 250 patients. Am. J. Cardiol., 20: 457–464.
- 27. Khot U.N., Jia G., Moliterno D.J. et al. (2003) Prognostic importance of physical examination for heart failure in non-ST-elevation acute coronary syndromes: the enduring value of Killip classification. JAMA, 290: 2174–2181.
- 28. McMurray J., Ostergren J., Pfeffer M. et al. (2003) Clinical features and contemporary management of patients with low and preserved ejection fraction heart failure: baseline characteristics of patients in the Candesartan in Heart failure-Assessment of Reduction in Mortality and morbidity (CHARM) programme. Eur. J. Heart Fail., 5: 261–270.
- 29. Luchner A., Burnett J.C., Jougasaki M. et al. (2000) Evaluation of brain natriuretic peptide as marker of left ventricular dysfunction and hypertrophy in the population. J. Hypertens., 18: 1121–1128.
- 30. Clerico A., Del Ry S., Maffei S. et al. (2002) The circulating levels of cardiac natriuretic hormones in healthy adults: effects of age and sex. Clin. Chem. Lab. Med., 40: 371–377.
- 31. Tsutamoto T., Wada A., Maeda K. et al. (1997) Attenuation of compensation of endogenous cardiac natriuretic peptide system in chronic heart failure: prognostic role of plasma brain natriuretic peptide concentration in patients with chronic symptomatic left ventricular dysfunction. Circulation, 96: 509–516.
- 32. Kruger S., Graf J., Merx M.W. et al. (2004) Brain natriuretic peptide predicts right heart failure in patients with acute pulmonary embolism. Am. Heart J., 147: 60–65.
- 33. Maisel A.S., Krishnaswamy P., Nowak R.M. et al. (2002) Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N. Engl. J. Med., 347: 161–167.
- 34. Working Group Report (1998) How to diagnose diastolic heart failure? European Study Group on Diastolic Heart Failure. Eur. Heart J., 19: 990–1003.
- 35. Caruana L., Petrie M.C., Davie A.P. et al. (2000) Do patients with suspected heart failure and preserved left ventricular systolic function suffer from «diastolic heart failure» or from misdiagnosis? A prospective descriptive study. BMJ, 321: 215–218.
- 36. Thomas J.D., Choong C.Y., Flachskampf F.A. et al. (1990) Analysis of the early transmitral Doppler velocity curve: effect of primary physiologic changes and compensatory preload adjustment. J. Am. Coll. Cardiol., 16: 644–655.
- 37. Sohn D.W., Chai I.H., Lee D.J. et al. (1997) Assessment of mitral annulus velocity by Doppler tissue imaging in the evaluation of left ventricular diastolic function. J. Am. Coll. Cardiol., 30: 474–480.
- 38. Bellenger N.G., Davies L.C., Francis J.M. et al. (2000) Reduction in sample size for studies of remodeling in heart failure by the use of cardiovascular magnetic resonance. J. Cardiovasc. Magn. Reson., 2: 271–278.
- 39. Grothues F., Moon J.C., Bellenger N.G. et al. (2004) Interstudy reproducibility of right ventricular volumes, function, and mass with cardiovascular magnetic resonance. Am. Heart J., 147: 218–223.
- 40. Turnbull F. (2003) Effects of different blood-pressure-lowering regimens on major cardiovascular events: results of prospectively-designed overviews of randomized trials. Lancet, 362: 1527–1535.
- 41. Anker S.D., Ponikowski P., Varney S. et al. (1997) Wasting as independent risk factor for mortality in chronic heart failure. Lancet, 349: 1050–1053.
- 42. Working Group on Cardiac Rehabilitation and Exercise Physiology and Working group on Heart Failure of the European Society of Cardiology (2001) Recommendations for exercise testing in chronic heart failure patients. Eur. Heart J., 22: 37–45.
- 43. The SOLVD Investigators (1992) Effect of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fractions. N. Engl. J. Med., 327: 685–691.
- 44. Pfeffer M.A., Braunwald E., Moye L.A. et al. (1992) Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the survival and ventricular enlargement trial. The SAVE Investigators. N. Engl. J. Med., 327: 669–677.
- 45. Kober L., Torp-Pedersen C., Carlsen J.E. et al. (1995) Effects on mortality by trandolapril after myocardial infarction. N. Engl. J. Med., 333: 1670–1676.
- 46. Jong P., Yusuf S., Rousseau M.F. et al. (2003) Effect of enalapril on 12-year survival and life expectancy in patients with left ventricular systolic dysfunction: a follow-up study. Lancet, 361: 1843–1848.
- 47. Flather M., Yusuf S., Kober L. et al. (2000) Long-term ACE-inhibitor therapy in patients with heart failure or left-ventricular dysfunction: a systematic overview of data from individual patients. ACE-Inhibitor Myocardial Infarction Collaborative Group. Lancet, 355: 1575–1581.
- 48. The CONSENSUS Trial Study Group (1987) Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N. Engl. J. Med., 316: 1429–1435.
- 49. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators (1993) Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. Lancet, 342: 821–828.
- 50. Kaddoura S., Patel D., Parameshwar J. et al. (1996) Objective assessment of the response to treatment of severe heart failure using a 9-minute walk test on a patient-powered treadmill. J. Card. Fail., 2: 133–139.
- 51. Bayliss J., Norell M., Canepa-Anson R. et al. (1987) Untreated heart failure: clinical and neuroendocrine effects of introducing diuretics. Br. Heart J., 57: 17–22.
- 52. Packer M., Bristow M.R., Cohn J.N. et al. (1996) The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. US Carvedilol Heart Failure Study Group. N. Engl. J. Med., 334: 1349–1355.
- 53. Australia/New Zealand Heart Failure Research Collaborative Group (1997) Randomized, placebo-controlled trial of carvedilol in patients with congestive heart failure due to ischaemic heart disease. Lancet, 349: 375–380.
- 54. Packer M., Coats A.J., Fowler M.B. et al. (2001) Effect of carvedilol on survival in severe chronic heart failure. N. Engl. J. Med., 344: 1651–1658.
- 55. CIBIS-II Investigators and Committees (1999) The cardiac insufficiency bisoprolol study II (CIBIS-II): a randomized trial. Lancet, 1999, 353: 9–13.
- 56. MERIT-HF Study Group (1999) Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomized Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet, 353: 2001–2007.
- 57. The RESOLVD Investigators (2000) Effects of metoprolol CR in patients with ischemic and dilated cardiomyopathy. Circulation, 101: 378–384.
- 58. Flather M.D., Shibata M.C., Coats A.J. et al. (2005) Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur. Heart J., 26: 215–225.
- 59. The Capricorn Investigators (2001) Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular dysfunction: the CAPRICORN randomized trial. Lancet, 357: 1385–1390.
- 60. The Beta-Blocker Evaluation of Survival Trial Investigators (2001) A trial of the beta-blocker bucindolol in patients with advanced chronic heart failure. N. Engl. J. Med., 344: 1659–1667.
- 61. Poole-Wilson P.A., Swedberg K., Cleland J.G. et al. (2003) Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomized controlled trial. Lancet, 362: 7–13.
- 62. Pitt B., Zannad F., Remme W.J. et al. (1999) The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N. Engl. J. Med., 341: 709–717.
- 63. Pitt B., Remme W., Zannad F. et al. (2003) Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N. Engl. J. Med., 348: 1309–1321.
- 64. Granger C.B., McMurray J.J., Yusuf S. et al. (2003) Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial. Lancet, 362: 772–776.
- 65. Pfeffer M.A., Swedberg K., Granger C.B. et al. (2003) Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme. Lancet, 362: 759–766.
- 66. Maggioni A.P., Anand I., Gottlieb S.O. et al. (2002) Effects of valsartan on morbidity and mortality in patients with heart failure not receiving angiotensin-converting enzyme inhibitors. J. Am. Coll. Cardiol., 40: 1414–1421.
- 67. Cohn J.N., Tognoni G. (2001) A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. N. Engl. J. Med., 345: 1667–1675.
- 68. Pfeffer M.A., McMurray J.J., Velazquez E.J. et al. (2003) Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N. Engl. J. Med., 349: 1893–1906.
- 69. McMurray J.J., Ostergren J., Swedberg K. et al. (2003) Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet, 362: 767–771.
- 70. Jong P., Demers C., McKelvie R.S. et al. (2002) Angiotensin receptor blockers in heart failure: meta-analysis of randomized controlled trials. J. Am. Coll. Cardiol., 39: 463–470.
- 71. Coletta A.P., Cleland J.G., Freemantle N. et al. (2003) Clinical trials update from the European Society of Cardiology: CHARM, BASEL, EUROPA and ESTEEM. Eur. J. Heart Fail., 5: 697–704.
- 72. Khand A.U., Rankin A.C., Kaye G.C. et al. (2000) Systematic review of the management of atrial fibrillation in patients with heart failure. Eur. Heart J., 21: 614–632.
- 73. Khand A.U., Rankin A.C., Martin W. et al. (2000) Digoxin or carvedilol for the treatment of atrial fibrillation in patients with heart failure? (Abstract). Heart, 83: 30.
- 74. Taylor A.L., Ziesche S., Yancy C. et al. (2004) Combination of isosorbide dinitrate and hydralazine in blacks with heart failure. N. Engl. J. Med., 351: 2049–2057.
- 75. Cohn J.N., Archibald D.G., Ziesche S. et al. (1986) Effect of vasodilator therapy on mortality in chronic congestive heart failure. Results of a Veterans Administration Cooperation Study. N. Engl. J. Med., 314: 1547–1552.
- 76. Cohn J.N., Ziesche S., Smith R. et al. (1997) Effect of the calcium antagonist felodipine as supplementary vasodilator therapy in patients with chronic heart failure treated with enalapril: V-HeFT III. Vasodilator-Heart Failure Trial (V-HeFT) Study Group. Circulation, 96: 856–863.
- 77. Thackray S., Witte K., Clark A.L. et al. (2000) Clinical trials update: OPTIME-CHF, PRAISE-2, ALL-HAT. Eur. J. Heart Fail., 2: 209–212.
- 78. Follath F., Cleland J.G., Just H. et al. (2002) Efficacy and safety of intravenous levosimendan compared with dobutamine in severe low-output heart failure (the LIDO study): a randomized double-blind trial. Lancet, 360: 196–202.
- 79. Cleland J.G., Cowburn P.J., Falk R.H. (1996) Should all patients with atrial fibrillation receive warfarin? Evidence from randomized clinical trials. Eur. Heart J., 17: 674–681.
- 80. Antithrombotic Trialists’ Collaboration (2002) Collaborative meta-analysis of randomized trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ, 324: 71–86.
- 81. Cleland J.G., Findlay I., Jafri S. et al. (2004) The Warfarin/Aspirin Study in Heart failure (WASH): a randomized trial comparing antithrombotic strategies for patients with heart failure. Am. Heart J., 148: 157–164.
- 82. Teo K.K., Yusuf S., Pfeffer M. et al. (2002) Effects of long-term treatment with angiotensin-converting-enzyme inhibitors in the presence or absence of aspirin: a systematic review. Lancet, 360: 1037–1043.
- 83. Cleland J.G., Ghosh J., Freemantle N. et al. (2004) Clinical trials update and cumulative meta-analyses from the American College of Cardiology: WATCH, SCD-HeFT, DINAMIT, CASINO, INSPIRE, STRATUS-US, RIOLipids and cardiac resynchronisation therapy in heart failure. Eur. J. Heart Fail., 6: 501–508.
- 84. The Cardiac Arrhythmia Suppression Trial (CAST) Investigators (1989) Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N. Engl. J. Med., 321: 406–412.
- 85. Lopez-Sendon J., Swedberg K., McMurray J. et al. (2004) Expert consensus document on beta-adrenergic receptor blockers. Eur. Heart J., 25: 1341–1362.
- 86. Steinbeck G., Andresen D., Bach P. et al. (1992) A comparison of electrophysiologically guided antiarrhythmic drug therapy with beta-blocker therapy in patients with symptomatic, sustained ventricular tachyarrhythmias. N. Engl. J. Med., 327: 987–992.
- 87. Amiodarone Trials Meta-Analysis Investigators (1997) Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in congestive heart failure: meta-analysis of individual data from 6500 patients in randomized trials. Amiodarone Trials Meta-Analysis Investigators. Lancet, 350: 1417–1424.
- 88. Levy S., Breithardt G., Campbell R.W. et al. (1998) Atrial fibrillation: current knowledge and recommendations for management. Working Group on Arrhythmias of the European Society of Cardiology. Eur. Heart J., 19: 1294–1320.
- 89. Singh S.N., Fletcher R.D., Fisher S.G. et al. (1995) Amiodarone in patients with congestive heart failure and asymptomatic ventricular arrhythmia. N. Engl. J. Med., 333: 77–82.
- 90. Bardy G.H., Lee K.L., Mark D.B. et al. (2005) Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N. Engl. J. Med., 352: 225–237.
- 91. Linde C., Leclercq C., Rex S. et al. (2002) Long-term benefits of biventricular pacing in congestive heart failure: results from the MUltisite STimulation in cardiomyopathy (MUSTIC) study. J. Am. Coll. Cardiol., 40: 111–118.
- 92. Abraham W.T., Fisher W.G., Smith A.L. et al. (2002) Cardiac resynchronization in chronic heart failure. N. Engl. J. Med., 346: 1845–1853.
- 93. Bristow M.R., Saxon L.A., Boehmer J. et al. (2004) Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N. Engl. J. Med., 350: 2140–2150.
- 94. Bradley D.J., Bradley E.A., Baughman K.L. et al. (2003) Cardiac resynchronization and death from progressive heart failure: a meta-analysis of randomized controlled trials. JAMA, 289: 730–740.
- 95. Moss A.J., Hall W.J., Cannom D.S. et al. (1996) Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N. Engl. J. Med., 335: 1933–1940.
- 96. Moss A.J., Zareba W., Hall W.J. et al. (2002) Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N. Engl. J. Med., 346: 877–883.
- 97. Kadish A., Dyer A., Daubert J.P. et al. (2004) Prophylactic defibrillator implantation in patients with nonischemic dilated cardiomyopathy. N. Engl. J. Med., 350: 2151–2158.
- 98. Jauhar S., Slotwiner D.J. (2004) The Economics of ICDs. N. Engl. J. Med., 351: 2542–2544.
- 99. Nanthakumar K., Epstein A.E., Kay G.N. et al. (2004) Prophylactic implantable cardioverter-defibrillator therapy in patients with left ventricular systolic dysfunction A pooled analysis of 10 primary prevention trials. J. Am. Coll. Cardiol., 44: 2166–2172.
- 100. Desai A.S., Fang J.C., Maisel W.H. et al. (2004) Implantable defibrillators for the prevention of mortality in patients with nonischemic cardiomyopathy: a meta-analysis of randomized controlled trials. JAMA, 292: 2874–2879.
- 101. Salukhe T.V., Dimopoulos K., Sutton R. et al. (2004) Life-years gained from defibrillator implantation: markedly nonlinear increase during 3 years of follow-up and its implications. Circulation, 109: 1848–1853.
- 102. Bennett L.E., Keck B.M., Hertz M.I. et al. (2001) Worldwide thoracic organ transplantation: a report from the UNOS/ISHLT international registry for thoracic organ transplantation. Clin. Transpl., 25–40.
- 103. Rose E.A., Gelijns A.C., Moskowitz A.J. et al. (2001) Long-term mechanical left ventricular assistance for end-stage heart failure. N. Engl. J. Med., 345: 1435–1443.
- 104. Rimondini A., Cipolla C.M., Della Bella P. et al. (1987) Hemofiltration as short-term treatment for refractory congestive heart failure. Am. J. Med., 83: 43–48.
- 105. Dormans T.P., Huige R.M., Gerlag P.G. (1996) Chronic intermittent haemofiltration and haemodialysis in end stage chronic heart failure with oedema refractory to high dose frusemide. Heart, 75: 349–351.
- 106. Fuster V., Ryden L.E., Asinger R.W. et al. (2001) ACC/AHA/ESC Guidelines for the Management of Patients With Atrial Fibrillation: Executive Summary. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Develop Guidelines for the Management of Patients With Atrial Fibrillation) Developed in Collaboration With the North American Society of Pacing and Electrophysiology. Circulation, 104: 2118–2150.
- 107. Setaro J.F., Zaret B.L., Schulman D.S. et al. (1990) Usefulness of verapamil for congestive heart failure associated with abnormal left ventricular diastolic filling and normal left ventricular systolic performance. Am. J. Cardiol., 66: 981–986.
- 108. Bonow R.O., Dilsizian V., Rosing D.R. et al. (1985) Verapamil-induced improvement in left ventricular diastolic filling and increased exercise tolerance in patients with hypertrophic cardiomyopathy: short- and long-term effects. Circulation, 72: 853–864.
- 109. Yusuf S., Pfeffer M.A., Swedberg K. et al. (2003) Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet, 362: 777–781.
- 110. The Antiarrhythmics versus Implantable Defibrillators (AVID) Investigators (1997) A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N. Engl. J. Med., 337: 1576–1583.
- 111. Buxton A.E., Lee K.L., Fisher J.D. et al. (1999) A randomized study of the prevention of sudden death in patients with coronary artery disease. Multicenter Unsustained Tachycardia Trial Investigators. N. Engl. J. Med., 341: 1882–1890.
- 112. Priori S.G., Aliot E., Blomstrom-Lundqvist C. et al. (2001) Task Force on Sudden Cardiac Death of the European Society of Cardiology. Eur. Heart J., 22: 1374–1450.
- 113. Torp-Pedersen C., Moller M., Bloch-Thomsen P.E. et al. (1999) Dofetilide in patients with congestive heart failure and left ventricular dysfunction. Danish Investigations of Arrhythmia and Mortality on Dofetilide Study Group. N. Engl. J. Med., 341: 857–865.
- 114. Rich M.W. (1999) Heart failure disease management: a critical review. J. Card. Fail., 5: 64–75.
- 115. McAlister F.A., Lawson F.M., Teo K.K. et al. (2001) Randomised trials of secondary prevention programmes in coronary heart disease: systematic review. BMJ, 323: 957–962.
- 116. Stewart S., Pearson S., Horowitz J.D. (1998) Effects of a home-based intervention among patients with congestive heart failure discharged from acute hospital care. Arch. Intern. Med., 158: 1067–1072.
- 117. Stewart S., Marley J.E., Horowitz J.D. (1999) Effects of a multidisciplinary, home-based intervention on unplanned readmissions and survival among patients with chronic congestive heart failure: a randomized controlled study. Lancet, 354: 1077–1083.
- 118. Stromberg A. (2003) Nurse-led heart failure clinics improve survival and self-care behaviour in patients with heart failure: results from a prospective, randomized trial. Eur. Heart J., 24: 1014–1023.
- 119. Weinberger M., Oddone E.Z., Henderson W.G. (1996) Does increased access to primary care reduce hospital readmissions? Veterans Affairs Cooperative Study Group on Primary Care and Hospital Readmission. N. Engl. J. Med., 334: 1441–1447.
- 120. Jaarsma T., Halfens R., Huijer Abu-Saad H. et al. (1999) Effects of education and support on self-care and resource utilization in patients with heart failure. Eur. Heart J., 20: 673–682.
- 121. Ekman I., Andersson B., Ehnfors M. et al. (1998) Feasibility of a nurse-monitored, outpatient-care programme for elderly patients with moderate-to-severe, chronic heart failure. Eur. Heart J., 19: 1254–1260.
- 122. McAlister F.A., Stewart S., Ferrua S., McMurray J.J. (2004) Multidisciplinary strategies of the management of heart failure patients at high risk for admission. A systematic review of randomized trials. J. Am. Coll. Cardiol., 44: 810–819.
- 123. Nohria A., Tsang S.W., Fang J.C. et al. (2003) Clinical assessment identifies haemodynamic profiles that predict outcomes in patients admitted with heart failure. J. Am. Coll. Cardiol., 41: 1797–1804.
- 124. Kearney M.T., Fox K.A., Lee A.J. et al. (2002) Predicting death due to progressive heart failure in patients with mild-to-moderate chronic heart failure. J. Am. Coll. Cardiol., 40: 1801–1808.
- 125. Pulignano G., Del Sindaco D., Tavazzi L. et al. (2002) Clinical features and outcomes of elderly outpatients with heart failure followed up in hospital cardiology units: data from a large nationwide cardiology database (IN-CHF Registry). Am. Heart J., 143: 45–55.
- 126. Yancy C.W. (2003) Does race matter in heart failure? Am. Heart J., 146: 203–206.
- 127. Baldasseroni S., Opasich C., Gorini M. et al. (2002) Left bundle-branch block is associated with increased 1-year sudden and total mortality rate in 5517 outpatients with congestive heart failure: a report from the Italian network on congestive heart failure. Am. Heart J., 143: 398–405.
- 128. Mancini D.M., Eisen H., Kussmaul W. et al. (1991) Value of peak exercise oxygen consumption for optimal timing of cardiac transplantation in ambulatory patients with heart failure. Circulation, 83: 778–786.
- 129. Working Group on Cardiac Rehabilitation and Exercise Physiology and Working group on Heart Failure of the European Society of Cardiology (2001) Recommendations for exercise testing in chronic heart failure patients. Eur. Heart J., 22: 37–45.
- 130. Opasich C., Pinna G.D., Bobbio M. et al. (1998) Peak exercise oxygen consumption in chronic heart failure: toward efficient use in the individual patient. J. Am. Coll. Cardiol., 31: 766–775.
- 131. Vrtovec B., Delgado R., Zewail A. et al. (2003) Prolonged QTc interval and high B-type natriuretic peptide levels together predict mortality in patients with advanced heart failure. Circulation, 107: 1764–1769.
- 132. Cintron G., Johnson G., Francis G. et al. (1993) Prognostic significance of serial changes in left ventricular ejection fraction in patients with congestive heart failure. The V-HeFT VA Cooperative Studies Group. Circulation, 87: VI17–VI23.
- 133. Lewis E.F., Moye L.A., Rouleau J.L. et al. (2003) Predictors of late development of heart failure in stable survivors of myocardial infarction: the CARE study. J. Am. Coll. Cardiol., 42: 1446–1453.
- 134. Hohnloser S.H., Klingenheben T., Bloomfield D. et al. (2003) Usefulness of microvolt T-wave alternans for prediction of ventricular tachyarrhythmic events in patients with dilated cardiomyopathy: results from a prospective observational study. J. Am. Coll. Cardiol., 41: 2220–2224.
- 135. Felker G.M., Shaw L.K., O’Connor C.M. (2002) A standardized definition of ischemic cardiomyopathy for use in clinical research. J. Am. Coll. Cardiol., 39: 210–218.
- 136. Nolan J., Batin P.D., Andrews R. et al. (1998) Prospective study of heart rate variability and mortality in chronic heart failure: results of the United Kingdom heart failure evaluation and assessment of risk trial (UK-heart). Circulation, 98: 1510–1516.
- 137. La Rovere M.T., Pinna G.D., Maestri R. et al. (2003) Short-term heart rate variability strongly predicts sudden cardiac death in chronic heart failure patients. Circulation, 107: 565–570.
- 138. Corra U., Mezzani A., Bosimini E. et al. (2002) Ventilatory response to exercise improves risk stratification in patients with chronic heart failure and intermediate functional capacity. Am. Heart J., 143: 418–426.
- 139. Cohn J.N., Johnson G.R., Shabetai R. et al. (1993) Ejection fraction, peak exercise oxygen consumption, cardiothoracic ratio, ventricular arrhythmias, and plasma norepinephrine as determinants of prognosis in heart failure. The V-HeFT VA Cooperative Studies Group. Circulation, 87: VI5–VI16.
- 140. Swedberg K., Eneroth P., Kjekshus J. et al. (1990) Hormones regulating cardiovascular function in patients with severe congestive heart failure and their relation to mortality. CONSENSUS Trial Study Group. Circulation, 82: 1730–1736.
- 141. St John S.M., Lee D., Rouleau J.L. et al. (2003) Left ventricular remodeling and ventricular arrhythmias after myocardial infarction. Circulation, 107: 2577–2582.
- 142. Koelling T.M., Aaronson K.D., Cody R.J. et al. (2002) Prognostic significance of mitral regurgitation and tricuspid regurgitation in patients with left ventricular systolic dysfunction. Am. Heart J., 144: 524–529.
- 143. Dries D.L., Sweitzer N.K., Drazner M.H. et al. (2001) Prognostic impact of diabetes mellitus in patients with heart failure according to the etiology of left ventricular systolic dysfunction. J. Am. Coll. Cardiol., 38: 421–428.
- 144. Gustafsson F., Torp-Pedersen C., Brendorp B. et al. (2003) Long-term survival in patients hospitalized with congestive heart failure: relation to preserved and reduced left ventricular systolic function. Eur. Heart J., 24: 863–870.
- 145. Bittner V., Weiner D.H., Yusuf S. et al. (1993) Prediction of mortality and morbidity with a 6-minute walk test in patients with left ventricular dysfunction. SOLVD Investigators. JAMA, 270: 1702–1707.
- 146. Opasich C., Pinna G.D., Mazza A. et al. (1998) Reproducibility of the six-minute walking test in patients with chronic congestive heart failure: practical implications. Am. J. Cardiol., 81: 1497–1500.
- 147. Gronda E., Mangiavacchi M., Frigerio M. et al. (2000) Determination of candidacy for mechanical circulatory support: importance of clinical indices. J. Heart Lung Transplant., 19: S83–S88.
- 148. Anker S.D., Negassa A., Coats A.J. et al. (2003) Prognostic importance of weight loss in chronic heart failure and the effect of treatment with angiotensin-converting-enzyme inhibitors: an observational study. Lancet, 361: 1077–1083.
- 149. Aaronson K.D., Schwartz J.S., Chen T.M. et al. (1997) Development and prospective validation of a clinical index to predict survival in ambulatory patients referred for cardiac transplant evaluation. Circulation, 95: 2660–2667.
- 150. Dries D.L., Exner D.V., Domanski M.J. et al. (2000) The prognostic implications of renal insufficiency in asymptomatic and symptomatic patients with left ventricular systolic dysfunction. J. Am. Coll. Cardiol., 35: 681–689.
- 151. Ponikowski P., Francis D.P., Piepoli M.F. et al. (2001) Enhanced ventilatory response to exercise in patients with chronic heart failure and preserved exercise tolerance: marker of abnormal cardiorespiratory reflex control and predictor of poor prognosis. Circulation, 103: 967–972.
- 152. Leite J.J., Mansur A.J., de Freitas H.F. et al. (2003) Periodic breathing during incremental exercise predicts mortality in patients with chronic heart failure evaluated for cardiac transplantation. J. Am. Coll. Cardiol., 41: 2175–2181.
- 153. Pozzoli M., Traversi E., Cioffi G. et al. (1997) Loading manipulations improve the prognostic value of Doppler evaluation of mitral flow in patients with chronic heart failure. Circulation, 95: 1222–1230.
- 154. Pinamonti B., Zecchin M., Di Lenarda A. et al. (1997) Persistence of restrictive left ventricular filling pattern in dilated cardiomyopathy: an ominous prognostic sign. J. Am. Coll. Cardiol., 29: 604–612.
- 155. Horwich T.B., Fonarow G.C., Hamilton M.A. et al. (2002) Anemia is associated with worse symptoms, greater impairment in functional capacity and a significant increase in mortality in patients with advanced heart failure. J. Am. Coll. Cardiol., 39: 1780–1786.
- 156. Ghio S., Gavazzi A., Campana C. et al. (2001) Independent and additive prognostic value of right ventricular systolic function and pulmonary artery pressure in patients with chronic heart failure. J. Am. Coll. Cardiol., 37: 183–188.
- 157. Polak J.F., Holman B.L., Wynne J. et al. (1983) Right ventricular ejection fraction: an indicator of increased mortality in patients with congestive heart failure associated with coronary artery disease. J. Am. Coll. Cardiol., 2: 217–224.
- 158. Ammann P., Maggiorini M., Bertel O. et al. (2003) Troponin as a risk factor for mortality in critically ill patients without acute coronary syndromes. J. Am. Coll. Cardiol., 41: 2004–2009.
- 159. Petrie M.C. (2003) It cannot be cardiac failure because the heart is not enlarged on the chest X-ray. Eur. J. Heart Fail., 5: 117–119.
- 160. Anker S.D., Doehner W., Rauchhaus M. et al. (2003) Uric acid and survival in chronic heart failure: validation and application in metabolic, functional, and haemodynamic staging. Circulation, 107: 1991–1997.
- 161. Cohn J.N., Johnson G., Ziesche S. et al. (1991) A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive heart failure. N. Engl. J. Med., 325: 303–310.
- 162. The SOLVD Investigators (1991) Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. The SOLVD Investigators. N. Engl. J. Med., 325: 293–302.
- 163. Packer M., Poole-Wilson P.A., Armstrong P.W. et al. (1999) Comparative effects of low and high doses of the angiotensin-converting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure. ATLAS Study Group. Circulation, 100: 2312–2318.
- 164. CIBIS-II Investigators and Committees (1999) The cardiac insufficiency bisoprolol study II (CIBIS-II): a randomized trial. Lancet, 1999, 353: 9–13.
- 165. Murdoch D.R., McDonagh T.A., Farmer R. et al. (2001) ADEPT: Addition of the AT1 receptor antagonist eprosartan to ACE-inhibitor therapy in chronic heart failure trial: haemodynamic and neurohormonal effects. Am. Heart J., 141: 800–807.
- 166. Pitt B., Poole-Wilson P.A., Segal R. et al. (2000) Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomized trial — the Losartan Heart Failure Survival Study ELITE II. Lancet, 355: 1582–1587.
- 167. Dahlof B., Devereux R.B., Kjeldsen S.E. et al. (2002) Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol. Lancet, 359: 995–1003.
- 168. Tonkon M. (2000) A study of the efficacy and safety of irbesartan in combination with conventional therapy, including ACE-inhibitors, in heart failure. Irbesartan Heart Failure Group. Int. J. Clin. Pract., 54: 11–14.
- 169. Dunselman P.H. (2001) Effects of the replacement of the angiotensin converting enzyme inhibitor enalapril by the angiotensin II receptor blocker telmisartan in patients with congestive heart failure. The replacement of angiotensin converting enzyme inhibition (REPLACE) investigators. Int. J. Cardiol., 77: 131–138.
- 170. McMurray J.J., Ostergren J., Swedberg K. et al. (2003) Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet, 362: 767–771.
- 171. Cleland J.G., Daubert J.C., Erdmann E. et al. (2005) The effect of cardiac resynchronization on morbidity and mortality in heart failure. N. Engl. J. Med., 352: 1539–1549.
З питань розповсюдження накладу видання звертайтеся до представництва «Ріхтер Гедеон рт.» в Україні:
01054, Київ, вул. Тургенєвська 17Б,
тел.: (044) 492-99-11, 492-99-19, факс: (044) 492-99-10,
www.richter.com.ua, e-mail: [email protected]
Примітки: АТ — артеріальний тиск; VE — хвилинний об’єм дихання; VCO2 — хвилинний об’єм видихуваного СО2.*Наявність сильної кореляції.*Адреса для листування: Karl Swedberg, Department of Medicine, Sahlgrenska University Hospital/Östra, Sahlgrenska Academy at Göteborg University, SE-416 85 Göteborg, Sweden. Tel: +46 31 3434078; fax: + 46 31 258933. E-mail address: [email protected]





