ВВЕДЕНИЕ
Среди лучевых методов диагностики особое место занимает рентгеновская компьютерная томография (КТ), которая на современном этапе развития получила широкое применение в медицинской практике и стала неотъемлемой частью диагностических исследований многих органов и систем при изучении их патологических изменений в анатомическом и молекулярном форматах (Позмогов А.И. и соавт., 1992; Китаев В.В., 1996; Терновой С.К., Синицин В.Е., 1998; Endo M. et al., 2003; Catalano C., Passariello R., 2004; Залесский В.Н., Дынник О.Б., 2005). Точное распознавание, определение характера многих заболеваний, особенно на ранних стадиях патологического процесса, оценка эффективности лечения стали возможными в настоящее время на основе КТ. Чувствительность и точность КТ в диагностике заболеваний внутренних органов превышает возможности многих других инструментальных методов исследования и составляет 85–90% (Рогожин В.А. и соавт., 2004; Fishman E.K., 2004). С помощью КТ получают поперечные срезы любого участка тела человека, позволяющие судить о топографии органов, локализации, характере и протяженности очаговых образований, их взаимосвязи с окружающими тканями и, таким образом, иметь трехмерное представление о патологическом процессе. Динамические исследования с контрастированием также позволяют судить о функциональном состоянии органов (Габуния Р.И., Колесникова Е.К., 1995). Самым технологичным является в настоящее время процесс объемного спирального сканирования. Основными его достоинствами являются быстрое сканирование и связанное с этим увеличение количества исследований, полное исключение пропуска срезов благодаря возможности исследования на одной задержке дыхания, возможность синхронизировать процесс быстрого сканирования с введением большого количества контрастного вещества (болюсное контрастирование) и выполнять КТ в разные временные интервалы от начала его введения (Терновой С.К., Синицын В.Е., 1998; Рогожин В.А. и соавт., 2004).
Получивший свое развитие еще в 1998 г. метод спиральной КТ (СКТ) сегодня стал одним из наиболее общепризнанных диагностических технологий прижизненной неинвазивной визуализации в клинике. КТ-сканеры с 8 спиралями прошли клиническое испытание в 2001 году и с 16 спиралями — в 2002 г. (Hofer M., 1995). Три вида детекторных карабинов были апробированы в рамках дизайна СКТ на 4 спиралях: «матриксного» (General Electric Medical Systems) и «адаптивного» (Siemens Medical Solution) типов, а также в формате «гибридных» детекторов. 8-спиральный томограф поддерживает «матриксный» дизайн детекторного ряда (Hoppenrath M., 2004). В 16-спиральном томографе «матриксный» и «адаптивный» тип детекторов трансформированы в гибридный формат СКТ-дизайна, который отличает 16-спиральный томограф оптимальной структурой карабина детекторных ячеек (16×0,5 мм, Toshiba; 16×0,625 мм, General Electric Medical Systems; 16×0,75 мм, Siemens Medical Solution) (Hanafusa K. et al., 2004).
Следует отметить, что сама по себе СКТ мало чем отличается от традиционных методик КТ и ее применение имеет смысл лишь в сочетании с болюсным контрастным усилением, позволяющим получать сочетанную картину контрастированных сосудов и органов, а также оценивать особенности кровотока внутри органа. Использование неионных контрастных препаратов резко повысило надежность и безопасность контрастного исследования при СКТ (Кармазановский Г.Г. и соавт., 2000). В обзорном аналитическом исследовании рассмотрены особенности КТ-визуализации диффузных поражений печени по материалам клинических исследований, представленных в отечественной и зарубежной литературе.
ПРОТОКОЛЫ СПИРАЛЬНОЙ
КТ-ВИЗУАЛИЗАЦИИ ПАТОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ ПЕЧЕНИ
Процедура проведения СКТ печени включает три фазы визуализирующего контрастирования: 1) раннюю (артериальную), 2) позднюю (артериально-венозную, портальную) и 3) отсроченную (печеночную) (Oliver J.H., Baron R.L., 1996; Oliver J.H. et al., 1996; Foley W.D. et al., 2000; Foley W.D., Kerimoglu U., 2004). Некоторые исследователи выделяют еще период циркуляторной фазы (Foley W.D. et al., 2000; Foley W.D., Kerimoglu U., 2004). Циркуляторная фаза наступает с момента предварительного введения мини-болюса (скорость 5 см3/с, объем до 15 см3) йодсодержащего контрастного вещества.
Первый скан для получения «сырых» данных осуществляют через 10 с после внутривенного введения болюса (на уровне надцелиакального сегмента аорты) с повторными одиночными или через каждые 0,2 с сканами (на протяжении 20 с). Это позволяет сравнивать кривую прохождения болюса контрастного вещества через определенную область интереса с уровнем его перемещения по аорте. Представленная на рис. 1 кривая характеризует «профиль» болюса — время повышения, пика и снижения концентрации контрастного вещества в области интереса (Foley W.D. et al., 2000; Foley W.D., Kerimoglu U., 2004). При этом индивидуальное различие времени циркуляции контрастного соединения зависит от частоты сердечных сокращений больного, сердечного выброса и объема циркулирующей крови. Необходимо отметить, что время аортального пика может колебаться от 12 до 30 с у отдельных пациентов. Однако ранняя (артериальная) фаза может быть зарегистрирована только на протяжении первых 10 с прохождения болюса контрастного вещества по аорте.
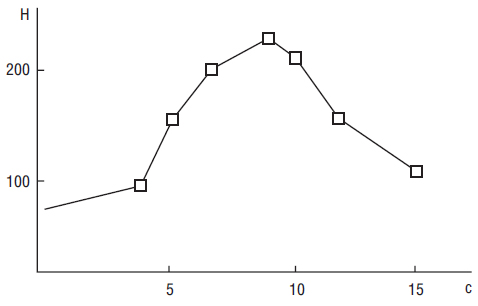
Рис. 1. Кривая «плотность — время» отображает контрастное усиление брюшной аорты (на уровне чревного ствола — truncus coeliacus) при внутривенном введении болюса контрастного вещества (концентрация йода — 370 мг/мл) со скоростью
5 см3/с на протяжении 3 с (Foley W.D., Kerimoglu U., 2004). Рентгеновская плотность изображения крови внутри аорты повышается (во время циркуляции болюса) через 5–8 с после его введения. Горизонтальная линия — шкала времени (с), нулевая отметка которой соответствует величине контрастного усиления Н (вертикальная линия) через 10 с после введения мини-болюса. Аортальный пик соответствует 18 с после инъекции мини-болюса
При проведении СКТ с болюсным контрастным усилением поздняя (портальная) фаза начинается через 15 с после аортального пика (рис. 2). Обе фазы печеночного кровотока — ранняя (артериальная) и поздняя (портальная) — могут быть зарегистрированы на одной задержке дыхания. Начало печеночной фазы соответствует 45 с после портального пика на кривой контрастного усиления (см. рис. 2) (Foley W.D., Kerimoglu U., 2004).
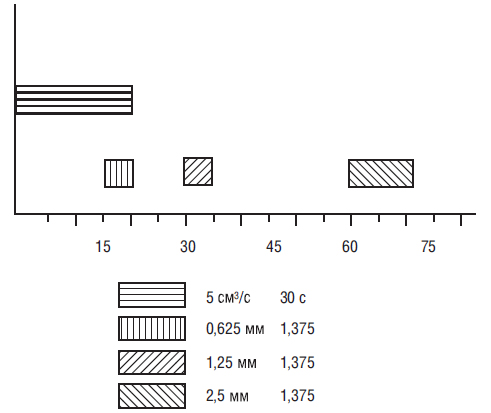
Рис. 2. Схема протокола трехфазного (ранняя, поздняя и отсроченная фазы) контрастирования сосудистых структур для проведения СКТ печени, выполненной на установке LightSpeed (General Electric Medical Systems) (Foley W.D., Kerimoglu U., 2004). Достижение болюсом выбранной зоны интереса определялось его скоростью введения и объемом контрастного вещества (5 см3/с, 150 см3) с предварительным выполнением процедуры введения мини-болюса. В ранней (артериальной) фазе использовали следующие параметры: коллимация = 0,625 мм, шаг спирали (питч; pitch) = 1,375; в поздней портальной фазе они составляли 1,25 мм и 1,375 соответственно. Для отсроченной (печеночной) фазы они составляли 2,5 мм и 1,375. Временное разрешение для всех фаз болюсного контрастирования — от 0,5 до 0,7 с.
Ранняя (артериальная) фаза требует оптимальных значений коэффициента ослабления рентгеновского излучения для проведения СКТ-ангиографии с болюсным контрастным усилением — в пределах 250–300 единиц Хаунсфилда (Hounsfield units/HU) — с целью обеспечения оптимального набора «сырых» данных и последующей реконструкции изображения сосудистого рисунка печени. Оптимальными условиями являются скорость введения и объем вводимого болюса для контрастирования (5 см3/с; концентрация йода в контрастном веществе — 300–370 мг/мл) (Foley W.D., Kerimoglu U., 2004). При этом снижение объема вводимого болюса контрастного вещества (при высокой концентрации йодсодержащего соединения) позволяет отчетливо усилить контрастирование как в портальную, так и печеночную фазы СКТ-визуализации. Коллимация изображения с целью реконструкции сосудистого русла должна быть не выше чем 2,5 мм и, предпочтительно, соответствовать пределам 1–1,25 мм. В среднем проекция печени на брюшную стенку при сканировании в каудальном направлении составляет 16 см, однако она может находиться в пределах 20 см и выше (Kopka L. et al., 1996). Установка СКТ с 4 спиралями (General Electric LightSpeed Plus) позволяет осуществлять коллимирование изображения (при толщине среза до 2,5 мм) в сочетании с одновременным поступательным движением стола в момент одного поворота гентри на 15 мм (питч = 1,5), а также длительностью времени поворота гентри 0,5–0,7 с в пределах поверхности области интереса равной 20 см (табл. 1) (Foley W.D., Kerimoglu U., 2004).
Таблица 1
Основные параметры сканирования при 4-спиральной КТ-визуализации сосудов печени с болюсным контрастным усилением (Foley W.D. et al., 2000; Foley W.D., Kerimoglu U., 2004)
|
Параметр |
Фазы контрастирования |
||
|
Ранняя (артериальная) |
Поздняя (портальная) |
Отсроченная (печеночная) |
|
|
Коллимация (толщина слоя), мм |
1,5 |
2,2 |
3,75 |
|
Шаг спирали («pitch») |
1,5 |
1,5 |
1,5 |
|
Ширина луча (мм) |
10,0 |
10,0 |
20,0 |
|
Длительность поворота гентри (с) |
0,5 |
0,5 |
0,5 |
|
Скорость движения стола (мм/с) |
30,0 |
30,0 |
45,0 |
|
Скорость введения болюса (см3/с) |
5,0 |
||
|
Объем вводимого болюса (см3) |
150,0 |
||
Восьмиспиральная установка КТ (General Electric LightSpeed Ultra), при использовании динамического дизайна конфигурации детекторов (от 4×2,5 мм до 8×1,25 мм), питча = 1,35 и времени вращения гентри 0,5–0,7 с, обеспечивает возможность достаточного расширения луча для проведения детектор-ассоциированного сканирования. При этом определенное повышение разрешающей способности СКТ с болюсным контрастным усилением (по Z-оси как в режиме СКТ-артериографии, так и СКТ-портовенографии) может быть достигнуто с помощью оптимизации скорости смещения стола (табл. 2).
Таблица 2
Основные параметры сканирования при 8-спиральной КТ-визуализации сосудов печени с болюсным контрастным усилением (Foley W.D., Kerimoglu U., 2004)
|
Параметры |
Фазы контрастирования |
||
|
Ранняя (артериальная) |
Поздняя (портальная) |
Отсроченная (печеночная) |
|
|
Коллимация (толщина слоя), мм |
1,25 |
1,25 |
2,5 |
|
Шаг спирали («pitch») |
1,35 |
1,35 |
1,35 |
|
Ширина луча (мм) |
10,0 |
20,0 |
20,0 |
|
Длительность поворота гентри (с) |
0,5 |
0,5 |
0,5 |
|
Скорость движения стола (мм/с) |
27,5 |
54,0 |
54,0 |
|
Скорость введения болюса (см3/с) |
5,0 |
||
|
Объем вводимого болюса (см3) |
150,0 |
||
16-спиральная КТ (General Electric LightSpeed 16) имеет такую конфигурацию расположения детекторов, которая позволяет визуализировать изменения в ранней (артериальной) фазе контрастирования печени в условиях соответствующего дизайна (от 8×1,25 — 8-спиральная КТ до 16×0,625 — 16-спиральная КТ) и обеспечивает повышение разрешающей способности по Z-оси.
Для проведения СКТ-визуализации в артериальной фазе контрастирования печени, а также в фазе портального кровотока используется соответствующая конфигурация расположения детекторов (16×1,25) с питчем = 1,375 и временем ротации гентри 0,5–0,7 с при временном разрешении 4–5 с (табл. 3). Для отсроченной (печеночной) фазы наибольшая чувствительность системы СКТ-визуализации печени соответствует оптимальным условиям конфигурации расположения детекторов (4×2,5 мм — 4-спиральная КТ; 8×1,25 мм — 8-спиральная КТ и 16×1,25 — 16-спиральная КТ) (Foley W.D., Kerimoglu U., 2004).
Таблица 3
Основные параметры сканирования при 16-спиральной КТ-визуализации сосудов печени с болюсным контрастным усилением (Foley W.D., Kerimoglu U., 2004)
|
Параметры |
Фазы контрастирования |
||
|
Ранняя (артериальная) |
Поздняя (портальная) |
Отсроченная (печеночная) |
|
|
Коллимация (толщина слоя), мм |
0,6255 |
1,25 |
2,5 |
|
Шаг спирали («pitch») |
1,375 |
1,375 |
1,375 |
|
Ширина луча (мм) |
10,0 |
20,0 |
20,0 |
|
Длительность поворота гентри (с) |
0,5 |
0,5 |
0,5 |
|
Скорость движения стола (мм/с) |
27,5 |
55,0 |
55,0 |
|
Скорость введения болюса (см3/с) |
5,0 |
||
|
Объем вводимого болюса (см3) |
150,0 |
||
МОРФОФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ ЦИРРОТИЧЕСКИХ ИЗМЕНЕНИЙ ПЕЧЕНОЧНОЙ ТКАНИ
Цирроз печени (ЦП) — хроническое прогрессирующее полиэтиологическое заболевание, характеризирующееся диффузным разрастанием соединительной ткани, патологической узловой регенерацией паренхимы с образованием псевдодолек, уменьшением количества функционирующих полноценных гепатоцитов, а также перестройкой структуры паренхимы и сосудистой сети (Подымова С.Д., 1984). Неотъемлемые атрибуты ЦП — портальная гипертензия (ПГ) и печеночная недостаточность, которые являются основными причинами смерти больных. Независимо от того, какой именно причинный фактор инициировал ЦП, в его механизме есть общие звенья, включающие гипоксию и некроз гепатоцитов, вслед за которыми начинается патологическая регенерация с образованием псевдодолек, диффузным разрастанием соединительной ткани (Логинов А.С., Аруин Л.И., 1985). Важнейшей чертой ЦП считается перестройка сосудистой архитектоники. Вследствие процессов воспаления и некроза, разрастания соединительной стромы и образования множества узлов в печени возникает сдавление и синусоидов, мелких внутрипеченочных сосудов. Беспорядочно образующиеся очаги регенерации печеночных клеток также сдавливают и отодвигают разветвления воротной вены (Murakami T. et al., 2001). В итоге портальное русло деформируется, что ведет к застою в системе воротной вены и перестройке сосудистой системы в органе. Развиваются прямые внутрипеченочные анастомозы между ветвями воротной и печеночных вен, которые, не устраняя ПГ, приводят к неэффективности органного кровотока. Одновременно развиваются множественные артериопортальные шунты. Компенсаторное расширение печеночной артерии и увеличение кровотока по ней способствует поддержанию перфузии синусоидов (Murakami T. et al., 2001). В создавшихся условиях повышается влияние артериального кровотока на портальный. Передача гидродинамического давления по печеночной артерии приводит к значительному повышению уровня портального давления. Таким образом обширные артериовенозные анастомозы, усиление тока артериальной крови и трудности ее оттока из печени приводят к повышению сопротивления кровотоку по портальным сосудам и рассматриваются как наиболее существенные причины ПГ у больных ЦП (Шерлок Ш., Дули Дж., 1999). При этом доля участия артериальной системы в кровоснабжении печени увеличивается с 25–30% до 45–75% (Максименков А.Н., 1972). Хотя патогенез ПГ окончательно не выяснен, в ее возникновении, помимо указанных причин, имеют место функциональные и нейрогенные влияния. Нарушение кровоснабжения в системе воротной вены также всегда связано с нарушением кровотока в сосудах селезенки (Шерлок Ш., Дули Дж., 1999; Murakami T. et al., 2001).
Механизм нарушения сосудистой архитектоники печени при развитии ЦП достаточно сложный. Даже в настоящее время этот вопрос остается в стадии обсуждения. Для правильного понимания ЦП важно подчеркнуть диффузность процесса, то есть вовлечение всего органа, хотя степень поражения долей может быть разной. К ЦП не относится ни очаговая гиперплазия печени, ни очаговый фиброз с участками регенераторной гиперплазии на месте поврежденной паренхимы. Не является циррозом и врожденный фиброз: хотя при нем выявляют узелки, однако нет диффузной нодулярной перестройки паренхимы — первого и основного признака ЦП. Узелки представляют собой округлые участки паренхимы, окруженные соединительной тканью. Они могут быть образованы как сохранившимися, так и регенерировавшимися гепатоцитами. В связи с этим все узелки в цирротически измененной печени называть регенераторными нельзя (Китаев В.В., 1996).
Условиями развития необратимого склероза при ЦП, по мнению В.В. Серова и А.Б. Шехтера (1981), являются: 1) массивные и диффузные повреждения паренхимы, ведущие к разрушению структурно-функциональных элементов и дезинтеграции паренхиматозно-стромальных взаимодействий; 2) длительное воздействие экзо- или эндогенных факторов (действие алкоголя, персистирование вируса); 3) поломка регуляторных систем; 4) дефекты синтеза и катаболизма (цит. по: Китаев В.В., 1996).
Все это приводит к нарушению ауторегуляции роста соединительной ткани, при этом синтез коллагена превалирует над его катаболизмом. При морфологическом исследовании биоптатов выявляли разрастание коллагеновых волокон в портальных трактах, внутри дольки, вокруг центральных вен, образование портоцентральных и портопортальных септ (Логинов А.С., Аруин Л.И., 1985). ЦП у человека — процесс необратимый, что однако не исключает принципиальной возможности его обратного развития. Обратное развитие ЦП в некоторых ситуациях позволило авторам высказать мнение, что известная формула «цирроз — всегда цирроз» не универсальна (Логинов А.С., Аруин Л.И., 1985). В последнее время ведущими учеными мира осуществлена разработка принципиально нового подхода к лечению ЦП. Ожидается появление препаратов, активирующих внеклеточные протеазы, тормозящих развитие апоптоза и обеспечивающих разложение коллагена. Хорошие результаты дает трансплантация стволовых клеток костного мозга (Kobayashi N. et al., 2000; Lagasse E. et al., 2000; Mallet V.O. et al., 2002; Masson S. et al., 2004). В будущем, возможно, будет разработана генная терапия, позволяющая непосредственно блокировать синтез белков соединительной ткани (Grossman M. et al., 1995; Kobayashi N. et al., 2000).
Выделяют мелкоузловую, крупноузловую и смешанную формы ЦП. Мелкоузловая форма наблюдается при алкогольном циррозе, билиарной обструкции, гемохроматозе, длительном нарушении венозного оттока из печени, болезни Вильсона, индийском детском циррозе. Крупноузловой цирроз встречается при вирусных гепатитах, недостаточности α1-антитрипсина. Смешанная форма (микромакронодулярный цирроз) диагностируется, когда количество мелких и крупных узлов приблизительно одинаково (Логинов А.С., Аруин Л.И., 1985). Однако в процессе заболевания размеры узелков могут изменяться. Сформировавшийся цирроз не является статическим процессом, он зависит от активности фибробластов в септах и в узелках, от наличия очагов некроза и апоптоза в сохранившейся паренхиме и от адекватности ее кровоснабжения (Mergo P.J., Ros P.R., 1998).
Основная масса циррозов — не самостоятельное заболевание, а цирроз, вышедший из вирусного гепатита. Вторая по частоте причина — хронический алкоголизм. По данным ряда исследователей в последнее время участилось развитие первичного рака печени на фоне цирроза. Отмечено, что около 50% узлов цирротической печени диаметром менее 1 см не имели опухолевой природы (Zardi E.M. et al., 2001). По мнению ряда авторов при диаметре образования более 2 см можно с уверенностью диагностировать гепатоцеллюлярную карциному (ГЦК) (Baron R.L. et al., 1996; Okano H. et al., 2001).
ОСОБЕННОСТИ СКТ-ВИЗУАЛИЗАЦИИ ДИФФУЗНЫХ ПОРАЖЕНИЙ ПЕЧЕНОЧНОЙ ТКАНИ
Основным дифференциально-диагностическим КТ-критерием при диффузных заболеваниях печени являются изменения ее величины, формы, денситометрических показателей, реже — структуры (Кармазановский Г.Г. и соавт., 1997; Mergo P.J., Ros P.R., 1998). Наиболее успешно из диффузных поражений КТ позволяет распознать жировую дистрофию печени (Габуния Р.И., Колесникова Е.К., 1995). Анализируя литературные данные, следует отметить, что большинство авторов выявляют такие КТ-признаки ЦП: узловатый, неровный край зачастую уменьшенной печени (чувствительность — 40,5%, специфичность — 95,9%), уменьшение в размерах правой доли, неоднородность паренхимы, увеличение селезенки, увеличение диаметра воротной и селезеночных вен (Кармазановский Г.Г. и соавт., 1997; Мизандари М. и соавт., 2002).
Некоторые исследователи (Габуния Р.И., Колесникова Е.К., 1995) с помощью КТ предлагают дифференцировать различные типы ЦП. Вопрос об изменении печени в размерах при ЦП остается спорным. Прежде всего потому, что существуют индивидуальные особенности строения и размеров органов у человека. КТ-картина печени имеет различные варианты не только при патологии, но даже в норме за счет изменения формы и объема ее долей и сегментов. Так, по данным G.D. Dodd и соавторов (1999a, b), в конечной стадии ЦП при КТ у 25% пациентов печень была нормальных размеров и формы, а у 36% — диффузно уменьшенная. Авторы отметили, что при выраженном ЦП выявляют не диффузное изменение ее размеров, а их соотношение между долями и сегментами. Наиболее часто в конечной стадии ЦП наблюдается атрофия правой доли, медиального сегмента и гипертрофия хвостатой доли. Этот феномен впервые описали W.P. Harbin и соавторы (1980). Редко встречается ограниченная атрофия латеральных и задних сегментов — преимущественно у пациентов, страдающих первичным склерозирующим холангитом. У той же группы больных наблюдается гиперденсивность увеличенной хвостатой доли, которая производит впечатление органа на фоне развития «псевдотуморозного» процесса. У пациентов с первичным билиарным циррозом печени чаще всего наблюдается диффузное увеличение органа (Dodd G.D. et al., 1999a, b; Caldwell S.H. et al., 2001).
В последнее время появляется все больше работ, посвященных КТ диффузных заболеваний печени (Vignaux O. et al., 1999; Foley W.D. et al., 2000; Васильев А.Ю. и соавт., 2003; Foley W.D., Kerimoglu U., 2004). Это связано с внедрением спиральных компьютерных томографов, с помощью которых можно провести исследование с внутривенным введением контрастного вещества и оценить томограммы в артериальной, портальной, а также отсроченной фазах контрастирования. Благодаря этому появилась возможность дифференцировать очаговые образования печени, а также оценивать кровоснабжение и сосудистый рисунок печени, что очень важно в диагностике ЦП, особенно в ранней стадии развития заболевания. С помощью имеющейся сейчас современной техники СКТ удается полностью и без возникновения артефактов проследить и зафиксировать перфузию контрастного вещества как в здоровом органе, так и в области поражения. Даже небольшое различие во времени при распределении и элиминации контрастного вещества облегчает обнаруживание поражений и позволяет установить их специфику. С помощью СКТ с контрастированием можно визуализировать воротную вену и оценить ее проходимость. Обструкция тромбом может хорошо визуализироваться, что особенно важно, так как ЦП довольно часто осложняется тромбозом воротной вены (Foley W.D., Kerimoglu U., 2004). СКТ с контрастированием позволяет визуализировать и селезеночную вену, а также ассоциированные с ПГ коллатерали, расположенные вокруг селезенки и забрюшинно.
При первичном биллиарном ЦП ПГ может быть первым проявлением заболевания задолго до развития узловой регенерации, характерной для склеротического процесса печеночной ткани. Поэтому СКТ с внутривенным болюсным контрастированием позволяет достоверно определить признаки ПГ на этом этапе заболевания (Кармазановский Г.Г. и соавт., 1997). Можно видеть также шунты как спонтанные, так и наложенные хирургическим путем (Шерлок Ш., Дули Дж., 1999).
При проведении СКТ с болюсным контрастированием у 44% больных ЦП различной этиологии в артериальной фазе выявляются гиперденсные зоны, расцениваемые как участки повышенного накопления контрастного вещества за счет нарушения перфузии паренхимы печени. В портальной фазе контрастирования указанные зоны становятся изоденсными. У 32% пациентов отмечают раннее контрастирование ствола воротной вены в артериальной фазе при отсутствии контрастирования селезеночной вены. Следует отметить, что указанные выше признаки у больных ЦП можно расценивать как СКТ-признаки наличия артериовенозных шунтов, описанных в литературе (Васильев А.Ю. и соавт., 2003).
Большую сложность представляет идентификация регенераторных узлов в цирротической печени, которые довольно трудно отличить с помощью СКТ от других очаговых образований печени (Zardi E.M. et al., 2001; Martin J. et al., 2002). Это требует наложения на анатомический формат изображения — молекулярного, при использовании специальных молекулярных зондов и соответствующего оборудования («Biograph» Siemens; «Discovery» GE или «Gemini» Philips) (Габуния Р.И., Колесникова Е.К., 1995; Grossman M. et al., 1995; Dodd G.D. et al., 1999a, b, Bettinardi V. et al., 2004; Залесский В.Н., Дынник О.Б., 2005; Kuehl H., Antoch G., 2005).
Как было отмечено ранее, ЦП часто сопровождается ГЦК, а любое очаговое образование печени при циррозе прежде всего должно направить исследователя на мысль о ГЦК (Hollett M.D. et al., 1995; Bolondi L., 2001; Choi D. et al., 2001; Okano H. et al., 2001; Lencioni R.A. et al., 2003; Bockisch A. et al., 2004). Существующая в Японии практика предполагает всем пациентам с верифицированным ЦП каждые 3 мес определять уровень α1-фетопротеина, проводить ультразвуковое исследование; каждые 6 мес — СКТ или магнитно-резонансную томографию. Такая схема обследования позволяет выявить небольшие (менее 2 см в диаметре) опухолевые узлы на ранней стадии развития рака (Murakami T. et al., 2001).
В связи с внедрением в широкую практику техники внутривенного болюсного контрастирования стали появляться работы, посвященные диагностике диффузных заболеваний печени, в том числе и ЦП, которые освещают новые СКТ-признаки, позволяющие оценивать расстройства кровообращения в печени, которые наблюдаются при циррозе. Так, O. Vignaux и соавторы (1999) осуществили СКТ с болюсным контрастированием усиления изображения печени в артериальной и портальной фазах у больных ЦП и сопоставляли полученные данные с показателями здоровых людей. Авторы отметили, что контрастирование ткани печени в портальной фазе у пациентов было существенно ниже, чем у здоровых лиц. Это доказывает то, что при ЦП уменьшен портальный кровоток, что позволяет косвенно судить о нарушении перфузии органа (Vignaux O. et al, 1999; Vignaux O. et al, 2002). R.H. Wachsberg и соавторы (2002) установили, что эффекты артериопортального и портосистемного веновенозного шунтирования, наблюдаемые у больных ЦП и с ПГ, можно визуализировать, применяя СКТ с введением неионных (йодсодержащих) контрастных препаратов, что позволяет прогнозировать варианты течения ЦП.
ЗАКЛЮЧЕНИЕ
Суммируя все вышеизложенное, можно сделать следующие выводы: 1) проблема своевременной СКТ-диагностики ЦП, несмотря на существенное количество исследований в области гепатологии, остается важной и обоснованной; 2) учитывая клинические и лабораторные данные у пациентов, метод СКТ может подтвердить установленный диагноз ЦП, а в ряде случаев заподозрить у больных с алкогольной зависимостью или гепатитом развитие ЦП; 3) метод СКТ позволяет выявить осложнения ЦП. Прежде всего велика его роль в диагностике ГЦК; 4) метод СКТ в сочетании с использованием молекулярных зондов позволяет оптимизировать программы ранней визуализации регенераторных узлов в цирротической печени с помощью наложения молекулярного формата изображения на анатомический.
ЛИТЕРАТУРА
Васильев А.Ю., Бахтиозин Р.Ф., Буланова Т.В. (2003) Спиральная компьютерная томография с болюсным контрастированием у больных циррозом печени. Рос. журн. гастроэнтерол., гепатол., колопроктол., 1: 11–17.
Габуния Р.И., Колесникова Е.К. (1995) Компьютерная томография в клинической диагностике. Медицина, Москва, 257 с.
Залесский В.Н., Дынник О.Б. (2005) Молекулярная визуализация в медицине. Проблемы и перспективы. Укр. мед. часопис, 2(46): 76–83 (http://www.umj.com.ua/arhiv/46/1749.asp).
Кармазановский Г.Г., Вилявин М.Ю., Никитаев Н.С. (1997) Компьютерная томография печени и желчных путей. Паганель-Бук, Москва, 358 с.
Кармазановский Г.Г., Гузеева Е.Б., Башкиров И.В. (2000) Компьютерная томография брюшной полости и малого таза. Видар, Москва, 217 с.
Китаев В.В. (1996) Новые горизонты компьютерной томографии: спиральная КТ. Медицинская визуализация, 1: 11–16.
Логинов А.С., Аруин Л.И. (1985) Клиническая морфология печени. Медицина, Москва, 240 с.
Максименков А.Н. (ред.) (1972) Хирургическая анатомия живота. Медицина, Ленинград, 688 с.
Мизандари М., Мтварaдзе А., Урушадзе О., Маисая К., Тодуа Ф. (2002) Комплексная лучевая диагностика диффузной патологии печени (жировой гепатоз, хронический гепатит, цирроз). Мед. визуализация, 1: 60–66.
Подымова С.Д. (1984) Болезни печени: руководство для врачей. Медицина, Москва, с. 269–307.
Позмогов А.И., Терновой С.К., Бабий Я.С., Лепихин Н.М. (1992) Томография грудной клетки. Здоров’я, Киев, 228 с.
Рогожин В.А. Розенфельд Л.Г., Пилипенко Н.П. (2004) Некоторые аспекты применения компьютерной томографии в клинической практике. Журн. АМН Украины, 10(4): 700–715.
Серов В.В., Шехтер А.Б. (1981) Соединительная ткань: функциональная морфология и общая патология. Медицина, Москва, 310 с.
Терновой С.К., Синицын В.Е. (1998) Спиральная компьютерная и электронно-лучевая ангиография. Видар, Москва, 144 с.
Шерлок Ш., Дули Дж. (1999) Заболевания печени и желчных путей (Пер. с англ.). ГЭОТАР Медицина, Москва, 864 с.
Baron R.L., Oliver J.H. 3rd, Dodd G.D. 3rd, Nalesnik M., Holbert B.L., Carr B. (1996) Hepatocellular carcinoma: evaluation with biphasic, contrast-enhanced, helical CT. Radiology, 199(2): 505–511.
Bettinardi V., Danna M., Savi A., Lecchi M., Castiglioni I., Gilardi M.C., Bammer H., Lucignani G., Fazio F. (2004) Performance evaluation of the new whole-body PET/CT scanner: Discovery ST. Eur. J. Nucl. Med. Mol. Imaging, 31(6): 867–881.
Bockisch A., Beyer T., Antoch G., Veit P., Muller S., Pink R., Rosenbaum S., Kuhl H. (2004) Principles of PET/CT and clinical application. Radiologe, 44(11): 1045–1054.
Bolondi L., Sofia S., Siringo S., Gaiani S., Casali A., Zironi G., Piscaglia F., Gramantieri L., Zanetti M., Sherman M. (2001) Surveillance programme of cirrhotic patients for early diagnosis and treatment of hepatocellular carcinoma: a cost effectiveness analysis. Gut, 48(2): 251–259.
Caldwell S.H., Hespenheide E.E., Harris D., de Lange E.E. (2001) Imaging and clinical characteristics of focal atrophy of segments 2 and 3 in primary sclerosing cholangitis. J. Gastroenterol. Hepatol., 16(2): 220–224.
Catalano C., Passariello R. (2004) Multidetector-Row CT Angiography. Springer-Verlag GmbH, 213 p.
Choi D., Kim S.H., Lim J.H., Cho J.M., Lee W.J., Lee S.J., Lim H.K. (2001) Detection of hepatocellular carcinoma: combined T2-weighted and dynamic gadolinium-enhanced MRI versus combined CT during arterial portography and CT hepatic arteriography. J. Comput. Assist. Tomogr., 25(5): 777–785.
Dodd G.D. 3rd, Baron R.L., Oliver J.H. 3rd, Federle M.P. (1999а) Spectrum of imaging findings of the liver in end-stage cirrhosis: part I, gross morphology and diffuse abnormalities. AJR Am. J. Roentgenol., 173(4): 1031–1036.
Dodd G.D. 3rd, Baron R.L., Oliver J.H. 3rd, Federle M.P. (1999b) Spectrum of imaging findings of the liver in end-stage cirrhosis: Part II, focal abnormalities. AJR Am. J. Roentgenol., 173(5): 1185–1192.
Endo M., Tsunoo T., Kandatsu S. et al. (2003) Four-dimensional computed tomography (4D CT) — concepts and preliminary development. Radiat. Med., 21(1): 17–22.
Fishman E.K. (2004) CT angiography: the state of the art in 2004. AR Online, 33(7): 5–9 (http://www.appliedradiology.com).
Foley W.D., Kerimoglu U. (2004) Abdominal MDCT: liver, pancreas, and biliary tract. Semin. Ultrasound CT MR, 25(2): 122–144.
Foley W.D., Mallisee T.A., Hohenwalter M.D., Wilson C.R., Quiroz F.A., Taylor A.J. (2000) Multiphase hepatic CT with a multirow detector CT scanner. AJR Am. J. Roentgenol., 175(3): 679–685.
Grossman M., Rader D.J., Muller D.W., Kolansky D.M., Kozarsky K., Clark B.J. 3rd, Stein E.A., Lupien P.J., Brewer H.B. Jr, Raper S.E. et al. (1995) A pilot study of ex vivo gene therapy for homozygous familial hypercholesterolaemia. Nat. Med., 1(11): 1148–1154.
Hanafusa K., Fukurashiki M., Burch J. (Eds.) (2004) Expanding clinical value of multislice CT. Toshiba Medical Syst. (InnerVision), Tokyo, pp. 4–8.
Harbin W.P., Robert N.J., Ferrucci J.T. Jr. (1980) Diagnosis of cirrhosis based on regional changes in hepatic morphology: a radiological and pathological analysis. Radiology, 135(2): 273–283.
Hofer M. (2005) CT teaching manual: a systematic approach to CT reading. Thieme, Stuttgart, 208 p.
Hollett M.D., Jeffrey R.B. Jr., Nino-Murcia M., Jorgensen M.J., Harris D.P. (1995) Dual-phase helical CT of the liver: value of arterial phase scans in the detection of small (< or = 1.5 cm) malignant hepatic neoplasms. AJR Am. J. Roentgenol., 164(4): 879–884.
Hoppenrath M. (2004) Multislice computed tomography: 64 and beyond. AR Online, 33(11): 58–68 (http://www.appliedradiology.com).
Kobayashi N., Ito M., Nakamura J., Cai J., Gao C., Hammel J.M., Fox I.J. (2000) Hepatocyte transplantation in rats with decompensated cirrhosis. Hepatology, 31(4): 851–857.
Kopka L., Rodenwaldt J., Fischer U., Mueller D.W., Oestmann J.W., Grabbe E. (1996) Dual-phase helical CT of the liver: effects of bolus tracking and different volumes of contrast material. Radiology, 201(2): 321–326.
Kuehl H., Antoch G. (2005) How much CT do we need for PET/CT? A radiologist’s perspective. Nuklearmedizin, 44 (Suppl. 1): S24–S31.
Lagasse E., Connors H., Al-Dhalimy M., Reitsma M., Dohse M., Osborne L., Wang X., Finegold M., Weissman I.L., Grompe M. (2000) Purified hematopoietic stem cells can differentiate into hepatocytes in vivo. Nat. Med., 6(11): 1229–1234.
Lencioni R.A., Allgaier H.P., Cioni D., Olschewski M., Deibert P., Crocetti L., Frings H., Laubenberger J., Zuber I., Blum H.E., Bartolozzi C. (2003) Small hepatocellular carcinoma in cirrhosis: randomized comparison of radio-frequency thermal ablation versus percutaneous ethanol injection. Radiology, 228(1): 235–240.
Mallet V.O., Mitchell C., Mezey E., Fabre M., Guidotti J.E., Renia L., Coulombel L., Kahn A., Gilgenkrantz H. (2002) Bone marrow transplantation in mice leads to a minor population of hepatocytes that can be selectively amplified in vivo. Hepatology, 35(4): 799–804.
Martin J., Puig J., Darnell A., Donoso L. (2002) Magnetic resonance of focal liver lesions in hepatic cirrhosis and chronic hepatitis. Semin. Ultrasound CT MR, 23(1): 62–78.
Masson S., Harrison D.J., Plevris J.N., Newsome P.N. (2004) Potential of hematopoietic stem cell therapy in hepatology: a critical review. Stem Cells, 22(6): 897–907.
Mergo P.J., Ros P.R. (1998) Imaging of diffuse liver disease. Radiol. Clin. North Am., 36(2): 365–375.
Murakami T., Mochizuki K., Nakamura H. (2001) Imaging evaluation of the cirrhotic liver. Semin. Liver Dis., 21(2): 213–224.
Okano H., Shiraki K., Inoue H., Ito T., Yamanaka T., Deguchi M., Sugimoto K., Sakai T., Ohmori S., Murata K., Takase K., Nakano T. (2001) Comparison of screening methods for hepatocellular carcinomas in patients with cirrhosis. Anticancer Res., 21(4В): 2979–2982.
Oliver J.H. 3rd, Baron R.L. (1996) Helical biphasic contrast-enhanced CT of the liver: technique, indications, interpretation, and pitfalls. Radiology, 201(1): 1–14.
Oliver J.H. 3rd, Baron R.L., Federle M.P., Rockette H.E. Jr. (1996) Detecting hepatocellular carcinoma: value of unenhanced or arterial phase CT imaging or both used in conjunction with conventional portal venous phase contrast-enhanced CT imaging. AJR Am. J. Roentgenol., 167(1): 71–77.
Vignaux O., Gouya H., Augui J., Oudjit A., Coste J., Dousset B., Chaussade S., Legmann P. (2002) Hepatofugal portal flow in advanced liver cirrhosis with spontaneous portosystemic shunts: effects on parenchymal hepatic enhancement at dual-phase helical CT. Abdom. Imaging, 27(5): 536–540.
Vignaux O., Legmann P., Coste J., Hoeffel C., Bonnin A. (1999) Cirrhotic liver enhancement on dual-phase helical CT: comparison with noncirrhotic livers in 146 patients. AJR Am. J. Roentgenol., 173(5): 1193–1197.
Wachsberg R.H., Bahramipour P., Sofocleous C.T., Barone A. (2002) Hepatofugal flow in the portal venous system: pathophysiology, imaging findings, and diagnostic pitfalls. Radiographics, 22(1): 123–140.
Zardi E.M., Uwechie V., Picardi A., Costantino S. (2001) Liver focal lesions and hepatocellular carcinoma in cirrhotic patients: from screening to diagnosis. Clin. Ther., 152(3): 185–188.
Резюме. Стаття присвячена проблемі спіральної комп’ютерно-томографічної візуалізації дифузних уражень печінкової тканини. Проаналізовані особливості проведення спіральної комп’ютерної томографії у хворих на цироз печінки з метою ранньої діагностики його ускладнень (синдром портальної гіпертензії, тромбоз ворітної вени та ін.), а також скринінгу асимптоматичної гепатоцелюлярної карциноми.
Ключові слова:цироз печінки, спіральна комп’ютерна томографія
Spiral computed tomography of the diffuse liver tissue lesions: hepatic cirrhosis
Summary. Article dedicated to the problem of the spiral computed tomography imaging of the diffuse liver tissue lesions. The peculiarities are considered on the spiral computed tomography application in patient with liver cirrhosis for early diagnostics of its complications (portal hypertension, portal vein thrombosis, etc.), as well as asymptomatic hepatocellular carcinoma screening.
Key words: hepatic cirrhosis, spiral computed tomography
Адрес для переписки:
Залесский Вячеслав Николаевич
03151, Киев, ул. Народного ополчения, 5
Институт кардиологии им Н.Д. Стражеско АМН Украины





