ВВЕДЕНИЕ
В последнее время интенсивно изучается состояние окислительных и антиоксидантных механизмов при рассеянном склерозе (РС). Показаны повышенные уровни антирадикальной активности липидов крови (Besler H.T., Comoglu S., 2003), малонового диальдегида (МДА) крови и ликвора, церулоплазмина (ЦП) крови (Keles M.S. et al., 2001), глутатионпероксидазы (Sakai T. et al., 2000), трансферрина ликвора (Zeman D. et al., 2000) и активированных форм азота в крови и ликворе при обострении. При этом выявлено снижение концентрации глутатиона (Calabrese V. et al., 2002), бета-каротина, ретинола, токоферола и аскорбиновой кислоты в крови и ликворе (Besler H.T., Comoglu S., 2003). В то же время по данным других авторов ЦП и трансферрин в ликворе не были выявлены, а уровень трансферрина в крови не отличался от нормальных показателей (Keles M.S. et al., 2001), так же, как концентрация лактоферрина и миелопероксидазы (Sakai T. et al., 2000). Отмечают снижение содержания мочевой кислоты (МК) у больных с РС (Staub M., 1999).
В дебюте заболевания выявлено повышение содержания МДА, ЦП, глутатионпероксидазы, токоферола и антирадикальной активности липидов крови при сниженных уровнях каталазы (КАТ), глутатионредуктазы, супероксиддисмутазы и тиоловых соединений (Луцкий М.А. и соавт., 2001).
В ремиссии сохраняется повышенный уровень активированных форм кислорода при сниженном содержании сульфгидрильных групп, интерфероновая терапия улучшала эти показатели (Lucas M. et al., 2003).
Концентрация трансферрина в крови снижена в большей степени при первично-прогредиентном типе течения по сравнению с вторично-прогредиентным и со стадией ремиссии при ремиттирующем. Содержание трансферрина в ликворе имело обратную направленность при этих состояниях. При этом уровень трансферрина в ликворе был ниже у больных с небольшой продолжительностью болезни (до 2 лет) и у женщин по сравнению с пациентами с большей длительностью заболевания и мужчинами и коррелировал с возрастом (Zeman D. et al., 2000). Также выявлены половые различия и особенности динамики содержания МДА и МК в зависимости от развития клинической картины (Дзюба А.Н. и соавт., 2005).
Для более полной оценки состояния антиоксидантной системы (АОС) при РС целью работы стало исследование параметров АОС в зависимости от возрастных характеристик больных.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Дизайн. Открытое проспективное обсервационное исследование текущей клинической практики.
Пациенты. Обследованы 119 больных с РС (90 женщин и 29 мужчин), средний возраст — 36,0±11,0 года (диапазон — от 16 до 54 лет), средняя длительность заболевания — 9,1±7,7 года (диапазон — от полугода до 32 лет), тяжесть состояния по шкале Expanded Disability Status Scale (EDSS) в среднем составила 4,3±1,9 (диапазон — от 1 до 9 баллов).
В контрольную группу вошли 23 практически здоровых лица, 13 мужчин и 10 женщин, средний возраст — 33,0±7,8 года.
Возрастные группы были такими (табл. 1): юноши (мужчины (М) от 17 лет до 21 года) и девушки (женщины (Ж) от 16 до 20 лет), I период зрелого возраста (М — от 22 до 35 лет, Ж — от 21 года до 35 лет), II период зрелого возраста (М — от 36 до 60 лет, Ж — от 36 до 55 лет).
Таблица 1
Общая характеристика клинического материала
| Тяжесть состояния (балл EDSS) | Юноши и девушки(М — 17–21; Ж — 16–20 лет) | Зрелый возраст, I период(М — 22–35; Ж — 21–35 лет) | Зрелый возраст, II период(М — 36–60; Ж — 36–55 лет) | |||
| М | Ж | М | Ж | М | Ж | |
| Легкая (≤3,5) | 3 | 7 | 7 | 19 | 3 | 17 |
| Средней степени тяжести (4–5,5) |
– | – | 1 | 6 | 5 | 19 |
| Тяжелая (≥6) | 2 | 3 | 3 | 5 | 5 | 14 |
Методы. С помощью фотометрирования при длине волны 410 нм определяли активность КАТ эритроцитов (%) в реакции перекиси водорода с молибденом, при длине волны 540 нм — перекисный гемолиз эритроцитов (ПГЭ, %) в реакции аутоокисления липидов эритроцитарных мембран в буферном растворе (Горячковский А.М., 1998), при длине волны 670 нм — МК эритроцитов (мкмоль/л) фосфорновольфрамовым методом (Тиц Н.У. (ред.), 1997), при длине волны 540 нм — ЦП сыворотки крови (мг/л) по методу Равина в реакции окисления р-фенилендиамина (Камышников В.С., 2002), при длине волны 540 нм — МДА эритроцитов (мкмоль/л) в реакции взаимодействия с тиобарбитуровой кислотой для вычисления отношения МДА/МК как характеристики баланса окислительно-антиоксидантных процессов (Камышников В.С., 2002).
Статистический анализ. Вычисляли среднее значение признака и стандартное отклонение (M±s). При сравнении нескольких групп применяли непараметрический метод сравнения независимых групп Краскела — Уоллиса (процедура дисперсионного анализа ANOVA). Для сопоставления двух независимых групп проверяли гипотезу о равенстве средних рангов с помощью U-критерия Манна — Уитни. Рисунки представлены в виде «коробочного» графика (box-and-whisker — «ящик с усами») с указанием средних значений, стандартной ошибки среднего (m) и 95% доверительных интервалов. Статистический анализ и построение графиков выполнялись в программе STATISTICA 6.0. Графики сравнения нескольких групп выполнены в программе Excel с указанием средних значений.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние возраста на показатели АОС в смешанных по полу и тяжести группах
В трех возрастных группах по данным теста Краскела — Уоллиса в зависимости от возраста различались уровни ПГЭ (р=0,038) и МК (р=0,032).
У больных молодого и I периода зрелого возраста различий в показателях АОС не выявлено.
В дальнейшем с возрастом снижались содержание МК и резистентность эритроцитов к гемолизу (рис. 1): у пациентов I и II периодов зрелого возраста различались уровни ПГЭ (6,1±3,8 и 11,2±10,4 соответственно; р=0,012) и МК (351,4±89,5 и 320,3±85,4; р=0,114). Наиболее статистически значимые различия для содержания МК были выявлены между больными молодого и II периода зрелого возраста: с возрастом значения МК уменьшались с 395,7±76,5 (р=0,049 с контролем) до 320,3±85,4 (р=0,015). Активность КАТ была повышенной во всех возрастных группах и отличалась от показателей контрольной группы: у больных молодого возраста — при р=0,086, I периода зрелого возраста — при р=0,004 и II периода — при р=0,012.
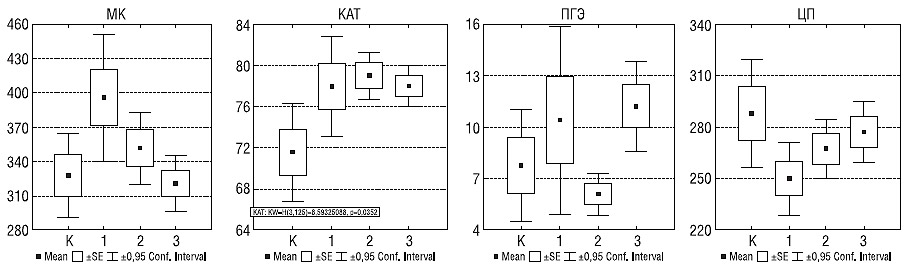
Рис. 1. Уровни МК (мкмоль/л), КАТ (%), ПГЭ (%) и ЦП (мг/л) в контрольной группе (К) и у больных с РС молодого (1), I (2) и II (3) периодов зрелого возраста
С возрастом больных коррелировали уровни ЦП (коэффициент корреляции Спирмена r=0,22; р=0,015; с возрастом дебюта — r=0,24; р=0,008), ПГЭ (r=0,21; р=0,026) и МК (r= –0,23; р=0,023).
Взаимосвязь возрастных и гендерных характеристик с показателями АОС в смешанных по тяжести группах
У женщин отмечали (рис. 2) тенденцию к повышению уровня ЦП с 246,6±41,4 в молодом возрасте до 286,7±72,8 во II период зрелого возраста (р=0,070). У мужчин в старшей возрастной группе содержание ЦП снижалось до 239,2±52,5, достигая статистически значимых различий с женщинами (р=0,023).
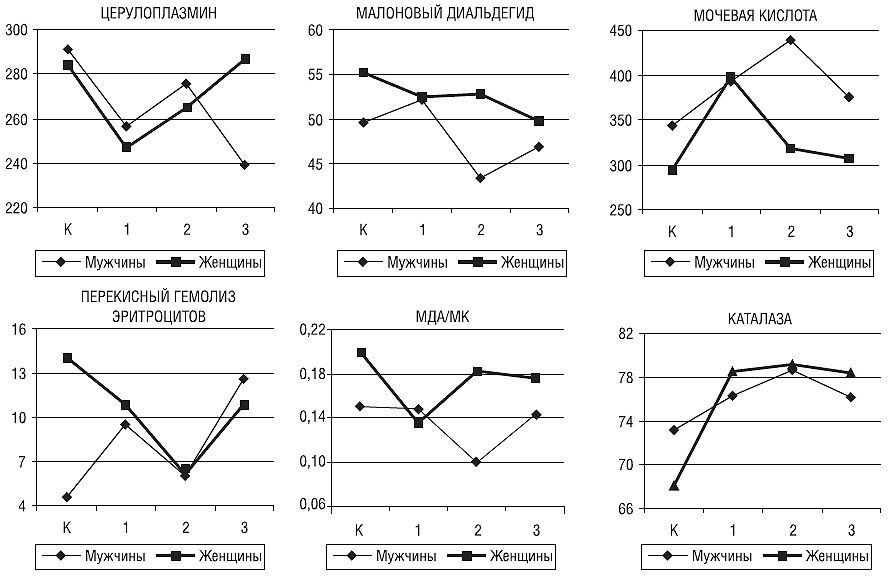
Рис. 2. Уровни ЦП (мг/л), МДА (мкмоль/л), МК (мкмоль/л), ПГЭ (%), активность КАТ (%) и отношение МДА/МК в контрольной группе (К) и у больных с РС молодого (1), I (2) и II (3) периодов зрелого возраста разного пола
В женской группе, в отличие от мужчин, отмечали более значительное повышение активности КАТ во всех возрастных группах по сравнению с контролем (р=0,099; р=0,024; р=0,033 для трех возрастных групп соответственно).
Содержание МК у женщин было максимальным в молодом возрасте (397,1±59,4; р=0,015 с контрольной группой), в I период зрелого возраста — снижалось до 318,6±76,6 (р=0,021), а во II период — до 307,2±82,3 (р=0,007). У мужчин самый высокий уровень МК (438,8±58,2) с достижением наибольших различий с группой женщин (р=0,0004) отмечали в I период зрелого возраста. Во II период зрелого возраста концентрация МК снижалась (р=0,102) до 375,5±79,6 (р=0,037 с группой женщин).
Уровень МДА имел тенденцию к снижению в группе мужчин в I период зрелого возраста (43,4±8,7; р=0,074 с контролем и р=0,070 с группой юношей). У женщин снижение содержания МДА было статистически незначимым, что в этой возрастной группе привело к значительным различиям с показателями у мужчин (52,8±8,1; р=0,006). Во II период зрелого возраста в группе мужчин отмечали тенденцию к повышению уровня МДА.
Отношение МДА/МК характеризовало окислительно-антиоксидантное равновесие, показывая его сдвиг в сторону преобладания антиоксидантных механизмов у девушек (р=0,015 с контрольной группой) и тенденцию к преобладанию окислительных процессов в I (р=0,065) и во II периоды зрелого возраста (р=0,076) у женщин. У мужчин в I период зрелого возраста отмечали сдвиг равновесия в сторону преобладания антиоксидантных механизмов (р=0,006 с контролем и р=0,0003 с группой женщин), во II период зрелого возраста отношение МДА/МК повышалось (р=0,007) до уровня контрольной группы и мужчин молодого возраста.
Уровень резистентности эритроцитов к гемолизу имел однонаправленную динамику в группах мужчин и женщин, значительно снижаясь у мужчин во II период зрелого возраста (р=0,035 с контролем). У женщин, учитывая высокий уровень ПГЭ в контрольной группе, повышение устойчивости эритроцитарных мембран к гемолизу в I период зрелого возраста достигало статистически значимых различий с контрольной группой (р=0,005). Во II период зрелого возраста уровень ПГЭ существенно повышался (р=0,024), не достигая при этом контрольных значений (р=0,097).
Таким образом, и у мужчин, и у женщин в молодом возрасте и во II период зрелого возраста состояние АОС характеризовалось неустойчивостью, что может быть связано с высокой активностью метаболических процессов в первой возрастной группе, а во второй — с возрастной недостаточностью антиоксидантных механизмов (Жебель В.Н., 1994) и их последующим истощением у мужчин. У женщин при этом отмечали повышение содержания ЦП и относительно стабильный уровень МК и МДА. В I период зрелого возраста отмечали наиболее устойчивое состояние АОС, что у мужчин достигалось максимальным напряжением антиоксидантных механизмов.
Влияние возраста на показатели АОС у больных с различной тяжестью состояния в смешанных по полу группах
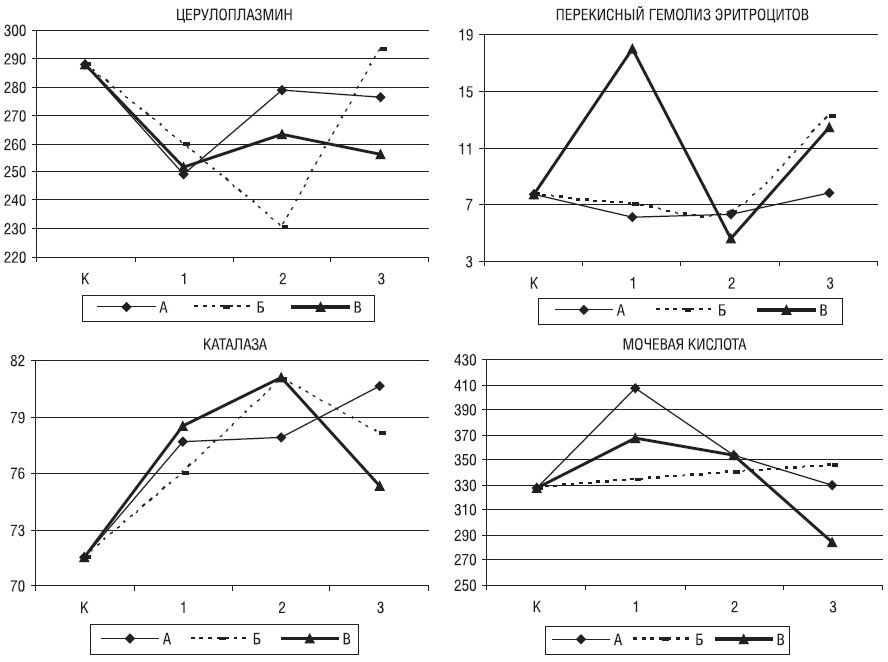
Рис. 3. Уровни ЦП (мг/л), МК (мкмоль/л), ПГЭ (%) и активность КАТ (%) в контрольной группе (К) и у больных с РС молодого (1), I (2) и II (3) периодов зрелого возраста при легкой (А), средней (Б) и тяжелой (В) степени тяжести
У больных с легкой степенью тяжести состояния (рис. 3) в трех возрастных группах статистической значимости различия не достигали. Содержание ЦП имело тенденцию к повышению с возрастом — от 249,0±27,1 у больных молодого возраста до 278,9±48,0 у больных I периода зрелого возраста (р=0,090). С возрастом снижался уровень МК
(у больных молодого возраста — 407,7±84,0, во
II период зрелого возраста — 329,2±81,9; р=0,061).
При средней степени тяжести больные I периода зрелого возраста характеризовались значительным снижением уровня ЦП по сравнению со
II периодом зрелого возраста (230,7±45,2 и 293,5±79,4 соответственно; р=0,023), при этом у первых отмечали тенденцию к большей резистентности эритроцитов к гемолизу (6,6±3,1 и 13,3±10,5; р=0,083).
У тяжелых больных по данным теста Краскела — Уоллиса различия показаны для уровней ПГЭ (р=0,053) и МК (р=0,076). У больных молодого возраста был значительно выше уровень ПГЭ, чем у больных I периода зрелого возраста (18,0±11,7 и 4,6±2,1 соответственно; р=0,019). У больных
II периода зрелого возраста по сравнению с больными I периода отмечали тенденцию к снижению устойчивости эритроцитов к гемолизу (4,6±2,1 и 12,5±12,4; р=0,078), уровня МК (284,4±70,2 и 354,0±103,2; р=0,070) и активности КАТ (75,3±7,6 и 81,1±6,0; р=0,089) на фоне повышения отношения МДА/МК (0,19±0,06 и 0,16±0,12; р=0,061).
Таким образом, повышение ПГЭ с возрастом более выражено у больных со средней степенью тяжести заболевания и у тяжелых больных, при этом самые низкие значения ПГЭ отмечали в I период зрелого возраста. У тяжелых больных подверженность эритроцитов гемолизу была максимальной в молодом возрасте, минимальной в I период зрелого возраста и вновь повышалась во II период зрелого возраста.
Снижение содержания МК с возрастом было более выражено у больных с легкой степенью тяжести заболевания и у тяжелых больных.
Повышение уровня ЦП с возрастом было более заметным у больных средней степени тяжести РС при минимальном значении в I период зрелого возраста, при легкой степени тяжести и у тяжелых больных повышение было менее значимым.
В старшей возрастной группе у больных с легкой степенью тяжести заболевания сохранялась тенденция к повышению активности КАТ, у больных со средней степенью тяжести и у тяжелых больных этой возрастной группы она снижалась.
Следовательно, у больных с легкой степенью тяжести заболевания с возрастом снижалось содержание МК, у больных средней степени тяжести в I период зрелого возраста отмечали снижение уровня ЦП, у тяжелых больных молодого возраста отмечали значительное повышение склонности эритроцитов к гемолизу, а во II период зрелого возраста выявлено наиболее выраженное снижение всех показателей АОС.
Влияние возраста на показатели АОС в разных по полу и тяжести группах
При легкой степени тяжести заболевания у мужчин в трех возрастных группах различий не выявлено. У женщин по данным теста Краскела — Уоллиса различались содержание МК (р=0,106) и отношение МДА/МК (р=0,083; медианный тест р=0,036).
У девушек по сравнению с женщинами I периода зрелого возраста (рис. 4) были ниже содержание ЦП (241,1±27,0 и 276,8±45,9; р=0,089) и отношение МДА/МК (0,12±0,02 и 0,18±0,07; р=0,016), а уровень МК был выше (395,4±72,6 и 326,0±74,7; р=0,074).
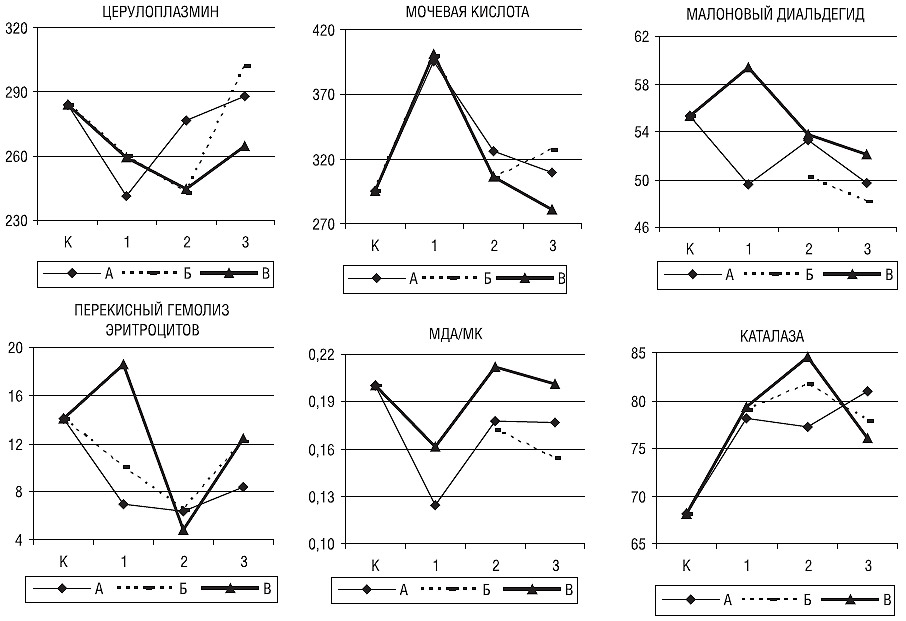
Рис. 4. Уровни ЦП (мг/л), МК (мкмоль/л), МДА (мкмоль/л), ПГЭ (%), активность КАТ (%) и отношение МДА/МК в контрольной группе (К) и у больных женского пола молодого (1), I (2) и II (3) периодов зрелого возраста при легкой (А), средней (Б) и тяжелой (В) степени тяжести РС
У женщин II периода зрелого возраста активность КАТ была выше, чем у больных I периода (77,2±8,4 и 81,0±7,2; р=0,078), а по сравнению с девушками отмечали снижение уровня МК (309,6±73,8 и 395,4±72,6; р=0,042) с тенденцией к повышению содержания ЦП (288,2±74,5 и 241,1±27,0; р=0,092) и отношения МДА/МК (0,18±0,08 и 0,12±0,02; р=0,096).
У юношей и девушек при легкой степени тяжести заболевания различий в уровне показателей АОС не выявлено. В I период зрелого возраста у мужчин (рис. 5), в отличие от женщин, отмечали более высокий уровень МК (436,8±61,8 и 326,0±74,7; р=0,010) и более низкое содержание МДА (43,4±6,8 и 53,3±7,2; р=0,009) и отношение МДА/МК (0,10±0,02 и 0,18±0,07; р=0,006). Во II период зрелого возраста у мужчин и женщин различия имели меньшую статистическую значимость для уровня МК (421,0±53,8 и 309,6±73,8; р=0,023) и отношения МДА/МК (0,11±0,01 и 0,18±0,08; р=0,078).
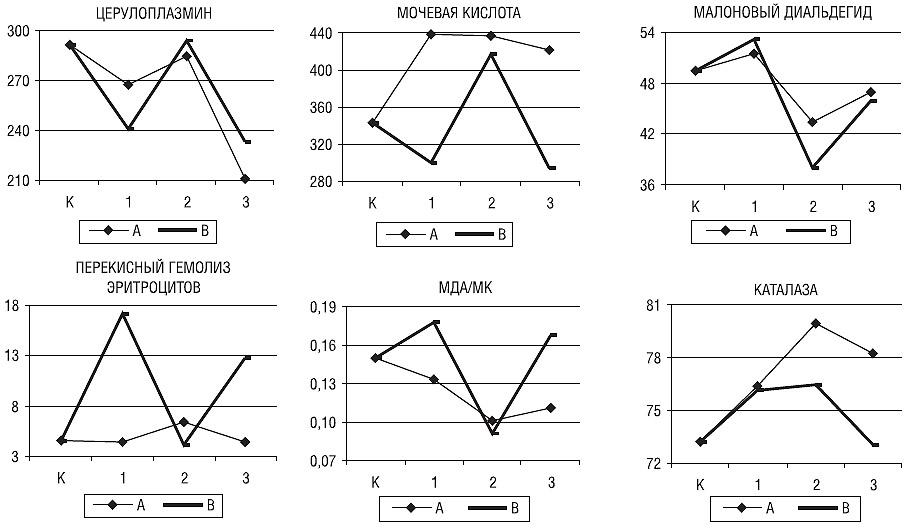
Рис. 5. Уровни ЦП (мг/л), МК (мкмоль/л), МДА (мкмоль/л), ПГЭ (%), активность КАТ (%) и отношение МДА/МК в контрольной группе (К) и у больных мужского пола молодого (1), I (2) и II (3) периодов зрелого возраста при легкой (А) и тяжелой (В) степени тяжести РС
При средней степени тяжести заболевания у женщин с возрастом от I ко II периоду зрелого возраста повышались уровни ЦП (243,0±34,4 и 301,8±85,0; р=0,036) и ПГЭ (6,5±3,3 и 12,1±10,5; р=0,096). У мужчин во II период зрелого возраста по сравнению с женщинами было выше содержание МК (438,3±48,6 и 327,4±90,9; р=0,066).
У тяжелых больных мужского пола по данным теста Краскела — Уоллиса различия получены для уровней МК (р=0,072) и отношения МДА/МК (р=0,074), у женщин — для уровней ПГЭ (р=0,110; медианный тест р=0,016), МК (р=0,106), КАТ (р=0,116; медианный тест р=0,066).
У юношей содержание МДА было выше по сравнению с мужчинами I периода зрелого возраста (53,2±0,5 и 38,1±7,8; р=0,083), различия с мужчинами II периода зрелого возраста и девушками не были выявлены.
С возрастом у мужчин снижалось содержание МК (417,0±48,4 в I период зрелого возраста и 294,3±26,6 — во II; р=0,034) и повышалось отношение МДА/МК (0,09±0,01 и 0,17±0,02 соответственно; р=0,034).
Девушки по сравнению с женщинами I периода зрелого возраста характеризовались снижением устойчивости эритроцитов к гемолизу (18,6±11,5 и 4,9±2,4; р=0,025), а с женщинами II периода зрелого возраста — повышенным уровнем МК (401,5±3,5 и 281,3±79,7; р=0,062). С возрастом у женщин снижалась активность КАТ (84,5±3,2 в I период зрелого возраста и 76,1±7,8 — во II; р=0,049).
В I период зрелого возраста у мужчин отмечали тенденцию к более низким значениям содержания МДА и отношения МДА/МК и к более высоким — уровня МК по сравнению с женщинами (соответственно 38,1±7,8 и 53,8±10,4; р=0,077; 0,09±0,01 и 0,21±0,15; р=0,034; 417,0±48,4 и 306,7±113,2; р=0,112).
Таким образом, при легкой степени тяжести заболевания у мужчин статистически значимой зависимости состояния параметров АОС от возраста не выявлено, отмечена лишь тенденция к снижению концентрации ЦП и МДА, стабильно низким был уровень ПГЭ и стабильно высоким — содержание МК во всех возрастных группах. У женщин молодого возраста отмечали максимальную концентрацию МК и минимальную — МДА и ЦП, с возрастом отмечали снижение содержания МК и тенденцию к повышению концентрации ЦП при стабильно низком уровне ПГЭ.
При средней степени тяжести у женщин с возрастом выявлено повышение концентрации ЦП и отмечена тенденция к увеличению склонности эритроцитов к гемолизу.
В группе тяжелых больных мужского пола были всего два пациента молодого возраста. С возрастом у мужчин отмечали снижение содержания МК с тенденцией к снижению уровней ЦП, МДА, КАТ и устойчивости эритроцитов к гемолизу, у больных женского пола — снижение уровня МК.
У девушек при тяжелом состоянии в ответ на значительную интенсификацию оксидативных процессов с максимальным повышением уровня МДА развивается выраженная активация АОС с наиболее высоким содержанием МК, которая не может адекватно компенсировать нарушения, — отмечается смещение окислительно-антиоксидантного равновесия влево и самое значительное снижение устойчивости эритроцитов к гемолизу. У женщин I периода зрелого возраста отмечали относительную компенсацию активности оксидативных механизмов — максимальное повышение устойчивости эритроцитов к гемолизу на фоне снижения уровней МК, ЦП и МДА. В следующей возрастной группе выявлено значительное снижение активности антиоксидантных механизмов по уровням МК, ПГЭ и КАТ.
Различия в состоянии АОС по половому признаку наиболее выражены у больных с РС легкой степени тяжести и в I период зрелого возраста (содержание МК и МДА). С увеличением тяжести состояния и во II период зрелого возраста гендерные различия между этими показателями уменьшаются, но появляются различия в уровне ЦП.
ВЫВОДЫ
1. В молодом возрасте у больных с РС отмечали повышенный уровень МК и ПГЭ, что может отражать высокую активность метаболических процессов. Во II период зрелого возраста резистентность эритроцитов к гемолизу также была сниженной у лиц обоих полов, сопровождаясь снижением содержания ЦП и МК с тенденцией к повышению концентрации МДА у мужчин и повышением содержания ЦП при сохранении уровня МК и МДА — у женщин.
2. Наиболее устойчивое функциональное состояние эритроцитарных мембран с минимальным уровнем ПГЭ отмечали в I период зрелого возраста, что у мужчин сочеталось с максимальным повышением концентрации МК и наиболее низким содержанием МДА.
3. С возрастом отмечали снижение уровня МК, наиболее выраженное у женщин, у больных с легкой степенью тяжести и у тяжелых больных. Активность КАТ оказалась повышенной во всех возрастных группах, снижаясь у тяжелых больных, особенно в группе женщин. С возрастом больных были связаны уровни ЦП, МК и ПГЭ.
4. Возрастные различия были наиболее выражены у тяжелых больных: отмечали самое значительное повышение ПГЭ у лиц обоих полов и низкий уровень МК у мужчин в молодом возрасте и снижение значений всех показателей АОС в старшей возрастной группе.
5. При анализе состояния АОС при РС необходимо учитывать возрастные и гендерные характеристики больных.
ЛИТЕРАТУРА
- Горячковский А.М. (1998) Клиническая биохимия. Астропринт, Одесса, 603 с.
- Дзюба А.Н., Сорокин Ю.Н., Ходош Л.В., Ковалева М.В. (2005) Параметры про- и антиоксидантных механизмов и особенности течения ремиттирующего рассеянного склероза. Укр. мед. альманах, 8(4, додаток): 59–61.
- Жебель В.Н. (1994) Активность ферментов антиоксидантной системы эритроцитов у практически здоровых людей разного возраста. Пробл. старения и долголетия, 2: 178–184.
- Камышников В.С. (2002) Справочник по клинико-биохимической лабораторной диагностике. В 2 т. Беларусь, Минск, Т. 2, 463 с.
- Луцкий М.А., Земсков А.М., Разинкин К.А. (2001) К вопросу ранней диагностики рассеянного склероза. Мед. труда и пром. экология, 7: 40–43.
- Тиц Н.У. (ред.) (1997) Энциклопедия клинических лабораторных тестов. Лабинформ, Москва, с. 335–336.
- Besler H.T., Comoglu S. (2003) Lipoprotein oxidation, plasma total antioxidant capacity and homocysteine level in patients with multiple sclerosis. Nutr. Neurosci., 6(3): 189–196.
- Calabrese V, Scapagnini G, Ravagna A, Bella R, Foresti R, Bates TE, Giuffrida Stella AM, Pennisi G. (2002) Nitric oxide synthase is present in the cerebrospinal fluid of patients with active multiple sclerosis and is associated with increases in cerebrospinal fluid protein nitrotyrosine and S-nitrosothiols and with changes in glutathione levels. J. Neurosci. Res., 70(4): 580–587.
- Keles M.S., Taysi S., Sen N., Aksoy H., Akcay F. (2001) Effect of corticosteroid therapy on serum and CSF malondialdehyde and antioxidant proteins in multiple sclerosis. Can. J. Neurol. Sci., 28(2): 141–143.
- Lucas M., Rodriguez M.C., Gata J.M., Zayas M.D., Solano F., Izquierdo G. (2003) Regulation by interferon beta-1a of reactive oxygen metabolites production by lymphocytes and monocytes and serum sulfhydryls in relapsing multiple sclerosis patients. Neurochem. Int., 42(1): 67–71.
- Sakai T., Inoue A., Koh C.S., Ikeda S. (2000) A study of free radical defense and oxidative stress in the sera of patients with neuroimmunological disorders. Arerugi, 49(1): 12–18.
- Staub M. (1999) Uric acid as a scavenger in oxidative stress. Orv. Hetil., 140(6): 275–279.
- Zeman D., Adam P., Kalistova H., Sobek O., Kelbich P., Andel J., Andel M. (2000) Transferrin in patients with multiple sclerosis: a comparison among various subgroups of multiple sclerosis patients. Acta Neurol. Scand., 101(2): 89–94.
Резюме. МЕТА. Визначення функціонального стану щитовидної та паращитовидних залоз у ліквідаторів наслідків аварії на ЧАЕС йодного періоду в найближчі роки після аварії. ОБ’ЄКТ. У дослідженні взяли участь 136 військовослужбовців з поглинутими дозами зовнішнього опромінення 10–112 сГр та 143 ліквідатора наслідків аварії на ЧАЕС також йодного періоду з дозами 25–100 сГр віком 20–45 років. Контрольна група представлена 140 практично здоровими чоловіками аналогічного віку, які не зазнали впливу іонізуючого опромінення. МЕТОДИ. Радіометрія щитовидної залози, визначення у сироватці крові базальної концентрації тироксину, трийодтироніну, тиреотропного гормону, паратиреоїдного гормону та кальцитоніну радіоімунологічним методом. Деяким особам було проведено адреналіновий тест. РЕЗУЛЬТАТИ. Виявлено тенденцію до підвищення потужності експозиційної дози опромінення в ділянці щитовидної залози у діапазоні доз загального зовнішнього опромінення від 10 до 29,9 сГр. Базальна концентрація гормонів тиреоїдної системи у ліквідаторів не має суттєвих відмінностей від нормальних значень, рівень паратгормону значно знизився, а кальцитоніну, навпаки, підвищився. На фоні адреналінового тесту у ліквідаторів не відмітили підвищення секреції тиреотропного гормону, що передбачає порушення функціонального стану тиреоїдної системи на рівні гіпоталамо-гіпофізарного комплексу.
Ключові слова:аварія на Чорнобильській АЕС, щитовидна залоза, паращитовидні залози, йодний період, радіометрія
Summary. Serum ceruloplasmin (CP) and uric acid (UA) levels, erythrocytes malonic dialdehyde (MDA) levels, erythrocytеs catalase activity and peroxide hemolysis of erythrocytes (PHE) was investigated in 119 (29 men and 90 women) patients with multiple sclerosis (age from 16 till 54 years; from 1 up to 9 points on the Expanded Disability Status Scale). At young age the increased UA and PHE levels was observed. In II period of mature age PHE has been increased in persons of both sexes, being accompanied by decrease in the CP and UA contents with the tendency to increase of MDA concentration in men and increase of CP contents under the preservation of UA and MDA levels in women. Minimum PHE level was observed in the I period of mature age and in men was combined with the maximal increase of UA concentration and with the least MDA contents. With increase in age the reduction of UA level, most expressed in women, in patients with an easy degree of severity and in serious patients was marked. Age distinctions were most expressed in serious patients: the most considerable increase of PHE in persons of both sexes, low level of UA in young men and decrease in values of all antioxidant system parameters in the senior age group were marked. The age of patients correlated with CP, UA and PHE levels.
Key words: multiple sclerosis, age, peroxide hemolysis of erythrocytes, uric acid, catalase, ceruloplasmin, antioxidant system
Адрес для переписки:
Сорокин Юрий Николаевич
91045, Луганск, квартал 50-летия обороныЛуганска, 1
Луганский государственный медицинский университет, кафедра нервных болезней факультета последипломного образованияE-mail: [email protected]





