ВВЕДЕНИЕ
Стресс-эхокардиография (стресс-эхоКГ) с добутамином является одним из основных неинвазивных методов диагностики ишемической болезни сердца (ИБС) (Gibbons R.G. et al., 1999), с помощью которого возможно не только диагностировать ИБС, но и сделать предположение о степени и локализации атеросклеротического поражения в венечных артериях (ВА) (O’Keefe J.H. et al., 1995; Bartunek J.et al., 1999; Elhendy A. et al., 2000; Chaudhry F.A. et al., 2004). Для оценки диагностической точности стресс-эхоКГ, а следовательно, и для диагностики ИБС разные исследователи применяют различные протоколы проведения пробы, варьируют критерии значимого атеросклеротического поражения (более 50–70% сужение просвета ВА), а также критерии положительного результата (McNeill A.J. et al., 1992; Lu C.
et al., 1995). Разными авторами было показано, что стресс-эхоКГ с добутамином более информативна для диагностики многососудистого поражения ВА, а также для выявления поражения в бассейне передней межжелудочковой ветви левой венечной артерии (ПМЖВ ЛВА) (Geleijnse M.L. et al., 1997; Krenning B.J. et al., 2004). Данные о выраженности ишемического ответа при разной степени локализации и распространенности поражений коронарного русла мало представлены в литературе и ограничиваются в основном показателями диагностической точности стресс-эхоКГ в отношении выявления ИБС вообще, без детализации нарушений сократимости и изменения глобальной систолической функции левого желудочка (ЛЖ) (Krahwinkel W., 1997; Marwick T.H., 2003). Также немногочисленны данные об изменении электрокардиографических показателей при проведении пробы с добутамином (De Felice F. et al., 1999). Ишемический ответ при стресс-эхоКГ, захватывающий большую зону ЛЖ с сопутствующим ухудшением глобальной систолической функции ЛЖ, связан с плохим прогнозом в отношении сердечно-сосудистых событий и смертности (Cortigiani L. et al., 1998; Poldermans D. et al., 1999; Banglalore S. et al., 2005).
Целью нашего исследования было оценить выраженность ишемического ответа, изменения региональной и глобальной систолической функции ЛЖ во время проведения стресс-эхоКГ у пациентов с разной степенью и локализацией поражения коронарных артерий, а также определить, есть ли различия в гемодинамическом ответе и длительности введения добутамина.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
В исследование включили 80 пациентов, из них 10 женщин (средний возраст составил 52±9 лет). В исследование не включили пациентов с клапанными пороками сердца, тяжелой сердечной недостаточностью (СН), с ранее проведенными операциями реваскуляризации ВА, а также пациентов с обострениями сопутствующих заболеваний и при противопоказаниях к проведению стресс-эхоКГ с добутамином. Стресс-эхоКГ проводили по стандартному протоколу (Geleijnse M.L. et al., 1997) со ступенчатым введением добутамина в начальной дозе 5 мкг/кг/мин с последующим повышением на 10 мкг/кг/мин через каждые 3 мин до достижения общей дозы 40 мкг/кг/мин с добавлением атропина на последней ступени (0,25 мг в течение 1 мин до общей дозы 1,0 г) или до развития конечных точек — возникновение новых или усугубление исходных нарушений сократимости, ишемические изменения электрокардиограммы (ЭКГ), серьезные нарушения ритма, стенокардия, повышение/снижение артериального давления (АД). Запись ЭКГ и регистрация АД проводили в исходном состоянии в конце каждой ступени и в реституции (на 2, 5-й и 10-й минутах). Запись эхоКГ-изоб-
ражений проводили постоянно на видеокассету, а также в конце каждой ступени на цифровой носитель. Ишемическим ответом считалось ухудшение сократимости на любом этапе проведения пробы или развитие двухфазного ответа с улучшением сократимости на малых дозах добутамина (5–10 мкг/кг/мин) и дальнейшим ухудшением на пиковых. Оценка сократимости ЛЖ проводилась по стандартной методике, принятой для стресс-эхоКГ-исследования, где каждому из 16 сегментов ЛЖ присваивается балл от 1 до 4 (1 — норма, 2 — гипокинезия, 3 — акинезия, 4 — дискинезия) на каждом этапе проведения пробы (Shiller N.B. et al., 1989; Becher H. et al., 2004). Для оценки глобальной систолической функции ЛЖ использовались показатели — суммарный индекс сократимости ЛЖ (ИС = сумма баллов всех сегментов ЛЖ, поделенная на 16) и фракция изгнания (ФИ) ЛЖ, рассчитанная по методу дисков из 4-камерной верхушечной позиции ЛЖ. Также рассчитывался региональный ИС для бассейнов ПМЖВ, огибающей ветви (ОВ) ЛВА и правой венечной артерии (ПВА), с учетом стандартной схемы кровоснабжения ЛЖ (Geleijnse M.L. et al., 1997). Выраженность поражения ВА сердца оценивали по данным селективной контрастной коронароангиографии, которая была проведена в течение 1 мес до или после стресс-эхоКГ. Учитывались такие параметры: количество пораженных артерий, степень сужения просвета ВА, локализация поражения в бассейнах ЛВА и ПВА, на основании которых рассчитывался показатель суммарного поражения артерий сердца (СПАС) (Фуркало Н.К. и соавт., 1990). При оценке количества пораженных ВА значимым поражением считалось сужение просвета артерии на 70% и более, при использовании метода СПАС учитывалось сужение ВА на 50%. У 21 пациента не отмечали значимого поражения ВА, поражение одной ВА выявлено у 27 человек, поражение двух ВА — у 18, поражение трех сосудов — у 14. По локализации поражения ВА пациентов распределили таким образом: с поражением в бассейне ЛВА — 29 человек, с поражением в бассейне ПВА — 9, с сочетанным поражением бассейнов ЛВА и ПВА — 21. Пациенты были разделены на группы по величине индекса СПАС: группа 1 (n=27) — СПАС от 2 до 24%, группа 2 (n=20) — СПАС от 25 до 49%, группа 3 (n=14) — СПАС 50% и более и контрольная группа (n=19) без значимого поражения ВА — СПАС=0%. Так как при расчете СПАС учитывается сужение просвета ВА на 50% и более, то в контрольной группе без значимого поражения ВА оказалось на 2 пациента меньше, чем в группе с интактными ВА по стандартным критериям значимого поражения ВА. Основные исходные характеристики групп представлены в табл. 1.
Таблица 1
Исходные показатели, характеризующие группы пациентов с разным СПАС
|
Показатель |
Контрольная группа СПАС=0% (n=19) |
1-я группа СПАС=2–24% (n=27) |
2-я группа СПАС=25–49% (n=20) |
3-я группа СПАС≥50% (n=14) |
|
Средний возраст, лет ФК стенокардии ИМ в анамнезе АГ СН≥2 ФК ФИ ЛЖ, % Суммарный ИС ЛЖ Индекс массы ЛЖ, г/м2 |
47±12 0,5±0,9 3 (15,8%) 10 (52,6%) 0 60±7 1,1±0,3 106±21 |
53±8* 1,3±1,3* 17 (63%)* 19 (70%) 6 (22%)* 55±9* 1,4±0,4* 113±28 |
55±8* 1,6±1,3* 16 (80%)* 13 (65%) 7 (35%)* 49±16* 1,6±0,5* 115±35 |
56±5* 2,1±1,6* 10 (71%)* 12 (86%) 5 (36%)* 51±13* 1,5±0,4* 116±29 |
*p<0,05 между 1, 2, 3-й и контрольной группой.
Пациенты 1, 2-й и 3-й групп не отличались между собой по возрасту, тогда как возраст пациентов контрольной группы был значительно меньше, чем у пациентов с поражениями ВА (47±12 лет, p<0,05). У пациентов 3-й группы средний функциональный класс (ФК) стенокардии значимо превышал ФК стенокардии у пациентов 1-й группы (2,1±1,6 против 1,3±1,3, p<0,05), ФК стенокардии пациентов контрольной группы был значительно ниже, чем ФК всех трех групп пациентов (0,5±0,9, p<0,05). Пациенты 1, 2-й и 3-й групп существенно не отличались по наличию инфаркта миокарда (ИМ) в анамнезе и СН≥2 ФК, однако их встречаемость была значимо выше по сравнению с пациентами контрольной группы (p<0,05). По распространенности артериальной гипертензии (АГ) пациенты всех групп существенно не отличались. По исходным показателям эхоКГ пациенты 1, 2-й и 3-й групп не отличались по ФИ ЛЖ, суммарному ИС ЛЖ, индексу массы ЛЖ, конечно-диастолическому размеру (КДР) ЛЖ, в то время как у пациентов контрольной группы показатели глобальной систолической функции ЛЖ были значительно лучше: ФИ была выше (60±7% против 55±9%, 49±16%, 51±13% соответственно для пациентов 1, 2-й и 3-й групп, p<0,05), а суммарный ИС — ниже (1,1±0,3 против 1,4±0,4, 1,6±0,5 и 1,5±0,4 соответственно, p<0,05).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Пациенты 1, 2, 3-й и контрольной групп существенно не отличались по средней максимальной дозе добутамина (31,9±12; 27,3±11; 29,3±10 и 33,3±10 мкг/кг/мин соответственно, p>0,05) и по частоте добавления атропина для достижения расчетной частоты сердечных сокращений (ЧСС) (3,7; 10; 0 и 21% случаев соответственно, p>0,05). Отмечали тенденцию к более высокой максимальной дозе добутамина у пациентов без поражения ВА и у пациентов 1-й группы (СПАС менее 25%), а также к несколько более частому добавлению атропина у пациентов без поражения ВА (в 21% случаев). Различия в длительности введения добутамина были получены для пациентов без поражения ВА и для пациентов 2-й группы (780±155 мс против 654±156 мс, p<0,05). Несколько более высокая доза добутамина и время его введения для пациентов 3-й группы по сравнению с пациентами 2-й группы связана, вероятно, с приемом блокаторов β-адренорецепторов в день исследования. Не было получено различий в максимальной достигнутой ЧСС, в процентах максимальной расчетной ЧСС и двойном произведении (ДП) между тремя группами пациентов, однако эти показатели были значимо ниже по сравнению с контрольной группой. Данные подтверждены корреляционным анализом, где не было получено взаимосвязи величины СПАС с максимальной дозой добутамина, временем введения добутамина, пиковой ЧСС и ДП (r=0,005, r=0,04, r=–0,02, r=–0,11 соответственно, p>0,05).
Одним из самых встречаемых побочных эффектов при проведении стресс-эхоКГ была стенокардия, которая чаще развивалась у пациентов 3-й и 2-й групп по сравнению с пациентами 1-й и контрольной групп (соответственно в 71,4 и 55% случаев против 37 и 26,3% случаев, p<0,05). Такие побочные эффекты, как повышение АД и нарушения ритма, значимо не отличались во всех группах. Неспецифические побочные эффекты (головная боль, головокружение, тремор, одышка) отмечали чаще в контрольной группе по сравнению с пациентами 1-й и 3-й групп (42,1% против 11,1 и 14,2% случаев, p<0,05). По изменениям ЭКГ получены значимые различия в развитии элевации сегмента ST≥2 мм, которую отмечали чаще у пациентов 3-й группы по сравнению с контрольной группой
(в 28,6% случаев, p<0,05). По причинам прекращения инфузии добутамина пациенты распределились таким образом: в группе с интактными ВА основной причиной было выполнение протокола или достижение расчетной ЧСС (42,1% случаев), затем нарушения ритма (в 28,6%), у трех пациентов причиной остановки была стенокардия (14,3%) и на последнем месте нарушения сократимости и депрессия сегмента ST (4,8%). У пациентов со значимыми поражениями коронарного русла основной причиной прекращения пробы было развитие нарушений сократимости (66,7% в 1-й группе, 75% — во 2-й и 78,6% — в 3-й, p>0,05), затем нарушения ритма и стенокардия, возникновение которых не различалось между группами, только у двух пациентов первой группы изменения ЭКГ и неспецифичные побочные эффекты стали причиной остановки пробы.
Таким образом, для пациентов с разным суммарным поражением ВА не было отмечено значимых различий в протоколе введения добутамина, в максимально достигнутой ЧСС и ДП. В целом, хотя и статистически незначимо, патологическую динамику сегмента ST чаще отмечали у пациентов с величиной СПАС 50% и более, у них же чаще причиной остановки пробы служили нарушения сократимости.
Получены различия в среднем количестве сегментов ЛЖ с ишемическим ответом у одного пациента между обследуемыми контрольной группы (0,6±1,2 сегмента) и пациентами трех групп с различным суммарным поражением ВА (4,4±2,5 для пациентов 1-й группы, 4,5±2,3 для пациентов 2-й группы и 6,4±3,1 для пациентов 3-й группы), а также между пациентами 3-й группы и пациентами 1-й и 2-й групп (p<0,05). Не отмечалось значительных различий в количестве сегментов с ишемическим ответом для пациентов 1-й и 2-й групп (табл. 2).
Таблица 2
Среднее количество сегментов с ишемическим ответом у одного пациента при разном суммарном поражении ВА
|
Группы |
||||
|
Контрольная группа (СПАС=0) |
1-я группа (СПАС=2–24%) |
2-я группа (СПАС=25–49%) |
3-я группа (СПАС≥50%) |
|
|
Количество сегментов |
0,6 |
4,4* |
4,5* |
6,4* |
|
Стандартное отклонение |
1,2 |
2,5 |
2,3 |
3,1 |
*p<0,05 между 1, 2, 3-й и контрольной группой.
Проведенный анализ показал положительную корреляцию выраженности поражения коронарного русла (СПАС) с количеством сегментов с ишемическим ответом у одного пациента (r=0,47; p<0,05), количество же сегментов с нормальным ответом имело обратную взаимосвязь с выраженностью поражения ВА (r=–0,5; p<0,05) (рис. 1). Критерием ишемического ответа в сегменте ЛЖ было ухудшение сократимости на любом этапе проведения пробы или двухфазный ответ с улучшением на малых и ухудшением на пиковых дозах добутамина.
При распределении пациентов на группы по количеству пораженных ВА были отмечены значимые различия в количестве сегментов с ишемическим ответом между пациентами с интактными ВА (0,8±1,4 сегмента) и с поражениями одного, двух и трех ВА (4,4±2,5 сегмента, 4,6±2,4 сегмента и 5,2±3,3 сегмента, p<0,05). Не было получено статистически значимых различий в количестве сегментов с ишемическим ответом между пациентами с разным количеством пораженных ВА, отмечали лишь тенденцию к большему количеству сегментов с ишемическим ответом с увеличением количества пораженных ВА (рис. 1).

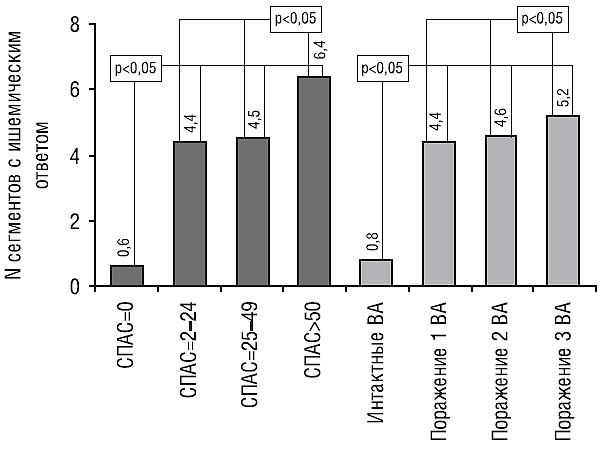
Рис. 1. Среднее количество сегментов с ишемическим ответом у одного пациента при разном суммарном поражении ВА и при разном количестве пораженных ВА
Для того чтобы определить критерии прогнозирования выраженности поражения ВА, пациентов разделили на группы по количеству сегментов с ишемическим ответом: без ишемического ответа (20 пациентов) и с ишемическим ответом с количеством сегментов от 1 до 6 (45 пациентов) и более 6 (15 пациентов). Оказалось, что у 70% пациентов с отсутствием ишемического ответа не выявлено поражений ВА (СПАС=0) и у 30% выявлены поражения ВА с индексом СПАС менее 50%. Среди пациентов с ишемическим ответом в 1–6 сегментах ЛЖ у 11,1% пациентов не выявлено поражений ВА (СПАС=0), у 73,3% было поражение ВА разной степени с индексом СПАС менее 50% и у 15,5% — выраженное поражение ВА (СПАС≥50%). У всех пациентов с нарушениями сократимости в более 6 сегментах ЛЖ были различной степени поражения ВА — у 53,3% с индексом СПАС менее 50% и у 46,7% пациентов СПАС≥50%(табл. 3). Средний индекс СПАС составил 4,4±10,8% для пациентов без ишемического ответа, 25,1±19,7% для пациентов с ишемическим ответом в 1–6 сегментах ЛЖ и 38,1±20,1% для пациентов с ишемическим ответом в более чем 6 сегментах ЛЖ (p<0,05).
Таблица 3
СПАС у пациентов с разным количеством сегментов с ишемическим ответом
|
СПАС |
Количество сегментов с ишемическим ответом у одного пациента |
||
|
0 (n=20) |
1–6 (n=45) |
Более 6 (n=15) |
|
|
СПАС=0 |
14 (70%) |
5 (11,1%) |
0 |
|
СПАС<50% |
6 (30%) |
33 (73,3%) |
8 (53,3%) |
|
СПАС≥50% |
0 |
7 (15,6%) |
7 (46,7%) |
|
Среднее СПАС |
4,4±10,8 |
25,1±19,7 |
38,1±20,1 |
Таким образом, по нашим данным у пациентов без ишемического ответа при проведении стресс- эхоКГ с добутамином наибольшая вероятность (положительное предсказывающее значение 70%) отсутствия поражения ВА, с ишемическим ответом в менее 6 сегментах ЛЖ наибольшая вероятность наличия умеренного поражения ВА (СПАС<50%) и в более чем 6 сегментах ЛЖ — примерно равная вероятность наличия как умеренного, так и выраженного поражения ВА (СПАС>50%). У пациентов с ишемическим ответом в более чем 6 сегментах ЛЖ практически отсутствует вероятность наличия интактных ВА.
Тот факт, что при разном количестве пораженных ВА не было отмечено значительных различий в количестве сегментов с ишемическим ответом, тогда как у пациентов с суммарным поражением ВА СПАС≥50% отмечали значительно большее количество сегментов с ишемическим ответом, объясняется тем, что вероятность развития ишемии повышается при более высокой степени сужения просвета ВА, что учитывается при расчете показателя СПАС. Несколько большее количество сегментов с ишемическим ответом среди пациентов с интактными ВА (0,8±1,4 сегмента) по сравнению с пациентами со СПАС=0 (0,6±1,2 сегмента) связано с тем, что у пациентов с поражением ВА до 75%, что было расценено как незначимое при оценке количества пораженных ВА, отмечался ишемический ответ при введении добутамина (при расчете показателя СПАС учитываются поражения ВА на 50% сужения просвета).
Для того чтобы определить критерии прогнозирования выраженности поражения ВА, пациенты без выраженных исходных нарушений сократимости были также разделены на группы по величине суммарного ИС на пиковых дозах добутамина: ИС=1,0 (17 пациентов), ИС от 1,05 до 1,49 (34 пациента) и ИС≥1,5 (14 пациентов). Для этого анализа были исключены 15 пациентов с исходными нарушениями сократимости в 2 и более сегментах ЛЖ. Среди пациентов с нормальным пиковым суммарным ИС (равном 1,0) у 76,5% не было выявлено поражений ВА (СПАС=0), у остальных 23,5% пациентов были выявлены поражения ВА с индексом СПАС менее 50%. Среди пациентов с пиковым суммарным ИС большим чем 1,0, но менее 1,5 у 20,6% пациентов не было выявлено поражений ВА (СПАС=0), у 64,7% было поражение ВА с индексом СПАС менее 50% и у 14,7% было выраженное поражение ВА (СПАС≥50%). У всех пациентов с пиковым ИС ≥1,5 были различной степени поражения ВА — у половины пациентов с индексом СПАС менее 50% и у другой половины со СПАС 50% и более (табл. 4). Средний индекс СПАС составил 5,1±11,6% для пациентов с нормальным пиковым ИС, 22,5±19% — с увеличенным пиковым ИС<1,5 и 40,3±20% — с пиковым ИС≥1,5 (p<0,05).
Для пациентов с нормальным пиковым ИС ЛЖ (равном 1) оказалась наиболее высокая вероятность (положительное предсказующее значение 76,5%) отсутствия поражения ВА. У пациентов с увеличенным, но менее 1,5 пиковым ИС наиболее высокая вероятность наличия умеренного поражения ВА (СПАС<50%), тогда как у пациентов с пиковым ИС 1,5 и более оказалась равная вероятность наличия как умеренного, так и выраженного поражения ВА (СПАС>50%), у этих пациентов практически отсутствует вероятность наличия интактных ВА.
Таблица 4
СПАС у пациентов с разным пиковым суммарным ИС
|
СПАС |
Пиковый суммарный ИС ЛЖ |
||
|
1,0 (n=17) |
1,05–1,49 (n=34) |
≥1,5 (n=14) |
|
|
СПАС=0 |
13 (76,5%) |
7 (20,6%) |
0 |
|
СПАС<50% |
4 (23,5%) |
22 (64,7%) |
7 (50%) |
|
СПАС≥50% |
0 |
5 (14,7%) |
7 (50%) |
|
Среднее СПАС |
5,1±11,6 |
22,5±19,0 |
40,3±20,0 |
При корреляционном анализе было показано, что увеличение ИС на пиковых дозах введения добутамина имеет положительную взаимосвязь с величиной СПАС (r=0,37, p<0,05) у пациентов без выраженных исходных нарушений сократимости (ИС<1,5). Отмечали значительную положительную корреляцию СПАС с величиной пикового ИС (r=0,51, p<0,05). Также отмечали отрицательную корреляционную взаимосвязь между СПАС и изменением ФИ, то есть отмечали больший прирост ФИ при меньшем суммарном поражении ВА (r= –0,38; p<0,05).
Таким образом, с увеличением суммарного поражения коронарного русла ухудшается глобальная систолическая функция ЛЖ, что проявляется в увеличении суммарного ИС и меньшем приросте ФИ на пиковых дозах добутамина. У пациентов со СПАС 50% и более отмечалось наибольшее увеличение суммарного ИС.
Была проведена оценка изменения регионального ИС в бассейне кровоснабжения пораженной ВА, при этом исключались те пациенты, у которых были исходные нарушения в исследуемых сегментах ЛЖ. Поражение ПМЖВ было у 12 пациентов, поражение ОВ ЛВА — у 18 и поражение ПВА — у 14 пациентов (рис. 2).
Различия в изменении регионального ИС отмечали уже при низкой дозе добутамина. Так, в бассейне ПВА не отмечали нарушений сократимости у всех пациентов, в то время как в бассейнах ПМЖВ и ОВ уже отмечен небольшой прирост ИС (на 5,6±10,1% для ПМЖВ и на 2,8±11,8% для ОВ). Различия в изменении ИС при низкой дозе добутамина получены для ПМЖВ и ПВА (5,6±10,1% против 0%, p<0,05). При максимальной дозе добутамина в бассейнах ПМЖВ и ПВА отмечали более выраженные изменения сократимости, чем в бассейне ОВ (прирост ИС на 34,5±30,7% для ПМЖВ, на 33,3±45,3% для ПВА и на 11,1±21,4% для ОВ, p<0,05). Не было отмечено значимых различий в изменениях ИС в реституции, однако для бассейна ОВ сохраняется тенденция к меньшему приросту ИС (17,7±28,9% для ПМЖВ, 19,0±28,4% для ПВА и 11,1±32,3% для ОВ, p>0,05). Таким образом, для сегментов ЛЖ в бассейне кровоснабжения ОВ были характерны менее выраженные индуцированные нарушения сократимости, чем в других регионах кровоснабжения ЛЖ при максимальной дозе добутамина. Не было значимых различий в изменении ИС в бассейнах ПМЖВ и ПВА. Для бассейна ПВА было характерно развитие нарушений сократимости только при максимальной дозе добутамина, тогда как для ПМЖВ и ОВ ЛВА нарушения сократимости начинали развиваться уже при минимальной дозе добутамина.

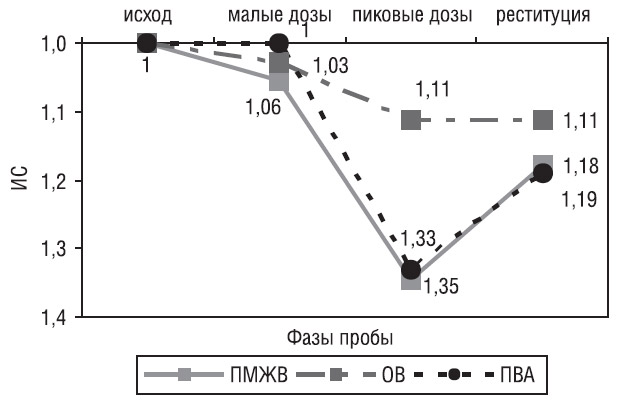
Рис. 2. Изменение регионального ИС в бассейнах, пораженных ВА, при исходном нормальном ИС
ВЫВОДЫ
Для пациентов с разным суммарным поражением артерий сердца не было отмечено значимых различий в протоколе введения добутамина, в максимально достигнутых ЧСС и двойном произведении. Изменения ЭКГ (депрессия/элевация сегмента ST) несколько чаще отмечали у пациентов с выраженными поражениями артерий сердца, у них же чаще причиной остановки пробы были нарушения сократимости.
Выраженность ишемического ответа на стимуляцию добутамином была прямо взаимосвязана с суммарным поражением ВА, тогда как не было получено значимых различий в выраженности ишемического ответа у пациентов с разным количеством пораженных ВА. Эти данные характеризуют взаимосвязь ишемии с локализацией атеросклеротического поражения ВА и степенью сужения ВА в большей мере, чем с количеством пораженных ВА.
При ишемическом ответе в 6 и менее сегментах ЛЖ и пиковом суммарном ИС более 1 и менее 1,5 с наибольшей вероятностью (73–65%) можно говорить о наличии умеренного поражения коронарного русла (СПАС менее 50%). При развитии ишемического ответа в более чем 6 сегментах ЛЖ и пиковом ИС более 1,5 отсутствует вероятность интактных ВА, а вероятность наличия умеренного (СПАС менее 50%) и выраженного (СПАС 50% и более) поражения ВА практически одинакова (50–53%).
При поражении ОВ были характерны менее выраженные нарушения сократимости на пиковых дозах добутамина, чем при поражениях ПМЖВ и ПВА. Для бассейна ПВА было характерно развитие нарушений сократимости только на пиковых дозах добутамина, тогда как для ПМЖВ и ОВ нарушения сократимости начинали развиваться уже на малых дозах добутамина.
ЛИТЕРАТУРА
Фуркало Н.К., Яневский Г.В., Следзевская И.К. (1990) Клинико-инструментальная диагностика поражений сердца и венечных сосудов. Здоров’я, К., 192 с.
Bangalore S., Yao S.S., Chaudhry F.A. (2005) Stress function index, a novel index for risk stratification and prognosis using stress echocardiography. J. Am. Soc. Echocardiogr., 18(12): 1335–1342.
Bartunek J., Wijns W., Heyndrickx G.R., de Bruyne B. (1999) Effects of dobutamine on coronary stenosis physiology and morphology: comparison with intracoronary adenosine. Circulation, 100(3): 243–249.
Becher H., Chambers J., Fox K., Jones R., Leech G.J., Masani N., Monaghan M., More R., Nihoyannopoulos P., Rimington H., Senior R., Warton G.; British Society of Echocardiography Policy Committee (2004) BSE procedure guidelines for the clinical application of stress echocardiography, recommendations for performance and interpretation of stress echocardiography: a report of the British Society of Echocardiography Policy Committee. Heart, 90(Suppl. 6): vi23–vi30.
Chaudhry F.A., Bangalore S., Yao S.S., Ramani K., Walton D., Lee A., Dohad S. (2004) Comparison of stress-induced myocardial ischemia in patients with and without coronary arterial collaterals. Am. J. Cardiol., 94(10): 1232–1236.
Cortigiani L., Picano E., Landi P., Previtali M., Pirelli S., Bellotti P., Bigi R., Magaia O., Galati A., Nannini E. (1998) Value of pharmacologic stress echocardiography in risk stratification of patients with single-vessel disease: a report from the Echo-Persantine and Echo-Dobutamine International Cooperative Studies. J. Am. Coll. Cardiol., 32 (1): 69–74.
De Felice F., Gostoli E., Russo M., Bonzano A., Recanzone P., Moretti C., Pinneri F., Borello G. (1999) Significance of T-wave changes during early dobutamine stress echocardiography in patients with Q-wave acute myocardial infarction. Am. J. Cardiol., 84(5): 535–539.
Elhendy A., van Domburg R.T., Bax J.J., Poldermans D., Nierop P.R., Geleijnse M.L., Roelandt J.R. (2000) The grade of worsening of regional function during dobutamine stress echocardiography predicts the extent of myocardial perfusion abnormalities. Heart, 83(1): 35–39.
Geleijnse M.L., Fioretti P.M., Roelandt J.R. (1997) Methodology, feasibility, safety and diagnostic accuracy of dobutamine stress echocardiography. J. Am. Coll. Cardiol., 30(3): 595–606.
Gibbons R.J., Chatterjee K., Daley J., Douglas J.S., Fihn S.D., Gardin J.M., Grunwald M.A., Levy D., Lytle B.W., O’Rourke R.A., Schafer W.P., Williams S.V., Ritchie J.L., Cheitlin M.D., Eagle K.A., Gardner T.J., Garson A. Jr, Russell R.O., Ryan T.J., Smith S.C. Jr. (1999) ACC/AHA/ACP-ASIM guidelines for the management of patients with chronic stable angina: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Management of Patients With Chronic Stable Angina). J. Am. Coll. Cardiol., 33(7): 2092–2197.
Krahwinkel W., Ketteler T., Godke J., Wolfertz J., Ulbricht L.J., Krakau I., Gulker H. (1997) Dobutamine stress echocardiography. Eur. Heart J., 18(Suppl. D): D9–D15.
Krenning B.J., Geleijnse M.L., Poldermans D., Roelandt J.R. (2004) Methodological analysis of diagnostic dobutamine stress echocardiography studies. Echocardiography, 21(8): 725–736.
Lu C., Picano E., Pingitore A., Sicari R., Tongiani R., Baratto M., Palmieri C., Marzilli M., L’Abbate A. (1995) Complex coronary artery lesion morphology influences results of stress echocardiography. Circulation, 91(6): 1669–1675.
Marwick T.H. (2003) Stress echocardiography. Heart, 89(1): 113–118.
McNeill A.J., Fioretti P.M., el-Said S.M., Salustri A., Forster T., Roelandt J.R., McNeill A.J., Fioretti P.M., El-Said S.M. et al. (1992) Enhanced sensitivity for detection of coronary artery disease by addition of atropine to dobutamine stress echocardiography. Am. J. Cardiol., 70(1): 41–46.
O’Keefe J.H., Barnhart C.S., Bateman T.M. (1995) Comparison of stress echocardiography and stress myocardial perfusion scintigraphy for diagnosing coronary artery disease and assessing its severity. Am. J. Cardiol., 75(11): 25D–34D.
Poldermans D., Fioretti P.M., Boersma E., Bax J.J., Thom-
son I.R., Roelandt J.R., Simoons M.L. (1999) Long-term prognostic value of dobutamine-atropine stress echocardiography in 1737 patients with known or suspected coronary artery disease: A single-center experience. Circulation, 99(6): 757–762.
Schiller N.B., Shah P.M., Crawford M., DeMaria A., Deve-
reux R., Feigenbaum H., Gutgesell H., Reichek N., Sahn D., Schnittger I., et al. (1989) Recommendations for quantitation of the left ventricle by two-dimensional echocardiography. American Society of Echocardiography Committee on Standards, Subcommittee on Quantitation of Two-Dimensional Echocardiograms. J. Am. Soc. Echocardiogr., 2(5): 358–367.
Резюме. Стрес-ехокардіографія з добутаміном дозволяє діагностувати коронарний атеросклероз, а також оцінити ступінь ішемії. У статті представлено результати обстеження 80 пацієнтів, у 61 з яких відзначали ураження вінцевих артерій різного ступеня. Проведено порівняльний аналіз показників гемодинаміки, змін електрокардіограми при стрес-ехокардіографії з добутаміном у пацієнтів з різним сумарним ураженням артерій серця. Визначено стрес-ехокардіографічні критерії помірного та вираженого ураження артерій серця за величиною сумарного пікового індексу скоротності і кількістю сегментів з індукованими порушеннями скоротності. Показано, що в сегментах лівого шлуночка з кровопостачанням із різних басейнів вінцевих артерій порушення скоротності розвивалися різною мірою. Встановлено, що ступінь порушень глобальної та регіональної скоротливої функції лівого шлуночка прямо пов’язаний зі ступенем ураження вінцевого русла.
Ключові слова:ішемічна хвороба серця, сумарне ураження артерій серця, стрес-ехокардіографія
Results of stress echocardiography with dobutamine in patients with ischemic heart disease with various damage of coronary arteries
Summary. Stress echocardiography with dobutamine allows to diagnose coronary artery disease as well as to evaluate severity of ischemia. In the article we present data of investigation of 80 patients, 61 of whom had various atherosclerotic damage of coronary arteries. We conducted comparative analyses of hemodynamic indices and changes of ECG during dobutamine stress echocardiography in patients with different summary damage of coronary arteries. Criterions of moderate and severe summary damage of coronary arteries were determined using summary wall motion score index and number of dyskinetic segments of left ventricle. We have shown that segments supplied by different coronary arteries developed different wall motion abnormalities. We have established that severity of global and regional left ventricular systolic dysfunction is directly correlated with severity of coronary arteries damage.
Key words: ischemic heart disease, summary damage of coronary arteries, stress echocardiography
Адрес для переписки:
Немчина Елена Александровна
03151, Киев, ул. Народного ополчения, 5
Институт кардиологии им. Н.Д. Стражеско
АМН Украины





