ВСТУП
В останні роки все більше уваги приділяється застосуванню комбінованої терапії при лікуванні артеріальної гіпертензії (АГ) (Hansson L., Hedner T., 2000; Сіренко Ю.М., 2002; ESH — ESC Guidelines Committee, 2003; Робоча група з артеріальної гіпертензії Української асоціації кардіологів, 2004). Так, рекомендації Американського товариства АГ (JNC-7, 2003) визначають необхідність призначення стартової комбінованої терапії усім хворим з рівнем артеріального тиску (АТ) 160/100 мм рт. ст. і більше (National High Blood Pressure Education Program, 2003). До того ж одним із компонентів цієї терапії повинен бути діуретик. За даними епідеміологічних досліджень в Україні близько 50% пацієнтів мають помірну або тяжку АГ, тобто АТ ≥160 та 100 мм рт. ст. А це означає, що половина хворих на АГ потребує комбінованої терапії, яка б включала діуретик. Реально в Україні призначається комбінована терапія лише 33,3 та 53,1% пацієнтів з АГ відповідно в місті та селі (Смірнова І.П. та співавт., 1998). При цьому переважає призначення комбінованих препаратів, що є неповнодозовими або зовсім нерекомендовані до застосування як стартова терапія.
На українському фармацевтичному ринку у 2006 р. з’явився препарат ЕНЗИКС® (виробництво компанії «Хемофарм», Сербія), що є нефіксованою комбінацією (окремі таблетки) в одній упаковці індапаміду (у дозі 2,5 мг) та еналаприлу у дозах 10 мг (ЕНЗИКС®), 10 мг двічі (ЕНЗИКС® ДУО), 20 мг двічі (ЕНЗИКС® ДУО ФОРТЕ). Блістер з таблетками ЕНЗИК® ДУО та ЕНЗИКС® ДУО ФОРТЕ розділено на дві частини: «ранок», де в кожну чарунку закладено таблетку еналаприлу й таблетку індапаміду, і «вечір», де в кожну чарунку закладено лише таблетку еналаприлу. Перевагами такої нефіксованої комбінації над фіксованою є можливість ширшого варіювання дози призначених ліків. Ефективність та безпеку препарату ЕНЗИКС® вже було продемонстровано у Росії, де проходило дослідження ЕПІГРАФ-1 та ЕПІГРАФ-2 (Беленков Ю.Н. и рабочая группа исследования ЭПИГРАФ-2, 2005). Відповідно до протоколу дослідження ЕПІГРАФ-2 розроблено протокол аналогічного дослідження, яке проходило у шести містах України. Метою цих досліджень було визначити клінічну ефективність та безпеку препарату ЕНЗИКС® — нового типу комбінованого лікування АГ — порівняно з традиційною антигіпертензивною терапією. Далі наведено основні первинні результати дослідження ЕПІГРАФ-2 в Україні.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
За протоколом у дослідження включили 235 па- цієнтів, середній вік яких становив 54,4±1,0 року. З них 6 (2,6%) пацієнтів мали рівень АТ <140/90 мм рт. ст., 101 (43%) — м’яку АГ, 122 (51,8%) — помірну та 6 (2,6%) — тяжку АГ. Усі пацієнти з тяжкою АГ раніше не лікувалися і були включені у дослідження за побажанням лікарів, які проводили дослідження. Пацієнти з рівнем АТ <140 та 90 мм рт. ст., що хворіли на цукровий діабет, були включені у дослідження з тих міркувань, що цільовим АТ у хворих на цукровий діабет є 130/85, а не 140 і 90 мм рт. ст.
У дослідженні не брали участі пацієнти з тяжкою АГ (АТ 180/110 мм рт. ст.), ішемічною хворобою серця та IV функціональним класом (ФК) стенокардії, з нестабільною стенокардією, ті, яким проводили інвазивні втручання раніше ніж за 30 днів до включення у дослідження, з порушенням серцевого ритму, які потребували спеціального лікування, фібриляцією передсердь, синдромом слабкості синусового вузла, атріовентрікулярною блокадою 2–3 ступеня, серцевою недостатністю IV ФК (за класифікацією NYHA), хронічним легеневим серцем, бронхіальною астмою, гемодинамічно значущими вадами серця, гіпертрофічною кардіоміопатією, вторинною АГ, з рівнем креатиніну більше як у 2 рази від верхньої границі норми відповідних лабораторій, що брали участь у дослідженні, декомпенсованими захворюваннями печінки (підвищення аланін амінотрансферази у 2 рази більше норми лабораторії), некоригованими електролітними порушеннями (рівень калію <3,5 ммлоль/л або >5,5 ммоль/л), декомпенсованим цукровим діабетом, ті, які були неспроможні підписати форму згоди або виконувати протокол дослідження, з непереносимістю інгібіторів ангіотензинперетворювального ферменту (АПФ) в анамнезі. Вагітні, ті, які планували завагітніти, та пацієнтки в період лактації також виключалися з дослідження.
Лікування. Залежно від терапії всіх пацієнтів розділили на 2 групи (рис. 1). 1-ша група (основна, група препарату ЕНЗИКС®, 161 (69%) хворий) приймала препарат за схемою:
>
*Достовірність різниці між групами р<0,05.
2-гу групу (контрольну) становили 74 (31%) пацієнти. Лікар самостійно приймав рішення про вибір терапії для пацієнта, за винятком інгібіторів АПФ та блокаторів рецепторів ангіотензину ІІ. Обов’язковою умовою було надання хворим усних рекомендацій щодо модифікації способу життя, кожний другий отримував надруковані «Пам’ятки хворого на артеріальну гіпертензію», розроблені в Національному науковому центрі «Інститут кардіології ім. М.Д. Стражеска» АМН України. Окрім того, обов’язковою була наполегливість лікаря у досягненні цільового АТ у хворих протягом 12 тиж лікування.
Якщо пацієнти на момент включення їх у дослідження вже отримували антигіпертензивну терапію, то її відміняли на 1–2 тиж (період відмивання).
Якщо на візиті 2 цільовий рівень не було досягнуто, дозу призначеного препарату підвищували або додавали інший препарат (у групі контролю).
Первинна ефективність призначеної терапії визначалася як частота досягнення цільового АТ за даними офісного вимірювання (<140/90 мм рт. ст.) та добового моніторування АТ (ДМАТ) (середній денний АТ <135/85 мм рт. ст.).
Дизайн дослідження. Схему візитів представлено у табл. 1.
| Дослідження | Візит 0 (1—2 тиж) Скринінг* |
Візит 1 (0 тиж) Рандомізація |
Візит 2 (4 тиж) Титрування |
Візит 3 (12 тиж) Закінчення |
|---|---|---|---|---|
| Підписання інформованої згоди | Х | |||
| Відміна попередньої антигіпертензивної терапії | Х | |||
| Анамнез | Х | |||
| АТ, ЧСС | Х | Х | Х | |
| Оцінка СС ризику | Х | Х | ||
| Побічні ефекти | Х | Х | Х | Х |
| Заповнення анкети оцінки якості життя | Х | Х | ||
| ЕКГ (в спокої) | Х | Х | ||
| ехоКГ | Х | Х | ||
| Моніторування АТ | Х | Х | ||
| Лабораторні дослідження (загальний аналіз крові, сечі, визначення мікроальбумінурії, біохімічний аналіз крові) |
Х | Х | ||
| Фармакоекономічний аналіз | Х | Х | ||
| Видача пам’ятки пацієнту** | Х |
Примітки:
*візит 0 проводився тільки пацієнтам, які отримували на момент підписання інформованої згоди антигіпертензивну терапію;
**пам’ятка видавалася кожному другому пацієнту;
ЧСС — частота серцевих скорочень, СС — серцево-судинний, ЕКГ — електрокардіографія, ехоКГ — ехокардіографія.
Методи обстеження. Усім хворим на початку та в кінці дослідження проводили офісне вимірювання АТ систолічного (САТ), діастолічного (ДАТ) з визначенням ЧСС; ДМАТ, біохімічне дослідження крові, визначення рівня мікроальбумінурії, визначали витрати пацієнта на придбання антигіпертензивних препаратів.
Вимірювання АТ проводили ртутним сфігмоманометром вранці між 8:00 та 10:00 год перед прийомом наступної дози препаратів. Реєстрацію САТ та ДАТ в положенні сидячи проводили на одній руці тричі та обчислювали середнє значення. ЧСС визначали після другого вимірювання. (Izzo J.L., Black H.R.; American Heart Association Council on High Blood Pressure Research, 1999). Ці параметри визначали не тільки на початку дослідження, але й на візитах 2 і 3 через 4 та 12 тиж лікування відповідно.
ДМАТ проводили на портативному апараті АВРМ-04 («Меdithech», Угорщина). При цьому вивчали наступні показники: середньодобовий (тСАТ), денний (дСАТ), нічний (нСАТ) САТ, середньодобовий (тДАТ), денний (дДАТ), нічний (нДАТ) ДАТ, середньодобовий (тПАТ), денний (дПАТ), нічний (нПАТ) пульсовий АТ (ПАТ) та ЧСС. При комп’ютерному аналізі ДМАТ для САТ і ДАТ розраховували часовий індекс (Час. ін.), що характеризує часове перевантаження тиском протягом доби і визначається як відсоток вимірів АТ, що перевищує 140/90 мм рт. ст. вдень і 120/80 мм рт. ст. уночі. Також індекс варіабельності (Ст. від.) обчислювали як стандартне відхилення величини АТ. Крім того, за допомогою програмного забезпечення вираховували добовий індекс (ДІ) — процент зниження нічного АТ порівняно з денним, моніторування проводили в наступному режимі: у день — кожні 15 хв, уночі (з 22:00 до 6:00 год) — кожні 30 хв. Хворі вели звичайний спосіб життя з побутовими фізичними та психоемоційними навантаженнями (Pickering T., 1998; White W. B., 2001). Величина ранкового підйому АТ вираховувалася як різниця між максимальним рівнем у період між 6:00 та 12:00 год ранку та мінімальним рівнем у нічний період відповідно САТ і ДАТ.
Біохімічні аналізи включали визначення рівня креатиніну, глюкози, калію, натрію, тригліцеридів та холестерину сироватки крові. Величину клубочкової фільтрації (КФ) розраховували за допомогою формули Cocroft — Gault (Сіренко Ю.М., 2002; Робоча група з артеріальної гіпертензії Української асоціації кардіологів, 2004). Визначення рівня мікроальбумінурії проводили за допомогою смужкового тесту.
Спостереження тривало 3 міс.
Статистична обробка результатів. Статистичну обробку результатів проводили після створення баз даних у системах Microsoft Excel за допомогою програми SPSS 13.0. Достовірність різниці між показниками на початку дослідження та на фоні лікування визначали методом парного двовідбіркового t-тесту для середніх. Достовірність різниці середніх між групами вираховувалася методом двовідбіркового незалежного t-тесту для середніх у групах з параметричним розподілом після визначення характеру розподілу.
РЕЗУЛЬТАТИ
Характеристика пацієнтів. Клініко-демографічна характеристика обстежених груп представлена у табл. 2. На початку дослідження групи достовірно не відрізнялися за основними клініко-демографічними показниками. В 1-й групі достовірно частіше відзначали вперше виявлену АГ, середня тривалість вже існуючої АГ була більшою. Підвищений загальний холестерин також частіше відзначали в основній групі, в якій призначали ЕНЗИКС®. За рівнем офісного САТ та ЧСС групи достовірно не відрізнялися. Рівень офісного ДАТ був достовірно вищим у 1-й групі. За даними лабораторних досліджень групи також достовірно не відрізнялися.
| Показник, одиниці вимірювання | Група | |
|---|---|---|
| 1-ша (n=161) |
2-га (n=74) |
|
| Вік, років | 54,7±0,77 | 54,0±1,3 |
| Жінки, n (%) Чоловіки, n (%) |
82 (50,9) 79 (49,1) |
36 (48,6) 38 (51,4) |
| Індекс маси тіла, кг/м2 | 30,5±0,42 | 29,1±0,46 |
| Тривалість АГ, міс | 99,5±7,2 | 67,1±7,9* |
| Вперше виявлена АГ, n (%) | 30 (18,6) | 7 (9,5)* |
| Не лікувалися, n (%) Лікувалися регулярно, n (%) Лікувалися нерегулярно, n (%) |
47 (29,2) 49 (30,4) 65 (40,4) |
19 (25,7) 20 (27) 35 (47,3) |
| Приймали інгібітори АПФ раніше, n (%) | 94 (58,2) | 37 (50) |
| Інсульт в анамнезі, n (%) | 3 (1,9) | 1 (1,4) |
| ІХС, n (%) | 39 (24,2) | 17 (23) |
| Інфаркт міокарда в анамнезі, n (%) | 14 (8,7) | 4 (5,4) |
| Стенокардія напруження, n (%) У т.ч. I ФК (NYHA), n (%) II ФК (NYHA), n (%) III ФК (NYHA), n (%) |
35 (21,7) 15 (9,3) 18 (11,2) 2 (1,2) |
13 (17,7) 9 (12,2) 1 (1,4)* 3 (4,1) |
| Серцева недостатність, n (%) У т.ч. I ФК (NYHA), n (%) II ФК (NYHA), n (%) III ФК (NYHA), n (%) У минулому, n (%) |
48 (29,8) 34 (21,1) 13 (8,1) 3 (1,7) 11 (6,8) |
20 (27) 16 (21,6) 3 (4,1) 1 (1,4) 8 (10,8) |
| Цукровий діабет, n (%) | 16 (9,9) | 4 (5,4) |
| Ураження нирок, n (%) У т.ч. підвищення креатиніну, n (%) протеінурія, n (%) мікроальбумінурія, n (%), за даними анамнезу |
43 (26,7) 4 (2,5) 11 (6,8) 28 (17,4) |
11 (14,9) 1 (1,4) 2 (2,8) 10 (13,5) |
| Ретинопатія, n (%) | 92 (57,1) | 35 (47,3) |
| Підвищений холестерин в анамнезі, n (%) | 103 (64) | 33 (44,6)** |
| Паління, n (%) Тривалість паління, років Кількість цигарок на добу |
36 (22,9) 21,8±1,9 20,3±1,9 |
25 (32,1) 16,4±1,3** 14,2±1,4** |
| Наявність родичів з серцево-судинними захворюваннями у молодому віці, n (%) | 101 (62,7) | 55 (74,3) |
| Ступінь підвищення АТ на початку дослідження: <140/90 мм рт. ст., n (%) 140–159/90–99 мм рт. ст., n (%) 160–179/100–109 мм рт. ст., n (%) 180/110 і більше, мм рт. ст., n (%) |
1 (0,6) 67 (41,6) 88 (54,7) 3 (3,1) |
5 (6,8)*** 34 (45,9) 34 (45,9) 1 (1,4) |
| Офісний САТ, мм рт. ст. Офісний ДАТ, мм рт. ст. ЧСС, уд. за 1 хв. |
158,8±0,9 96,2±0,6 75,6±0,7 |
155,4±1,5 92,5±1,1* 76,9±1,3 |
Примітки:
*достовірність різниці між показниками р<0,005;
**достовірність різниці між показниками р<0,02;
***достовірність різниці між показниками р<0,05.
На початку дослідження 47 (29,2%) пацієнтів 1-ї групи та 19 (25,7%) 2-ї групи не приймали ліків. При цьому з них 17 (36,2%) та 12 (63,2%) відповідно знали про підвищений АТ, але не лікувалися, а інші мали вперше виявлену АГ. Розподіл пацієнтів за групами препаратів, які вони приймали на початку дослідження, представлено на рис. 1. Більшість пацієнтів в обох групах приймали інгібітори АПФ. Причому в основній групі (ЕНЗИКС®) попереднє лікування інгібіторами АПФ та діуретиками було достовірно частішим.
Таким чином, з огляду на початковий стан пацієнти 1-ї групи, яким призначали ЕНЗИКС®, мали тяжчий стан за даними деяких показників.
Антигіпертензивна ефективність за даними офісного вимірювання АТ. Для стартової терапії у 1-й групі було призначено ЕНЗИКС® 70 (43,5 %) пацієнтам та ЕНЗИКС® ДУО 91 (56,5%). У 2-й групі 37 (50%) хворим призначали антагоністи кальцію, 38 (51,4 %) — блокатори β-адренорецепторів, 19 (25,7%) — діуретики, 3 (4,1%) — моксонідин. Окрім того, 2 пацієнтам було призначено інгібітор АПФ та 2 — блокатор рецепторів ангіотензину ІІ. Загалом на даному етапі в 2-й групі 47 (63,5%) пацієнтів отримували монотерапію, 24 (32,4%) два препарати, 3 (4,1%) три антигіпертензивних препарати. Динаміка АТ та ЧСС на етапах лікування представлена на рис. 2. Вже через 4 тиж відзначали достовірне зниження САТ/ДАТ у 1-й групі з 158,8±0,9/96,2±0,6 до 135,9±1,0/84,7±0,7 мм рт. ст. (р<0,001 для обох показників). Тоді як у 2-й групі достовірно знизився лише ДАТ з 92,5±1,1 до 83,9±0,9 мм рт. ст. (р<0,001). Цільовий офісний АТ (<140/90 мм рт. ст.) на етапі 4 тиж лікування було досягнуто у 109 (67,7%) пацієнтів 1-ї групи та 37 (50%) 2-ї групи (р<0,02).
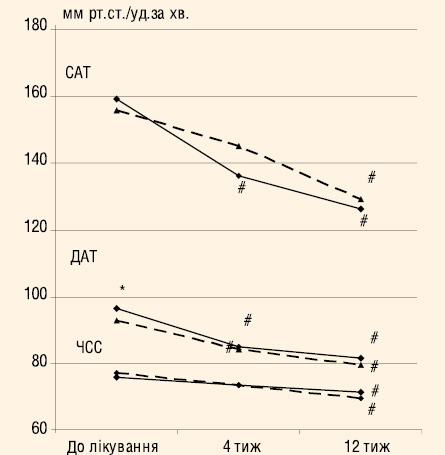
На етапі 12 тиж лікування 55 (34,2%) пацієнтів 1-ї групи продовжували отримувати ЕНЗИКС®, 68 (42,2%) — ЕНЗИКС® ДУО та 38 (23,6%) пацієнтам був призначений ЕНЗИКС® ДУО ФОРТЕ. При цьому відзначали ще більше достовірне зниження як САТ, так і ДАТ до 126,1±0,7 і 81,5±1,7 мм рт. ст. відповідно (р<0,001). Цільовий АТ було досягнуто у 142 (88,2%) пацієнтів.
У 2-й групі на етапі 12 тиж лікування 42 (56,8%) пацієнти отримували антагоністи кальцієвих каналів, 43 (58,1%) — блокатори β-адренорецепторів, 27 (36,5%) — діуретики, 4 (5,4%) — моксонідин, 3 (4,1%) — блокатори рецепторів ангіотензину ІІ, 2 (2,7%) — інгібітори АПФ. На даному етапі 38 (51,4%) отримували монотерапію, 29 (39,2%) — комбінацію двох препаратів, 7 (9,5%) — комбінацію трьох препаратів. При цьому величини САТ і ДАТ достовірно знизилися порівняно з початком до 129,0±1,2 та 79,4±0,9 мм рт. ст. (р<0,003 та р<0,001). Цільовий АТ було досягнуто у 62 (83,7%).
В середньому офісний САТ та ДАТ знизився в основній групі (ЕНЗИКС®) на 32,7 та 14,7 мм рт. ст., що було достовірно більше, ніж у групі контролю — відповідно 26,4 та 13,1 мм рт. ст. (р=0,001 та 0,003). Тобто ЕНЗИКС® ефективніше знижував АТ.
В обох групах спостерігалося достовірне зниження ЧСС. Це цілком закономірно для групи контролю, адже більшість пацієнтів отримували блокатори β-адренорецепторів. Для 1-ї групи такий вплив комбінованої терапії є свідченням антиадренергічної активності інгібітора АПФ — еналаприлу.
Таким чином результати дослідження вказують на високу антигіпертензивну ефективність проведеного лікування, коли за відносно короткий строк (3 міс) вдалося досягти цільового АТ у понад 80% пацієнтів. Це стало можливим завдяки як застосуванню повнодозової раціональної комбінації (група препарату ЕНЗИКС®), так і наполегливості та кваліфікованості лікарів, які проводили дослідження (група контролю). При цьому в групі препарату ЕНЗИКС® достовірне зниження АТ відбувалося значно швидше, на відміну від групи контролю — вже на 4-му тижні лікування.
Антигіпертензивна ефективність за даними ДМАТ. Динаміка показників ДМАТ представлена у табл. 3. На початку дослідження пацієнти 1-ї групи мали достовірно вищий рівень середньодобового та нічного САТ (р=0,03). За іншими показниками групи достовірно не відрізнялися. Під впливом терапії в обох групах достовірно знизилися середньодобові, денні та нічні САТ, ДАТ, ПАТ. Причому в основній групі (ЕНЗИКС®) дещо більшою мірою, ніж у групі контролю (рис. 3). Такі додаткові показники, як індекс навантаження часом для САТ і ДАТ, що також свідчать про ефективність терапії, знизилися достовірно в обох групах.
| Показник | На початку дослідження | Через 12 тиж | ||
|---|---|---|---|---|
| 1-ша група (n=161) | 2-га група (n=74) | 1-ша група (n=161) | 2-га група (n=74) | |
| тСАТ, мм рт. ст. | 142,5±1,2 | 138,1±1,6# | 120,7±1,5* | 122,8±1,6* |
| тДАТ, мм рт. ст. | 82,7±0,9 | 80,1±1,0 | 71,4±0,8* | 73,0±1,1* |
| тПАТ, мм рт. ст. | 59,8±1,0 | 58,0±1,4 | 50,3±0,8* | 50,1±0,9* |
| тЧСС, уд. за 1 хв. | 71,5±0,9 | 72,4±1,4 | 69,9±0,8 | 68,4±1,2** |
| дСАТ, мм рт. ст. | 146,2±1,2 | 142,6±1,5 | 126,1±0,9* | 127,3±1,5* |
| дДАТ, мм рт. ст. | 85,4±0,9 | 84,2±1,1 | 74,9±0,78* | 77,1±1,1* |
| дПАТ, мм рт. ст. | 59,6±1,0 | 58,3±1,4 | 51,3±0,8 | 53,5±1,4*** |
| нСАТ, мм рт. ст. | 134,9±1,4 | 129,8±1,9# | 114,2±1,1* | 113,5±1,6* |
| нДАТ, мм рт. ст. | 75,0±0,9 | 73,0±1,2 | 65,0±0,7* | 65,1±1,1* |
| нПАТ, мм рт. ст. | 60,5±1,2 | 57,9±1,6 | 49,6±0,9 | 49,4±1,1 |
| ДІ САТ, % | 8,1±0,7 | 9,0±0,9 | 13,1±0,62* | 14,0±1,0* |
| ДІ ДАТ, % | 12,5±0,6 | 13,4±1,1 | 15,1±0,35* | 14,2±0,6 |
| Ст. від. дСАТ, мм рт. ст. | 15,6±0,4 | 16,4±0,5 | 13,8±0,3* | 13,7±0,4* |
| Ст. від. дДАТ, мм рт. ст. | 11,5±0,3 | 12,3±0,4 | 10,2±0,21* | 11,0±0,4* |
| Ст. від. дПАТ, мм рт. ст. | 11,3±0,3 | 11,1±0,41 | 10,2±0,24* | 9,8±0,34** |
| Ст. від. нСАТ, мм рт. ст. | 14,2±0,5 | 13,1±0,5 | 13,6±0,9 | 12,5±0,5 |
| Ст. від. нДАТ, мм рт. ст. | 10,5±0,3 | 10,2±0,4 | 9,2±0,2* | 9,8±0,4 |
| Ст. від. нПАТ, мм рт. ст. | 8,4±0,3 | 8,4±0,4 | 8,2±0,3 | 8,0±0,3 |
| Час. ін. САТ, % | 63,4±2,3 | 56,4±3,1 | 24,9±1,8* | 26,43,1* |
| Час. ін. ДАТ, % | 37,3±2,4 | 30,2±2,9 | 11,6±1,2* | 16,0±2,5* |
Примітки:
*достовірність різниці у групі на етапах лікування р<0,001;
**достовірність різниці у групі на етапах лікування p<0,02;
***достовірність різниці у групі на етапах лікування p<0,002;
#достовірність різниці між групами на відповідному етапі лікування р<0,03.
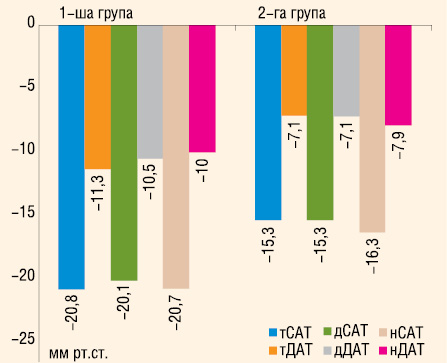
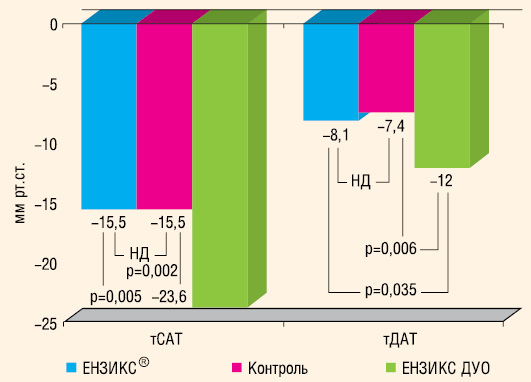
В середньому середньодобовий та середній денний САТ/ДАТ знизилися на 20,7/10,6 та 20,1/10,6 мм рт. ст., що було достовірно більше, ніж у групі контролю — відповідно 15,4/7 та 15,3/6,8 мм рт. ст. (р=0,018/0,026 та р=0,041/0,019).
Як відомо, варіабельність АТ є однією з важливих детермінант ураження органів-мішеней. Підвищення цього показника, в тому числі й на фоні терапії, супроводжується підвищенням частоти виникнення серцево-судинних ускладнень (Jones D.W., Sands C. D., 1991; Moser M., 1999). На початку дослідження пацієнти обох груп характеризувалися збільшеною порівняно з нормою варіабельністю денного САТ і ДАТ та нічного ДАТ (см. табл. 3). Під впливом терапії в обох групах високодостовірно зменшилася варіабельність денних показників, але варіабельність нічного ДАТ достовірно зменшилася тільки у 1-й групі (р=0,001).
Більше половини пацієнтів обох груп мали порушений добовий профіль САТ по типу «нон-діпер» (ДІ<10%) — 99 (61,5%) та 37 (50%) відповідно в 1-й та 2-й групі (різниця між групами недостовірна). Через 12 тиж лікування відзначали зменшення кількості пацієнтів з недостатнім зниженням САТ в нічних час до 59 (36,7%) та 21 (28,4%) відповідно в 1-й та 2-й групах (р<0,001 та p<0,01). Середнє значення показника ДІ для САТ достовірно збільшилося (р<0,001) в обох групах (див. табл. 3). Середня величина ДІ для ДАТ на початку дослідження була понад 10% в обох групах. Під впливом лікування достовірно збільшилася тільки в 1-й групі (див. табл. 3).
Цільовий денний АТ за даними ДМАТ було досягнуто у 118 (73,3%) пацієнтів 1-ї групи та у 45 (60,8%) 2-ї групи (різниця недостовірна). Дані щодо величини середньодобового АТ були відсутніми у протоколах 10 пацієнтів 2-ї групи та 20 пацієнтів 1-ї групи. З тих хворих, у яких дані середньодобового АТ були представлені, цільовий середньодобовий АТ під впливом терапії було досягнуто у 80 з 141 (56,7%) пацієнта 1-ї групи та 37 з 64 (57,8%) пацієнтів 2-ї групи (різниця недостовірна).
Таким чином проведена терапія в обох групах ефективно знижувала середньодобовий, денний та нічний АТ, варіабельність денних САТ і ДАТ, сприяла нормалізації добового профілю АТ у переважної більшості пацієнтів з м’якою та помірною АГ. Призначення основного препарату (ЕНЗИКС®, ЕНЗИКС® ДУО, ЕНЗИКС® ДУО ФОРТЕ) характеризувалося більшим, ніж в групі контролю, ступенем зниження АТ та достовірним позитивним впливом на варіабельність нічного ДАТ.
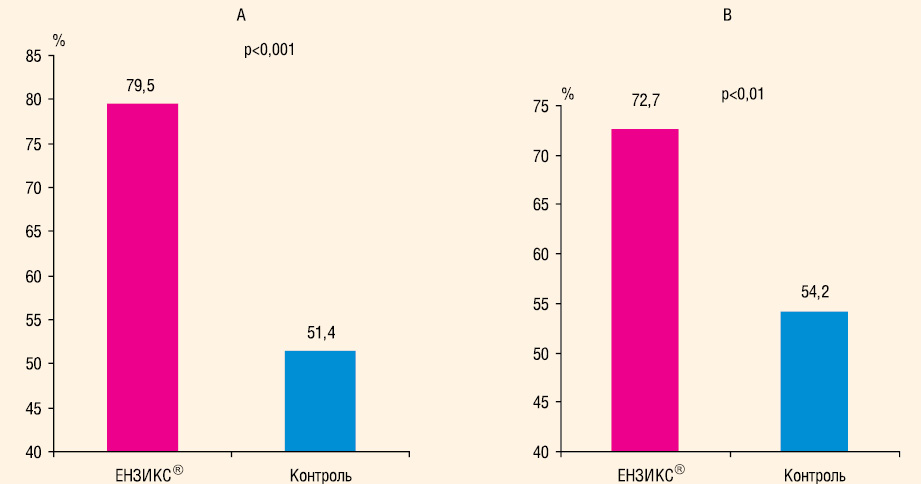
Оцінка ефективності лікування. Оцінку ефективності лікування проводили окремо лікарі та хворі за 5-бальною шкалою (рис. 4). Результати лікування 1-ї групи як за оцінкою пацієнтів, так і за оцінкою лікарів достовірно частіше оцінювалися як «добрі» та «відмінні», ніж результати лікування контрольної групи.
Антигіпертензивна ефективність «ЕНЗИКС ДУО». Як вже вказувалося вище, на етапі 12 тиж лікування 38 (23,6%) пацієнтів 1-ї групи отримували препарат ЕНЗИКС® ДУО ФОРТЕ та 68 (42,2%) — ЕН-ЗИКС® ДУО. Вони склали підгрупу «ЕНЗИКС ДУО», яку порівнювали з підгрупою «ЕНЗИКС» (пацієнти, які отримували ЕНЗИКС®) та контрольною. На початку дослідження хворі підгрупи «ЕНЗИКС ДУО» характеризувалися достовірно більш високим рівнем офісного, середньодобового, денного та нічного САТ і ДАТ — 163,3±0,9/97,9±0,7, 146,5±1,5/84,8±1,1, 150,3±1,4/88,1±1,1 та 138,6±1,8/77,0±1,1 мм рт. ст. порівняно з пацієнтами підгрупи ЕНЗИКС® — відповідно 149,5±1,1/92,9±0,8, 134,2±1,7/78,5±1,2, 137,4±1,7/80,2±1,53 та 126,9±1,870,8±1,2 мм рт. ст. (р<0,001 для всіх показників), що відповідало умовам протоколу, коли при АТ 160/100 мм рт. ст. і вище потрібно було призначати ЕНЗИКС® ДУО. Пацієнти контрольної групи мали також достовірно нижчий АТ (р<0,001), ніж пацієнти підгрупи «ЕНЗИКС ДУО» (див. табл. 2 і 3), але в середньому вищий офісний САТ (р=0,001), денні САТ (р=0,012) та ДАТ (р=0,033), ніж пацієнти підгрупи «ЕНЗИКС», що відповідало умовам протоколу.
Під впливом лікування АТ (як за даними офісного вимірювання, так і за даними ДМАТ) достовірно знизився в усіх підгрупах (рис. 5 і 6). Проте найбільший ступінь зниження, як й очікувалося, відзначали у підгрупі «ЕНЗИКС ДУО». Підгрупа «ЕНЗИКС» та група контролю достовірно не відрізнялися за ступенем зниження АТ. Цільовий офісний АТ (<140/90 мм рт. ст.) було досягнуто у 89 із 106 (84%) пацієнтів підгрупи «ЕНЗИКС ДУО», у 54 з 55 (98,2%) — підгрупи «ЕНЗИКС» та у 61 з 74 (82,4%) підгрупи контролю. Це свідчить про те, що призначення комбінованого препарату ЕНЗИКС® приводить до нормалізації офісного АТ у 98% хворих з м’якою АГ, а препарату ЕНЗИКС® ДУО або ЕНЗИКС® ДУО ФОРТЕ — у 84% пацієнтів з помірною АГ. Цільовий середній денний АТ за даними ДМАТ було досягнуто у 48 (87,3%) пацієнтів підгрупи «ЕНЗИКС» та у 73 (68,9%) хворих підгрупи «ЕНЗИКС ДУО».
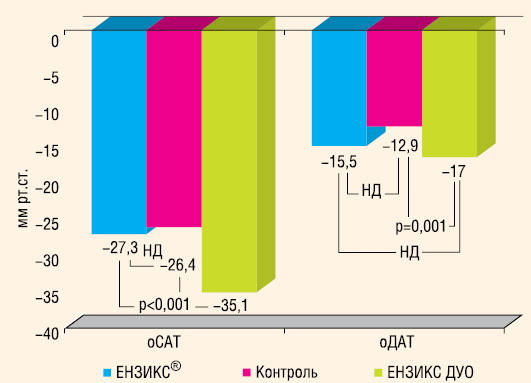
Таким чином, призначення препарату ЕНЗИКС® пацієнтам з м’якою АГ та ЕНЗИКС® ДУО/ЕН-ЗИКС® ДУО ФОРТЕ пацієнтам з помірною АГ є високоефективним антигіпертензивним лікуванням.
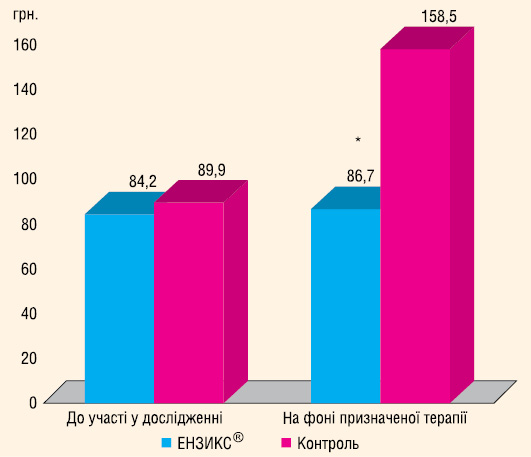
Порівняння коштів, які було витрачено на лікування. Кошти, які пацієнт мінімально міг витрачати на своє лікування протягом трьох місяців, визначалися за допомогою прайс-листів фірми з оптового продажу ліків, що діяли на момент включення хворих у дослідження. Витрати пацієнта на лікування протягом трьох місяців до включення у дослідження та в кінці дослідження представлено на рис. 7. На початку дослідження групи достовірно не відрізнялися за витратами на трьохмісячне лікування. В кінці дослідження витрати хворих 1-ї групи на придбання ліків достовірно не змінилися, тоді як 2-ї групи достовірно зросли майже удвічі (p<0,001). Отже, майже однакова антигіпертензивна ефективність лікування досягалася в основній групі за менших витрат, ніж у групі контрою.
В обох групах однаково достовірно зменшилася кількість пацієнтів, які потребували внутрішньовенного введення препаратів для зниження АТ: з 59 (36,6%) та 31 (41,9%) до 25 (15,5%) та 20 (27%) відповідно для 1-ї та 2-ї груп. Окрім того, в основній групі достовірно менш частою була необхідність підвищувати дозу препаратів у пацієнтів, які на початку дослідження вже мали досвід прийому антигіпертензивних препаратів (n=113): з 33 (29,2%) до 19 (16,8%) (р<0,05).
Вплив на біохімічні показники та мікроальбумінурію. Ми не спостерігали достовірної зміни електролітів, рівня креатиніну сироватки крові та глюкози під впливом лікування в обох групах. Рівні загального холестерину/тригліцеридів достовірно зменшилися як в основній групі, так і в групі контрою — з 5,9±0,09/1,8±0,08 та 5,8±0,1/1,6±0,07 до 5,5±0,007/1,6±0,06 та 5,5±0,1/1,5±0,05 відповідно в 1-й та 2-й групах (р<0,008 для обох груп). Ці зміни ліпідного спектра вірогідніше відбувалися не за рахунок гіполіпідемічної дії призначеної антигіпертензивної терапії, а за рахунок тих рекомендацій щодо модифікації способу життя, які всі хворі отримували в усній або письмовій формі.
Під час лікування в обох групах недостовірно, але зменшувалася кількість пацієнтів, у яких відзначали мікроальбумінурію (>30 мг/добу) — з 9 (12,2%) до 5 (6,8%) у групі контролю та з 18 (11,2%) до 13 (8%) в основній. В обох групах достовірно зменшувалася середня величина вмісту альбуміну у сечі з 24,2±4,2 та 16,2±2,0 мг/добу до 20,7±3,6 та 12,0±1,9 мг/добу (р=0,009 та 0,034 відповідно для 1-ї та 2-ї груп).
Побічні ефекти. Ми не спостерігали в обох групах побічних ефектів, що потребували б відміни призначеної терапії, та відмінностей між групами в частоті виникнення побічних реакцій. Загалом побічні реакції виникли у 5 (3,1%) пацієнтів 1-ї групи: у двох збільшився креатинін сироватки крові більше як у два рази; у 2 пацієнтів був кашель, вираженість якого зменшилася після зниження дози препарату; у 1 пацієнта відзначали виражену слабкість. У 2-й групі також побічні реакції виникли у 5 (6,8%) пацієнтів: у 2 відзначали набряки на фоні прийому антагоністів кальцію; у 1 — почервоніння обличчя після прийому ліків; у 1 — слабкість; у 1 виникла гіперкаліємія.
ОБГОВОРЕННЯ РЕЗУЛЬТАТІВ ТА ОБМЕЖЕННЯ ДОСЛІДЖЕННЯ
Дослідження ЕПІГРАФ-2 в Україні продемонструвало, що застосування нефіксованої комбінації інгібітора АПФ еналаприлу та діуретика індапаміду є високоефективним способом зниження АТ у пацієнтів з м’якою та помірною АГ. Рівень офісного САТ і ДАТ достовірно знизився на 12 тиж лікування на 32,7 та 14,7 мм рт. ст. відповідно. Ці дані майже узгоджуються з даними інших досліджень, де вивчалася ефективність еналаприлу (монотерапія або в комбінації), в тому числі й з даними дослідження ЕПІГРАФ-2 в Росії, де середнє зниження САТ і ДАТ становило 26,1 та 13,2 мм рт. ст. (Беленков Ю.Н. и рабочая группа исследования ЭПИГРАФ-2, 2005). Дещо вищий ступінь зниження САТ в нашому дослідженні можна пояснити тим, що в російському дослідженні в групі препарату ЕНЗИКС® достовірно (р<0,05) переважали хворі з м’якою АГ (56%), тоді як у нашому — пацієнти з помірною АГ (54,7%). У пацієнтів з помірною АГ за даними російського дослідження САТ знизився також майже на 30 мм рт. ст.
У нашому дослідженні частота досягнення офісного АТ <140/90 мм рт. ст. була дуже високою як в основній групі, так і в групі контролю — відповідно 88,2 та 83,7%. Якщо для групи контролю це можна пояснити тим, що дослідники мали змогу вільно комбінувати два, три і більше препаратів для досягнення цільового АТ, то для групи препарату ЕНЗИКС® єдиним поясненням може бути застосування раціональної збалансованої комбінації двох препаратів: діуретика індапаміду та інгібітора АПФ еналаприлу. ЕНЗИКС® — комбінація двох препаратів в одній упаковці, що сприяло високій прихильності до терапії пацієнтів, включених у дослідження. В інших дослідженнях також була продемонстрована висока ефективність комбінації діуретика та еналаприлу в досягненні цільового офісного АТ відповідно у 80 та 87,8% пацієнтів (Omvik P. et al., 1994; Сиренко Ю.Н., Радченко А.Д., 2001). В російському дослідженні ЕПІГРАФ-2 даний показник був також достатньо високим — 72,5%.
Антигіпертензивний ефект терапії в нашому дослідженні підтверджено даними ДМАТ. При цьому, середньодобовий САТ/ДАТ знизився на 20,8/11,3 та 15,3/7,1 мм рт. ст. відповідно в групі препарату ЕНЗИКС® та контрольній. Це узгоджується з даними інших досліджень, в яких вивчалася ефективність еналаприлу, в тому числі при комбінації з діуретиком. Так, в дослідженні Ю.М. Сіренка та Г.Д. Радченко (Сиренко Ю.Н., Радченко А.Д., 2001) зниження середньодобового САТ і ДАТ становило 17,6 та 10,4 мм рт. ст., у дослідженні Т. Bental та співавторів (1997) — 18 та 11 мм рт. ст., у дослідженні B.E. Karlberg та співавторів (1999) — 18,4 та 9,8 мм рт. ст. При цьому результати вищезгаданих та інших досліджень свідчать про те, що у значної кількості пацієнтів (25–40%) відзначали нормалізацію добового профілю АТ та зменшення його варіабельності (Dahlof B. et al., 1988; Fowler G. et al., 1993; Mehmel H.C., Gorne R.C., 1993; Oigman W. et al., 1993; Stokes G.S. et al., 1994; Bental T. et al., 1997; Meredith P.A., Elliott H.L., 1997; Philipp T. et al., 1997; Tan K.W., Frise S.A., 1997; Karlberg B.E. et al., 1999; Moser M., 1999; Сиренко Ю.Н., Радченко А.Д., 2001). У нашому дослідженні 26% обстежених у групі препарату ЕНЗИКС® з категорії «нон-діппер» перейшли у категорію «діппер».
Варто зазначити, що за даними офісного вимірювання АТ ефект застосування препарату ЕНЗИКС® підвищувався протягом усього періоду лікування. Це, з одного боку. можна пояснити титрацією дози, з іншого — що ефект інгібіторів АПФ підсилюється протягом перших 4–12 тиж лікування, а іноді навіть — 3–6 міс (Робоча група з артеріальної гіпертензії Української асоціації кардіологів, 2004).
За даними літератури, частота виникнення побічних реакцій при призначенні інгібіторів АПФ коливається від 37 до 54% (Dahlof B. et al., 1988; Jones D. W., Sands C.D., 1991; Fowler G. et al., 1993; Mehmel H.C., Gorne R.C., 1993; Oigman W. et al., 1993; Weir M.R. et al., 1993; Stokes G.S. et al., 1994; Bental T. et al., 1997; Meredith P.A., Elliott H.L., 1997; Philipp T. et al., 1997; Tan K.W., Frise S.A., 1997; Karlberg B.E. et al., 1999; Moser M., 1999; Сиренко Ю.Н., Радченко А.Д., 2001). У нашому дослідженні цей показник становив 3,1%. Таку низьку частоту виникнення побічних реакцій можна пояснити, по-перше, тим, що більшість пацієнтів у групі препарату ЕНЗИКС® мали досвід застосування інгібіторів АПФ, а по-друге, хворих, які мали непереносимість до цієї групи препаратів, не включали у дослідження. У групі контролю також частота виникнення побічних реакцій була низькою та достовірно не відрізнялася від основної групи, що окрім зазначеного свідчить про досвід та високу кваліфікацію лікарів, які проводили дослідження.
В цілому, проведене багатоцентрове дослідження показало високу ефективність та хорошу переносимість препарату ЕНЗИКС® у хворих з м’якою та помірною АГ.
ВИСНОВКИ
1. Терапія препаратом ЕНЗИКС® характеризувалася високою антигіпертензивною ефективністю за даними офісного вимірювання: систолічний та діастолічний АТ знижувався відповідно на 32,7 та 14,7 мм рт. ст., а цільовий АТ (<140 та 90 мм рт. ст.) було досягнуто у 88,2% пацієнтів, тоді як рутинна терапія була недостовірно, але менш ефективною — відповідні показники становили 26,4 та 13,1 мм рт. ст. (83,7%).
2. Комбінована терапія препаратом ЕНЗИКС® сприяла більш швидкому достовірному зниженню АТ — вже на 4-му тижні лікування спостерігалося достовірне зниження АТ, тоді як у групі контролю в цей період зміни були недостовірними.
3. Терапія препаратом ЕНЗИКС® сприяла достовірному зниженню середньодобового, денного та нічного АТ в більшій мірі, ніж рутинна терапія, сприяла зменшенню варіабельності АТ та нормалізації добового профілю АТ.
4. Як терапія препаратом ЕНЗИКС®, так і рутинна терапія, що призначалася в контрольній групі, були безпечними та добре переносилися хворими.
5. Терапія препаратом ЕНЗИКС® була майже удвічі дешевшою, тобто економічно вигіднішою, аніж рутинна терапія.
ЛІТЕРАТУРА
- Беленков Ю.Н. и рабочая группа исследования ЭПИГРАФ-2 (2005) Эналаприл Плюс Индапамид в лечении АГ: оценка эффективности и безопасности РАциональной Фармакотерапии. Применение нефиксированной комбинации Эналаприла и Индапамида (Энзикс®). Дизайн и основные результаты исследования ЭПИГРАФ-2. Сердце, 4(5): 3–9.
- Робоча група з артеріальної гіпертензії Української асоціації кардіологів (2004) Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії. Посібник до Національної програми профілактики і лікування артеріальної гіпертензії (3-тє вид., випр. і доп.). Інститут кардіології АМН України, Київ, 86 с.
- Сиренко Ю.Н., Радченко А.Д. (2001) Антигипертензивная эффективность Эднита (эналаприла малеата) у больных с мягкой и умеренной артериальной гипертензией: результаты открытого многоцентрового исследования. Укр. мед. часопис, 4(24): 115–121 (http://www.umj.com.ua/arhiv/24/24.php; http://www.umj.com.ua/pdf/24/umj_24_1177.pdf)
- Сіренко Ю.М. (2002) Артеріальна гіпертензія 2002. 2-ге вид., доп. Моріон, Київ, 204 с.
- Смірнова І.П., Горбась І.М., Кваша О.О. (1998) Артеріальна гіпертензія: епідеміологія і статистика. Укр. кардіол. журн., 6: 3–8.
- Bental T., Lishner M., Lalkin A., Elis A., Ravid M. (1997) Comparison of enalapril to captopril by 24-hour ambulatory blood pressure monitoring. J. Clin. Pharmacol., 37(6): 514–519.
- Dahlof B., Hansson L., Acosta J.H., Bolzano K., Fairhurst G., Ferreira C., Kaarsalo E., Silva M.C., Simone A. (1988) Controlled trial of enalapril and hydrochlorothiazide in 200 hypertensive patients. Am. J. Hypertens., 1(1): 38–41.
- ESH — ESC Guidelines Committee (2003) 2003 European Society of Hypertension — European Society of Cardiology guidelines for the management of arterial hypertension. J. Hypertens., 21(6): 1011–1053.
- Fowler G., Webster J., Lyons D., Witte K., Crichton W.A., Jeffers T.A., Wickham E.A., Sanghera S.S., Cornish R., Petrie J.C. (1993) A comparison of amlodipine with enalapril in the treatment of moderate/severe hypertension. Br. J. Clin. Pharmacol., 35(5): 491–498.
- Hansson L., Hedner T. (2000) Hypertension Manual 2000. Layout Bohlin Production AB, 128 p.
- Izzo J.L., Black H.R.; American Heart Association Council on High Blood Pressure Research (1999) Hypertension Primer: The Essentials of High Blood Pressure. Lippincott Williams & Wilkins, 471 p.
- Jones D.W., Sands C.D. (1991) Treatment of essential hypertension in Asians: enalapril as monotherapy versus combination therapy with hydrochlorothiazide. Pharmacotherapy, 11(2): 127–130.
- Karlberg B.E., Lins L.E., Hermansson K. (1999) Efficacy and safety of telmisartan, a selective AT1 receptor antagonist, compared with enalapril in elderly patients with primary hypertension. TEES Study Group. J. Hypertens., 17(2): 293–302.
- Mehmel H.C., Gorne R.C. (1993) Monotherapy of mild to moderate hypertension. Double-blind comparative study: amlodipine versus enalapril. Fortschr. Med., 111(28): 447–450.
- Meredith P.A., Elliott H.L. (1997) ACE Inhibition and 24-hour Control of Blood Pressure. Science Press, London, 64 p.
- Moser M. (1999) Clinical Management of Hypertension. Fourth Edition. Professional Communications, Caddo, 240 p.
- National High Blood Pressure Education Program (2003) The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC 7). Bethesda (MD): U.S. Department of Health and Human Services, National Institutes of Health, National Heart, Lung, and Blood Institute; 2003 NIH Publication No.: 03-5233, 34 p. (http://www.nhlbi.nih.gov/guidelines/hypertension/; http://www.nhlbi.nih.gov/guidelines/hypertension/express.pdf).
- Oigman W., Spritzer N., Introcaso L., Santello J.L. (1993) Evaluation of efficacy of the enalapril-hydrochlorothiazide combination by ambulatory blood pressure monitoring in essential hypertensive patients. Arq. Bras. Cardiol., 60(2): 123–127.
- Omvik P., Thaulow E., Herland O.B., Eide I., Midha R., Turner R.R. (1994) A long-term, double-blind, comparative study on quality of life during treatment with amlodipine or enalapril in mild or moderate hypertensive patients: a multicentre study. Br. J. Clin. Pract. Suppl., 73: 23–30.
- Philipp T., Anlauf M., Distler A., Holzgreve H., Michaelis J., Wellek S. (1997) Randomised, double blind, multicentre comparison of hydrochlorothiazide, atenolol, nitrendipine, and enalapril in antihypertensive treatment: results of the HANE study. HANE Trial Research Group. BMJ, 315(7101): 154–159.
- Pickering T. (1998) Clinician’s Manual on Self-monitoring of Blood Pressure. Science Press, London, 64 p.
- Stokes G.S., Johnston H.J., Okoro E.O., Boutagy J., Monaghan J.C., Marwood J.F. (1994) Comparative and combined efficacy of doxazosin and enalapril in hypertensive patients. Clin. Exp. Hypertens., 16(6): 709–727.
- Tan K.W., Frise S.A. (1997) Efficacy and tolerability of doxazosin versus enalapril in the treatment of patients with mild-to-moderate hypertension. Clin. Ther., 19(3): 459–470.
- Weir M.R., Lavin P.T., Byrnes C.A. (1993) Efficacy and tolerability of a combination of enalapril and hydrochlorothiazide in the treatment of hypertension measured manually and with an ambulatory blood pressure monitor. Clin. Ther., 15(3): 527–538.
- White W.B. (Ed.) (2001) Blood pressure monitoring in cardiovascular medicine and therapeutics. Humana Press, New Jersey, 308 p.
Резюме. Цель исследования — определить клиническую эффективность и безопасность препарата ЭНЗИКС® (эналаприл с индапамидом) — нового типа комбинированного лечения артериальной гипертензии (АГ) — в сравнении с традиционной антигипертензивной терапией. В исследование включили 235 пациентов с мягкой и умеренной артериальной гипертензией (АГ), которые были рандомизированы для получения либо препарата ЭНЗИКС® (n=161), либо стандартную антигипертензивную терапию (n=74). Всем пациентам в начале и конце исследования проводили сбор анамнеза, офисное измерение артериального давления (АД), суточное мониторирование АД, биохимическое исследование крови, определяли средства, которые пациент тратит на приобретение медикаментов на протяжении трех месяцев, оценивали эффективность лечения по балльной системе. Установлено, что терапия препаратом ЭНЗИКС® имеет высокую антигипертензивную эффективность по данных офисного измерения: систолическое и диастолическое АД снижалось соответственно на 32,7 и 14,7 мм рт. ст., а целевое АД (
Ключевые слова: артериальная гипертензия, комбинированная терапия, ЭНЗИКС®.
Summary. The aim of the trial was to evaluate clinical efficacy and safety of a new type of the non-fixed combined therapy in hypertension — preparation ENZIX (enalapril plus indapamide) — in comparison with routine antihypertensive treatment. 235 patients with mild and moderate arterial hypertension were randomized to take ENZIX (n=161) or traditional therapy (n=74). Anamnesis collection, office and 24 hours’ blood pressure measurements, biochemical investigations, evaluation of the 3 months costs for pharmacotherapy and the treatment efficacy scoring were performed in all the patients. Treatment with ENZIX was find to be more effective than routine therapy — systolic/diastolic blood pressure decreased on 32.7/14.7 mmHg vs 26.4/13.1 mmHg. The target blood pressure levels were achieved in 88.2% vs 83.7% of patients on ENZIX and routine therapy respectively. Combination therapy with ENZIX promote the office blood pressure lowering significantly faster (on the 4th week of the treatment) than traditional therapy. Therapy with ENZIX lead to significant lowering of 24 hours’, daily and nocturnal systolic and diastolic blood pressure, normalization of blood pressure variability and diurnal profile. Therapy with ENZIX was safe with low rate of averse reaction. Therapy with ENZIX was almost in 2 times cheaper than traditional therapy.
Адреса для листування:
Сіренко Юрій Миколайович
03151, Київ, вул. Народного ополчення, 5
Національний науковий центр «Інститут кардіології ім. М.Д. Стражеска» АМН України





