Складні проблеми проведення інфузійної терапії у різних клінічних ситуаціях стали предметом обговорення експертів під час телемосту «ІІІ Школа інфузійної терапії». Саме інфузійна терапія є потужним і поширеним засобом лікування хворих у різних клінічних ситуаціях без винятку. Вона не є прерогативою обраного кола лікарів і може бути доступною до застосування у будь-якій ситуації лікарями будь-яких спеціальностей. Однак головною передумовою такого заходу має бути чітке слідування певним принципам. Телеміст, який відбувся 8 липня 2021 р., мав на меті міждисциплінарне обговорення складних проблем призначення та проведення інфузійної терапії у різних клінічних ситуаціях. Особливо актуальним проведення інфузійної терапії стало у розпал поширення пандемії COVID-19 та серед пацієнтів із супутніми патологічними станами, такими як метаболічний синдром, порушення ниркової функції та серцево-легенева недостатність або порушення кровотоку периферичних судин. У переважній більшості випадків лише завдяки проведенню раціональної інфузійної терапії стають можливими швидка доставка лікарської форми до клітин, досягнення високої біодоступності препаратів при мінімальній токсичності. І це лише найбільш головні з переваг інфузійної терапії.
Наразі для обговорення запропоновано теми, які найбільш часто викликають стурбованість, передусім це енергетична підтримка пацієнта з астенією, варіанти лікування пневмоній виключно на засадах доказової медицини, дезінтоксикаційна терапія отруєнь та інфекційних станів, лікування астматичного синдрому, супровід пацієнтів із Long COVID та післяковідними станами, особливості терапії гіперглікемії та цукрового діабету. І це далеко не всі теми, які потребують нагального обговорення, лише найактуальніші.
Завдяки сучасному розвитку телекомунікаційних технологій запропонований телеміст надав можливість долучити до обговорення фахівців різних медичних спеціальностей та створити умови для активного спілкування й дискусійного обговорення широку аудиторію лікарів різних спеціальностей. Серед спікерів, які взяли участь у висвітленні цієї важливої теми, відомі фахівці:
- Олександр Галушко,
- Володимир Корсунов,
- Володимир Черній,
- Ольга Голубовська,
- Людмила Конопкіна,
- Вадим Жебель,
- Любов Соколова,
- Віктор Черняк,
- Дмитро Іванов,
- Марина Тріщинська.
Напрямки та засадничі умови інфузійної терапії
Олександр Галушко, д.м.н., професор кафедри анестезіології та інтенсивної терапії Національного університету охорони здоров’я (НУОЗ) України імені П.Л. Шупика, підкреслив, що інфузійна терапія на сьогодні є найбільш ефективним методом лікування багатьох тяжких клінічних станів. Передусім це зумовлено низкою чинників:
А. Раціональне застосування інфузійної терапії є наріжним каменем успішного лікування більшості внутрішніх захворювань.
В. Її роль у лікуванні, обсяг та склад залежать від певних обставин:
- загального стану пацієнта;
- вираженості та поширеності ураження;
- виду захворювання та супутніх ускладнень.
А. Призначаючи інфузію, завжди намагаються коригувати порушення, викликані захворюванням, та запобігти розвитку ускладнень: водно-електролітних, інтоксикаційних, порушень стану реології крові та анемії тощо.
Тому, аби досягти поставленої мети, лікар як фахівець має вирішити низку суто практичних питань перед її призначенням. А саме: чому шлях введення має бути внутрішньовенним, чому інфузія; чи повинен інфузійну терапію проводити лише фахівець блоку інтенсивної терапії/анестезіолог-реаніматолог; як побудувати програму інфузійної терапії при захворюваннях різних органів і систем?
Відповідаючи на окреслене коло питань з приводу тактичних кроків у разі призначення інфузійної терапії, доповідач зауважив: «…будь-який шлях застосування лікарських засобів (окрім внутрішньовенного) не надає можливості максимально повного потрапляння лікарського засобу у системний кровотік. А отже, доставка введеної дози (біодоступність) є набагато нижчою від необхідної. Така ситуація відбувається внаслідок неповного всмоктування препарату, його руйнування в агресивному середовищі шлунково-кишкового тракту, несприятливого рН середовища, площі всмоктування, ступеня гідратації та гемоконцентрації, а також стану мікроциркуляторних порушень у зоні всмоктування (якщо це пероральний шлях введення). Дії неспецифічних ферментів та/або рН при потраплянні препаратів у печінку — ефект «першого проходження». Не важко здогадатися, що перелік такої низки несприятливих факторів на шляху застосування лікарських засобів при пероральному застосуванні спонукав лікарів шукати більш ефективні методи їх застосування. У разі внутрішньовенного введення препаратів у більшості випадків перелічені недоліки відсутні. Вдається досягнути 100% біодоступності препарату, забезпечується надійний, відтворюваний та прогнозований ефект. Можливість забезпечити при внутрішньовенному введенні сталу концентрацію лікарського засобу в крові підвищує ефективність лікування та знижує до мінімуму частоту небажаних реакцій на препарат».
Однак чому саме інфузійна методика виявилася такою ефективною? Внутрішньовенний шлях введення доволі ефективний та швидкий для створення оптимальної концентрації лікарського препарату в плазмі крові. А створення оптимальної концентрації препарату впродовж визначеного проміжку часу може забезпечити тривала інфузія із визначеним темпом введення. Це найбільш важлива ознака методу, яка забезпечує доставку лікарського засобу до тканин-мішеней із заданою концентрацією і на тривалий час, підкреслив О. Галушко. Саме забезпечення повільного введення препаратів під час інфузії дозволяє створювати оптимальну концентрацію препарату в плазмі крові впродовж тривалого часу, знизити вірогідність їх токсичної дії. А у разі суттєвого зниження концентрації білків у плазмі крові (так звані диспротеїнемії): цироз печінки, нефротичний синдром, опікова хвороба, суворе дотримання темпу інфузії у більшості випадків гарантує безпеку терапії та є передумовою досягнення позитивного ефекту. Отже, виникає питання, хто має проводити інфузійну терапію, лікар якої спеціальності?
Як зазначив О. Галушко, стани, які потребують інфузійної підтримки та лікування, в клінічній практиці відмічають досить часто. Існує безліч ситуацій, коли лікарю потрібно відкоригувати наявні у хворого некритичні порушення (наприклад розлади обміну речовин, мікроциркуляції і т.п.) із застосуванням незначних за обсягом внутрішньовенних вливань, які б якісно і швидко відновили порушений стан. А отже, проводити таку інфузійну терапію може лікар внутрішньої медицини: терапевт, кардіолог, невролог, пульмонолог, ендокринолог, а методика здобула назву неінтенсивної інфузійної терапії. Таким чином, широке запровадження інфузійної терапії в клінічну практику із залученням широкого кола лікарів дозволить вирішувати певні клінічні питання:
- відновлення об’єму рідини при дегідратації, яка розвивається при різних патологічних процесах (порушення функції шлунково-кишкового тракту, тяжка форма цукрового діабету та інфекційні захворювання);
- усунення порушень обміну речовин;
- поліпшення реологічних властивостей крові, поліпшення мікроциркуляції і перфузії тканин;
- корекція гемостатичного потенціалу крові;
- відновлення електролітного, осмотичного і кислотно-лужного балансу;
- проведення дезінтоксикаційної терапії;
- поліпшення доставки ліків до патологічного вогнища;
- лікування больового синдрому та гіпертермії.
Започаткована школа, як підкреслив О. Галушко, має на меті довести до широкого загалу лікарів принципи інфузійної терапії, які зможе застосувати лікар будь-якої спеціальності для досягнення поставленої мети.
Продовженням лекції стала тема «Інфузійна терапія астенічного синдрому. Розчини, що забезпечують енергетичну підтримку при астенічному синдромі». Як зазначив доповідач, тема обрана не випадково, оскільки пацієнти, які перехворіли на COVID-19, на тривалий час залишаються поза увагою лікарів, при тому що симптоматика у декого зберігається протягом тижнів або навіть місяців. Її збереження після виписки із стаціонару зумовлює висока частота коморбідності на тлі ушкодження певних органів і систем (рис. 1).

Це дало привід виділяти певні періоди в захворюванні на COVID-19: гострого або триваючого захворювання та постковідного синдрому. Їх періодизація наведена на рис. 2.
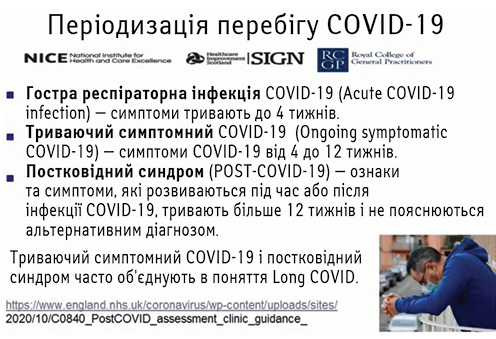
Аналізуючи клінічний стан, О. Галушко наголосив, що у хворих на постковідний синдром, незважаючи на наявність багатьох клінічних симптомів, їх відмічають не так часто, як у гострий період. Однак у реконвалесцентів доволі часто (майже кожен другий) виявляють симптоми значної стомлюваності та слабкості, які є в абсолютної більшості пацієнтів, і вони повною мірою відповідають класичній симптоматиці астенічного синдрому. Симптоматика клінічно має мінливий характер і супроводжується:
- зниженням фізичної активності (знижуються витривалість і працездатність, швидко настає втома, наявне постійне відчуття «розбитості»);
- погіршується інтелектуальна функція (знижується концентрація уваги, з’являються труднощі в засвоєнні нової інформації, порушується пам’ять, уповільнюється швидкість прийняття рішень);
- психологічними розладами (дратівливість, внутрішня напруженість, нестійкий настрій, зниження мотивації до роботи і творчості, боязнь майбутніх труднощів, втрата інтересу до життя).
Однак астенічний синдром у постковідний період має певні специфічні ознаки, які варто брати до уваги.
Найпоширеніші неспецифічні прояви астенічного постковідного синдрому включають:
- швидку втомлюваність;
- дратівливу слабкість (підвищена збудливість, яка швидко змінюється виснаженістю);
- афективну лабільність з переважно зниженим настроєм з рисами примхливого невдоволення;
- сльозливість;
- іноді — розлади пам’яті.
Далі автор навів основні причини, які, на його думку, імовірно є основними чинниками розвитку постковідного астенічного синдрому. Це перш за все:
- масивне медикаментозне навантаження під час терапії COVID-19 (дексаметазон);
- тривалий і виснажливий перебіг захворювання з дихальною недостатністю та водно-електролітними розладами;
- супутні тяжкі та/або системні захворювання у стані декомпенсації.
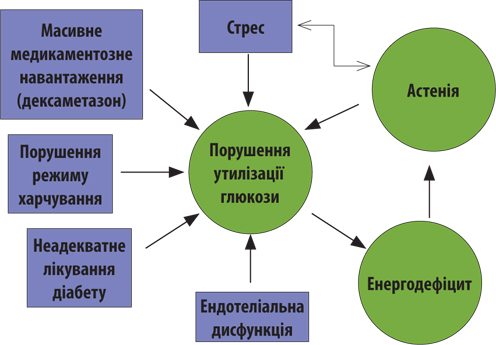
Схематично патогенез розвитку астенічного синдрому представлено на рис. 3. Врешті розвиток енергодефіциту за рахунок порушення утилізації вуглеводів (перш за все глюкози) і є тією ахіллесовою п’ятою розвитку астенічного синдрому на тлі перенесеного СOVID-19, наголосив доповідач.
О. Галушко підкреслив, що на сьогодні, на жаль, численні нормативні документи стосовно лікування COVID-19 не містять рекомендацій щодо медикаментозного лікування постковідного астенічного синдрому. Однак попри те, що такі пацієнти в епідеміологічному сенсі не становлять прямої загрози і не зумовлюють поширення інфекційного вогнища, водночас вони створюють низку проблем для суспільства, перш за все для медицини і її первинної ланки. Адже накопичується певна кількість осіб, які мають низку проблем зі здоров’ям, зниженням якості життя без наявної клініки інфекційного захворювання. Тому так важливо визначити основні напрямки лікування постковідного астенічного синдрому, аби максимально покращити загальний стан здоров’я таких пацієнтів, а разом з тим підвищити їх соціальну адаптацію. Деякі основні напрямки такого лікування представлені нижче.
Далі автор доповіді зупинився на медикаментозному лікуванні проявів астенічного синдрому. Підкресливши, що три останні пункти найбільше піддаються медикаментозній корекції. А препаратом вибору для поповнення енергетичного дефіциту має стати ксилітол. Лікування наслідків «цитокінового шторму» у вигляді «тліючого» системного запалення мають стати протизапальні препарати, здатні зменшити продукування прозапальних цитокінів.
Стосовно основних переваг ксилітолу необхідно брати до уваги його високу енергетичну цінність (1 г/837 кДж енергії), незалежну від інсуліну, та здатність підвищувати утворення піровиноградної кислоти, одночасно впливаючи на окиснення ацетил-коензиму А, головного енергетичного субстрату циклу Кребса. Це призводить до стабілізації енергетичних процесів, нормалізації водно-електролітного балансу та посилює антикетогенну дію. Клінічно проявляється зниженням рівня ацетону в сечі у 2,5 раза впродовж перших 2 год застосування (рис. 4).
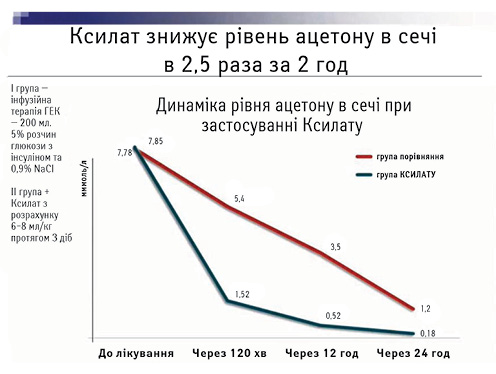
При цьому не варто очікувати підвищення ацетону до 4 «+» в сечі у хворого із супутнім цукровим діабетом (глікемія натще >13,9 ммоль/л), а одразу призначати інфузію ксилітолвмісних розчинів у дозі 6–10 мл/кг/добу впродовж 5–7 днів, підкреслив доповідач.
Розвиток астенічного постковідного синдрому на тлі порушення регуляції викиду прозапальних цитокінів (інтерлейкіну (IL)-1, -4, -6, -17) та довготривалої гіперімунної відповіді призводить до довготривалого запалення після одужання. Можливими напрямками такого лікування мають стати такі тактики:
- виведення надмірної кількості агресивних вільних радикалів;
- зниження рівня цитокінів та медіаторів запалення;
- зниження проникності крізь гематоенцефалічний бар’єр, ейксатоксичності;
- покращення функції endothelial nos (enos);
- підвищення ефективності власних антиоксидантних систем організму;
- застосування препаратів-поглиначів агресивних вільних радикалів.

Підсумовуючи свій виступ, О. Галушко зазначив наступне:
- частота виникнення астенічного постковідного синдрому становить 10–35%;
- причинами розвитку астенії при постковідному синдромі є масивне медикаментозне навантаження під час терапії COVID-19 (дексаметазон), тривалий і виснажливий перебіг захворювання, супутні тяжкі та/або системні захворювання у стані декомпенсації;
- основні напрямки лікування при астенічному постковідному синдромі включають профілактику розвитку метаболічних розладів, поповнення внутрішньоклітинного енергодефіциту і усунення «тліючого» системного запалення.
Дезінтоксикаційна терапія позагоспітальної пневмонії з точки зору доказової медицини
 Лариса Мороз, професор, д.м.н. завідувач кафедри інфекційних хвороб Вінницького національного медичного університету імені М.І. Пирогова, розглянула проблему дезінтоксикаційної терапії позагоспітальної пневмонії з точки зору доказової медицини. Вона наголосила, що в основному позагоспітальні пневмонії мають бактеріальне походження. І застосування інфузійної терапії у цієї категорії хворих без перебільшення є обґрунтованим, доцільним і високоефективним терапевтичним засобом лікування. Загалом інфузійна терапія має на меті швидко та безпечно досягти корекції порушеного гомеостазу та забезпечити дезінтоксикацію, покращити стан мікроциркуляції, усунути порушення реологічних та коагуляційних станів крові та сприяти усуненню порушення обміну речовин. У цьому сенсі викликали цікавість з позиції доказової медицини наведені спікером результати багатоцентрового міжнародного рандомізованого відкритого клінічного дослідження «RheoSTAT» стосовно ефективності та безпеки застосування препарату РЕОСОРБІЛАКТ у хворих із тяжким перебігом інфекції. У обстеження були залучені хворі на сепсис, перитоніт, позагоспітальну пневмонію та опікову хворобу. Всього 628 хворих включено у 4 рандомізовані дослідження, виконані на 44 клінічних базах в 6 країнах, включно з Україною. Як зазначила Л. Мороз, препарат довів високу ефективність у хворих із бактеріальною позагоспітальною пневмонією при застосуванні у якості засобу для зниження інтоксикації. Кількість хворих на пневмонію у дослідженні становила 150 пацієнтів: 78 — основна група та 72 — група контролю. У якості дезінтоксикаційного засобу вивчався препарат Реосорбілакт із добовою дозою 200–400 мл/добу. Як зазначила доповідач, після багатофакторного аналізу, який включав визначення стану хворого за шкалами SOFA, APACHEII, SAPS, MODS,CURB-65, PSI/PORT та клінічних показників (температура тіла, частота пульсу, систолічний та діастолічний артеріальний тиск), впродовж триденної інфузії препарату отримано позитивні результати лікування. Основні клінічні результати відповідали наступним показникам:
Лариса Мороз, професор, д.м.н. завідувач кафедри інфекційних хвороб Вінницького національного медичного університету імені М.І. Пирогова, розглянула проблему дезінтоксикаційної терапії позагоспітальної пневмонії з точки зору доказової медицини. Вона наголосила, що в основному позагоспітальні пневмонії мають бактеріальне походження. І застосування інфузійної терапії у цієї категорії хворих без перебільшення є обґрунтованим, доцільним і високоефективним терапевтичним засобом лікування. Загалом інфузійна терапія має на меті швидко та безпечно досягти корекції порушеного гомеостазу та забезпечити дезінтоксикацію, покращити стан мікроциркуляції, усунути порушення реологічних та коагуляційних станів крові та сприяти усуненню порушення обміну речовин. У цьому сенсі викликали цікавість з позиції доказової медицини наведені спікером результати багатоцентрового міжнародного рандомізованого відкритого клінічного дослідження «RheoSTAT» стосовно ефективності та безпеки застосування препарату РЕОСОРБІЛАКТ у хворих із тяжким перебігом інфекції. У обстеження були залучені хворі на сепсис, перитоніт, позагоспітальну пневмонію та опікову хворобу. Всього 628 хворих включено у 4 рандомізовані дослідження, виконані на 44 клінічних базах в 6 країнах, включно з Україною. Як зазначила Л. Мороз, препарат довів високу ефективність у хворих із бактеріальною позагоспітальною пневмонією при застосуванні у якості засобу для зниження інтоксикації. Кількість хворих на пневмонію у дослідженні становила 150 пацієнтів: 78 — основна група та 72 — група контролю. У якості дезінтоксикаційного засобу вивчався препарат Реосорбілакт із добовою дозою 200–400 мл/добу. Як зазначила доповідач, після багатофакторного аналізу, який включав визначення стану хворого за шкалами SOFA, APACHEII, SAPS, MODS,CURB-65, PSI/PORT та клінічних показників (температура тіла, частота пульсу, систолічний та діастолічний артеріальний тиск), впродовж триденної інфузії препарату отримано позитивні результати лікування. Основні клінічні результати відповідали наступним показникам:
- загальний стан хворих значно покращувався;
- прояви (полі-) органної недостатності зменшилися;
- нормалізувалися температура тіла та частота дихання;
- оцінка стану за всіма шкалами визначення ступеня тяжкості (які використовувалися у дослідженні) пневмонії та критичних станів суттєво покращується.
Водночас додавання препарату до комплексної схеми лікування хворих на пневмонію сприяло пришвидшенню одужання пацієнтів та нормалізації клінічного стану, що супроводжувалося:
- суттєвим зниженням кількості лейкоцитів у загальному аналізі крові;
- тенденцією до зниження лейкоцитарного та гематологічного індексів;
- нормалізацією співвідношення нейтрофіли/лімфоцити;
- зниженням концентрації С-реактивного протеїну;
- покращенням показників кислотно-лужного балансу.
Отримані результати, як наголосила доповідач, довели здатність Реосорбілакту зменшувати прояви ендогенної інтоксикації на тлі загального інфекційного процесу, яким є пневмонія, при доведеній безпеці застосування препарату (рис. 5).
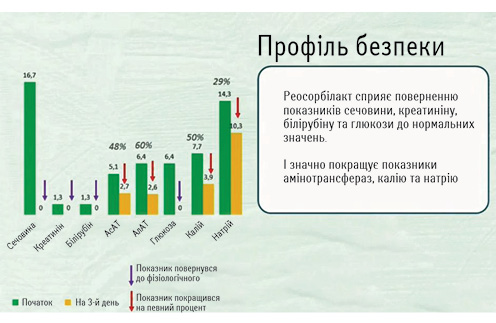
Важливою для препарату як представника багатоатомного спирту є здатність метаболізуватися в організмі без участі інсуліну. Ця якість досить важлива, оскільки при всіх критичних станах, яким є пневмонія, також спостерігається гіпоінсулінемія з порушенням толерантності до глюкози. Застосування сорбітолу, основного інгредієнта препарату, забезпечує відновлення енергетичних потреб організму та стабілізації метаболічних внутрішньоклітинних розладів. Беручи до уваги перелічені позитивні ефекти від застосування Реосорбілакту у терапії дезінтоксикаційного синдрому, його призначення має проводитися за такою схемою: термін лікування (інфузійна терапія) — 7–14 днів з добовою дозою залежно від маси тіла хворого: 200 мл/добу при масі тіла хворого ≤60 кг та 400 мл/добу — ≥60 кг.
Загальні принципи та важливість детоксикації у пацієнтів з розладами шлунково-кишкового тракту — ще одна тема обговорення нагальних питань інфузійної терапії. Її продовжив головний науковий співробітник наукового відділу малоінвазивної хірургії ДНУ «Науково-практичний центр профілактичної та клінічної медицини» ДУС, д.м.н., професор, чл.-кор. НАМН України Володимир Черній. Доповідач наголосив, що шлунково-кишковий тракт відіграє вагому роль в підтримці гомеостазу організму, забезпечуючи не лише харчову функцію, а й підтримку трофічного гомеостазу, регуляторну (в тому числі ендокринну) підтримку водно-електролітного балансу, детоксикацію, імунний захист. Водночас шлунково-кишковий тракт відіграє чи не ключову роль в життєдіяльності організму в процесах інтоксикації та детоксикації, особливо у разі потрапляння агресивних речовин ззовні та в процесі накопичення під час життєдіяльності або захворювань. Все це може спричинити розвиток інтоксикаційного синдрому на тлі патологічного процесу у шлунково-кишковому тракті. Основними ускладненнями інтоксикаційного синдрому в гастроентерології можуть бути зневоднення, розвиток судом, гостра ниркова недостатність, недостатність підшлункової залози та печінки, розвиток токсичного ураження печінки (гепатит) загострення виразкової хвороби, гастриту та розвиток енцефалопатії. Серед станів, які найбільш часто призводять до розвитку інтоксикаційних розладів в гастроентерології, є екзогенні отруєння (наприклад етанолом) та неспецифічні запальні захворювання кишечнику (НЗЗК). Як зазначив доповідач, інфузійна терапія, яка б могла стати наріжним каменем у подоланні інтоксикаційного синдрому та порушення водно-електролітного балансу, принаймні у лікуванні НЗЗК, не знайшла свого місця у терапії цих тяжких захворювань. Водночас у цієї категорії хворих її призначення, тим більше з урахуванням багатьох несприятливих чинників: ендогенної інтоксикації, масивної циркуляції прозапальних цитокінів, активації аутоімунної відповіді, порушення мікроциркуляції, водно-електролітного балансу, формування енергетичного дефіциту — дало би змогу успішно подолати завдяки обґрунтованому призначенню інфузійних засобів. Це в кінцевому підсумку зумовить покращення загального стану хворого. Далі доповідач навів деякі додаткові несприятливі аспекти клінічного перебігу НЗЗК, які необхідно враховувати при призначенні інфузійних засобів.
Перш за все, необхідно враховувати додаткові чинники, які призводять до надмірної втрати рідини та мікроелементів:
- втрата рідини при лихоманці — 3 мл/кг маси тіла при підвищенні температури тіла на 1 0C;
- втрата рідини при задишці — 10 мл/кг маси тіла при підвищенні частоти дихання на 10 після 25;
- втрата рідини з дренажів та ранових виділень — 1–2 мл/кг маси тіла на годину.
Така картина додаткових втрат значно обтяжує перебіг захворювання, створює значні проблеми з відновленням та підтримкою водно-електролітних та енергетичних втрат організму, призводячи до розвитку ендогенного інтоксикаційного синдрому. Патогенетично виділяють три головні ланки цього процесу, які мають чіткі клінічні ознаки:
- токсемія;
- порушення мікроциркуляції;
- пригнічення власних захисних факторів та систем детоксикації організму.
Таким чином, наведений патогенетичний ланцюжок має чітке клінічне завдання, як підкреслив В. Черній, виробити чіткий алгоритм показань до проведення детоксикаційної терапії. Вони можуть бути наступними:
- відновлення власних механізмів детоксикації в організмі (підвищення метаболічної функції печінки, екскреторної здатності нирок, легень та шлунково-кишкового тракту, а також імунної відповіді);
- зменшення ендотоксинового навантаження;
- відновлення чутливості до терапії, яка проводиться;
- відновлення або підвищення власного імунного статусу.
Основним засобом впливу на підвищення детоксикаційної функції організму може стати збалансована інфузійна терапія, головними задачами якої є:
- підвищення перфузії тканин з метою покращення умов дифузії токсичних речовин з уражених клітин, тканин та органів у загальний кровотік;
- досягнення гемодилюції для зниження концентрації токсинів у плазмі крові;
- усунення наслідків інтоксикаційного синдрому (метаболічний ацидоз, електролітні та енергетичні (метаболічні) порушення;
- підтримка функціонального стану гепатоцитів — головної ланки метаболічної детоксикації.
Усі наведені задачі неможливо забезпечити без досягнення збалансованого водно-електролітного розподілу у внутрішньому середовищі організму, де розподіл води має суворі фізіологічні закони, а її рух визначається колоїдно-осмотичним тиском у певних анатомо-фізіологічних просторах. Отже, частка води є внутрішньоклітинною — (40%) та позаклітинною (20%), які складають загальний об’єм рідини в організмі. З них внутрішньосудинна (5%) та інтерстиціальна (15%) є складовими рідини позаклітинного простору. Виділяють також рідини «третього простору» — просвіт кишечнику, підшкірно-жирова клітковина, заочеревинний простір та очеревинний простір. Основним компонентом, який забезпечує константу внутрішнього водного середовища, є колоїдно-осмотичний тиск, що залежить від концентрації білка, аніонно-катіонного розподілу та фізіологічної рН середовища. Концентрація катіонного, бікарбонатного та білкового складу кожного із рідинних просторів підтримується у фізіологічних параметрах функціонуванням глікокаліксних мембран, забезпечуючи стан ізоосмії. Це необхідно враховувати при виборі інфузійного розчину в тій чи іншій клінічній ситуації. Сучасні розчини для інфузійної терапії та їх вплив на колоїдно-осмотичний тиск наведено на рис. 6.
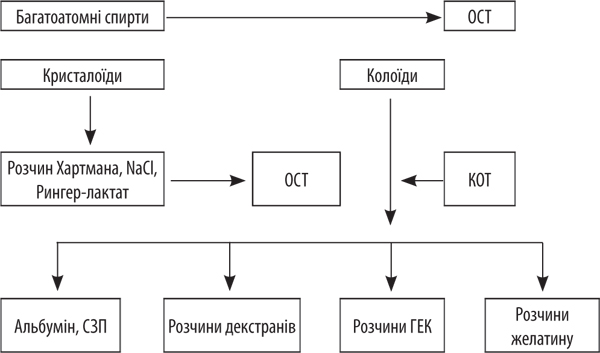
Потім доповідач зупинився на основних принципах призначення інфузійної терапії та дав вичерпну характеристику розчинам, які мають застосовуватися у тих чи інших клінічних випадках. Так, найбільш звичними, за словами спікера, інфузійними розчинами для корекції водно-електролітних порушень при екзогенних та ендогенних інтоксикаціях шлунково-кишкового тракту є сольові розчини (ізотонічний розчин 0,9% NaCL, Рингера-лактат, розчин Хартмана). Однак треба мати на увазі, що попри значну поширеність та низьку вартість їх надмірне застосування супроводжується розвитком низки загрозливих ускладнень, таких як гіперхлоремія, гіперхлоремічний ацидоз та зниження діурезу із загрозою розвитку гострої ниркової дисфункції та потребою в замісній терапії (особливо це стосується надмірного застосування розчину NaCl). Натомість застосування збалансованих кристалоїдних розчинів (таким є Рингер малат) є більш безпечним для широкого використання у клінічній практиці. Відносно плазми він ізотонічний, ізоволемічний, ізоіонічний, ізогідричний. Забезпечує достатній потенціал резервної лужності за рахунок вмісту малату та ацетату. Що дозволяє підтримувати надійну корекцію ацидозу при інфузіях. Однак у разі значного ацидозу для корекції бажано застосування збалансованого розчину соди. Особливо добре себе зарекомендував розчин сода-буфер як більш близький до природного буфер, здатний забезпечити плавну корекцію ацидозу при значних відхиленнях від норми. При цьому В. Черній зазначив, що корекція метаболічного ацидозу із застосуванням бікарбонату натрію вдвічі знижувала госпітальну летальність та підвищувала частоту виживання у хворих із гострою нирковою дисфункцією. Водночас водно-електролітні розлади, які виникають часто при загрозливих ситуаціях, — гостра гіповолемія, гіповолемічний шок (опіковий, травматичний, септичний), інтоксикаційні стани, порушення мікроциркуляції та метаболічний ацидоз — потребують негайної, ефективної і безпечної корекції. Саме за таких обставин збалансована інфузійна терапія є досить дієвим та ефективним засобом лікування. А фізіологічне відновлення водно-електролітного, осмолярного, онкотичного й енергетичного стану внутрішнього середовища на тлі стабілізації кислотно-лужної рівноваги є передумовою успішної терапії. На сьогодні для досягнення цієї мети застосовують розчини багатоатомних спиртів, зокрема сорбітолу і створеного на його базі лікарського засобу Реосорбілакту (розчин сорбітолу та натрію лактату в ізотонічній концентрації та осмолярністю 900 мОсм/л). Застосування розчину дає змогу швидко відновити водно-електролітні та кислотно-лужні порушення та стабілізувати осмо-онкотичну константу водних просторів організму. Механізм дезінтоксикаційної дії розчину пов’язують з покращенням мікроциркуляції та перфузії тканин за рахунок переміщення рідин із інтерстиціального простору у судинне русло та стимуляції діурезу. Підвищена осмолярність відносно плазми крові забезпечує зменшення набряку ендотеліоцитів та призводить до покращення мікроциркуляції та зниження судинного опору за рахунок відновлення еластичності судинного русла, підкреслив В. Черній.
 Одним із клінічних станів, які призводять до потреби корекції водно-електролітних втрат, є різноманітні шлунково-кишкові розлади, про що говорив попередній доповідач. Однак стани, які мають ознаки епідемічного поширення і несуть загрозу для існування безпеки регіону й навіть держави, — це шлунково-кишкові інфекційні захворювання та харчові токсикоінфекції, саме їх розглянула Ольга Голубовська, д.м.н., професор, завідувач кафедри інфекційних хвороб Національного медичного університету імені О.О. Богомольця. Перш за все, необхідно виділити такі стани:
Одним із клінічних станів, які призводять до потреби корекції водно-електролітних втрат, є різноманітні шлунково-кишкові розлади, про що говорив попередній доповідач. Однак стани, які мають ознаки епідемічного поширення і несуть загрозу для існування безпеки регіону й навіть держави, — це шлунково-кишкові інфекційні захворювання та харчові токсикоінфекції, саме їх розглянула Ольга Голубовська, д.м.н., професор, завідувач кафедри інфекційних хвороб Національного медичного університету імені О.О. Богомольця. Перш за все, необхідно виділити такі стани:
- харчова токсикоінфекція — стан, спричинений мікроорганізмами та продуктами їх життєдіяльності при потраплянні в організм людини;
- харчове отруєння — патологічний стан, викликаний вживанням небезпечних (отруйних) продуктів: гриби, отруйні ягоди, злаки і т. п.;
- харчова інтоксикація — патологічний стан, викликаний вживанням продуктів, забруднених токсичними речовинами, які потрапили в продукти зовні (пестициди, важкі метали, інші хімічні сполуки).
Однак особливу стурбованість, на думку доповідача, викликають харчові токсикоінфекції, причиною яких є недоброякісні харчові продукти, зіпсовані чи забруднені бактеріальними збудниками харчових інфекцій у разі неналежного зберігання, транспортування та приготування їжі. До переліку збудників та найбільш улюблених продуктів, де розмножуються ці хвороботворні бактерії, належать:
Salmonella — яйця птахів, м’ясо домашніх тварин та птахів та продукти тваринного походження;
Esherichia coli — ентерогеморагічна інфекція, викликана вживанням непастеризованого молока, м’яса без достатньої термічної обробки, свіжих овочів та фруктів;
Campilobacter — свіже молоко, свіже м’ясо домашніх птахів без достатньої термічної обробки, інфікована питна вода;
Listeria — непастеризоване молоко та молочні продукти, а також готові інфіковані продукти (зберігаються в упаковках продуктів). Бактерії розмножуються при низьких температурах!!!
Vibrio cholerae — потрапляє в організм з інфікованою водою та продуктами харчування при епідемічному поширенні захворювання.
Деякі віруси, паразити та пріони.
Про всі ці моменти необхідно пам’ятати та брати до уваги, враховуючи, що ми живемо у світі, який швидко змінюється, хвороби мають тенденцію до глобального поширення, особливо там, де не дотримуються належного санітарно-епідеміологічного контролю. На жаль! При цьому необхідно зважати на такі негативні чинники масового виробництва продуктів харчування, як застосування антибіотиків та прискорювачів росту, що спричинило розвиток флори, яка погано піддається знезараженню. А застосування нових технологій збереження та харчової обробки продуктів не завжди продумане в плані забезпечення надійного знезараження. Все разом призводить до формування низки небезпечних факторів на шляху виготовлення, зберігання та розповсюдження харчових продуктів. Особливо загрозлива ситуація склалася у сільському господарстві, де нераціональне застосування антибіотиків та стимуляторів росту призвело до появи нових штамів бактерій, котрі раніше не асоціювалися із харчовим отруєннями, наголосила О. Голубовська. У клінічному відношенні однією з характерних ознак харчового отруєння, токсикоінфекції та інтоксикації є діарея, її ознаками є консистенція випорожнень (мають неоформлений вигляд) та частота. При цьому важливо пам’ятати, що її наслідком є перевага водно-електролітної секреції над абсорбцією в кишечнику, що призводить до підвищення секреторної активності стінки кишечнику, підвищення осмотичного тиску в просвіті кишечнику, порушення транзиту вмісту та збільшення кишкового ексудату. Попри відмінності перебігу діареї, залежно від виду інфекційного захворювання вона має пов’язаний механізм розвитку і поділяється на секреторну, ексудативну, осмотичну та змішану. Таким чином, для діареї головним патоморфологічним наслідком є втрата значної кількості води та електролітів, що призводить до водно-електролітного дисбалансу в організмі. Найбільш небезпечні в цьому плані секреторна діарея та розвиток на її тлі дегідратації та електролітних порушень.
Ступінь дегідратації за рекомендаціями ВООЗ визначають так:
рання дегідратація: не відмічають клінічних ознак;
помірна дегідратація (≥2 наявних клінічних ознак):
- достатнє вживання рідини через спрагу;
- стурбована поведінка, дратівливість;
- очі при натисканні м’які;
- язик ближче до сухого;
- діурез знижений;
- кінцівки прохолодні;
тяжка форма дегідратації:
- пацієнт не вживає або ж відмовляється від води;
- патологічна сонливість, сплутана свідомість;
- складка шкіри розправляється >2 с;
- очі запалі;
- сухий язик;
- анурія;
- кінцівки холодні, вологі, ціанотичні;
- пульс прискорений, слабкого наповнення, артеріальна гіпотензія та бліді шкірні покриви.
Для більшого розуміння необхідності вжиття тих чи інших клінічних заходів у лікуванні діареї важливо пам’ятати про провідний чинник патогенетичного механізму розвитку порушень, за яким всі форми діареї поділяються на:
- ентеротоксигенні — переважає ураження верхніх відділів шлунково-кишкового тракту, токсикоз, осмотичні та секреторні втрати (харчові токсикоінфекції, сальмонельоз, деякі ешерихіози);
- ентероінвазивні — переважають ураження нижніх відділів кишечнику, ексудативні втрати (шигельоз та деякі ешерихіози).
Далі О. Голубовська зупинилась на особливостях лікування різних форм діареї та регідратації. Основні принципи наведено нижче.
Лікування середньої/тяжкої форми ентероінвазивної діареї:
- антибактеріальні засоби (ципрофлоксацин, азитроміцин);
- пероральна детоксикація із застосуванням оральних детоксикаційних сумішей 2-го покоління;
- внутрішньовенна детоксикація тяжких хворих за допомогою глюкозо-сольових розчинів;
- дієтичне харчування залежно від стану випорожнень;
- спазмолітики до зникнення болю;
- замісна ферментна терапія;
- пре- та пробіотики для попередження дисбактеріозу.
Лікування ентеротоксигенних форм діареї:
- ентеросорбція (амбулаторно) або механічне виведення токсинів з кишечнику (стаціонар);
- посилення природньої детоксикації: внутрішньовенні глюкозо-сольові розчини;
- пероральна детоксикація призначенням оральних детоксикаційних сумішей 2-го покоління;
- диклофенак 50 мг (одноразовий прийом);
- замісна терапія ферментами;
- тимчасове обмеження вживання харчових продуктів з подальшим розширенням дієтичного харчування;
- антибактеріальна терапія можлива лише в осіб похилого віку, при септичних станах, наявних імплантах.
На завершення доповідач наголосила, що в критичних ситуаціях інфузійна терапія кристалоїдами може виявитися ефективним засобом на шляху убезпечення життя хворого. Детоксикаційна терапія із застосуванням препаратів на основі багатоатомного спирту сорбітолу покращує зв’язування агресивних метаболітів та поліпептидів, пришвидшує їх виведення з організму на тлі покращення метаболізму у печінці та підвищення діурезу.
Олександр Осадчий
Редакція журналу «Український медичний часопис»





