Вступ
Стандарти лікування пацієнтів із локалізованим нирково-клітинним раком (НКР) змінилися протягом останнього десятиліття (Ljungberg B. et al., 2007). Приводом для цього стали результати когортних досліджень, основаних на обробці даних понад 1 млн пацієнтів. Доведено, що проведення нефректомії призводить до подовження тривалості госпіталізації, підвищення рівня серцево-судинних захворювань та ризику смерті пацієнтів (Go A.S. et al., 2004).
Внаслідок цього переглянуто ставлення до органозберігаючого лікування пацієнтів із локалізованим НКР, і резекція нирки стала операцією вибору (European Association of Urology, 2018; National Comprehensive Cancer Network, 2019). У подальшому її ефективність підтверджена багаточисленними клінічними дослідженнями з доведеною більшою тривалістю життя, мінімальним ризиком розвитку хронічної хвороби нирок та значно кращою якістю життя пацієнтів (Go A.S. et al., 2004; Herzog C.A. et al., 2011). Однак у більшості випадків при локалізованому НКР >4 см або при локалізації пухлини у воротах нирки проводять нефректомію, а у більшості світових публікацій повідомляють про середній розмір резектованих пухлин 2–3 см.
Одна з потенційних переваг передопераційної неоад’ювантної таргетної терапії (НТТ) — можливість зменшення розміру пухлини нирки і перетворення нерезектабельних пухлин на резектабельні. Існують небагаточисленні дослідження такого підходу в літературі, в яких відзначено суттєву неоднорідність груп, що аналізуються (Silberstein J.L. et al., 2010; Rini B.I. et al., 2015). Проведення НТТ при локалізованому НКР може мати значні переваги у пацієнтів із великими пухлинами за рахунок зменшення розмірів пухлини та більш вірогідного проведення резекції нирки, що дозволить максимально зберегти функціональні можливості нирок і стати профілактичним заходом розвитку хронічної хвороби нирок у майбутньому. Однак можливий токсичний вплив НТТ на функцію нирок може нівелювати всі потенційні переваги такого підходу.
Мета — визначити вплив НТТ на функцію нирок у пацієнтів із локалізованим НКР.
Об’єкт і методи дослідження
У дослідження включено 75 пацієнтів із локалізованим НКР (Т1–Т2 N0 M0), яким у період 2017–2019 рр. у науково-дослідному відділенні пластичної та реконструктивної онкоурології Національного інституту раку проведено два блоки НТТ препаратами першої лінії з подальшим оперативним лікуванням. Набір даних мав проспективний характер у ході проведення рандомізованого дослідження з вивчення ефективності НТТ в лікуванні хворих на локалізований НКР.
Клінічна характеристика пацієнтів: чоловіків — 51 (68%), жінок — 24 (32%), вік 26–79 років (Me 58 (50–63) років), ECOG-статус — Me 0 (0–1) балів. Розміри пухлинного ураження становили 16–113 мм (M±SD 61,3±19,5 мм; 95% довірчий інтервал (ДІ) 56,5–65,7 мм). Загальна швидкість клубочкової фільтрації (ШКФ) становила: M±SD 93,5±25,2 (95% ДІ 81,7–105,3 мл/хв/1,73 м2), на боці ураження — 46,5±12,9 (95% ДІ 40,5–52,5 мл/хв/1,73 м2). 34 (45,3%) пацієнтів мали супутню патологію: ожиріння — 30 (40,0%), артеріальну гіпертензію — 29 (38,7%), кісти контралатеральної нирки — 9 (12,0%), цукровий діабет — 7 (9,3%), сечокам’яну хворобу — 6 (8,0%), інфаркт міокарда в анамнезі — 4 (5,3%) пацієнтів.
В усіх пацієнтів діагностовано світлоклітинний тип НКР. Діагноз підтверджено за допомогою пункційної біопсії, виконаної до проведення НТТ.
НТТ проводили за стандартною схемою: пазопаніб 800 мг щоденно перорально протягом 2 міс, сунітиніб 50 мг щоденно протягом 28 діб із перервою протягом 14 діб та повторним 28-денним курсом терапії.
Показники загальної очисної функції вивчали за допомогою визначення креатиніну сироватки крові, загальної ШКФ за формулами CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) та MDRD (Modification of Diet in Renal Disease Study). Визначали рівень як загальної ШКФ, так і ШКФ на боці ураження за даними динамічної реносцинтиграфії. Оцінку проводили до та через 2 тиж після проведення НТТ (напередодні хірургічного втручання).
Статистичну обробку отриманих результатів виконували за допомогою програмного забезпечення SPSS. Оцінку розподілу неперервних даних у групі проводили за побудовою діаграм розподілу за критерієм Ліллієфорса. Описова статистика включала обчислення середньої величини зі стандартним відхиленням та ДІ. Порівняння кількісних показників у групах проводили з використанням U-критерію Манна — Уїтні, статистично значущими відмінностями вважали вірогідності помилки 1-го роду <5% (р<0,05).
Результати та їх обговорення
Проаналізовано дані функціонального стану нирок до та після проведення НТТ. Показники креатиніну сироватки крові, загальної ШКФ за формулами CKD-EPI та MDRD представлено у табл. 1.
| Показник | До проведення НТТM±SD (95% ДІ) | Після проведення НТТM±SD (95% ДІ) | р |
|---|---|---|---|
| Креатинін, мкмоль/л | 90,4±22,4
(85,2–95,5) |
90,6±18,3
(86,4–94,9) |
0,95 |
| Загальна ШКФ за формулою CKD-EPI, мл/хв/1,73 м2 | 78,4±22,9
(72,3–82,9) |
77,4±22,3
(72,4–82,6) |
0,8 |
| Загальна ШКФ за формулою MDRD, мл/хв/1,73 м2 | 75,5±25,5
(69,7–81,5) |
73,8±23,4
(68,4–79,2) |
0,7 |
Рівень креатиніну сироватки крові до та після проведення НТТ становив 90,4±22,4 та 90,6±18,3 мкмоль/л відповідно (p=0,95). Статистично значущої зміни рівня загальної ШКФ за вибраними формулами до та після проведення НТТ не відзначено (p=0,8 та p=0,7 відповідно). На рис. 1–3 графічно зображено зміни функціонального статусу нирок при порівнянні за цими показниками.
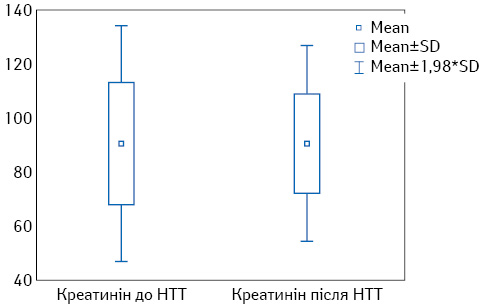

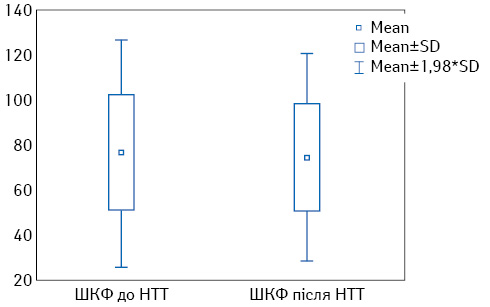
Оскільки вищенаведені дані не дають можливості оцінити ізольовано функцію ураженої нирки та визначити вірогідність її покращення/погіршення у процесі дослідження, проспективно вивчено роздільну ШКФ за допомогою динамічної реносцинтиграфії до та після проведення НТТ (табл. 2).
| Показник | До проведення НТТM±SD (95% ДІ) | Після проведення НТТM±SD (95% ДІ) | р |
|---|---|---|---|
| Загальна ШКФ, мл/хв | 93,5±25,2
(81,7–105,3) |
98,3±27,7
(85,3–111,2) |
0,57 |
| ШКФ ураженої нирки, мл/хв | 46,5±12,9
(40,5–52,5) |
47,4±15,6
(40,1–54,7) |
0,84 |
| ШКФ контралатеральної нирки, мл/хв | 47,3±17,2
(39,3–55,4) |
50,9±14,2
(44,2–57,5) |
0,48 |
Результати свідчать про відсутність статистично достовірної різниці між показниками загальної та роздільної ШКФ як на боці ураження, так і контралатеральної нирки, до та після проведення НТТ. На рис. 4 представлені результати порівняння ШКФ ураженої нирки.
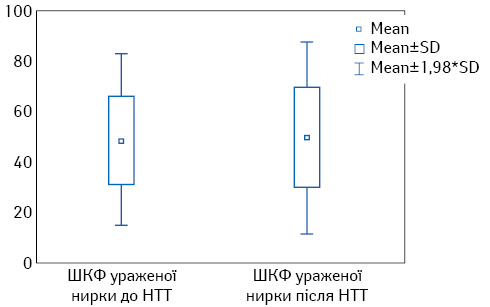
Враховуючи отримані дані, можна зробити висновок, що системна терапія перед хірургічним втручанням не впливає на роздільну функцію нирок.
Клінічна ефективність НТТ у лікуванні пухлин нирок розширює спектр напрямків її застосування. Згідно з рекомендаціями Національної загальної онкологічної мережі (National Comprehensive Cancer Network, 2019) та Європейської асоціації урологів (European Association of Urology, 2018) НТТ в лікуванні НКР показана при метастатичній хворобі. Новим перспективним напрямком використання НТТ може бути застосування неоад’ювантного режиму при локалізованому та місцево-поширеному НКР з метою зменшення первинної пухлини та полегшення перебігу оперативного втручання. В окремих клінічних дослідженнях показано ефективність зазначеної схеми, що дозволило підвищити вірогідність проведення органозберігаючого лікування (Silberstein J.L. et al., 2010; Lane B.R. et al., 2015).
Незважаючи на ефективність НТТ, цей вид лікування супроводжується значною кількістю побічних проявів, яка сягає 50–80% (Margulis V. et al., 2008). Враховуючи це, вважають вкрай важливим елементом терапії адекватне динамічне спостереження пацієнта та запобігання імовірним побічним реакціям (Kamba T. et al., McDonald D.M., 2007). Токсичність при НТТ добре визначено в окремих клінічних випробуваннях, і встановлено алгоритми щодо курації цих ускладнень.
Одним з основних критичних моментів в передопераційній НТТ при локалізованому НКР є, з одного боку, стурбованість пацієнтів щодо можливості розвитку побічних проявів НТТ, з іншого — надія на зменшення об’єму пухлини та збільшення вірогідності збереження нирки. Це, у свою чергу, може забезпечити високий рівень якості життя після завершення лікування.
Отримані в ході нашого дослідження дані свідчать про відсутність негативного впливу НТТ на загальний функціональний стан нирок. Цей факт підтверджує відсутність токсичного впливу таргетних агентів на паренхіму нирок. Результати аналізу вказують на безпеку проведення досліджуваного режиму лікування. Інтерпретуючи загальні дані, отримані в ході дослідження, можна стверджувати, що НТТ не викликає незворотних змін клінічно значущих параметрів, проте сприяє зменшенню хірургічної складності пухлини.
Також у ході роботи доведено, що системна терапія перед хірургічним втручанням не впливає на роздільну функцію нирок. Відсутність погіршення фільтраційних процесів нирки з пухлиною підтверджує відсутність негативного впливу в розрізі збереження здорової паренхіми. Зокрема, зменшення об’єму пухлинного ураження не підвищує рівня клубочкової фільтрації.
Висновки
Проведення двох блоків НТТ при локалізованому НКР не призводить до статистично значущого зниження рівня креатиніну сироватки крові (p=0,95), не впливає на рівень як загальної ШКФ (p=0,7), так і ШКФ на боці пухлинного ураження (p=0,84) і може вважатися безпечним.
Фінансування
Дослідження фінансувалося в межах науково-дослідницької роботи «Визначення шляхів зменшення інвалідизації хворих з локалізованим раком нирки на основі розробки та оптимізації інноваційних методів діагностики, НТТ та хірургічного лікування», що виконується у Національному інституті раку (шифр теми ВН.14.01.07.178-18, № державної рeєстрації 0118U003727).
Список використаної літератури
- European Association of Urology (2018) Renal Cell Carcinoma (https://uroweb.org/guideline/renal-cell-carcinoma).
- Go A.S., Chertow G.M., Fan D. et al. (2004) Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N. Engl. J. Med., 351(13): 1296–1305. doi: 10.1056/NEJMoa041031.
- Herzog C.A., Asinger R.W., Berger A.K. et al. (2011) Cardiovascular disease in chronic kidney disease. A clinical update from Kidney Disease: Improving Global Outcomes. Kidney Int., 80(6): 572–586. doi: 10.1038/ki.2011.223.
- Kamba T., McDonald D.M. (2007) Mechanisms of adverse effects of anti-VEGF therapy for cancer. Br. J. Cancer, 96(12): 1788–1795, doi: 10.1038/sj.bjc.6603813.
- Lane B.R., Derweesh I.H., Kim H.L. et al. (2015) Presurgical sunitinib reduces tumor size and may facilitate partial nephrectomy in patients with renal cell carcinoma. Urol. Oncol., 33(3): 112.e15–112.e21. doi: 10.1016/j.urolonc.2014.11.009.
- Ljungberg B., Hanbury D.C., Kuczyk M.A. et al. (2007) EAU renal cell carcinoma guideline. Eur. Urol., 51(6): 1502–1510. doi: 10.1016/j.eururo.2007.03.035.
- Margulis V., Matin S.F., Tannir N. et al. (2008) Surgical morbidity associated with administration of targeted molecular therapies before cytoreductive nephrectomy or resection of locally recurrent renal cell carcinoma. J. Urol., 180(1): 94–98. doi: 10.1016/j.juro.2008.03.047.
- National Comprehensive Cancer Network (2019) Kidney cancer (https://www.nccn.org/professionals/physician_gls/pdf/kidney.pdf).
- Rini B.I., Plimack E.R., Takagi T. et al. (2015) A phase II study of pazopanib in patients with localized renal cell carcinoma to optimize preservation of renal parenchyma. J. Urol., 194(2): 297–303. doi: 10.1016/j.juro.2015.03.096.
- Silberstein J.L., Millard F., Mehrazin R. et al. (2010) Feasibility and efficacy of neoadjuvant sunitinib before nephron-sparing surgery. BJU Int., 106(9): 1270–1276. doi: 10.1111/j.1464-410X.2010.09357.x.
Резюме. Цель — определить влияние неоадъювантной таргетной терапии (НТТ) на функцию почек у пациентов с локализованным почечно-клеточным раком (ПКР). Объект и методы исследования. В исследование включено 75 пациентов с локализованным ПКР, которым в период 2017–2019 гг. проведены два блока НТТ препаратами первой линии с определением креатинина сыворотки крови, общей скорости клубочковой фильтрации (СКФ) по формулам CKD-EPI и MDRD и СКФ на стороне поражения по данным динамической реносцинтиграфии. Результаты. Уровень креатинина сыворотки крови до и после проведения НТТ составил 90,4±22,4 и 90,6±18,3 мкмоль/л соответственно (p=0,95). Статистически значимого изменения уровня общей СКФ согласно выбранным формулам не выявлено (p=0,8 и p=0,7 соответственно). Разницы между показателями раздельной СКФ на стороне поражения до и после проведения НТТ не выявлено (46,5±12,9 и 47,4±15,6 мл/мин соответственно; p=0,84). Выводы. Проведение двух блоков НТТ при локализованном ПКР не приводит к статистически значимому снижению уровня креатинина сыворотки крови (p=0,95), не влияет на уровень как общей СКФ (p=0,7), так и СКФ на стороне опухолевого поражения (p=0,84) и может считаться безопасным.
Ключевые слова: почечно-клеточный рак, неоадъювантная таргетна терапия, функция почки, скорость клубочковой фильтрации.
Адреса для листування:
Войленко Олег Анатолійович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку,
відділення пластичної та реконструктивної онкоурології
E-mail: [email protected]
orcid.org/0000-0003-3781-3622
Одержано 09.01.2020





