Злоякісні пухлини: як правильно сформулювати діагноз
 «Терміни — це не тільки слова. Неправильне використання лікарем онкологічних термінів як мінімум викликає в колег здивування та сумніви щодо його професіоналізму, а деколи — навіть призводить до помилок і втрат», — переконаний Василь Попович, доктор медичних наук, професор ДВНЗ «Івано-Франківський національний медичний університет». На прикладі пухлин гортані спікер продемонстрував, як оториноларингологу вірно сформулювати онкологічний діагноз.
«Терміни — це не тільки слова. Неправильне використання лікарем онкологічних термінів як мінімум викликає в колег здивування та сумніви щодо його професіоналізму, а деколи — навіть призводить до помилок і втрат», — переконаний Василь Попович, доктор медичних наук, професор ДВНЗ «Івано-Франківський національний медичний університет». На прикладі пухлин гортані спікер продемонстрував, як оториноларингологу вірно сформулювати онкологічний діагноз.
Класифікація (оцінка поширеності процесу) стосується тільки епітеліальних (ракових) злоякісних пухлин. Усі інші злоякісні процеси (саркоми, лімфоми тощо) відносяться до розряду некласифікованих.
Класифікація
Існує кілька класифікацій:
- вітчизняна — І–IV стадія, кожна з яких може індексуватися як А чи Б;
- міжнародна — (TNM), яка включає долікувальну — (Tis, T0, T1–4, Tx; N0–3; M0–1, Mx) і постхірургічну — рTNM.
Встановлена стадія злоякісного процесу у конкретного хворого не змінюється протягом усього його життя.
Відповідно до класифікації пухлин, яка базується на гістопатологічному диференціюванні (G), ступінь диференціювання:
- Gx — не може бути встановлений;
- G1 — високий;
- G2 — середній;
- G3 — низький;
- G4 — недиференційовані пухлини.
Доповідач зауважив, що ступінь диференціювання пухлини впливає на визначення стратегії лікування. А стадія захворювання і клінічна група не є ідентичними поняттями. Клінічні групи відображають тактику ведення онкологічних пацієнтів, оскільки клінічний діагноз, що визначає стадію захворювання, встановлюється тільки один раз і в процесі динамічного спостереження не змінюється протягом життя хворого.
Конструкція діагнозу
Спікер навів кілька прикладів формулювання діагнозу.
Папіломатоз гортані. Підозра на рак гортані (Susp. c-r laryngis). Клінічна група Iа. Показане дообстеження протягом 10 днів.Після дообстеження. Папіломатоз гортані. Клінічна група Iб (рекомендується динамічне диспансерне спостереження).
При конструкції діагнозу в діагностичному процесі можна виокремити два етапи: етап установної діагностики, завдання якого — встановити діагноз раку, та уточнювальної діагностики, що має на меті визначити поширеність процесу.
Етап установної діагностики. Рак гортані T3Nх Mх, клінічна група II. Показане подальше дообстеження (етап уточнювальної діагностики).Після дообстеження. Рак гортані T3N1M0, клінічна група IIа (варіант Т3N1M1, клінічна група IV).
Критерієм радикального — оперативного, променевого чи іншого — лікування є доведена клінічно, інструментально і (бажано) морфологічно відсутність пухлини на момент завершення лікування.
Рецидив (від recidivus — відновлення) — це відновлення пухлинного росту на місці або в зоні попереднього новоутворення через будь-який термін після радикального оперативного, променевого чи іншого лікування за умови доведеної клінічно, інструментально і (бажано) морфологічно відсутності пухлини на момент закінчення лікування.
Продовжений ріст (prolongatio morbi) — відновлення росту залишкової пухлини після умовно-радикального лікування.
Рак гортані T3N1M0, стан після комбінованого (комплексного) лікування (місяць, рік). Рецидив (продовжений ріст, метастазування). Клінічна група IIа (IV).Рак гортані T3N1M0, стан після комбінованого (комплексного) лікування (місяць, рік). Рецидив (продовжений ріст, метастаз). Клінічна група III.
Із визначеннями «рецидив», «продовжений ріст», «метастазування» пов’язані поняття прогресування захворювання (progresio morbi) і первинно-множинного раку. Дуже важливо чітко розмежовувати ці стани.
Хірургічні втручання
Радикальна операція — видалення пухлини єдиним блоком з регіонарними лімфатичним вузлами і навколишньою клітковиною (принцип «анатомічної футлярності» і зональності метастазування). Радикальність втручання визначається макроскопічно і шляхом морфологічного дослідження тканин по краях резекції.
Операції при пухлинах III стадії вважаються умовно-радикальними. Тому після (або до) них виникає необхідність у додатковій променевій чи медикаментозній терапії.
Комбіноване оперативне втручання — радикальне видалення пухлини з ураженим одним чи кількома сусідніми органами. Розширене оперативне втручання — видалення більш віддалених лімфатичних колекторів (групи глибоких лімфатичних вузлів шиї).
Економні операції (резекції) показані при облігатних передракових процесах і на початкових стадіях раку, коли зона пухлинного росту не виходить за межі тканинного шару, в якому відбулася малігнізація (рак іn situ, мікроінвазивний рак). Економні органозберігаючі втручання (різні варіанти резекцій) можливі і при II–III стадії ракового процесу, але тільки в рамках комбінованого та комплексного лікування.
Оцінка результатів лікування
Оцінка безпосередніх результатів з використанням хірургічного методу (хірургічне, комбіноване, комплексне) лікування:
- хворі, які отримали радикальне лікування (клінічне одужання, клінічна група III);
- нерадикально проліковані хворі (клінічна група II або IV).
Оцінка безпосередніх результатів з використанням консервативних методів:
- повна регресія (радикально проліковані хворі — клінічне одужання, клінічна група III);
- часткова регресія (≥50%);
- стабілізація (регресія >25% але <50%);
- прогресування.
Кінцеву оцінку стану регресії проводять через 40–50 днів після завершення лікування.
Оцінка результатів лікування у процесі динамічного спостереження:
- клінічне одужання (повна відсутність ознак пухлинного росту до 5 років);
- біологічне одужання (≥5 років);
- рецидив;
- продовжений ріст;
- метастазування;
- радіоіндуковані, хіміоіндуковані пухлини (розцінюються як новий випадок, а не рецидив пухлини).
«Знання і розуміння класифікаційних підходів дозволяють уникнути помилок у галузі онкології», — завершив виступ В. Попович.
Оптимізація втручань при пухлинах ротоглотки та парафарингеального простору
Досвідом хірургічного лікування доброякісних новоутворень ротоглотки та парафарингеального простору від імені групи фахівців відділу запальних захворювань ЛОР-органів ДУ «Інститут отоларингології імені професора О.С. Коломійченка Національної академії медичних наук (НАМН) України» (Д.Д. Заболотна, І.Р. Цвірінько, Я.В. Кізім, Е.Р. Ісмагілов) під керівництвом Д.І. Заболотного поділився Ярослав Кізім.

Пухлини парафарингеального простору трапляються рідко. Їхня частка у структурі всіх новоутворень голови і шиї становить 1–1,5% (Pool С.D. et al., 2017). З них 70–80% новоутворень цієї локалізації є доброякісними (Pool C.D. et al., 2018). Пухлини слинних залоз (аденоми) становлять 40–50% усіх новоутворень парафарингеального простору (Riffat F. et al., 2014).
За походженням доброякісні пухлини парафарингеального простору бувають епітеліальними (папілома, аденома) та неепітеліальними (сполучнотканинні: фіброма, хондрома, ліпома, ангіома; міогенні; нейрогенні: невринома, парагангліома). За анатомічною класифікацією, що використовується фахівцями Інституту, виділяють престилоїдний та постстилоїдний відділи парафарингеального простору; межею між ними є шилоподібний відросток. У постстилоїдному відділі локалізується внутрішня яремна вена, внутрішня сонна артерія, IX–XII пари внутрішньочерепних нервів. Це слід враховувати при виборі хірургічної методики лікування.
Зазвичай пацієнти з доброякісними новоутвореннями парафарингеального простору скаржаться на відчуття дискомфорту в горлі, зниження слуху, біль у вусі, зміну тембру голосу, порушене носове дихання, асиметрію обличчя, утруднений прийом їжі. Окрім збору анамнезу захворювання, діагностика таких пухлин включає проведення комп’ютерної томографії, магнітно-резонансної томографії (МРТ), ультразвукового дослідження, за необхідності — селективної ангіографії, біопсії новоутворення.
Рекомендоване хірургічне лікування (використовують трансоральний доступ; трансцервікальний доступ; транспаротидний доступ; трансцервікальний і трансмандибулярний доступ). Оперативні втручання можуть зумовити розвиток ускладнень: найчастіше виникають кровотечі, пошкодження нервів, судинні розлади, так званий синдром першого укусу. Для синдрому першого укусу, що є наслідком порушення симпатичної іннервації, характерний виражений інтенсивний біль, що спостерігається при кожному першому укусі та регресує з подальшими укусами. Це ускладнення є типовим для оперативного втручання з використанням зовнішнього доступу.
Спеціалісти ДУ «Інститут отоларингології імені професора О.С. Коломійченка НАМН України» при виконанні операції надають перевагу трансоральному доступу (без зовнішнього розрізу шиї). Результати аналізу структури доброякісних пухлин ротоглотки й парафарингеального простору у 92 пацієнтів (2011–2018 рр.) свідчать, що найчастіше виявляли плеоморфні аденоми (59% випадків), екто- й ендодермальні кісти (14%). За локалізацією новоутворення розподілилися так: престилоїдний відділ — 84%, постстилоїдний відділ — 16%.
Використання трансорального доступу при видаленні пухлин супроводжувалося високою ефективністю, у більшості випадків відзначалося швидке відновлення усіх функцій організму. Серед зареєстрованих ускладнень були тризм (у ранній післяопераційний період, що регресував на 2-гу–3-тю добу) — у 13 (14,1%) хворих, кровотечі — у 4 (4,3%), нагноєння післяопераційної рани — у 3 (3,4%), гостре порушення мозкового кровообігу — в 1 (1,1%) пацієнта. Випадків синдрому першого укусу не зафіксовано.
Клінічний випадок
Хвора М., віком 37 років, звернулася зі скаргами на відчуття дискомфорту в горлі. Порушення спостерігалися протягом місяця. Проходила амбулаторне лікування з приводу «паратонзилярного абсцесу».
Під час комп’ютерної томографії виявлено новоутворення кулястої форми. Хворій виконали оперативне видалення пухлини ротоглотки й парафарингельного простору трансоральним доступом.
За даними патогістологічного дослідження встановлено, що це плеоморфна аденома.
На комп’ютерній томографії через 6 міс ознак рецидиву не зафіксовано.
«Пухлини парафарингеального простору є рідкісною і складною патологією, яка характеризується неспецифічними клінічними проявами та латентним перебігом. При підозрі на наявність новоутворення судинного генезу використовується селективна ангіографія з подальшою превентивною емболізацією судини, що живить пухлину, — пояснив Я. Кізім. — Перевагами використання трансорального доступу при видаленні новоутворень парафарингеального простору є відсутність косметичних дефектів, швидке загоєння післяопераційної рани та швидке відновлення працездатності пацієнта. Синдром першого укусу при застосуванні трансорального доступу відсутній».
Хірургічне лікування при метастатичних лімфатичних вузлах шиї
Про досвід сучасного хірургічного лікування при метастатичних лімфатичних вузлах шиї групою фахівців (професор Е.В. Лукач, В.Я. Діхтярук) розповів Віктор Діхтярук, кандидат медичних наук, старший науковий співробітник ДУ «Інститут отоларингології імені професора О.С. Коломійченка НАМН України».
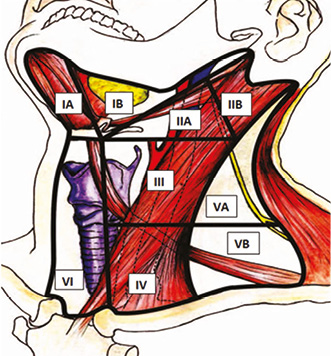
Метастази в регіонарні лімфатичні вузли шиї у хворих зі злоякісними новоутвореннями голови та шиї знижують 5-річну виживаність майже на 50% (рис. 1).
Закономірності метастазування різних пухлин голови та шиї:
- при раку губи або передньої частини рота вражаються лімфатичні вузли IА рівня;
- при раку ротоглотки — IIВ рівня;
- при раку гортані — IIА–III рівня;
- при раку носоглотки — IIВ і VА рівня;
- при раку щитовидної залози — VI рівня.
Золотим стандартом лікування при метастатичних лімфатичних вузлах шиї є шийна дисекція в різних варіантах:
1. Класична радикальна та модифіковані радикальні шийні дисекції.
2. Селективні шийні дисекції.
3. Розширені шийні дисекції.
Доповідач нагадав суть кожного із втручань. Класична радикальна шийна дисекція (операція Крайля) включає видалення одним блоком клітковини з метастатичними лімфатичними вузлами на всіх V рівнях шиї та кивального м’яза, внутрішньої яремної вени, додаткового нерва. Після виконання такої операції сонна артерія прикрита тільки шкірою. При селективній шийній дисекції видаляється група лімфатичних вузлів тільки з деяких рівнів шиї; допускається збереження додаткового нерва, внутрішньої яремної вени та кивального м’яза. При розширеній шийній дисекції видаляються всі структури (як при радикальній операції), а також ретрофарингеальні, паратрахеальні групи вузлів, за необхідності — стінка глотки, корінь язика, м’яке піднебіння, виконується резекція сонної артерії (загальної чи внутрішньої).
При поширенні метастатичних лімфатичних вузлів на магістральні судини шиї в більшості онкологічних клінік пацієнтам відмовляють у хірургічному лікуванні у зв’язку з високою імовірністю кровотеч.
Доповідач зазначив, що фахівці ДУ «Інститут отоларингології імені професора О.С. Коломійченка НАМН України» удосконалили методику реконструкції сонної артерії при її пухлинній інвазії під час шийної дисекції, що допомагає уникнути кровотеч. Протягом останніх 5 років в Інституті прооперовано 51 хворого з метастатичними лімфатичними вузлами шиї, які поширювалися на магістральні судини (34 пацієнти були первинні, 17 — після променевої терапії).
«Хворим виконувалася розширена шийна диcекція з видалення пухлини єдиним блоком разом із ділянкою сонної артерії. Дефект судини, що утворився після резекції, ми усували шляхом накладання анастомозу судин кінець в кінець. Стінки судин зшивали нитками з пролену № 5. Анастомоз створювали між загальною та внутрішньою сонними артеріями. При цьому зовнішня сонна артерія була повністю перев’язана, — описав втручання В. Діхтярук. — Післяопераційний період минав задовільно, геморагічні ускладнення не виникали».
Доповідач зробив висновок, що хірургічне видалення метастатичних лімфатичних вузлів шиї, які поширюються на магістральні судини, м’які тканини та шкіру шиї, разом із резекцією та анастомозом сонної артерії і одномоментним заміщенням післяопераційного дефекту шиї шкірно-м’язовим пекторальним клаптем наразі є єдиним радикальним лікуванням, що дозволяє відновити кровообіг по магістральній судині, значно покращує реабілітацію цих хворих, зменшує вірогідність виникнення геморагічних ускладнень та сприяє збільшенню 5-річної виживаності.
Біопсія сторожових лімфатичних вузлів
Даріуш Кашмарчик (Dariusz Kaczmarczyk), кафедра хірургії новоутворень голови та шиї Медичного університету м. Лодзь (співавтори — Marcin Kubiak, Dawid Zagacki, Izabela Niedźwiecka, Marcin Repetowski, Alina Morawiec-Sztandera) обрав темою виступу біопсію сторожових лімфатичних вузлів N0 плоскоклітинного раку порожнини рота. Вважається, що структурно-функціональний стан сторожових лімфатичних вузлів відображає стан регіонарної лімфатичної системи, а метастазування в них є найімовірнішим (адже вони першими з регіонарних лімфатичних вузлів отримують лімфу від первинної пухлини).
Спікер презентував результати дослідження, що включало 160 пацієнтів віком 42–90 років із плоскоклітинним раком порожнини рота (переважно раком язика) T1/T2N0M0. За день до оперативного втручання хворим виконували лімфосцинтиграфію. Під час операції, після видалення пухлини, здійснювали пошук сторожових лімфатичних вузлів безпровідним гамма-детектором. 46 пацієнтам виконали біопсію сторожових лімфатичних вузлів та селективну шийну дисекцію I–III рівня, 114 — тільки біопсію. Виконували гістологічне дослідження кожного лімфатичного вузла й фарбування на цитокератин. У 19 учасників підтвердили наявність метастазів у сторожових лімфатичних вузлах (діагноз скоригували на N1), у 114 метастази не виявили.
«Біопсія сторожових лімфатичних вузлів є сучасною діагностичною процедурою, яка безпечніша за лімфаденектомію, а також малоінвазивна. Вона дозволяє зберегти регіонарні лімфатичні вузли як першу лінію захисту, отримати достатню кількість матеріалу для ретельного гістологічного дослідження, уникнути профілактичної лімфаденектомії, за потреби (у разі виявлення метастазів) — розширити хірургічне втручання», — констатував Д. Кашмарчик.
Діагностичне і прогностичне значення мікроРНК
Доповідь «Оцінка діагностичного і прогностичного значення мікроРНК у пацієнтів із раком гортані у Польщі» презентував Антоні Брюзгілєвич (Antoni Bruzgielewicz), кафедра отоларингології Варшавського медичного університету (співавтори — Ewa Osuch-Wójcikiewicz, Ireneusz Majsterek, Przemysław Krawczyk, Kazimierz Niemczyk).
Відкриття принципово нового класу малих молекул РНК (мікроРНК), які регулюють експресію генів, стало визначною подією в біології кінця XX ст. Доведено, що мікроРНК задіяні у розвитку та прогресуванні раку. У 2002 р. був підтверджений зв’язок між пригніченням мікроРНК і хронічним лімфолейкозом (Calin G.A. et al., 2002). Через 3 роки з’явилися перші публікації, присвячені ролі мікроРНК у виникненні плоскоклітинних карцином голови й шиї. У 2009 р. група вчених під керівництвом С. Liu дослідила значення мікроРНК у появі плоскоклітинного раку гортані. У 2013 р. мікроРНК вперше застосували у молекулярній терапії гепатоцелюлярної карциноми.

Мета дослідження, результати якого презентував спікер, — представити еволюцію підходів до діагностики і лікування плоскоклітинного раку гортані. У спостереження було включено 12 основних ЛОР-відділень у Польщі. Здійснено ретроспективний аналіз 4124 випадків плоскоклітинного раку гортані — 3682 (89,3%) у чоловіків, 442 (10,7%) — у жінок.
Виявлено, що поліморфізми DICER1 (rs3742330, rs13078), TARBP2 (rs784567), XPO5 (rs11077) можуть асоціюватися з ризиком раку гортані у польській популяції.
Поліморфізми DGCR8 (rs417309), DICER1 (rs3742330 та rs13078), TARBP2 (rs784567), XPO5 (rs11077) здатні впливати на прогресування раку гортані залежно від розміру пухлини і метастазів у лімфатичні вузли. Необхідні подальші дослідження для уточнення механізмів впливу поліморфізмів генів мікроРНК на розвиток раку гортані.
Поліморфізми DGCR8 (rs417309 і rs1640299), DROSHA (rs6877842) ймовірно асоційовані з вищим ризиком виникнення раку гортані у польській популяції внаслідок порушень дозрівання мікроРНК.
Змінена експресія мікроРНК пов’язана зі стадією ТNМ раку гортані та статусом куріння:
- експресія miR-29a і miR-548aa позитивно корелювала зі стадією TNM;
- експресія miR-4768-3p негативно корелювала з метастазуванням у лімфатичні вузли;
- miR-29a і miR-548aa можуть діяти як онкогени, а miR-4768-3p — виступати супресором пухлини при раку гортані;
- рівень експресії miR-202-3p був значно підвищеним у пацієнтів, які курили, порівняно з тими, які не мали цієї шкідливої звички;
- рівні експресії miR-4768-3р, miR-548aa і miR-3713 помітно знижувалися у курців.
«МікроРНК залучені до процесу проліферації, апоптозу, міграції та ангіогенезу. Зміна експресії мікроРНК може відігравати важливу роль у канцерогенезі, прогресуванні пухлини. Спосіб життя і звички (наприклад куріння) впливають на зміни експресії мікроРНК. МікроРНК є потенційними біомаркерами раку гортані, які потенційно можуть застосовуватися в клініці як інструмент діагностики та контролю лікування та стати імовірною мішенню персоналізованої терапії у пацієнтів із плоскоклітинним раком гортані», — підсумував сказане А. Брюзгілєвич.
Як підвищити точність передопераційної діагностики пухлин привушної залози
Наразі стандартна діагностика пухлин привушної залози включає збір анамнезу, об’єктивний огляд, тонкоголкову аспіраційну біопсію, ультразвукове дослідження; комп’ютерну томографію та МРТ. Дифузійно-зважена й перфузійно-зважена МРТ — це альтернатива тонкоголковій біопсії чи лише допоміжні методи при передопераційній диференційній діагностиці злоякісних і доброякісних пухлин привушної залози? Відповідь на це запитання шукав Богуслав Мікашевський (Bogusław Mikaszewski), відділ отоларингології Медичного університету м. Гданськ, Польща (співавтори — Karolina Markiet, Dominik Stodulski, Edyta Szurowska, Jacek Kobak, Jerzy Kuczkowski).
Дифузійно-зважена МРТ дозволяє кількісно оцінити дифузію молекул води у позаклітинному просторі досліджуваного органа. Перфузійно-зважена МРТ відображає зміни інтенсивності сигналу, який створює контрастна речовина, введена внутрішньовенно.
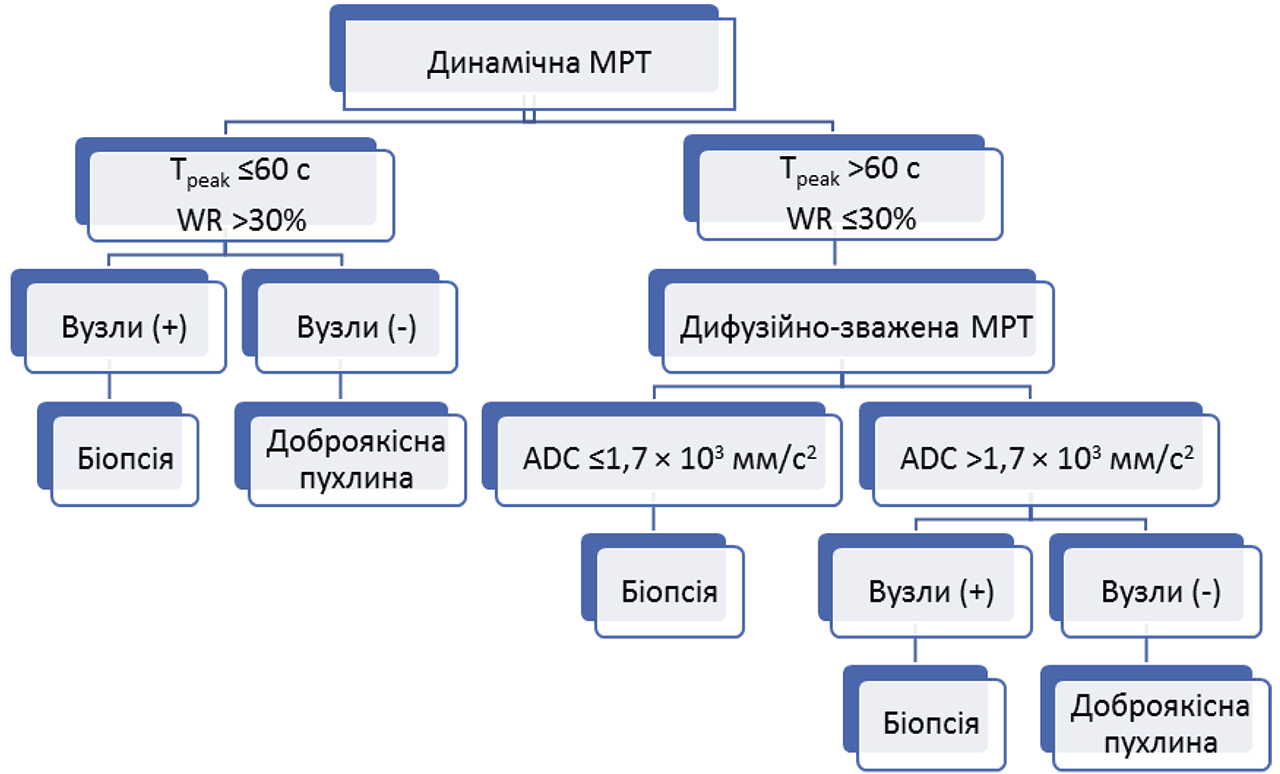
Спікер представив результати власної роботи, у рамках якої 100 пацієнтам проводили передопераційну МРТ і тонкоголкову аспіраційну біопсію. Згідно з результатами МРТ, 17 уражень оцінили як потенційно злоякісні, 83 — як потенційно доброякісні. За даними біопсії показники становили 20 та 80 відповідно. За допомогою ROC-аналізу дослідниками виявлено, що чутливість передопераційної МРТ — 89,5%, специфічність — 100%. Для тонкоголкової аспіраційної біопсії аналогічні показники становили 47,4 та 86,4%. Дифузійно-зважена та перфузійно-зважена МРТ мали подібну до тонкоголкової аспіраційної біопсії точність у виявленні злоякісних пухлин (рис. 2).
Tpeak — час до пікового підвищення, WR — швидкість вимивання, ADC — вимірюваний коефіцієнт дифузії
За даними дослідження, виконаного групою вчених на чолі зі спікером у 2017 р., вдалося встановити, що існує принаймні дві групи привушних злоякісних новоутворень, в тому числі одна, параметри динамічної МРТ якої близькі до таких плеоморфних аденом.
Чи можна підвищити точність динамічної МРТ за допомогою дифузійно-зваженої МРТ у діагностиці злоякісних новоутворень і плеоморфних аденом? На відміну від динамічної МРТ, дифузійно-зважена МРТ ефективна в диференційній діагностиці привушних злоякісних пухлин і плеоморфних аденом. Оптимізація передопераційної діагностики привушних пухлин повинна включати попередній відбір пухлин Вортина (Warthin) на основі динамічної МРТ, виявлення плеоморфних аденом на основі дифузійно-зваженої МРТ та цитологічне дослідження решти новоутворень, які викликають занепокоєння.
«Чи повинні ми застосовувати дифузійно-зважену та перфузійно-зважену МРТ у діагностиці пухлин привушних залоз? Відповідь чітка: так», — запевнив Б. Мікашевський.
Українсько-польський конгрес «Інноваційні технології в оториноларингології» запам’ятався насиченою програмою, практичною орієнтованістю виступів, яскравими фото- та відеоматеріалами. Тут були представлені найкращі здобутки українських оториноларингологів та їхніх польських, німецьких, італійських колег: дані останніх наукових робіт, вдосконалені методики хірургічних втручань, схеми лікування, що неодноразово продемонстрували ефективність у практиці. У кожному з виступів звучало переконання, що наразі, окрім забезпечення ефективності лікування і відновлення функцій, важливо дбати про естетику та якість життя пацієнтів.
Ольга Радучич,
фото Сергія Бека