Флекаинид — новое или забытое старое?
Флекаинид известен в клинической практике достаточно давно: препарат синтезирован в 1972 г., в странах Европы его активно применяют с 1982 г. В Украине флекаинид зарегистрирован лишь несколько лет назад, однако с середины 1990-х годов был в наличии по гуманитарной помощи, и врачи-кардиологи имели возможность применять его в клинической практике.
Какова точка приложения действия флекаинида?
Флекаинид ингибирует натриевые каналы, способствуя снижению концентрации внутриклеточного кальция, за счет чего уменьшается выраженность оксидативного стресса (Aliot E. et al., 2011).
Препарат применяют в очень многих аспектах аритмологии: и при желудочковых, и при суправентрикулярных нарушениях ритма сердца. В настоящей лекции внимание сфокусировано на фибрилляции предсердий (ФП) и применении флекаинида именно при этом виде нарушения ритма.
Чем опасна ФП?
ФП — самая распространенная на сегодняшний день аритмия после суправентрикулярной экстрасистолии. К сожалению, статистика неутешительна: по данным европейских экспертов, в 2018 г. у каждого 4-го жителя Европы среднего возраста диагностирована ФП. По прогнозам к 2030 г. количество жителей Европейского Союза с диагнозом «фибрилляция предсердий» достигнет 14–17 млн человек (Kirchhof P. et al., 2016).
ФП чревата двумя основными осложнениями:
- кардиоэмболическим инсультом сопровождающимся высокой инвалидизацией и смертностью;
- развитием сердечной недостаточности (СН) — основным осложнением ФП, также приводящим к летальному исходу.
Медикаментозное восстановление синусового ритма
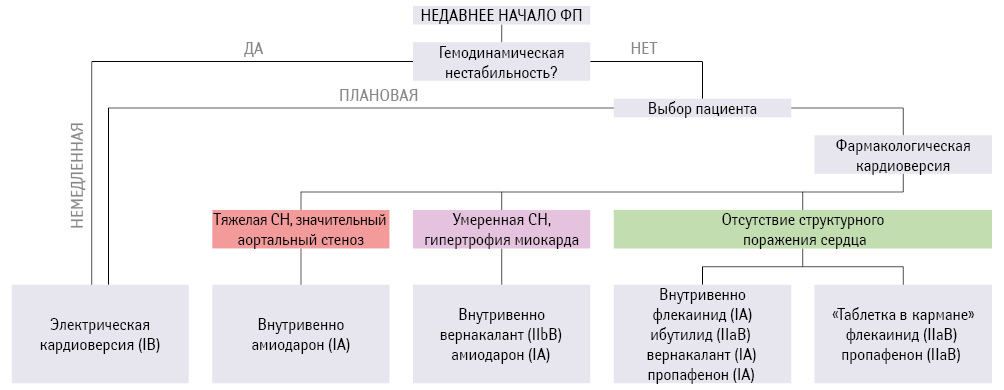
В настоящее время во всем мире стратегия ведения пациентов с ФП заключается в сохранении синусового ритма: у пациентов с синусовым ритмом реже развиваются инсульт, СН, они живут лучше, качественнее и дольше. Алгоритм фармакологической или электрической кардиоверсии при «срыве» ритма и возникновении у пациента пароксизма ФП, рекомендованный Европейским обществом кардиологов (European Society of Cardiology — ESC) (Kirchhof P. et al., 2016), представлен на рис. 1.
При осуществлении фармакологической кардиоверсии на сегодняшний день тактика врача основывается на выявлении основной патологии, на фоне которой возникло нарушение ритма.
Выделяют три основные группы пациентов:
1) с отсутствием или минимально выраженными структурными поражениями миокарда;
2) с умеренной СН и гипертрофией миокарда;
3) с выраженной СН и аортальным стенозом (пожалуй, наиболее тяжелая в прогностическом плане и плане курации группа).
В каждой из вышеперечисленных групп пациентов своя тактика фармакологической кардиоверсии. Наиболее широкую палитру антиаритмических препаратов (ААП) можно применять у пациентов с отсутствием структурных поражений миокарда. Согласно рекомендациям ESC (2016), у лиц без ишемического или структурного поражения сердца флекаинид, пропафенон или вернакалант (последний не зарегистрирован в Украине) рекомендованы для фармакологической кардиоверсии при новых эпизодах ФП (самый высокий класс рекомендаций и уровень доказательности — IА). У некоторых пациентов с недавно возникшей ФП при отсутствии выраженных структурных или ишемических заболеваний сердца единичная пероральная доза флекаинида или пропафенона (стратегия «таблетка в кармане») может быть рекомендована для кардиоверсии после оценки безопасности (класс рекомендаций IIа, уровень доказательности В) (табл. 1).
| Рекомендации | Класс рекомендаций | Уровень доказательности |
|---|---|---|
| Кардиоверсия при ФП | ||
| У пациентов без ишемического или структурного поражения сердца флекаинид, пропафенон или вернакалант рекомендованы для фармакологической кардиоверсии при новых эпизодах ФП | I | А |
| У пациентов с ишемическим или структурным заболеванием сердца ибутилид рекомендован для фармакологической кардиоверсии при ФП | IIа | В |
| У некоторых пациентов с недавно возникшей ФП при отсутствии выраженных структурных или ишемических заболеваний сердца единичная пероральная доза флекаинида или пропафенона (стратегия «таблетка в кармане») может быть рекомендована для кардиоверсии после оценки безопасности | IIа | В |
| У пациентов с ишемическим и/или структурным изменением сердца амиодарон рекомендован для кардиоверсии при ФП | I | А |
| Вернакалант может быть рекомендован как альтернатива амиодарону для фармакологической кардиоверсии при ФП у пациентов без гипотензии, тяжелой СН или выраженных структурных заболеваний сердца (особенно аортальный стеноз) | IIb | В |
Что означает термин «без органического поражения сердца»?
Понятие «без органического поражения сердца» четко оговаривается следующими позициями:
- отсутствие Q-инфаркта миокарда (ИМ) в анамнезе;
- отсутствие гипертрофической и дилатационной кардиомиопатии;
- фракция выброса левого желудочка (ФВ ЛЖ) >45%;
- отсутствие признаков застойной или прогрессирующей СН;
- стадия СН не более IIА;
- отсутствие врожденных или ревматических пороков сердца;
- отсутствие выраженной гипертрофии левого желудочка (ЛЖ) (толщина одной из стенок ЛЖ ≥14 мм).
В каких случаях следует прекратить применение ААП?
ААП Iс-класса можно применять только у пациентов без органического поражения сердца, поскольку в ряде исследований, к сожалению, завершившихся досрочно, на фоне их применения у пациентов часто наступала внезапная кардиальная смерть (The ESVEM Investigators, 1989; Echt D.S. et al., 1991; Cardiac Arrhythmia Suppression Trial II Investigators, 1992; Waldo A.L. et al., 1996). Как видно на рис. 2, пациенты были тяжелыми: преимущественно после ИМ, с частой желудочковой экстрасистолией высоких градаций по классификации B. Lown, M. Wolf (1971), низкой ФВ ЛЖ. Именно у этой тяжелой группы пациентов может возникать проаритмогенный эффект ААП. Развитие последнего обусловлено угнетением гемодинамики, удлинением интервала Q–T, снижением порога индукции аритмии, влиянием на проводящую систему сердца, усилением эктопической активности желудочков.

Предвестником проаритмогенного эффекта ААП Iс-класса является прогрессирующее ухудшение внутрижелудочковой проводимости и расширение комплекса QRS до 0,16–0,24 с. При использовании метода Холтеровского мониторинга электрокардиограммы (ЭКГ) отмечают:
- увеличение общего количества желудочковых экстрасистол в >2 раза;
- увеличение количества парных желудочковых экстрасистол в >4 раза;
- повышение частоты коротких (до 15 с) эпизодов желудочковой тахикардии в >10 раз;
- повышение частоты ритма при пароксизмах желудочковой тахикардии на >20 уд./мин;
- появление новых вариантов желудочковой тахикардии;
- появление эпизодов фибрилляции желудочков, прогрессирующее ухудшение внутрижелудочковой проводимости с трансформацией в желудочковую тахикардию и фибрилляцию желудочков (очень серьезное осложнение, требующее прекращения приема ААП вследствие риска возникновения неблагоприятных желудочковых аритмий).
Лечение следует прекратить при:
- учащении эктопических желудочковых комплексов;
- появлении блокад, брадикардии;
- расширении комплекса QRS на >25%, уменьшении его амплитуды;
- увеличении продолжительности зубца Р на ЭКГ >0,12 с.
Флекаинид: преимущества по сравнению с другими ААП
В метаанализе US Agency for Healthcare Research and Quality (AHRQ) показано, что при применении флекаинида у пациентов с отсутствием или минимально выраженными структурными изменениями миокарда эффективность кардиоверсии достаточно высока по сравнению с другими ААП (McNamara R.L. et al., 2000). В табл. 2 приведены результаты нескольких исследований, в которых сравнивали флекаинид, амиодарон, пропафенон и плацебо. Согласно полученным данным, флекаинид обеспечивает более эффективную кардиоверсию даже по сравнению с амиодароном (95 и 89% соответственно).
| Исследование | Пациенты, группы | Флекаинид (n, доза) |
Исход: конверсия в сердечный ритм | Основные результаты, % |
|---|---|---|---|---|
| Capucci A. et al. (1992) | 62 пациента с ФП ≤7 сут
Плацебо vs амиодарон внутривенно болюсно + инфузионно или флекаинид перорально |
n=22 300 мг |
Через 3 ч Через 8 ч Через 12 ч Через 24 ч |
Плацебо — 29, амиодарон — 16, флекаинид — 68
Плацебо — 48, амиодарон — 37, флекаинид — 91 Амиодарон — 47, флекаинид — 91 Амиодарон — 89, флекаинид — 95 |
| Boriani G. et al. (1998) | 417 пациентов с ФП ≤7 сут
Плацебо vs амиодарон внутривенно, флекаинид перорально, пропафенон внутривенно или перорально |
n=69 300 мг |
Через 1 ч Через 3 ч Через 8 ч |
Плацебо — 9, амиодарон — 6, флекаинид — 13
Плацебо — 18, амиодарон — 25, флекаинид — 57 Плацебо — 37, амиодарон — 57, флекаинид — 75 |
| Romano S. et al. (2001) | 352 пациента с ФП ≤7 сут
Плацебо, флекаинид, пропафенон внутривенно |
n=138 2 мг/кг массы тела |
Через 1 ч Через 3 ч Через 6 ч Через 24 ч |
Плацебо — 22, флекаинид — 73, пропафенон — 54
Плацебо — 28, флекаинид — 80, пропафенон — 68 Плацебо — 35, флекаинид — 86, пропафенон — 75 Плацебо — 46, флекаинид — 90, пропафенон — 92 |
Подход «таблетка в кармане» («pill-in-the-poсket»)
«Таблетка в кармане» — успешный метод восстановления синусового ритма, который можно применять с использованием нагрузочной дозы пропафенона (450–600 мг) или флекаинида (200–300 мг) перорально. Такой подход может быть использован у отдельных пациентов с выраженной симптоматикой и нечастыми (от 1 раза в месяц до 1 раза в год) пароксизмами ФП. При этом необходимо соблюдать ряд важных условий.
Прежде всего, безопасность стратегии должна быть оценена в стационарных условиях под наблюдением врача, поскольку существует риск трансформации мерцательной аритмии в трепетание предсердий. Этот риск незначителен, однако имеет место, и если трансформация возникла один раз, вероятность повторных эпизодов чрезвычайно высока. Опасность трансформации в том, что частота желудочковых сокращений 2:1–1:1 чревата развитием достаточно серьезного нарушения ритма, возможно с гемодинамическими осложнениями.
Другой важный момент: следует убедиться в отсутствии у пациента структурных изменений миокарда. Для этого необходимо провести как минимум скрининговое обследование. P. Alboni (2007) предложил распределять пациентов на две группы, в зависимости от того, кому подходит или не подходит методика «таблетка в кармане» (табл. 3). При этом во 2-й группе вероятно присутствие пациентов, которых нельзя отнести к категории больных без структурных изменений миокарда.
| «Таблетка в кармане» | |
|---|---|
| Подходит | Не подходит |
| Продолжительность эпизода ФП <48 ч | Комплекс QRS >120 мс |
| Частота сердечных сокращений на фоне ФП >70 уд./мин | P–Q <120 мс |
| Систолическое артериальное давление >100 мм рт. ст. | Длительные эпизоды ФП в анамнезе (>7 сут) |
| Хорошая переносимость ФП (отсутствие одышки, обмороков) | Хроническая СН или ФВ ЛЖ <45% |
| Частота приступов — 12 в год | Частота сердечных сокращений в покое ≤50 уд./мин |
| Синоатриальная блокада | |
| Атриовентрикулярная блокада II–III степени | |
| Тромбоэмболия легочной артерии в анамнезе | |
Электрическая и фармакологическая кардиоверсия при ФП
Рекомендации ESC (2016) относительно применения ААП сочетанно с электрической кардиоверсией представлены в табл. 4. Отмечено, что предварительная терапия амиодароном, флекаинидом, ибутилидом или пропафеноном может быть рекомендована для повышения эффективности электрической кардиоверсии и профилактики рецидива ФП (класс рекомендаций IIa, уровень доказательности В).
| Рекомендации | Класс рекомендаций | Уровень доказательности |
|---|---|---|
| Основные рекомендации | ||
| Терапия контроля ритма сердца предназначена для улучшения симптомов у пациентов с ФП | I | B |
| Влияние на факторы кардиоваскулярного риска и предотвращение пусковых механизмов ФП должно быть целью терапии контроля ритма, чтобы облегчить сохранение синусового ритма у пациентов | IIa | B |
| За исключением ФП, ассоциированной с гемодинамической нестабильностью, выбор между электрической и фармакологической кардиоверсией должен зависеть от пациента и выбора врача | IIa | С |
| Кардиоверсия при ФП | ||
| Электрическая кардиоверсия при ФП рекомендована пациентам с острой гемодинамической нестабильностью для восстановления сердечной деятельности | I | B |
| Кардиоверсия при ФП (электрическая или фармакологическая) рекомендована у симптомных пациентов с персистирующей/длительно персистирующей ФП как часть терапии контроля ритма сердца | I | B |
| Предварительная терапия амиодароном, флекаинидом, ибутилидом или пропафеноном может быть рекомендована для повышения эффективности электрической кардиоверсии и профилактики рецидива ФП | IIa | B |
Сравнение двух методик кардиоверсии — электрической и фармакологической — представлено в табл. 5.
| Кардиоверсия | |
|---|---|
| Электрическая | Фармакологическая |
| Более эффективна (до 90%) | Хорошо «работает» при раннем применении (продолжительность пароксизма ФП <48 ч) |
| Быстрая | Можно проводить без седации |
| Проводится после трансэзофагеальной эхокардиографии | Дешевле |
| Более безопасна | Раннее применение ААП позволяет избежать госпитализации пациентов |
Фармакологическую кардиоверсию используют чаще по сравнению с электрической (примерно 69 и 31% соответственно). Однако на сегодняшний день в странах Европы, в том числе Украине, имеет место тенденция чаще использовать электрическую кардиоверсию. По данным исследования, проведенного в 57 центрах разных стран Европы (72% из которых — университетские клиники, то есть высокопрофессиональные учреждения с высоким уровнем медицинской подготовки), в 56% центров в течение последних 5 лет отмечено увеличение числа проводимых кардиоверсий при ФП и лишь в 12,5% — снижение, что свидетельствует о тенденции к сохранению синусового ритма. При этом 68% клиник предпочитали электрическую, 19% — медикаментозную кардиоверсию, что, вероятно, объяснимо более быстрым достижением эффекта и отсутствием побочных действий первой (EUROPACE, 2013).
С целью фармакологической кардиоверсии в разных странах применяют различные ААП (рис. 3). Например, во Франции в основном назначают амиодарон, в других странах — флекаинид, пропафенон примерно в равных соотношениях, реже амиодарон.

Как «удержать» ритм после кардиоверсии?
Необходимо понимать, что успешно проведенная кардиоверсия — лишь половина задачи, другая же половина — «удержать» ритм. Согласно рекомендациям ESC (2016), краткосрочная терапия ААП после кардиоверсии и/или процедуры абляции в течение 4 нед на 80% снижает риск рецидива аритмии и не сопровождается побочными эффектами ААП. Именно эти 4 нед — наиболее уязвимый период в аспекте повторного «срыва» ритма. Даже при синусовом ритме на ЭКГ достаточно нестабильно предсердие, присутствуют элементы электрической нестабильности, которые при любом, даже минимальном, раздражителе могут повторно «сорвать» ритм.
Противорецидивная антиаритмическая терапия
Итак, ритм восстановлен. Как вести пациента в дальнейшем? Почему следует применять ААП? Когда и какой препарат назначить? Все эти вопросы необходимо решить перед выпиской пациента из стационара.
Пациенту необходимо принимать противорецидивную антиаритмическую терапию достаточно длительно, и врач должен ее контролировать. Факторы, влияющие на принятие решения о необходимости ее назначения:
- динамика заболевания (учащение пароксизмов ФП приведет к решению вопроса о противорецидивной терапии);
- прогрессия симптомов ФП (ухудшение переносимости пациентом пароксизмов, увеличение их продолжительности);
- течение основного заболевания (чаще всего артериальная гипертензия, ишемическая болезнь сердца и их сочетание, сахарный диабет, СН, дисфункция щитовидной железы, физическая («фибрилляция предсердий атлета») или алкогольная («синдром праздничного сердца») нагрузка, избыточная масса тела, тяжелый стресс, курение).
В рекомендациях ESC (2016) отмечено, что влияние на факторы кардиоваскулярного риска и предотвращение пусковых механизмов ФП должно быть целью терапии контроля ритма, чтобы облегчить сохранение синусового ритма у пациентов (см. табл. 4).
Нередко пациенты предъявляют жалобы на «срыв» ритма при резком повышении артериального давления, после стресса на работе, чрезмерной физической усталости на даче и т.д. — все эти пусковые механизмы развития ФП необходимо нивелировать.
Какой ААП выбрать?
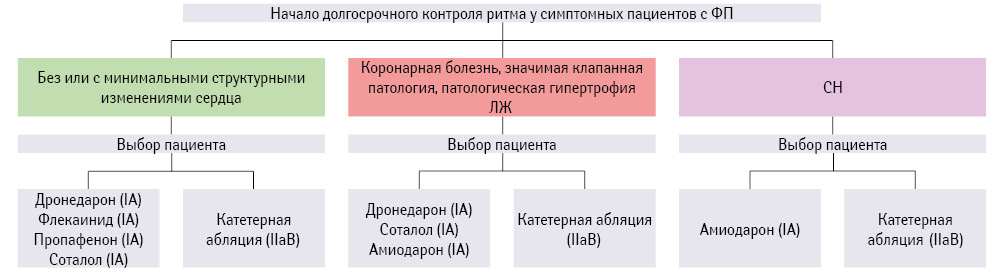
Рекомендации ESC (2016) предлагают четкую стратегию выбора ААП для поддержания синусового ритма у пациента (рис. 4). Самый скудный выбор у пациентов с СН: только ААП III класса (амиодарон). При наличии у пациента коронарной болезни сердца, выраженной патологии клапанов, патологической гипертрофии ЛЖ выбор чуть больше, но тем не менее замыкается он на ААП III класса (дронедарон, соталол, амиодарон). Наибольший выбор ААП у пациентов без или с минимально выраженными структурными изменениями сердца: дронедарон, пропафенон, соталол, флекаинид рекомендованы им под классом рекомендаций IA. При этом катетерная абляция как метод лечения при ФП приемлема у каждой вышеуказанной категории пациентов.
Сравнение фармакокинетики флекаинида и пропафенона — ААП I класса, рекомендованных ESC (2016) под самым высоким классом рекомендаций и уровнем доказательности (IA), — представлено в табл. 6:
- флекаинид имеет достаточно длительный период полувыведения — 20 ч по сравнению с 8 ч у пропафенона, что определяет кратность их приема 2 и 3 раза в сутки соответственно;
- флекаинид имеет очень высокую биодоступность — 90% (биодоступность пропафенона вряд ли можно прогнозировать ввиду очень большого разброса показателей);
- пик концентрации примерно одинаков (до 3 ч);
- разный путь выведения.
| Критерий | Фармакокинетика | |
|---|---|---|
| Флекаинид | Пропафенон | |
| Период полувыведения, ч | 20 | 5–8 |
| Биодоступность, % | 90 | 25–75 |
| Пик концентрации, ч | 3–4 | 1–3 |
| Основной путь элиминации | Почки | Печень |
Проведено несколько сравнительных исследований эффективности пропафенона и флекаинида. Согласно результатам анализа трех исследований по каждому препарату, минимальный срок наблюдения в которых составил 6 мес после кардиоверсии, применение пропафенона сопровождалось большим количеством рецидива ФП (Aliot E. et al., 2011) (рис. 5).

ESC (2016) рекомендует тщательно оценивать выбор ААП, учитывая вопросы коморбидности, кардиоваскулярного риска и потенциально тяжелых проаритмий, а также экстракардиальные, токсические эффекты (класс рекомендаций I, уровень доказательности А). Дронедарон, флекаинид, пропафенон или соталол рекомендованы для профилактики пароксизмов ФП у пациентов с нормальной функцией ЛЖ без патологической гипертрофии ЛЖ. К сожалению, в клинической практике нередко отмечают другую картину: в пользу применения ААП III класса (в частности амиодарона) у пациентов без структурных изменений сердца или признаков СН. В то же время в рекомендациях ESC (2016) указано, что амиодарон более эффективен для профилактики рецидива ФП, нежели другие ААП, однако экстракардиальные токсические эффекты при его применении распространены и нарастают со временем (класс рекомендаций II, уровень доказательности А), поэтому пациентам с отсутствием или минимально выраженными структурными изменениями миокарда вначале должны быть назначены другие ААП (табл. 7).
| Рекомендации | Класс рекомендаций | Уровень доказательности |
|---|---|---|
| ААП для длительной терапии синусового ритма/профилактики рецидива ФП | ||
| Выбор ААП должен быть тщательно оценен, учитывая вопросы коморбидности, кардиоваскулярного риска и потенциально тяжелой проаритмии, экстракардиальные токсические эффекты, предпочтения пациента и симптомы | I | А |
| Дронедарон, флекаинид, пропафенон или соталол рекомендованы для профилактики пароксизмов ФП у пациентов с нормальной функцией ЛЖ без патологической гипертрофии ЛЖ | I | А |
| Дронедарон рекомендован для профилактики рецидива симптомов ФП у пациентов со стабильной коронарной болезнью сердца без СН | I | А |
| Амиодарон рекомендован для профилактики рецидива симптомов ФП у пациентов с СН | I | В |
| Амиодарон более эффективен для профилактики рецидива ФП, нежели другие ААП, однако экстракардиальные токсические эффекты при его применении распространены и нарастают со временем. Поэтому вначале должны быть назначены другие ААП | IIa | С |
| Пациенты, применяющие ААП, должны быть периодически оценены для подтверждения необходимости терапии | IIa | C |
| ЭКГ-мониторинг на протяжении длительной антиаритмической терапии должен быть рекомендован для контроля частоты ритма, выявления удлинения комплекса QRS и интервала Q–T и возникновения атриовентрикулярной блокады | IIa | В |
| Терапия ААП не рекомендована пациентам с удлиненным интервалом Q–T (>0,5 с) или значимыми заболеваниями синоатриального узла или атриовентрикулярной узловой дисфункции, не имеющим функционирующего кардиостимулятора | III (вредно) | С |
| Продолжение антиаритмической терапии в период после абляции при ФП должно быть рекомендовано для поддержания синусового ритма, когда рецидив весьма вероятен | IIa | В |
В этом аспекте представляют интерес результаты регистра RealiseAF, цель которого — определить, насколько назначение ААП пациентам с ФП соответствует современным рекомендациям Американского колледжа кардиологов/Американской ассоциации сердца/Европейского общества кардиологов (American College of Cardiology/American Heart Association/European Society of Cardiology — ACC/AHA/ESC) 2006 г. (The RealiseAF registry, 2010). Основу исследования составила информация о лечении 4947 пациентов с пароксизмальной или персистирующей формами ФП. Полученные результаты весьма интересны. При пароксизмальной форме ФП наиболее часто назначаемыми препаратами были флекаинид, пропафенон и соталол, при персистирующей — амиодарон, что, вероятно, логично. ААП класса IC назначены 11,9% пациентов, однако у 20% из них показания не соответствовали рекомендациям. Соталол назначен 4,4% пациентов, при этом у 16% показания не соответствовали рекомендациям. Амиодарон в качестве терапии первого ряда назначен 25,6% пациентов, при этом у 49,9% не было ни недостаточности кровообращения, ни выраженной гипертрофии ЛЖ.
Побочные эффекты амиодарона
С учетом вышесказанного отметим побочные эффекты длительного применения амиодарона, среди которых выделяют:
1. Кардиальные (блокада сердца, брадикардия, проаритмический эффект).
2. Экстракардиальные:
- эндокринные (дисфункция щитовидной железы). Амиодарон — йодосодержащий препарат, который встраивается в структуру обмена гормонов щитовидной железы. При длительном его применении необходим контроль уровня тиреотропного гормона. Отмена препарата обязательна при развитии амиодарон-индуцированного тиреотоксикоза;
- желудочно-кишечные (диспепсия, повышение уровня печеночных ферментов);
- кожные (изменение цвета кожи, сенсибилизация, облысение);
- неврологические (тремор, атаксия, бессонница);
- разнообразные нарушения зрения;
- поражение легких с развитием так называемой амиодарон-индуцированной легочной токсичности, для которой характерны:
− более частое развитие у мужчин, у лиц, длительно пребывавших на искусственной вентиляции легких (вспомогательное воздействие кислорода в высоких концентрациях вместе с механической вентиляцией легких может стимулировать развитие амиодарон-индуцированной легочной токсичности), а также длительно применявших амиодарон в высоких дозах (при применении в дозе ≥400 мг/сут развивается в 5–15% случаев с пиком через 2 мес, в дозе 200 мг/сут — 2% и >2 лет соответственно), у лиц с бронхолегочной патологией;
− повышение риска развития с возрастом;
− повышение риска развития токсичности амиодарона по мере увеличения его концентрации в плазме крови;
− зависимость от расовых и этнических факторов (например у японцев отмечается в несколько раз чаще, чем в других этнических группах).
Рентгенологическая картина при амиодарон-индуцированной легочной токсичности поражает своей динамикой: буквально в течение 3–4 дней на рентгенологических снимках легких одного и того же пациента можно получить абсолютно разную рентгенологическую картину. Эта патология характеризуется очаговыми или диффузными инфильтратами, обычно двусторонними и нередко мигрирующими. Заболевание сопровождается лихорадкой, лейкоцитозом и достаточно выраженной одышкой. Поэтому перед началом терапии амиодароном больному необходимо сделать контрольный рентгенологический снимок легких и провести спирометрическую оценку функции внешнего дыхания. Пациентам, длительно применяющим амиодарон, следует ежегодно проводить контрольное рентгенологическое обследование легких.
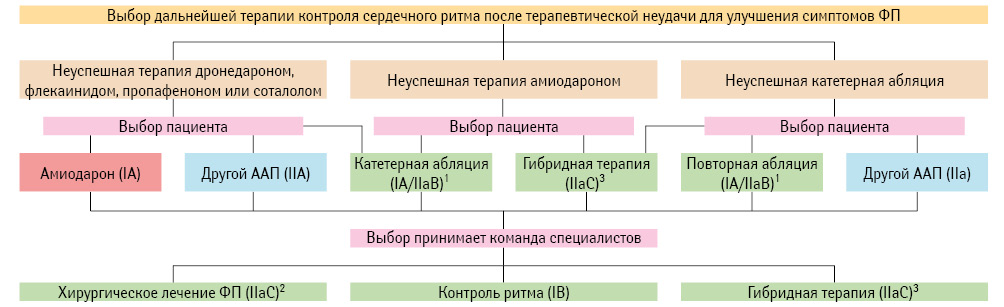
Тактика ведения пациента при терапевтической неудаче
В рекомендациях ESC (2016) предложена четкая тактика ведения пациента при невозможности удержать синусовый ритм на фоне применения ААП (рис. 6). Так, если пациент применял амиодарон, ему необходимо предложить либо катетерную абляцию, либо гибридную терапию. Последняя представляет собой совокупность методик (катетерная абляция, антиаритмическая терапия, хирургия на открытом сердце), совмещение которых дает возможность максимально долго сохранять у пациента синусовый ритм. Если неудача в лечении произошла на фоне применения дронедарона, флекаининда, пропафенона или соталола — следует выбрать либо амиодарон, либо другой ААП из этой же группы, либо прибегнуть к катетерной абляции. В этой ситуации должно быть принято единое решение команды специалистов (так называемая Atrial Fibrillation Heart Team), ведущих пациента.
2Хирургическим лечением ФП может быть изоляция легочных вен (например при пароксизмальной ФП) или лабиринтный метод (например при рефрактерной к терапии или персистирующей/длительно персистирующей ФП).
3Гибридная терапия включает комбинацию ААП, катетерную абляцию и/или хирургическое лечение ФП.
Если пациенту назначен ААП, необходимо периодически оценивать целесообразность его дальнейшего применения (класс рекомендаций IIa), проводить мониторинг ЭКГ, обращая внимание на длительность комплекса QRS и интервала Q–T, выявлять наличие атриовентрикулярной блокады (см. табл. 7). Увеличение продолжительности комплекса QRS на >25% по сравнению с исходным на фоне применения флекаинида должно насторожить, поскольку это явление проаритмогенного эффекта. Этот показатель необходимо проверить до назначения, на следующий день после назначения и через 2–3 дня от начала применения препарата (табл. 8). Чаще доза применяемого флекаинида составляет 50 или 100 мг 2 раза в сутки. Поскольку препарат выводится почками, необходимо принимать во внимание клиренс креатинина: при <50 мл/мин рекомендуют снизить дозу (табл. 9).
| Препарат | Угрожающие признаки, требующие прекращения приема | Замедление проведения в атриовентрикулярном узле | Рекомендуемый мониторинг ЭКГ при инициации терапии |
|---|---|---|---|
| Амиодарон | Удлинение интервала Q–T >500 мс | 10–12 уд./мин при ФП | Исходно, через 1 и 4 нед |
| Дронедарон | |||
| Флекаинид SR | Увеличение продолжительности комплекса QRS на >25% по сравнению с исходным | Нет | – |
| Пропафенон, пропафенон SR | Незначительное | ||
| D- и L-Соталол | Удлинение интервала Q–T >500 мс, удлинение интервала Q–T >60 мс после начала терапии | Аналогичное высокой дозе блокаторов β-адренорецепторов |
| Препарат | Доза | Основные противопоказания и предосторожности |
|---|---|---|
| Флекаинид
Флекаинид SR |
100–150 мг 2 раза в сутки
200 мг 1 раз в сутки |
Снизить дозу при клиренсе креатинина <50 мл/мин, болезнях печени, ишемической болезни сердца или сниженной ФВ ЛЖ. С осторожностью применять при болезни синусового узла, атриовентрикулярного узла и нарушениях проведения. CYP 2D6-ингибиторы (флуоксетин, трициклические антидепрессанты) повышают концентрацию препарата в плазме крови |
| Пропафенон
Пропафенон SR |
150–300 мг 3 раза в сутки
225–425 мг 2 раза в сутки |
Противопоказан при ишемической болезни сердца или сниженной ФВ ЛЖ. С осторожностью применять при болезни синусового узла, атриовентрикулярного узла и нарушениях проведения, нарушении функции почек, печени и при бронхиальной астме. Повышает концентрацию препаратов дигиталиса и варфарина |
| D- и L-cоталол | 80–160 мг 2 раза в сутки | Противопоказан при значительной гипертрофии ЛЖ, систолической СН, бронхиальной астме, существовавшем ранее удлинении интервала Q–T, гипокалиемии, клиренсе креатинина <50 мл/мин. Умеренное нарушение функции почек требует осторожной адаптации дозы |
Тяжесть ФП может нарастать со временем, клиренс креатинина — снижаться, поэтому обязателен мониторинг этого показателя у пациента. Для назначения даты следующего визита к врачу используют формулу:
Клиренс креатинина/10 = количество месяцев до следующего визита к врачу.
Все эти рекомендации подтверждены Советом экспертов на совместном заседании Рабочей группы по нарушениям ритма сердца, Ассоциации кардиологов Украины и Президии ассоциации аритмологов Украины «Мистецтво прийняття обґрунтованих рішень», который состоялся 11–12 октября 2018 г. в Одессе. В них четко прописано, какую противорецидивную терапию следует применять у пациентов, в какой дозе, как использовать схему «таблетка в кармане», какова тактика у пациентов со снижением функции почек и как наблюдать такого пациента в динамике.
Клинический случай № 1
Пациент Р., 57 лет. Применяет флекаинид в дозе 100 мг 2 раза в сутки в связи с пароксизмами ФП. В течение >3 мес на фоне лечения пароксизмы ФП не возникают. В данном случае можно рассмотреть переход на флекаинид в дозе 50 мг 2 раза в сутки.
Клинический случай № 2
Пациент Б., 60 лет. Регулярно применяет флекаинид. В 14:00, после планового утреннего приема препарата в дозе 100 мг, «сорвался» ритм. Пациент, согласно стратегии «таблетка в кармане», принял нагрузочную дозу флекаинида — 200 мг сразу и еще 100 мг через 2 ч (суммарно 300 мг дополнительно к принятой утром дозе) (важно учитывать, что максимальная терапевтическая суточная доза при ФП составляет 300 мг). Поскольку пациент уже принял достаточно высокую дозу препарата, а период его полувыведения составляет 20 ч, вечерний прием флекаинида следует пропустить независимо от восстановления ритма.
Возможна ли комбинация флекаинида с блокаторами β-адренорецепторов?
Достаточно большое количество пациентов применяют блокаторы β-адренорецепторов. Комбинация последних с флекаинидом возможна, что доказано результатами нескольких исследований. В одном из них четко показано, что у пациентов, применявших флекаинид сочетанно с метопрололом, максимально долго сохранялся синусовый ритм (Capucci A. et al., 2016).
Побочные эффекты флекаинида
Побочные эффекты при применении флекаинида отмечают достаточно редко. Среди часто отмечаемых (1–3% пациентов): недомогание, лихорадка, тахикардия, признаки дисфункции синоатриального и/или атриовентрикулярного узлов, диплопия, парестезии, повышенное потоотделение, головокружение, сонливость, шум в ушах, нарушения со стороны желудочно-кишечного тракта и др. Нечасто (<1% пациентов) отмечают отек ротовой полости, артралгию, бронхоспазм, повышение/снижение артериального давления, изменения со стороны системы крови, нервной, дыхательной системы.
Напомним: флекаинид следует применять у пациентов без или с минимально выраженными структурными изменениями миокарда.
Клинический случай № 3
Пациент С., 52 года. Жалобы на «срыв» ритма после сильного стресса на работе. Госпитализирован в отдел аритмий сердца Национального научного центра «Институт кардиологии имени академика Н.Д. Стражеско» с пароксизмом ФП длительностью около 10 ч. Основное заболевание — гипертоническая болезнь II ст., риск умеренный. Переносимость аритмии достаточно тяжелая: III класс ФП по классификации Европейской ассоциации сердечного ритма (European Heart Rhythm Association — EHRA).
Прежде чем определиться с выбором антиаритмической терапии и тактикой ведения данного пациента, необходимо определить наличие у него выраженной структурной патологии сердца или минимальных изменений миокарда либо их отсутствие. С этой целью пациенту проведена эхокардиография, согласно которой выявлены нормальные полости сердца, незначительная гипертрофия ЛЖ и сохранная фракция ЛЖ (то есть минимально выраженные структурные изменения сердца). Это позволило назначить пациенту ААП I класса. Поскольку больной находился в стационаре, пароксизмы ФП у него были редки, применена схема «таблетка в кармане»: флекаинид в дозе 200 мг сразу, еще 100 мг — через 2 ч (суммарно 300 мг).
Результат — синусовый ритм восстановлен с хорошей частотой.
Спустя 4 года у пациента диагностировано онкологическое заболевание почки. В этой ситуации, принимая во внимание путь выделения флекаинида почками, необходимо определить, как и с какой частотой осуществлять контроль клиренса креатинина и при каких его значениях следует снизить дозу флекаинида или отменить прием препарата. Пациент применял флекаинид в дозе 100 мг 2 раза в сутки, однако благодаря достижению высокого эффекта препарата через 3 мес терапии дозу снизили до 50 мг 2 раза в сутки. После диагностики онкопатологии почки выявлено снижение клиренса креатинина, поэтому тактика снизить дозу флекаинида до 50 мг 2 раза в сутки была абсолютно оправданной. Пациент предупрежден, что при необходимости применения «таблетки в кармане» доза флекаинида должна составить 100 мг и через 2 ч — еще 50 мг (нагрузочная доза — 150 мг).
Заключение
Флекаинид обладает высокой эффективностью в аспекте как восстановления синусового ритма с использованием схемы «таблетка в кармане», так и в противорецидивной терапии.
Список использованной литературы
- Alboni P. (2007) «Pill-in-the-Pocket» Approach. In: M.M. Gulizia (Eds.) Current News in Cardiology. Milano, Springer.
- Aliot E., Capucci A., Crijns H.J. et al. (2011) Twenty-five years in the making: flecainide is safe and effective for the management of atrial fibrillation. Europace, 13(2): 161–173.
- Boriani G., Biffi M., Capucci A. et al. (1998) Conversion of recent-onset atrial fibrillation to sinus rhythm: effects of different drug protocols. Pacing. Clin. Electrophysiol., 21(11 Pt. 2): 2470–2474.
- Capucci A., Lenzi T., Boriani G. et al. (1992) Effectiveness of loading oral flecainide for converting recent-onset atrial fibrillation to sinus rhythm in patients without organic heart disease or with only systemic hypertension. Am. J. Cardiol., 70(1): 69–72.
- Capucci A., Piangerelli L., Ricciotti J. et al. (2016) Flecainide-metoprolol combination reduces atrial fibrillation clinical recurrences and improves tolerability at 1-year follow-up in persistent symptomatic atrial fibrillation. Europace, 18(11): 1698–1704.
- Cardiac Arrhythmia Suppression Trial II Investigators (1992) Effect of the antiarrhythmic agent moricizine on survival after myocardial infarction. N. Engl. J. Med., 327(4): 227–233.
- Crijns H.J., Bash L.D., Chazelle F. et al. (2012) RHYTHM-AF: design of an international registry on cardioversion of atrial fibrillation and characteristics of participating centers. BMC Cardiovasc. Disord., 12: 85.
- Crijns H.J., Weijs B., Fairley A.M. et al. (2014) Contemporary real life cardioversion of atrial fibrillation: Results from the multinational RHYTHM-AF study. Int. J. Cardiol., 172(3): 588–594.
- Echt D.S., Liebson P.R., Mitchell L.B. et al. (1991) Mortality and morbidity in patients receiving encainide, flecainide, or placebo. The Cardiac Arrhythmia Suppression Trial. N. Engl. J. Med., 324(12): 781–788.
- Kirchhof P., Benussi S., Kotecha D. et al.; ESC Scientific Document Group (2016) 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur. Heart J., 37(38): 2893–2962.
- Lown B., Wolf M. (1971) Approaches to sudden death from coronary heart disease. Circulation, 44(1): 130–142.
- McNamara R.L., Bass E.B., Miller M.R. et al. (2000) Management of new onset atrial fibrillation. Evid. Rep. Technol. Assess. (Summ.), 12: 1–7.
- Romano S., Fattore L., Toscano G. et al. (2001) Effectiveness and side effects of the treatment with propafenone and flecainide for recent-onset atrial fibrillation. Ital. Heart J. Suppl., 2(1): 41–45.
- The ESVEM Investigators (1989) The ESVEM trial. Electrophysiologic Study Versus Electrocardiographic Monitoring for selection of antiarrhythmic therapy of ventricular tachyarrhythmias. Circulation, 79(6): 1354–1360.
- The RealiseAF registry (2010) An international, observational, cross-sectional survey evaluating atrial fibrillation management and the cardiovascular risk profile of AF patients initial results (http://spo.escardio.org/eslides/view.aspx?eevtid=40&fp=5080).
- Waldo A.L., Camm A.J., deRuyter H. et al. (1996) Effect of d-sotalol on mortality in patients with left ventricular dysfunction after recent and remote myocardial infarction. The SWORD Investigators. Survival With Oral d-Sotalol. Lancet, 348(9019): 7–12.
Информация для специалистов сферы здравоохранения
1-13-ФЛК-РЕЦ-0219
*Данная схема применения препарата базируется на личном опыте автора лекции. Согласно международным рекомендациям, суточная доза флекаинида для лечения ФП составляет 300 мг.