ВСТУП
Мозковий інсульт — це не окремий синдром, а сукупність різних ушкоджень, які є наслідком гострого порушення мозкового кровообігу і визначають об’єм неврологічних порушень: мовних, рухових, чутливих, координаторних тощо. До таких розладів слід віднести і нейрогенну дисфагію, яка досить часто виникає в разі розвитку стовбурових і півкульних інсультів внаслідок ураження ковтальних центрів у мозковому стовбурі або залучення до патологічного процесу кірково-ядерних шляхів однієї чи обох півкуль великого мозку (Buchholz D.W., 1993; Hamdy S. et al., 1997; Bakheit A.M., 2001; Виничук С.М. и соавт., 2005).
За даними літератури від порушення ковтання в гострий період мозкового інсульту страждає від 22 до 65% хворих, які поступають на стаціонарне лікування (Gordon C. et al., 1987; Barer D.H., 1989; Kidd D. et al., 1993; Davenport R.J. et al., 1995; Daniels S.K. et al., 1998). Дисфагія очікувано проявляється у понад 50% пацієнтів, які перебувають на етапі реабілітації після інсульту, причому приблизно 11% з них потребують призначення зондового харчування (Ickenstein G.W. et al., 2005). Тому очевидним є той факт, що дисфагія негативно впливає на якість життя пацієнта після інсульту і призводить до ускладнень з боку респіраторної системи (аспіраційна пневмонія), зумовлює зневоднення, порушення енергетичного обміну, патологічне схуднення, поглиблення ступеня інвалідизації (Barer D.H., 1989; Buchholz D.W., 1993; Holas M.A. et al., 1994; Ramsey D.J. et al., 2003). Рівень смертності пацієнтів з дисфагією після перенесеного інсульту варіює в межах від 20 до 24% для осіб зі стабільним зондовим харчуванням (Ickenstein G.W. et al., 2005). Разом з тим смертність хворих у цьому разі більше пов’язана з тяжкістю інсульту, ніж власне з проблемами порушення ковтання.
Безумовно, нейрогенна дисфагія погіршує перебіг мозкового інсульту, оскільки дегідремія, зневоднення може збільшити неврологічний дефіцит у хворих з тяжкими півкульними та стовбуровими інсультами (Віничук С.М., Прокопів М.М., 2006). Цілком закономірно в рекомендаціях Європейської ініціативи з профілактики та лікування інсульту (EUSI — European Stroke Initiative) пропонується обов’язково перевіряти ковтальну функцію в усіх пацієнтів, які перенесли мозковий інсульт, а лікування має передбачати заходи щодо корекції дисфагії та забезпечення відповідного харчування як важливої складової базисної терапії інсульту (Hack W. et al., 2003). Однак, незважаючи на частоту і тяжкість наслідків недіагностованої дисфагії, лікарі-неврологи часто не оцінюють ковтальну функцію і здатність до самостійного перорального харчування пацієнтів у гострий період мозкового інсульту, в більшості випадків не виявляють хворих із легеневою аспірацією. Це може бути особливо важливим, оскільки прихована (асимптомна) аспірація — вагомий чинник ризику розвитку ускладнень (Holas M.A. et al., 1994; Ramsey D.J. et al., 2003). Їх можна уникнути в тому разі, якщо нейрогенна дисфагія буде своєчасно виявлена та адекватно пролікована. Звичайно, це залежить від уважності лікаря і застосування сучасних методів діагностики.
Для оцінки порушень акту ковтання у пацієнта після перенесеного мозкового інсульту перевага надається клінічним методам обстеження безпосередньо біля ліжка хворого. Об’єктивне виявлення проявів нейрогенної дисфагії матиме важливе значення для визначення заходів невідкладної допомоги, спрямованої на відновлення та стабілізацію життєво важливих функцій організму і забезпечення адекватного перорального харчування незалежно від виду інсульту.
Фізіологія ковтання
Як відомо, ковтання — це складний рефлекторний акт, який забезпечує транспорт їжі з ротової порожнини у шлунок. У дорослої людини в фізіологічних умовах ковтання частіше відбувається під час прийому їжі, але ковтальні акти спостерігаються і в період між її прийомами. Загальна середня кількість актів ковтання за день становить близько 1200, з них співвідношення між прийомом їжі та ковтанням рідини становить 600:200. До того ж 350 актів ковтання відбувається без прийому їжі, а під час сну їх кількість може досягати 50. Ковтальна функція забезпечується комплексною та координованою дією орального нервово-м’язового апарату завдяки послідовному здійсненню ланцюга рефлексів. До того ж початкова рефлекторна реакція стає сигналом для включення наступного рефлексу (Ганонг В.Ф., 2002; Patti F. et al., 2002).
Ще на початку ХІХ ст. французький фізіолог Ф. Мажанді (F. Magendie) розділив акт ковтання на три взаємопов’язані фізіологічні стадії: ротову довільну; глоткову мимовільну, яка здійснюється швидко; стравохідну мимовільну, яка проходить повільно. Такий погляд на механізм акту ковтання і дотепер розділяє більшість дослідників (Bakheit A.M., 2001; Patti F. et al., 2002; Ramsey D.J. et al., 2003; Ickenstein G.W. et al., 2005).
Ротова стадія ковтання розпочинається довільними рухами щік, язика, щелеп і забезпечує пережовування, обробку їжі та подальше формування харчової грудки. Сформована певних розмірів та консистенції харчова грудка рухами щік та язика переміщується на спинку останнього, а відтак скороченнями м’язів його передньої та середньої третин переправляється до отвору глотки. Ця частина ковтального процесу довільна. Після переміщення харчової грудки на рівень піднебінних дужок скорочення м’язів стають мимовільними, керованими ковтальним рефлексом. Включення в роботу каскаду ковтальних рефлексів зумовлене подразненням рецепторів слизової оболонки піднебіння і глотки харчовою грудкою та її протидією силі м’язів на різних рівнях. Рефлекторні механізми здійснюються за рахунок ланцюга нейронів — рефлекторної дуги: чутливі волокна ІХ та Х пар черепних нервів, чутливе ядро одиночного шляху (nucleus tractus solitarius), спільне з VII парою черепних нервів; переключення на еферентні шляхи: рухове подвійне ядро (nucleus ambiguus) та рухові волокна ІХ та Х пар черепних нервів.
Глоткова стадія ковтання розпочинається рефлекторним скороченням м’язів піднебіння і глотки. М’яке піднебіння посувається назад і підіймається, наближаючись своїм краєм до задньої стінки глотки, таким чином утворюючи перегородку між ротовою та носовою порожнинами. Одночасне скорочення верхнього стискувача глотки притискує до піднебіння бічні та задню її стінки. Внаслідок таких поєднаних рухів носоглотка відділяється від середньої частини глотки. Скоординована рефлекторна взаємодія травної та дихальної систем попереджає потрапляння харчової маси у носоглотку, дихальні шляхи, вічко євстахієвих труб. На цьому етапі глоткова стадія ковтання супроводжується короткочасним припиненням дихання (ковтальне апное). Закінчується вона подовженим видихом для попередження виникнення прихованої аспірації. Після потрапляння в глотку харчової грудки виникає послідовне скорочення середнього та нижнього стискувачів, якими вона проштовхується в бік стравоходу.
Ковтальний рефлекс зумовлює розслаблення крікофарингеального сфінктера, започатковуючи перехід до наступної стравохідної (мимовільної) стадії акту ковтання. У цьому разі гортань опускається вниз, відновлюється дихання, а харчова грудка під впливом перистальтичних скорочень м’язів стравоходу та гравітації переміщується вниз до шлунку з середньою швидкістю 4 см/с (Ганонг В.Ф., 2002). У разі наповнення шлунку тонус м’язів його кардіального відділу підвищується, що запобігає процесу зворотного закидання шлункового вмісту в стравохід (Perlman A.L., Schulze-Delrieu K.S. (Eds.), 1997).
Довільна регуляція акту ковтання забезпечується білатеральним супрануклеарним впливом кіркових центрів ковтання: передцентральна звивина, лобно-тім’яна покришка, премоторна кора, передня ділянка острівця (Daniels S.K., Foundas A.L., 1999). Найважливішим центром у моторній корі, що ініціює ковтальний процес, вважають ділянку кори, розташовану дещо попереду від зони кіркової іннервації руки (Hamdy S. et al., 1997; Daniels S.K., Foundas A.L., 1999).
Стовбурові центри ковтання локалізуються в дорсолатеральній ділянці довгастого мозку (чутливе ядро одиночного шляху, рухове подвійне ядро) та в сітчастій формації мозкового стовбура (Jean A., Car A., 1979). Остання здійснює інтеграцію сигналів і забезпечує скоординовану дію багатьох м’язів, які беруть безпосередню участь в акті ковтання.
Деякі автори (Kennedy J.G. 3rd, Kent R.D., 1988) у ковтальному процесі виділяють три рівні фізіологічної організації:
- формування харчової грудки та її протидія силі м’язів на різних стадіях ковтального процесу;
- послідовне здійснення ланцюга безумовних рефлексів на рівні стовбура мозку, циркуляція імпульсів у нейрональних субкортикальних ланцюгах;
- низхідна кортикальна модуляція, що модифікує процес ковтання.
Отже, ротова початкова стадія механізму ковтання розпочинається довільно внаслідок супрабульбарного подразнення кіркових відділів (Martin R.E., Sessle B.J., 1993). В подальшому акт ковтання стає незалежним та мимовільним. Кора головного мозку лише активує нейрональні центри довгастого мозку (Miller A. et al., 1997), які контролюють периферичний нервово-м’язовий апарат ковтального процесу. Безпосередньо функція ковтання реалізується завдяки складній упорядкованій динамічній взаємодії різних функціональних систем.
Патофізіологія нейрогенної дисфагії
Дисфагія (від грец. dys — префікс, що надає слову протилежного значення, phagein — ковтати, поглинати) — це порушення фізіологічного акту ковтання. Утруднення ковтання або повна його неможливість (афагія) виникають у разі ураження периферичних мотонейронів ІХ, Х, ХІІ пар черепних нервів, тобто їх ядер або корінців. Симптомокомплекс розладів, що виникає за таких умов, носить назву бульбарного паралічу. Клінічна картина із симптомами дисфагії та дизартрії, гугнявим «носовим» відтінком голосу, порушенням руху язика може виникати і за умови двобічного ураження центральних мотонейронів або кортико-нуклеарних шляхів, які йдуть до ядер ІХ, Х, ХІІ пар черепних нервів, що зумовлює розвиток псевдобульбарного паралічу. Ураження чутливого іннерваційного апарату на різних рівнях також призводить до розвитку дисфагії внаслідок порушення взаємозв’язку між окремими ланками ковтального акту.
Отже, нейрогенна дисфагія спостерігається як у разі локалізації патологічного процесу в ділянці мозкового стовбура, так і за умови двобічного пошкодження півкуль великого мозку. Виявляється при органічних ураженнях головного мозку різного генезу (судинних, запальних, пухлинних, дегенеративних тощо). Моторні розлади у разі розвитку постдифтерійної полінейропатії, порушення нервово-м’язової провідності (міастенія, синдром Ітона — Ламберта) також супроводжуються проявами дисфагії.
Порушення ковтання при неврологічних захворюваннях здебільшого пов’язані з ротоглотковою стадією ковтального акту, але іноді нейрогенна дисфагія може виникати внаслідок ушкодження іннервації стравоходу (Bakheit A.M., 2001).
Найчастіше нейрогенна ротоглоткова дисфункція виникає при гострому мозковому інсульті. До того ж, за даними деяких авторів (Hamdy S. et al., 1997), з однаковою частотою маніфестує як у разі ураження мозкового стовбура, так і за умови двобічного пошкодження півкуль великого мозку.
Однобічна цереброваскулярна подія асоціюється з дисфагією значно рідше, ніж двобічна, що пов’язано з білатеральним представництвом кортикальних центрів ковтання в моторній корі. Принагідно зауважимо, що правопівкульне ушкодження головного мозку спричиняє більш значний ступінь розвитку порушення ковтання і вищий ризик аспірації, ніж лівопівкульне, яке здебільшого асоціюється з апраксією та розладами мови (Ickenstein G.W. et al., 2005).
Вартим уваги є повідомлення деяких авторів (Smithard D.G. et al., 1997) про те, що довготривале порушення ковтання (понад 6 міс після інсульту) досить часто пов’язане із залученням до патологічного процесу правої тім’яної частки головного мозку (Bakheit A.M., 2001). На жаль, автори не дають патофізіологічної трактовки розвитку тривалих дисфагічних порушень за умови подібної локалізації вогнища ураження.
Описані випадки ізольованих проявів дисфагії без ознак інших неврологічних порушень при ураженні перфорівних артерій із розвитком лакунарних інфарктів у перивентрикулярній білій речовині півкуль великого мозку (Celifarco A. et al., 1990). На наш погляд, такі порушення можуть проявлятися в разі виникнення повторних лакунарних інфарктів в обох півкулях головного мозку з подальшим формуванням лакунарного стану (status lacunaris) як прояву гіпертонічної енцефалопатії. Разом з тим ураження окремої парамедіанної гілки основної артерії чи хребтових артерій на фоні артеріальної гіпертензії іноді супроводжується ізольованими проявами дисфагії (Buchholz D.W., 1993). Такі порушення, безумовно, є результатом розвитку осередку лакунарного інфаркту в довгастому мозку. Як відомо, будова стовбура мозку має таку особливість: у ньому компактно локалізуються життєво важливі нервові центри, ядра та сітчаста формація. Тому навіть мінімальне ушкодження стовбурових структур проявляється значним неврологічним дефіцитом, складовою якого зазвичай є дисфагія.
Гострі порушення мозкового кровообігу з локалізацією осередку інфаркту або інсульт-гематоми в півкулях мозочка також часто супроводжується нейрогенною дисфагією (Bakheit A.M., 2001). Мозочкова патологія здебільшого зумовлює дисфункцію ротової фази ковтального акту, причиною якої є дискоординація діяльності м’язів лиця та язика.
Таким чином, патофізіологія нейрогенної ротоглоткової дисфагії тісно взаємопов’язана з анатомічною та функціональною організацією нейронних систем, розташованих на різних рівнях центральної та периферичної нервової системи, пов’язаних з аферентними та еферентними функціями і реалізацією рефлекторного ковтального процесу.
Мета дослідження — з використанням клінічних критеріїв оцінити порушення акту ковтання у пацієнтів з нейрогенною дисфагією після перенесеного мозкового інсульту і обґрунтувати механізми її виникнення залежно від локалізації ішемічного чи геморагічного осередку ураження.
ОБ’ЄКТ і МЕТОДИ ДОСЛІДЖЕННЯ
Проведено клінічне обстеження та магнітно-резонансну томографію (МРТ) у 61 хворого віком від 32 до 88 років (середній вік — 63,9±1,6 року) з порушенням акту ковтання після перенесеного мозкового інсульту. Чоловіків було 38, жінок — 23. Залежно від типу інсульту обстежених розподілили на дві підгрупи: 1-ша — 50 пацієнтів (середній вік — 64,0±1,6 року), у яких нейрогенна дисфагія виникла після ішемічного інсульту; друга — 11 хворих (середній вік — 60,6±2,9 року), порушення ковтання у яких було зумовлене гострим розвитком внутрішньомозкового крововиливу (ВМК). Основною причиною порушення мозкового кровообігу була артеріальна гіпертензія в поєднанні з атеросклерозом судин (73,8%), що у 13,1% випадків ще поєднувалась із цукровим діабетом; у 26,2% обстежених основним етіологічним фактором захворювання був атеросклероз. Діагноз «мозковий інсульт» встановлювали за даними клініко-неврологічного обстеження, а також спіральної комп’ютерної томографії (СКТ) та МРТ. Хворі були госпіталізовані в перші 6–24 год після розвитку інсульту.
Ступінь порушення неврологічних функцій оцінювали на час госпіталізації при півкульних інсультах за шкалою Національного інституту інсульту США (National Institutes of Health Stroke Scale — NIHSS) (Biller J. et al., 1990), у разі стовбурових — за допомогою шкали B. Hoffenberth та співавторів. Для визначення ступеня порушення свідомості використовували шкалу ком Глазго (ШКГ). Підтипи ішемічного інсульту виділяли відповідно до класифікації, запропонованої групою з вивчення цереброваскулярних захворювань Національного інституту інсульту США (Adams H.P. Jr et al., 1993). Оцінку порушення функції ковтання та харчування починали з уважного огляду ротової порожнини стосовно очищення її від часток їжі. Наявність нейрогенної дисфагії встановлювали біля ліжка хворого, використовуючи тест «пробного ковтання» (Nathadwarawala K.M. et al., 1992). Тестування полягає у вимірюванні швидкості ковтання води: хворому в положенні сидячи пропонували проковтнути 150 мл прохолодної води. Швидкість ковтання <10 мл/с свідчила про наявність дисфагії. Цей тест визнано достатньо чутливим і достовірним (Ramsey D.J. et al., 2003).
Оцінку ступеня вираженості нейрогенної дисфагії проводили за розробленою нами спеціалізованою шкалою оцінки функції ковтання. Ця шкала включає розгляд і оцінку 7 клінічних ознак, пов’язаних із ковтанням: важкість ініціації акту ковтання; затримка проходження їжі в ротовій порожнині; затримка проходження їжі в глотці; назальна регургітація (потрапляння їжі в носову порожнину); кашель під час прийняття їжі та ознаки легеневої аспірації; зниження здатності управління слиновиділенням; порушення мови (невиразна «булькаючи» мова). Згідно з цією шкалою кожну з клінічних ознак оцінювали за 5-значною градацією в балах від найвищої функціональності — 5 балів, до найнижчої — 1 бал. Максимальна сума балів за цією шкалою — 35. Запропонована шкала характеризує нормальний стан ковтання; незначні порушення функції ковтання; помірну ступінь порушення; значні порушення ковтання; повну втрату ковтальної функції. Сумарний бал клінічних проявів від 33 до 35 свідчить про функціональну незалежність акту ковтання, 7 балів — про повну втрату функції ковтання.
Усім хворим проводили стандартні лабораторні тести: дослідження рівня глюкози крові, сечовини, гематокриту, фібриногену, показників коагуляційних властивостей крові; здійснювали моніторинг АТ, електрокардіографію, ультразвукову допплєрографію, транскраніальну допплєрографію. Статистична обробка матеріалу включала використання двовибіркового критерію Стьюдента.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Клініко-нейровізуалізаційний аналіз пацієнтів з гострим мозковим інсультом свідчить, що у 39 обстежених порушення мозкового кровообігу виникало за ішемічним типом в судинах вертебрально-базилярного басейну (ВББ), ще в 11 — у каротидному. З урахуванням калібру ураженої артерії та за критеріями TOAST (Trial of ORG 10172 in Acute Stroke Treatment) (Grau A.J. et al., 2001) всі інфаркти у ВББ були нелакунарними. За патогенетичними механізмами розвитку задньоциркулярні інсульти були таких підтипів: кардіоемболічний (n=10), атеротромботичний (n=26), гемодинамічний (n=1). У 2 пацієнтів не з’ясовано механізм розвитку інсульту.
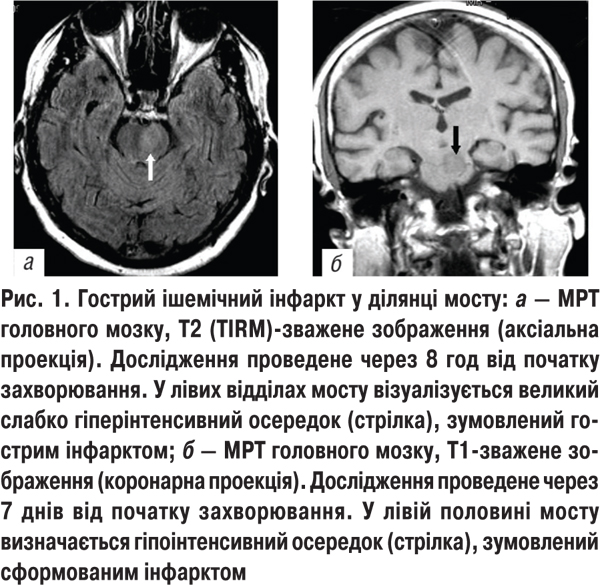
Частота локалізації ішемічного інфаркту у ВББ, верифікованого методами нейровізуалізації, була різною. Найчастіше осередки інфаркту виявляли у ділянці мосту (88,5%) (рис. 1), рідше — у ділянці мозочка (7,7%), ніжок мозку (5,1%). У багатьох обстежених задньоциркулярні інфаркти зумовлювались багатоосередковим ураженням: довгастий мозок і півкулі мозочка (30,8%) (рис. 2), різні відділи стовбура головного мозку і півкуль мозочка, потиличної та лобної часток мозку (15,3%), півкулі мозочка і таламус (2,6%).
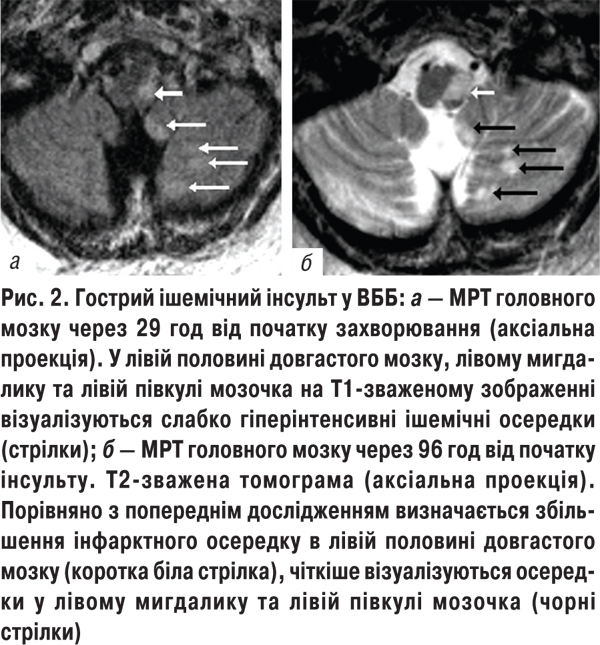
Клінічна картина інфарктів у ВББ була гетерогенною і залежала від рівня ураження артеріального русла та локалізації ішемічного осередку. Найчастіше виявлялися неврологічні синдроми, які супроводжувалися або поєднувалися з нейрогенною дисфагією та мозочковими симптомами: альтернувальний синдром Валленберга — Захарченко — у 8 пацієнтів, варіанти цього синдрому — у 3, альтернувальні синдроми Мійяра — Гублера — у 4, Фовілля — у 3, Вебера — у 2 хворих. Бульбарний синдром або його компоненти спостерігалися у 20 пацієнтів, псевдобульбарний — у 2.
Ішемічні інфаркти в каротидному басейні діагностували у 11 пацієнтів, з них у 10 вони були зумовлені ураженням артерій великого (у 3) і середнього (у 7) калібру (макроангіопатії), ще в 1 пацієнта — ураженням внутрішньочерепних судин дрібного калібру (мікроангіопатії). За механізмом розвитку виділяли такі підтипи передньоциркулярного ішемічного інсульту: атеротромботичний — у 5 хворих, кардіоемболічний — у 4, гемодинамічний і лакунарний — по 1 пацієнту відповідно.
У 2 хворих каротидні інфаркти, асоційовані з нейрогенною дисфагією, локалізувалися в правій півкулі великого мозку, у 3 — в лівій, у 5 пацієнтів — в обох півкулях головного мозку. Ще в одному випадку ураження було багатоосередковим: лакунарні інфаркти виявляли в ділянці заднього стегна внутрішньої капсули справа, правої ніжки мозку і семіовальних центрах півкуль. Локалізація передньоциркулярних інфарктів зумовлювала розвиток характерних неврологічних синдромів: псевдобульбарного — у 6 хворих, агностичного (анозогнозія) — у 2, апрактичного (апраксія, оральна дисфункція) — у 3 обстежених.
У 11 пацієнтів розлади акту ковтання виникли після розвитку геморагічного інсульту, з них у 4 обстежених виявлена правопівкульна латеральна (у 2) і кортикальна (у 2) внутрішньомозкова гематома (ВМГ), у 4 — стовбурова гематома у ділянці мосту, у 2 випадках — крововиливи в обох півкулях головного мозку, ще в 1 пацієнта ВМГ у півкулі мозочка поєднувалась з енцефаломаляцією в обох півкулях головного мозку. ВМК зумовлював розвиток псевдобульбарного синдрому у 3 хворих, бульбарного — у 4, агностичного — у 4 обстежених.
Отже, в групу аналізу ми включили хворих з різними видами мозкового інсульту, асоційованого з дисфагією, різною локалізацією осередку ураження: півкульна — у 18 пацієнтів (правопівкульна — у 6, лівопівкульна — у 3, двопівкульна — у 9); стовбурова — у 20 (міст — у 18, ніжка мозку — у 2); мозочкова — у 3; ще у 20 обстежених спостерігалось багатоосередкове ішемічне або геморагічне ураження стовбура мозку, півкуль головного мозку і мозочка. Саме локалізація ішемії чи геморагії і тяжкість інсульту здебільшого визначали об’єм неврологічного дефіциту і його вплив на функцію ковтання.
Вихідний рівень неврологічного дефіциту за шкалою NIHSS у 18 хворих із супратенторіальним інсультом (ішемічним і геморагічним) в середньому становив 11,9±0,52 бала, що відповідало середньому ступеню тяжкості: у 4 випадках порушення були тяжкими, у 3 — надто тяжкими, у 11 — середнього ступеня тяжкості. Свідомість була порушена у 3 пацієнтів — сопор (10,7±1,02 бала за ШКГ). Об’єм ВМГ у 7 хворих коливався від 3 до 15 см3 (в середньому — 6,64±1,75 см3).
Звичайно, складовою частиною післяінсультного неврологічного дефіциту в усіх пацієнтів були розлади функції ковтання, здебільшого пов’язані з ротоглотковою фазою. Фоновий рівень нейрогенної дисфагії за розробленою нами шкалою оцінки функції ковтання становив у середньому 21,3±0,78 бала, що свідчило про помірні порушення функції ковтання: у 5 хворих порушення були значними, у 9 — помірними, у 4 — незначними.
Нейрогенна дисфагія після розвитку супратенторіального мозкового інсульту найчастіше (у 9 випадках) виникала за умови двобічного ураження кірково-ядерних шляхів, що йдуть від ковтальних кіркових центрів до ядер нервів бульбарної групи. З цієї причини виникали також порушення фонації, артикуляції, іноді — насильні плач та сміх (складові симптоми псевдобульбарного синдрому). У 6 пацієнтів із псевдобульбарним синдромом порушення мозкового кровообігу в обох півкулях мозку були верифіковані методами нейровізуалізації. Ще у 3 хворих порушення функції судинної системи і нейрональних утворів протилежної від осередку ураження півкулі мозку була зумовлена негативними рефлекторними впливами, а також пов’язаним з ними трансгемісферальним діашизом.
Однобічні півкульні ураження викликали дисфагію не так часто як двобічні, що пояснюється білатеральним представництвом кортикальних центрів ковтання в моторній корі. Водночас у літературі описані випадки довготривалої дисфункції ковтання та підвищеного ризику аспірації після гострого мозкового інсульту в разі залучення до патологічного процесу правої тім’яної частки головного мозку. З іншого боку, лівобічне півкульне ушкодження призводить до високого ступеня оральної дисфункції.
На нашу думку, дисфункція ковтання після інсульту з однобічним гемісферним ураженням тісно взаємопов’язана з філогенезом нервової системи і проблемою латералізації мозкових функцій. Відомо, що фізіологічний акт ковтання пов’язаний із стародавніми функціями головного мозку, які мають представництво в обох півкулях. До того ж необхідно зазначити, що ступінь локалізованості ковтальних функцій кори півкуль неоднаковий. Кіркові функції ковтання онтогенетично більш тісно пов’язані з правою півкулею головного мозку. Водночас старіші філогенетичні функції стійкіші, ніж еволюційно молодші. З іншого боку, права півкуля мозку функціонально пов’язана із сприйманням і переробкою екстероцептивних, пропріоцептивних та інтероцептивних імпульсів, що забезпечує здійснення філогенетично новіших гностичних функцій. Відома також роль тім’яної частки правої півкулі у сфері візуально-просторових відносин, в управлінні емоційно-вольовим станом, мотивацією. Тому при її ураженні у пацієнтів втрачається відчуття просторового сприйняття навколишнього світу, положення власного тіла, виникає неусвідомлення свого дефекту (анозогнозія), апатія, утруднення ініціації акту ковтання, відчуття страху, побоювання легеневої аспірації. Висловлюється припущення, що за умови правопівкульного ураження права півкуля головного мозку не може «надсилати» інформацію про функцію організму до лівої півкулі (Starkstein S.E. et al., 1990; Adair J.C. et al., 1997). У такому разі порушується взаємодія між гнозисом і праксисом (С.М. Віничук). Безумовно, такі патофізіологічні процеси подовжують ініціацію акту ковтання, негативно впливають на процес ковтання та його відновлення на фоні терапії.
За нашими даними мозкові інсульти з однобічним великовогнищевим правопівкульним ушкодженням тім’яної частки мозку спричиняли порушення ковтання і повільніше його відновлення у 6 випадках. Такі неврологічні порушення можна також пояснити, виходячи із принципів філогенетичного розвитку нервової системи і вчення К.І. Монакова про диссолюцію (від лат. dissolutio — розкладання на складові частини) функцій: у разі великих правопівкульних осередків спочатку випадає функція новіших філогенетичних систем (гностичних), а відтак і старіших (ковтальних). У процесі відновлення неврологічних функцій К.І. Монаков велике значення також надавав філогенетичній давності її елементів (Маньковский Б.Н., 1935).
Інший механізм виникнення порушення ковтання в разі лівопівкульної локалізації осередку ураження після мозкового інсульту. Нейрогенна дисфагія в такому разі (3 спостереження) була проявом щічно-язикової апраксії внаслідок ураження нижніх відділів тім’яної частки лівої півкулі великого мозку. За таких умов одночасно спостерігалася важкість рухів мовних м’язів, зокрема губ, язика, щік (оральна кінестетична апраксія), що завжди поєднувалася з моторною аферентною афазією. Могла одночасно виникати оральна і артикуляційна кінетична апраксія.
Клінічна картина інсультів у вертебрально-базилярному басейні (43 хворих) за шкалою B. Hoffenberth та співавторів відповідала тяжким неврологічним порушенням — 23,3±0,72 бала: у 16 випадках неврологічний дефіцит був середнього ступеня тяжкості, у 27 — тяжким. Задньоциркулярні інсульти частіше, ніж передньоциркулярні, супроводжувались розладами свідомості: сопор — у 6 пацієнтів (10,3±0,49 бала за ШКГ); кома — у 5 хворих (7,4±0,19 бала за ШКГ). Об’єм гематоми у 4 пацієнтів становив 5,5±1,21 см3.
Гострі порушення мозкового кровообігу у ВББ у 37 хворих (86%) зумовлювали розвиток бульбарного синдрому, у 3 — псевдобульбарного, ще у 3 пацієнтів переважали мозочкові порушення з бульбарними розладами. Бульбарний синдром здебільшого виникав при ураженні довгастого мозку, моста, рідше — ніжок мозку і поєднувався з характерною стовбуровою симптоматикою та мозочковими порушеннями. Псевдобульбарний синдром у 2 випадках був зумовлений двобічним ураженням коротких огинаючих артерій основної артерії, ще в 1 — розвитком інфарктних вогнищ в обох півкулях головного мозку після ВМК у гемісферу мозочка.
Фоновий рівень нейрогенної дисфагії після інсульту у ВББ становив 16,0±0,83 бала, тобто відповідав значним порушенням функції ковтання: у 7 пацієнтів акт ковтання був повністю втрачений, у 19 — порушення ковтання були значними; у 14 — помірними і лише у 3 випадках — незначними.
Ураження стовбура головного мозку після перенесеного мозкового інсульту, що проявлялося бульбарним синдромом, здебільшого впливало на ротову фазу ковтального процесу. Подібні порушення акту ковтання (недостатня обробка їжі в ротовій порожнині, утруднення подальшого транспорту харчової грудки) спостерігалися і за умови білатерального супратенторіального ушкодження при каротидних інсультах. У разі ураження довгастого мозку виникала також затримка транзиту їжі через глотку, тобто порушення ковтання було пов’язане не тільки з ротовою, але й з глотковою фазою. Мозочкова патологія перш за все зумовлювала дискоординацію діяльності ротових та лицевих м’язів і негативно впливала на ротову стадію ковтального процесу. При багатоосередковому ураженні нейрогенна дисфагія була зумовлена поєднаною дією різних механізмів, які синергічно впливали на різні стадії акту ковтання.
Отже, проведене дослідження показало, що після стовбурових і півкульних інсультів виникають дисфагічні порушення різного ступеня тяжкості: повна втрата функції ковтання з необхідністю зондового харчування — у 11,5% пацієнтів; значні порушення ковтання — у 39,3%; помірні — у 37,7% і незначні дисфагічні розлади — у 11,5% випадків.
ВИСНОВКИ
Нейрогенна дисфагія — достатньо поширена патологія серед пацієнтів після перенесеного гострого мозкового інсульту; її виникнення не залежить від виду інсульту, а взаємозв’язано з локалізацією осередку ураження і тяжкістю захворювання.
Порушення ковтання здебільшого виникає у пацієнтів з кардіоемболічним та атеротромботичним підтипами ішемічного інсульту; в окремих випадках дисфагія буває ізольованою чи поєднаною з іншими неврологічними симптомами лакунарного інфаркту мозку.
Нейрогенна дисфагія найчастіше буває проявом бульбарного синдрому в разі розвитку стовбурового інсульту, а також псевдобульбарного синдрому за умови виникнення супратенторіального інсульту з двобічним півкульним ураженням.
Однобічні півкульні ушкодження після інсульту призводять до розвитку нейрогенної дисфагії рідше, що пояснюється білатеральним представництвом кортикальних центрів ковтання в моторній корі.
Порушення акту ковтання після гострого інсульту з однобічним півкульним ураженням взаємозв’язано з філогенезом нервової системи та концепцією латералізації мозкових функцій: гностичних, пов’язаних з правою півкулею головного мозку, і праксичних — з лівою.
Довготривала дисфагія та підвищення ризику аспірації після мозкового інсульту з локалізацією вогнища ураження у правій тім’яній частці головного мозку пояснюється порушенням взаємодії між гнозисом і праксисом, тобто агностично-апраксичними розладами.
Виявлено взаємозв’язок між локалізацією інсультного осередку і стадією розвитку нейрогенної дисфагії: ураження стовбура головного мозку або двобічне ушкодження кірково-ядерних шляхів після мозкового інсульту, а також осередки у ділянці мозочка негативно впливають на ротову стадію ковтального процесу; водночас порушення мозкового кровообігу в ділянці довгастого мозку не тільки зумовлює дисфункцію ротової стадії, а й призводить до затримки транспорту харчової грудки через глотку, тобто викликає дисфункцію глоткової стадії акту ковтання; однобічне ушкодження тім’яної частки правої півкулі головного мозку негативно впливає на ініціацію акту ковтання, ковтальний процес загалом та його відновлення; лівобічне півкульне ураження зумовлює дисфункцію оральної стадії ковтання.
Проведене дослідження свідчить, що обов’язкова перевірка ковтальної функції в усіх пацієнтів з мозковим інсультом має важливе значення для вибору програми лікування, попередження ускладнень з боку респіраторної системи, забезпечення соціальної реабілітації та незалежної життєдіяльності пацієнта.
ЛІТЕРАТУРА
- Виничук С.М., Ялынская Т.А., Виничук И.С. (2005) Инфаркты в вертебрально-базилярном бассейне: клиника и диагностика. Междунар. невролог. журн., 3: 13–21.
- Віничук С.М., Прокопів М.М. (2006) Гострий ішемічний інсульт. Наукова думка, Київ, 280 с.
- Ганонг В.Ф. (2002) Фізіологія людини: підручник. БаК, Львів, 784 с.
- Маньковский Б.Н. (1935) О так называемом физиологическом методе в трактовке некоторых явлений нервной патологии. В кн.: Труды Киевского психоневрологического института, Т. IV, с. 7–15.
- Adair J.C., Schwartz R.L., Na D.L. et al. (1997) Anosognosia: examining the disconnection hypothesis. J. Neurol. Neurosurg. Psychiatry, 63(6): 798–800.
- Adams H.P. Jr, Bendixen B.H., Kapelle L.J. et al. (1993) Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke, 24(1): 35–41.
- Bakheit A.M. (2001) Management of neurogenic dysphagia. Postgrad. Med. J., 77(913): 694–699.
- Barer D.H. (1989) The natural history and functional consequences of dysphagia after hemispheric stroke. J. Neurol. Neurosurg. Psychiatry, 52(2): 236–241.
- Biller J., Love B.B., Marsh E.E. III et al. (1990) Spontaneous improvement after acute ischemic stroke. A pilot study. Stroke, 21(7): 1008–1012.
- Buchholz D.W. (1993) Clinically probable brain stem stroke presenting as dysphagia and nonvisualised by MRI. Dysphagia; 8(3): 235–238.
- Celifarco A., Gerard G., Faegenburg D., Burakoff R. (1990) Dysphagia as the sole manifestation of bilateral strokes. Am. J. Gastroenterol., 85(5): 610–613.
- Daniels S.K., Brailey K., Priestly D.H. et al. (1998) Aspiration in patients with acute stroke. Arch. Phys. Med. Rehabil., 79(1): 14–19.
- Daniels S.K., Foundas A.L. (1999) Lesion localization in acute stroke patients with risk of aspiration. J. Neuroimaging., 9(2): 91–98.
- Davenport R.J., Dennis M.S., Warlow C.P. (1995) Improving the recording of the clinical assessment of stroke patients using a clerking pro forma. Age Ageing, 24(1): 43–48.
- Gordon C., Hewer R.L., Wade D.T. (1987) Dysphagia in acute stroke. Br. Med. J., 295(6595): 411–414.
- Grau A.J., Weimar C., Buggle F. et al. (2001) Risk factors, outcome, and treatment in subtypes of ischemic stroke: the German stroke data bank. Stroke, 32(11): 2559–2566.
- Hack W., Kaste M., Bogousslavsky J. et al.; European Stroke Initiative Executive Committee and the EUSI Writing Committee (2003) European Stroke Initiative Recommendations for Stroke Management-update 2003. Cerebrovasc. Dis., 16(4): 311–337.
- Hamdy S., Aziz Q., Rothwell J.C. et al. (1997) Explaining oropharyngeal dysphagia after unilateral hemispheric stroke. Lancet, 350(9079): 686–692.
- Holas M.A., DePippo K.L., Reding M.J. (1994) Aspiration and relative risk of medical complications following stroke. Arch. Neurol., 51(10): 1051–1053.
- Ickenstein G.W., Stein J., Ambrosi D. et al. (2005) Predictors of survival after severe dysphagic stroke. J. Neurol., 252(12): 1510–1516.
- Jean A., Car A. (1979) Inputs to the swallowing medullary neurons from the peripheral afferent fibers and the swallowing cortical area. Brain Res., 178(2–3): 567–572.
- Kennedy J.G. 3rd, Kent R.D. (1988) Physiological substrates of normal deglutition. Dysphagia, 3(1): 27–34.
- Kidd D., Lawson J., Nesbitt R., MacMahon J. (1993) Aspiration in acute stroke: a clinical study with videofluoroscopy. Q. J. Med., 86(12): 825–829.
- Martin R.E., Sessle B.J. (1993) The role of the cerebral cortex in swallowing. Dysphagia, 8(3): 195–202.
- Miller A., Bieger D., Conklin J.L. (1997) Functional controls of deglutition. In: A.L. Perlman, K.S. Schulze-Delrieu (Eds.) Deglutition and its disorders. Singular Publishing Group, Inc., San Diego, pp. 43–98.
- Nathadwarawala K.M., Nicklin J., Wiles C.M. (1992) A timed test of swallowing capacity for neurological patients. J. Neurol. Neurosurg. Psychiatry, 55(9): 822–825.
- Patti F., Emmi N., Restivo D.A. et al. (2002) Neurogenic dysphagia: physiology, physiopathology and rehabilitative treatment. Clin. Ter., 153(6): 403–419.
- Perlman A.L., Schulze-Delrieu K.S. (Eds.) (1997) Deglutition and its disorders: Anatomy, physiology, clinical diagnosis, and management. Singular Publishing Group, Inc., San Diego, pp. 43–97.
- Ramsey D.J., Smithard D.G., Kalra L. (2003) Early assessments of dysphagia and aspiration risk in acute stroke patients. Stroke, 34(5): 1252–1257.
- Smithard D.G., O’Neill P.A., England R.E. et al. (1997) The natural history of dysphagia following a stroke. Dysphagia, 12(4): 188–193.
- Starkstein S.E., Berthier M.L., Fedoroff P. et al. (1990) Anosognosia and major depression in 2 patients with cerebrovascular lesions. Neurology, 40(9): 1380–1382.
Резюме. По данным разных авторов у 22–68% пациентов после мозгового инсульта выявляют нейрогенную дисфагию, которая оказывает отрицательное влияние на клиническое состояние больных, повышая их инвалидизацию. Цель исследования — с использованием клинических критериев оценить нарушения акта глотания у пациентов с нейрогенной дисфагией после перенесенного мозгового инсульта и обосновать механизмы ее возникновения в зависимости от локализации ишемического или геморрагического очага поражения. Обследован 61 пациент с нейрогенной дисфагией, возникшей после острого ишемического (n=50) и геморагического (n=11) инсульта в каротидном (n=18) и вертебрально-базилярном (n=43) бассейнах. Описаны физиологические механизмы акта глотания, патофизиология нейрогенной дисфагии и ее диагностика. Проведенное исследование показало, что после стволовых и полушарных инсультов возникают дисфагические нарушения разной степени тяжести: полная потеря функции глотания с необходимостью зондового питания — у 11,5% ; значительные нарушения глотания — у 39,3%; умеренные — у 37,7% и незначительные дисфагические нарушения — у 11,5% пациентов. Обоснованы механизмы возникновения дисфагии в зависимости от локализации очага инсульта и целесообразность обязательной проверки глотательной функции у всех пациентов после острого мозгового инсульта.
Ключевые слова: инсульт, дисфагия, патофизиология, клинические проявления, диагностика
Summary. According to information from different authors dysphagia appears in 22–68% of stroke patients. It has strong negative influence on clinical status of patients and increase their functional disability. Main aim of our research is to evaluate swallowing disorders in stroke patients using specific clinical signs and to explain its pathophysiological mechanism in connection with localization of ischemic or hemorrhagic impairment. 61 stroke patients with swallowing disorders were examined. 50 patients had ischemic stroke and 11 — hemorrhagic stroke. From that group 18 patients had carotid localization of impairment and 43 had localization of impairment in brainstem territory. This article represents physiological mechanism of swallowing act, pathophysiological causes of neurogenic dysphagia and ways of its quick and adequate bedside assessment. Our research led us to the conclusion that because of hemispheric and brainstem stroke we may see such types of deglutition disorders: complete loss of swallowing function (11.5%); severe disorders of deglutition (39.3%); average swallowing disorders (37.7%) and light insignificant swallowing dysfunction (11.5%). We discovered mechanisms of dysphagia’s onset and showed that appearance of deglutition disorders is strongly connected with localization of brain impairment. Also in this article we showed an importance of obligatory assessment of swallowing function in all acute stroke patients.
Key words: stroke, dysphagia, pathophysiology, clinical signs, assessment
Адреса для листування:
Волосовець Антон Олександрович
01601, Київ, бульв. Тараса Шевченка, 13
Національний медичний університет
ім. О.О. Богомольця, кафедра нервових хвороб





