Введение
Артериальная гипертензия (АГ) — наиболее распространенное хроническое заболевание в мире и в значительной мере определяет высокую смертность и инвалидность от сердечно- сосудистых и цереброваскулярных заболеваний. Приблизительно каждый третий взрослый страдает от этого заболевания. В 2007 г. в Украине официально зарегистрировано более 11 млн больных c АГ, что составляет более 29% взрослого населения страны. Около 5% всех больных c АГ имеют определенные формы вторичных АГ, при которых с помощью радикального вмешательства (чаще хирургического) пациент может быть практически излечен. Но и 5% больных c АГ — это сотни тысяч пациентов в Украине, которых навсегда можно вылечить от этого недуга. К таким формам АГ относится большинство эндокринных гипертензий.
Перед врачом, который принимает пациента с синдромом АГ, всегда стоит несколько диагностических вопросов и первый среди них — какая форма АГ у больного — эссенциальная или вторичная? Для построения правильного диагноза АГ необходимо отталкиваться от симптомов, нехарактерных для эссенциальной гипертензии. Для последней присущи: развитие в возрасте между 30–50 годами; медленно прогрессирующее течение, часто бессипмтомный характер болезни до появления поражения органов-мишеней. Толчком для расширенного обследования пациента с АГ должны стать: юношеский и молодой возраст, внезапное начало или ухудшение заболевания, тяжелая АГ — АД >180/120 мм рт. ст., рефрактерный или злокачественный характер течения, наличие любых симптомов, присущих вторичным АГ.
Пациенты со вторичной или симптоматической АГ составляют приблизительно 5–10% всех больных с повышенным АД, а доля эндокринных АГ в общей популяции больных c АГ по данным разных авторов — 0,2–1%. По данным отделения симптоматических артериальных гипертензий Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» АМН Украины среди 3495 первичных больных, которые находились в отделении на протяжении 1994–2003 гг., вторичные формы АГ составили 26,8%. Частота различных форм вторичных АГ в нашем наблюдении представлена на рис. 1. Безусловно, что в общей популяции больных с АГ и соответственно на приеме участкового (семейного) врача их доля будет меньше.

К ренопаренхиматозным АГ относят все типы АГ при поражении паренхимы почек. Кодирование по МКБ-10: I12 — гипертензивная [гипертоническая] болезнь с преимущественным поражением почек. Сюда относятся все заболевания, включенные в рубрику N18, N19, N26. Кроме этого, используют код I15.1 — гипертензия вторичная по отношению к другим поражениям почек.
К реноваскулярным АГ относят АГ при атеросклерозе почечных артерий, фибромускулярной дисплазии и неспецифическом аортоартериите. Код диагноза по МКБ-10: I15.0 — реноваскулярная гипертензия.
К эндокринным АГ относятся:
– феохромоцитома;
– первичный минералокортицизм;
– гиперкортицизм (синдром и болезнь Кушинга);
– акромегалия;
– гиперпаратиреоз;
– гипер- и гипотиреоз;
– первичный гиперренинизм;
– эндотелинпродуцирующие опухоли.
Код диагноза по МКБ-10: I15.2 — гипертензия вторичная по отношению к эндокринным нарушениям.
Следует подчеркнуть, что в большинстве случаев вторичных АГ прогноз жизни больного определяется развитием сердечно-сосудистых осложнений, но обычное рутинное применение антигипертензивных препаратов в большинстве случаев не позволяет стабилизировать состояние больного и предупредить возникновение осложнений. Диагностика и лечение больных с вторичными формами АГ является предметом профессиональной деятельности врачей различных специальностей: терапевтов, кардиологов, эндокринологов, нефрологов, хирургов. Но, как известно, у семи нянек ребенок без глаза. Появление новых методов диагностики и лечения на протяжении последних 25 лет значительно расширили возможности медицины в этом направлении. Своевременное хирургическое вмешательство при некоторых нозологических формах позволяет у значительного числа больных достичь нормализации АД и прекратить постоянный прием антигипертензивных средств. В большинстве случаев для достижения успеха необходима четкая работа целой команды. Потенциальная курабельность вторичных АГ требует от каждого специалиста четкого понимания своей роли в современном алгоритме ведения таких пациентов.
АГ, которая возникает у больных сахарным диабетом, не относится к группе эндокринных АГ и рассматривается как эссенциальная (первичная) АГ в сочетании с сахарным диабетом или как вторичная ренопаренхиматозная — при диабетическом поражении почек.
Ренопаренхиматозная АГ
Определение
Ренопаренхиматозная (ренопаренхимная) АГ — синдром, при котором стойкое повышение АД обусловлено поражением паренхимы при различных заболеваниях почек.
Эпидемиология
Ренопаренхиматозная АГ — наиболее частая форма вторичной АГ. Частота ее среди всех больных с АГ — 5–15%. В специализированных отделениях, где находятся больные с рефрактерными формами АГ, частота ренопаренхиматозной достигает 30–40%. По данным отделения симптоматических артериальных гипертензий Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» АМН Украины среди 3495 первичных больных АГ, которые лечились в отделении на протяжении 1994–2003 гг., диагноз «ренопаренхиматозная АГ», подтвержденный инструментальными и лабораторными исследованиями, был поставлен 784 пациентам, что составляет 22,4%. Таким образом, ренопаренхиматозная АГ является второй по частоте причиной хронического повышения АД после эссенциальной АГ.
В начале ХIХ века английский врач R. Bright описал взаимосвязь заболеваний почек, развития сердечно-сосудистых осложнений и смерти у таких пациентов. Этот момент можно считать отправным в исследовании роли почечных факторов при АГ. В 30–50-е годы ХХ века коллективы исследователей под руководством H. Goldblatt, F. Gross и некоторых других положили начало исследованию биохимии ренин-ангиотензиновой системы (РАС). Это способствовало накоплению данных о нормальной и патологической физиологии сердечно-сосудистой системы, патогенезе АГ и ее осложнениях. Полученные в последние десятилетия факты позволили кардинально изменить наши представления об этих процессах, а также разработать принципиально новые классы эффективных лекарственных средств.
Этиология и патогенез
Как уже отмечалось, поражение паренхимы почек с последующим повышением АД может возникнуть вследствие различных нозологических форм заболеваний почек. Независимо от этиологического фактора, который привел к первичному поражению почек, дальнейшее течение заболевания, его прогрессирование характеризуется общими закономерностями патогенетических механизмов и стадийностью. Со временем при отсутствии адекватного лечения возникает нарушение функции почек, которое постепенно прогрессирует к ее крайнему проявлению — хронической почечной недостаточности (ХПН). При этом АГ вначале может быть следствием, а затем важным патогенетическим фактором дальнейшего прогрессирования заболевания. Такая схожесть патогенетических факторов прогрессирования поражения почек привела к внедрению в клиническую практику с начала 2000-х годов понятия «хроническое заболевание (поражение) почек» (ХЗП) по аналогии с «сердечно-сосудистым заболеванием». Этот термин был предложен Американской национальной федерацией нефрологии (АНФН) и в данный момент является принятым специалистами во всем мире. По литературным данным в зависимости от стадии ХЗП повышенное АД выявляют у 60–90% таких больных. Появление АГ у больных на ранних стадиях ХЗП ассоциируется с быстрым дальнейшим прогрессированием поражения почек и развитием ХПН.
Традиционно в нашей стране кардиологи и терапевты большое внимание уделяют лечению больных с сердечной недостаточностью (СН) и ишемической болезнью сердца (ИБС) и считают компетенцией нефрологов ведение пациентов с заболеваниями почек. Но наиболее частыми причинами возникновения поражения почек в современном мире считаются АГ и сахарный диабет. При этом, с одной стороны, повышенное АД является причиной ХЗП, с другой — ренопаренхиматозная АГ является второй по частоте причиной хронического повышения АД после эссенциальной. За последние 10 лет количество таких больных с ХЗП в США и Западной Европе удвоилось. В США в 1998 г. было 326 тыс. таких больных, в 2000 г.— уже 372 тыс., а в 2010 г. ожидается 650 тыс. Приблизительно 20–25% больных с ХПН — это пациенты с так называемым гипертензивным нефросклерозом (в нашей стране более распространенным считается термин «первично сморщенная почка»), который является прямым следствием прогрессирования поражения почек при АГ. Более того, сердечно-сосудистые осложнения и смерть вследствие указанных поражений у больных с ХЗП отмечают более часто, чем смерть от почечной недостаточности. Таким образом, необходимо рассматривать ХЗП как независимый фактор возникновения сердечно-сосудистых осложнений и кардиальной смерти. Возникновение даже незначительных признаков нарушения функции почек (повышение содержания креатинина, снижение клиренса креатинина, появление микро- и макроальбуминурии) означает достоверное значительное повышение риска развития сердечно-сосудистых осложнений и кардиальной смерти.
Патогенетические аспекты ренопаренхиматозной АГ, роль РАС
Основными механизмами, которые поддерживают повышение АД при ХЗП, считают повышение общего периферического сосудистого сопротивления (ОПСС) и задержку жидкости. Соответственно наиболее эффективными средствами для контроля АД будут вазодилататоры и диуретики, а также препараты, которые блокируют РАС.
Как известно, РАС обеспечивает в организме регуляцию кровообращения, водно-солевого обмена, принимает участие в процессах дифференциации тканей, воспаления, регенерации, развития гипертрофии, склероза. В общих чертах функционирование РАС осуществляется таким образом: секреция почками энзима ренина в кровь является первым этапом в каскаде реакций, которые приводят к продукции вазоконстрикторного пептида — ангиотензина II (АII). Кроме того, ренин и ангиотензинпревращающий фермент (АПФ) участвуют в активации АII в тканях всего организма, в частности в почках, миокарде, сосудах, мозговой ткани и других, втянутых в сферу регуляции. Циркулирующая РАС отвечает за быстрые и кратковременные эффекты (например, компенсаторные реакции во время возникновения кровотечения, острой СН или гипертензивного криза), тогда как тканевая РАС — продолжительные эффекты на органном уровне (структурно-функциональные изменения сосудов и сердца при АГ, хронической СН (ХСН) и др.). Почки играют ведущую роль в регуляции АД, которая реализуется путем влияния АII на кровообращение в почке и функции канальцев. Причем влияние АII одинаково как при эссенциальной, так и вторичной АГ. Избыток АII вследствие активации РАС играет ведущую роль в прогрессировании ХЗП, задержке натрия при АГ и СН, высвобождении альдостерона.
Основные почечные эффекты РАС представлены в табл. 1. В физиологических условиях в почках при снижении перфузионного давления постоянный уровень гломерулярной фильтрации поддерживается путем повышения тонуса эфферентных артериол и повышением почечного сосудистого сопротивления. Кроме того, АII также регулирует тонус мезангиальных клеток и количество гломерулярных капилляров, которые принимают участие в процессе фильтрации (площадь фильтрации). В случае возникновения гиповолемических ситуаций под влиянием АII снижается почечная экскреция натрия посредством регуляции клубочкового кровообращения, процессов фильтрации и реабсорбции.
Таблица 1
Почечные эффекты РАС
|
Регуляция ренального кровообращения |
|
Регуляция скорости гломерулярной фильтрации: а) вазоконстрикция афферентной и эфферентной артериолы б) сокращение мезангиума в) изменение коэффициента проницаемости фильтрирующей мембраны |
|
Канальцевая реабсорбция натрия |
|
Влияние на концентрационный механизм |
|
Модуляция ренальной симпатической активности |
|
Медиация воспаления |
|
Влияние на гипертрофию и гиперплазию |
|
Взаимодействие с почечными простагландинами |
Ведущая роль почек в развитии и поддержании АГ требует обсуждения роли ренальных эффектов АII, которые вызывают изменения в водно-солевом гомеостазе и регуляции АД. Задержка натрия реализуется через несколько механизмов: ренальную вазоконстрикцию, прямое влияние АII на состояние канальцев и повышение секреции альдостерона. На модели АГ у крыс с односторонним наложением клипсы на почечную артерию (модель Goldblatt) показано, что повышенный уровень АII влияет на обе почки и в неоперированной почке наступают изменения нарушения экскреции натрия как в состоянии нормотензии, так и при повышении давления. У крыс со спонтанной АГ также показано, что влияние АII на почки приводит к нарушению их экскреторной функции, причем этот факт связывают с генетически обусловленным повышением чувствительности к АII на уровне рецепторов.
Участие АII в развитии и поддержании повышенного уровня АД показано в клинических условиях при эссенциальной АГ. Вазоконстрикция сосудов почек, которую отмечают при АГ, у большей части больных обусловлена ответом почки на повышенный уровень АII в органе. В литературе подчеркивается связь между изменениями ренальной гемодинамики и их влиянием на регуляцию натриевого гомеостаза почками с развитием АГ и поддержанием хронически повышенного АД. Таким образом, АII способствует проявлению патологического процесса в почках, что в свою очередь способствует развитию АГ. Кроме вазоконстрикторного действия, АII как стимулятор клеточного роста, в том числе для клеток гладких мышц, играет ключевую роль в развитии гломерулосклероза, вызывая гипертрофию мезангиальных клеток.
При ХЗП активация РАС является одним из ведущих компонентов патогенеза заболевания. При этом у значительной части таких больных определяется нормальный или несколько сниженный уровень активности ренина плазмы крови, в то время как активность РАС в тканях, в том числе в почках, повышается в несколько раз. В многочисленных исследованиях доказана роль РАС, особенно ее локальной экспрессии в почках, в прогрессировании ХПН. Различные гемодинамические и негемодинамические эффекты РАС, включая повышение системного и интрагломерулярного давления, активацию роста и воспаление в почечных тканях, повышение реабсорбции натрия, создание условий для протеинурии (повышение мезангиальной проницаемости для макромолекул), принимают участие в прогрессировании заболевания. Показано, что активация РАС в почках происходит преимущественно в участках, которые окружают уже сформированную рубцовую ткань.
Таким образом, при ХЗП имеет место системная и локальная активация РАС, которая в свою очередь приводит к повышению степени повреждения почки: порочный круг замыкается. Взаимосвязь АГ и факторов патогенеза ХЗП представлено на рис. 2.
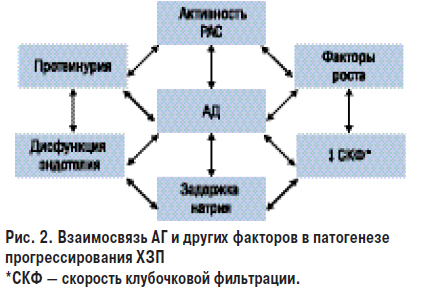
Еще один важный механизм прогрессирования ХЗП связан с протеинурией. В норме с мочой экскретируется незначительное количество белка. Постоянное повышение содержания белка в моче является важным симптомом поражения почек. Специфичность экскреции белков — альбумина или низкомолекулярных глобулинов зависит от типа заболевания почек. Так, например, экскреция альбумина является важным маркером ХЗП вследствие АГ, сахарного диабета или патологии клубочков. Повышение экскреции низкомолекулярных глобулинов является маркером тубулоинтерстициального поражения почек.
Важной причиной возникновения протеинурии считается нарушение автономной регуляции кровообращения в почках. При хроническом поражении почек, АГ, сахарном диабете высокое АД передается на клубочковые артериолы и возникает стабильная внутриклубочковая гипертензия, которая приводит к гиперфильтрации и продавливанию белка через мембрану под действием высокого гидростатического давления. Кроме того, возникновению протеинурии способствует нарушение функции эндотелия и повышение проницаемости базальной мембраны. Транспорт белка через мембрану приводит к развитию в ней патологических процессов: нарушению проницаемости, активации воспаления, утолщению и, наконец, нарушению функции. Таким образом, при ХЗП протеинурия — не только симптом заболевания, но и важный патогенетический механизм его прогрессирования.
Классификация
Для оценки функционального состояния почек используется несколько разных классификаций. По нашему мнению, наиболее простой и рациональной следует признать классификацию АНФН, которая выделяет 5 стадий поражения почек (табл. 2). Показатель СКФ принят как наилучший индекс для оценки общей функции почек как у здоровых, так и у пациентов с патологией. Как уже отмечалось, в норме показатель СКФ зависит от пола, массы тела и снижается с возрастом. Величина СКФ менее 60 мл/мин/1,73 м2 является критерием диагноза ХЗП независимо от наличия других признаков поражения или заболевания почек, поскольку при таком значении этого показателя следует констатировать потерю половины нормальной функции почек, что означает высокий риск развития почечных и сердечно-сосудистых осложнений.
Таблица 2
Стадии ХЗП согласно АНФН
|
Стадия |
Название |
СКФ |
|
1 |
Поражение почек с нормальной или повышенной СКФ |
≥90 |
|
2 |
Поражение почек с незначительно сниженной СКФ |
60–89 |
|
3 |
Поражение почек с умеренно сниженной СКФ |
30–59 |
|
4 |
Поражение почек со значительно сниженной СКФ |
15–29 |
|
5 |
Конечная стадия почечной недостаточности |
<15 или гемодиализ |
В Украине существует классификация ХПН, которая была утверждена приказом МЗ Украины № 05/462 от 30.09.2003 (табл. 3). Различия между приведенными классификациями состоят в том, что первая характеризует стадию заболевания, а вторая лишь стадию ХПН. Известно, что на ранних стадиях поражения при АГ отмечают повышение СКФ (более 133 мл/мин/1,73 м2) и появление микроальбуминурии. Это состояние еще не является ХПН, о которой можно говорить только при снижении СКФ, но признаки поражения почек уже можно констатировать. На ранних стадиях ХЗП (пиелонефрита, гломерулонефрита) отмечают изменения в осадке мочи, протеинурию, морфологические нарушения по данным УЗИ, тем не менее при выявлении нормальной СКФ ХПН еще не диагностируется. Поэтому классификация АНФН является более универсальной и пригодной для практики.
Таблица 3
Степени ХПН
|
Степень |
СКФ |
Уровень креатинина (мкмоль/л) |
|
1 |
<90>60 |
>123<176 |
|
2 |
<60>30 |
>176<352 |
|
3 |
<30>15 |
>352<528 |
|
4 |
<15 |
>528 |
Клиническая картина
Клиническая оценка больных с ХЗП и АГ
У больных с ХЗП необходимо определить: тип поражения (заболевания) почек, коморбидные состояния, тяжесть поражения функции почек (количественно), риск прогрессирования почечной дисфункции, наличие и риск развития сердечно- сосудистых и почечных осложнений. Заболевание почек определяют при наличии клинических признаков их поражения, а также значимых характерных изменений в анализах крови, мочи или показателях визуализирующих обследований. Перечень основных причин ХЗП приведено в табл. 4.
Таблица 4
Типы хронического поражения почек
|
Диабетическое поражение почек |
– тип I и тип II сахарного диабета |
|
Недиабетическое поражение почек |
– поражение клубочков (аутоимунное заболевание, системная инфекция, действие токсических веществ и лекарств, опухоль) – поражение сосудов (патология больших артерий, АГ, микроангиопатия) – тубулоинтерстициальная патология (инфекция мочевыводящих путей, мочекаменная болезнь, обструкция мочевыводящих путей, действие токсических веществ и лекарств) – кистозное поражение (поликистоз почек) |
|
Поражение трансплантированной почки |
– реакция отторжения – действие токсических веществ и лекарств (в том числе циклоспорина) – гломерулопатия трансплантата – вторичные поражения клубочков |
Всем больным при подозрении на наличие ХЗП необходимо контролировать уровень АД. Кроме того, следует определить уровень креатинина в сыворотке крови (критическим, по мнению экспертов, является значение 133 мкмоль/л (1,5 мг/дл) для мужчин и 124 мкмоль/л (1,4 мг/дл) для женщин) и вычислить СКФ, а также провести общий анализ мочи с микроскопией осадка и определением протеинурии. При наличии признаков патологии обязательным является проведение УЗИ почек, определение электролитного баланса крови и специальных анализов мочи для определения суточной протеинурии (при необходимости микроальбуминурии), лейкоцитурии и концентрационной функции почек. Клиническими предпосылками для расширенного обследования должны быть: наличие АГ, сахарного диабета, аутоимунных заболеваний, инфекции мочевыводящих путей, мочекаменной болезни, обструкции нижнего отдела мочевыводящих путей (в том числе аденомы простаты), неоплазм почек и мочевого тракта, семейный почечный анамнез, перенесенный эпизод острой почечной недостаточности, потеря массы почек (операция, травма, инфаркт), низкая масса тела при рождении, применение нефротоксических веществ. Кроме того, необходимо определить уровень холестерина (ХС) и его фракций в сыворотке крови. У больных с ХЗП чаще, чем в общей популяции, отмечают дислипидемии, которые, безусловно, повышают риск сердечно-сосудистых осложнений.
В табл. 5 представлена взаимосвязь между клиническими проявлениями при ХЗП, а в табл. 6 — взаимосвязь между типом поражения почек и клиническими проявлениями.
Таблица 5
Симптомы и синдромы при хроническом поражении почек
|
Клинические проявления |
СКФ (мл/мин/ |
Протеинурия |
Изменения в осадке мочи |
Изменения при визуализирующем обследовании |
Другие состояния |
|
Снижение СКФ |
15–89 |
НА |
НА |
НА |
Осложнения, связанные со снижением СКФ |
|
Конечная стадия ХПН |
<15 или на диализе |
НА |
НА |
НА |
Уремия, анемия, дислипидемия, АГ |
|
Нефритический синдром (нефрит) |
НА |
Обычно >1,5 г/сут |
Эритроциты |
НА |
Отеки, повышенное АД |
|
Нефротический синдром (нефроз) |
НА |
>3,5 г/сут |
Эритроциты, цилиндры |
НА |
Отеки, снижение уровня альбумина крови, повышение уровня липидов, АГ |
|
Почечный тубулярный ацидоз |
Обычно в норме |
Обычно <1,5 г/сут |
Обычно норма |
Обычно норма |
Водно-электролитные нарушения, гипоизостенурия |
|
ХЗП с признаками поражения мочевого тракта |
НА |
Обычно <1,5 г/сут |
НА |
Обычно есть нарушение |
Наличие бактериурии, камешков, признаков обструкции |
|
Асимптомные изменения в анализе мочи (протеинурия, гематурия, пиурия) |
>90 |
<3,5 г/л |
Эритроциты, лейкоциты, цилиндры |
НА |
Нет |
|
Асимптомные изменения при рентгенологическом и радиологическом обследовании |
>90 |
Обычно норма |
Обычно норма |
Гидронефроз, расширение чашечно-лоханочной системы (при пиелографии), расширение трубочек, кисты, ассимметрия размеров или функции |
Нет |
|
АГ, связанная с ХЗП |
НА |
± |
± |
± |
Повышенное АД |
Примечания: НА — не применяется для характеристики; ± — может быть, может не быть.
Таблица 6
Симптоматика при различных типах поражения почек
|
Заболевание почек |
Клинические проявления |
|
Диабетическое поражение почек (при I и II типе) |
Асимптомные изменения в моче (альбумин-, протеинурия), нефротический синдром |
|
Гломерулярное поражение: пролиферативный гломерулонефрит невоспалительные заболевания |
Нефротический синдром, асимптомные изменения в моче (гематурия и протеинурия) Нефротический синдром, асимптомные изменения в моче (протеинурия) |
|
Поражение сосудов почек: сосуды крупного калибра сосуды среднего калибра сосуды малого калибра |
Повышенное АД, асимптомные аномалии при визуализирующем обследовании, в дальнейшем снижение функции и размера почки на стороне поражения Повышенное АД, асимптомные изменения в моче (протеинурия) Повышенное АД, асимптомные изменения в моче (гематурия) |
|
Тубулоинтерстициальное заболевание: тубулоинтерстициальный нефрит невоспалительные заболевания |
Симптомы поражения мочевого тракта, почечный тубулярный ацидоз, асимптомные изменения в моче (пиурия, цилиндрурия), асимптоматические изменения при визуализирующих исследованиях, нарушение концентрационной функции почек Почечный тубулярный ацидоз, асимптомные изменения в моче (протеинурия, пиурия, цилиндрурия) Асимптомные изменения при визуализирующем исследовании |
|
Кистозные заболевания |
Симптомы поражения мочевого тракта, асимптомные изменения в моче, асимптомные изменения при визуализирующем исследовании |
|
Заболевание трансплантированных почек |
Повышенное АД, асимптомные изменения в моче (пиурия, протеинурия), нефротический синдром |
В рекомендациях Европейского общества гипертензии и Европейского общества кардиологов (2007) значительное внимание уделяется стратификации риска возникновения сердечно-сосудистых осложнений в зависимости от уровня АД, наличия общих факторов риска, поражения органов-мишеней и клинических состояний, связанных с АГ, что определяет терапевтическую тактику ведения больных. Согласно этим рекомендациям наличие незначительного нарушения функции почек при уровне АД >130–139/85–89 мм рт. ст. характеризуется высоким (20–30%) или очень высоким (>30%) риском возникновения сердечно-сосудистых осложнений на протяжении следующих 10 лет и нуждается в активном терапевтическом вмешательстве. Нарушение функции почек определяется по повышению уровня креатинина сыворотки крови (>107 мкмоль/л у женщин и >115 мкмоль/л у мужчин), снижением величины клубочковой фильтрации (<60–70 мл/мин) и наличием микро- (30–300 мг/сут) или макропротеинурии (>300 мг/сут).
Диагностика
Лабораторные и инструментальные методы обследования больных с ХЗП
Определение СКФ. Наиболее точно диагноз ХЗП может быть установлен с помощью лабораторных и инструментальных методов исследования. Даже у здорового человека с возрастом функция почек ухудшается: в среднем после 40 лет СКФ снижается на 1% за год (1–2 мл/мин). Наличие ХЗП ускоряет снижение функции почек, а развитие АГ еще больше ускоряет этот процесс — у нелеченых больных с ХЗП и АГ уменьшение СКФ составляет 12–15 мл/мин. Мониторинг СКФ позволяет врачу четко прогнозировать течение заболевания и оценивать эффективность лечебных мероприятий.
Таким образом, основой для оценки функции почек является определение СКФ. В клинике для ее определения используют ряд различных методов, которые позволяют врачу в реальных условиях оценивать степень поражения почек. Наиболее точным методом являются определения СКФ по принципу клиренса — «очищения», который впервые предложил Van Slyke в 1929 г. В клинике для характеристики величины СКФ методом прямого измерения клиренса чаще всего применяют такие вещества, как инулин, эндогенные креатины, мочевина, ЭДТА-51Cr (ЭДТА — этилендиаминтетрауксусная кислота), ДТПА-99mТс (ДТПА — диэтилентриаминпентауксусная кислота), 125I, 131I натрия йоталамат и согласно последним исследованиям — цистатин-С.
Широкое внедрение радиоизотопов в медицинскую практику сделало более доступным определение величины СКФ с помощью соединений, которые экскретируются почками тем же путем, что и инулин: ЭДТА-51Cr, натрия йоталамат, ДТПА-99mТс.
Измерения проводятся по стандартной методике клиренса, когда вещество, меченное изотопом, вводится внутривенно, после чего через определенные промежутки времени берут 1 или чаще 2 пробы крови и собирается моча. По активности изотопа в моче и крови, которые отвечают концентрации соединения, определяют величину клиренса. Этот метод является золотым стандартом (корреляция с клиренсом инулина 0,97) для определения величины СКФ.
Таким способом СКФ можно определить отдельно для каждой почки. Особое внимание следует уделять тому, чтобы перед проведением исследования больной вел обычный образ жизни и не имел значительных ограничений относительно употребления жидкости.
Преимущества данного метода исследования — точность определения СКФ и относительная простота выполнения. Недостатки: 1) необходимость иметь специализированную лабораторию с подготовленным персоналом и дорогостоящей техникой; 2) относительно высокая стоимость исследования, что не позволяет проводить исследования всем больным с АГ; 3) невозможность, особенно для реносцинтиграфии, частого проведения и соответственно применения для контроля терапевтического вмешательства.
Учитывая актуальность определения состояния почек у широкого круга пациентов (с АГ, ХЗП) и технические трудности определения клиренсов веществ, были предложены расчетные методы оценки фильтрационной функции почек только по концентрации креатинина сыворотки крови с учетом пола, возраста, массы тела и расы пациента.
Наиболее широко и долго применяется формула Cockroft — Gault (1976):
КК = [(140 — возраст) × (масса тела)] × (0,85 у женщин) ,
72 × (креатинин сыворотки крови)
где КК (клиренс креатинина) выражается в мл/мин, масса тела — в кг, возраст — в годах, креатинин сыворотки крови — в мг/дл (при необходимости для перерасчета мкмоль/л делят на коэффициент 88). Величина КК равняется стандартизованному к площади тела уровню СКФ. Эта формула используется для определения наличия и степени почечной недостаточности, при подборе дозы препаратов, которые экскретируются почками, при оценке эффективности терапии в плане предупреждения или замедления прогрессирования ХЗП.
Кроме того, широкое распространение за более высокую точность получила в последние годы сокращенная формула исследования MDRD (Modification of Diet in Renal Disease), в которой учитывается возраст, пол, раса и уровень креатинина сыворотки крови:
СКФ = 186 × (креатинин сыворотки крови)-1,154 × (возраст)-0,203 × (0,742 если женщина) ×
(1,210 если негроидная раса),
где СКФ вычисляют в мл/ мин/1,73 м2, возраст —
в годах, креатинин сыворотки крови — в мг/дл.
В многоцентровых исследованиях, в том числе MDRD, была доказана достаточная точность расчетных методов определения СКФ для использования на популяционном уровне, а также экономическая нецелесообразность использования прямых методов оценки СКФ для широкой популяции больных. Определение СКФ по формуле Cockroft — Gault у взрослых как стандарт рекомендован АНФН и признается во всем мире. Эта формула более простая для расчета (не нужно определять сложный корень) и, по мнению ведущих экспертов Украины, является достаточно точной для нашей популяции, поскольку количество пациентов негроидной расы в повседневной практике очень незначительно.
В отделении симптоматических артериальных гипертензий Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» проведено проспективное исследование относительно определения динамики состояния почек у больных с ренопаренхиматозной АГ на фоне лечения.
В исследование был включен 51 пациент с различной степенью ренопаренхиматозной АГ и средним возрастом 56,5±1,2 года. Женщины составили 37,3%, мужчины — 62,7%. Продолжительность наблюдения в среднем 29,4±1,1 мес. В ходе исследования показано отсутствие достоверной разности между величи-
ной СКФ, определенной с помощью формулы Coc-
kroft — Gault, и радиоизотопной реносцинтиграфии и существование достоверной корреляции между этими показателями — 112,2±7,8 против 106,1±1,9 мл/мин (R=0,65, р=0,02) (рис. 3).
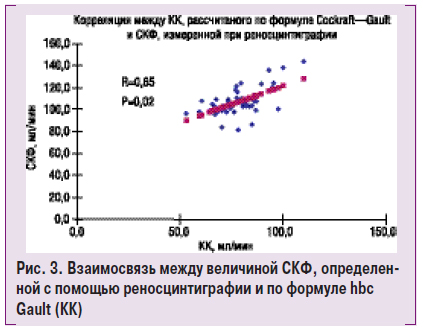
Таким образом, нет необходимости проводить более дорогостоящие исследования функции почек (в том числе реносцинтиграфию). Применение расчетного метода определения СКФ позволяет быстро и с достаточной точностью выявить и оценить степень поражения почек. Кроме того, с помощью расчетного метода можно проводить мониторинг состояния почек с той частотой, которая будет необходима (изотопную реносцинтиграфию не рекомендуется применять чаще 1 раза в год).
В 7-м докладе Американского национального объединенного комитета по диагностике и лечению АГ (2003) к перечню основных сердечно-сосудистых факторов риска добавлено микроальбуминурию или уровень СКФ (рассчитанный) менее 60 мл/мин/1,73 м2. Таким образом, соответственно современным требованиям вычисление этого показателя должно стать рутинной практикой для каждого кардиолога. В норме величина СКФ составляет 110–120 мл/мин/1,73 м2. При этом у разных людей при одинаковом уровне креатинина сыворотки крови могут отмечать разный уровень СКФ и соответственно разный уровень поражения почек и кардиоваскулярный риск, который подтверждает необходимость определения СКФ.
Всем пациентам с ХЗП (в том числе при АГ) следует проводить определение креатинина сыворотки крови и величины СКФ не менее чем 1 раз в год. Более часто его необходимо определять при наличии уровня СКФ <60–70 мл/мин/1,73 м2 или КК <60 мл/мин; быстром прогрессировании ухудшения состояния почек (снижение СКФ >4 мл/ мин/1,73 м2 или КК >4 мл/мин за год); наличии факторов риска более быстрого прогрессирования дисфункции почек (анемии, высокого АД, сахарного диабета, воспаления и др.); назначении терапии, направленной на замедление прогрессирования поражения почек (назначении ингибиторов АПФ или блокаторов рецепторов АII — БРАII). Это позволяет прогнозировать течение заболевания с определением сроков развития ХПН, а также оценивать эффективность лечебных мероприятий, направленных на замедление прогрессирования заболевания.
Определение микро- и макропротеинурии. В практической деятельности выделяют протеинурию при увеличении экскреции альбумина и других белков, альбуминурию — при увеличенной экскреции именно альбумина, а также микроальбуминурию. Кроме того, желательно вычислять соотношение протеин (альбумин)/креатинин в моче. Клиническая трактовка указанных показателей представлена в табл. 7.
Таблица 7
Определение протеинурии и альбуминурии
|
Показатель |
Метод анализа мочи |
Нормальные значения |
Микроальбуминурия |
Альбуминурия или клинически выраженная протеинурия |
|
Общий белок |
24-часовая экскреция |
<300 мг/сут |
Не определяется |
>300 мг/сут |
|
Полосковый тест на протеинурию |
<30 мг/дл |
Не определяется |
>30 мг/сут |
|
|
Белок мочи/креатинин |
<200 мг/г |
Не определяется |
>200 мг/г |
|
|
Альбумин |
24-часовая экскреция |
<30 мг/сут |
30–300 мг/сут |
>300 мг/сут |
|
Полосковый тест на альбуминурию |
<3 мг/дл |
>3 мг/дл |
Не определяется |
|
|
Альбумин мочи/креатинин |
<17 мг/г (для мужчин) <25 мг/г (для женщин) |
17–250 мг/г (для мужчин) 25–355 мг/г (для женщин) |
>250 мг/г (для мужчин) >355 мг/г (для женщин) |
Для определения альбуминурии и микроальбуминурии необходимо использовать специальные лабораторные наборы. В большинстве случаев применяют полосковые экспресс-тесты, которые позволяют быстро и без специальной подготовки и дополнительного оборудования определять наличие и уровень протеинурии в любом медицинском учреждении.
Наличие микроальбуминурии у больных с АГ является независимым фактором риска поражения почек, а также развития сердечно-сосудистых осложнений — наличие микроальбуминурии повышает риск более чем в 2 раза. В некоторых современных рекомендациях микроальбуминурия определяется как маркер системного поражения эндотелия.
Риск развития сердечно-сосудистых осложнений и прогрессирование поражения почек пропорционально возрастает с повышением уровня экскреции белка. Величина суточной протеинурии больше 1 г является критической и такие больные нуждаются в дополнительных терапевтических мероприятиях, в том числе более жестком контроле АД (смотри далее). Оценка суточной экскреции белка с мочой может быть как количественным признаком поражения почек, так и использоваться в динамике для оценки эффективности терапевтических мероприятий.
Лечение
При прогрессирующем характере течения ХЗП задача врача — выявление таких больных на ранних стадиях заболевания, когда функция почек не изменена (уровень СКФ высокий), и назначение максимально агрессивной терапии, направленной на нормализацию АД и нефропротекцию, для замедления возникновения почечной дисфункции. Таким образом, при ранней диагностике и лечении можно предупредить или замедлить неблагоприятное течение заболевания (как АГ, так и ХЗП).
Стратегия антигипертензивной терапии при хроническом поражении почек
Общие положения. Антигипертензивная терапия назначается для:
a) cнижения АД (класс рекомендаций I, уровень доказательности А);
б) cнижения риска сердечно-сосудистых заболеваний у больных с АГ (класс рекомендаций I, уровень доказательности B) и без (класс рекомендаций I, уровень доказательности B);
в) замедления прогрессирования поражения почек у больных с АГ (класс рекомендаций I, уровень доказательности A) и без (класс рекомендаций I, уровень доказательности A, C).
Антигипертензивную терапию следует согласовать с другим лечением ХЗП как главную часть комплексного подхода. При наличии расхождений между лечением, направленным на замедление прогрессирования поражения почек и снижение риска сердечно- сосудистых заболеваний, окончательное решение должно базироваться на индивидуальной стратификации риска у конкретного больного.
Цели антигипертензивной терапии при ХЗП:
- снижение АД;
- замедление прогрессирования поражения почек;
- снижение сердечно-сосудистого риска.
Стратегия лечения включает модификацию образа жизни, диету, назначение антигипертензивных средств, а также других препаратов.
Терапевтические цели: уровень АД, протеинурия, степень снижения СКФ. Современные целевые установки при лечении ХЗП представлены в табл. 8.
Таблица 8
Целевые установки при лечении АГ у больных с ХЗП
|
Целевой показатель |
Рекомендованный уровень |
|
Целевое АД |
Для всех <130/80 мм рт. ст. При протеинурии 1 г/сут и больше — <125/75 мм рт. ст. |
|
Уровень протеинурии |
Максимальное снижение до ее отсутствия |
|
Снижение СКФ |
Менее 2 мл/мин/1,73 м2 за год |
Снижение АД само по себе приводит к снижению риска прогрессирования ХЗП. При этом абсолютный эффект (количество случаев на 1000 пациентов за год) в предупреждении сердечно-сосудистых осложнений при снижении АД на 10/5 мм рт. ст. составляет >7–10 случаев; на 20/10 мм рт. ст. — >11–17 случаев. Анализ данных многоцентровых исследований, проведенных за последние годы, показывает, что для предупреждения прогрессирования поражения почек у больных с АГ необходимо обеспечить жесткий контроль АД, а также корректировать другие факторы риска (гипергликемия, дислипидемия и др.). Последние рекомендации ВОЗ и МОГ (Международное общество по гипертензии) JNC-7 (7-й доклад Объединенного Национального Комитета, 2003) и Европейских обществ гипертензии и кардиологов (2007) определяют как целевой уровень АД — 130/80 мм рт. ст., а при выявлении протеинурии более 1 г/ сут ниже — 125/75 мм рт. ст.
Все классы антигипертензивных препаратов, снижая АД, снижают степень поражения почек. В прямых сравнительных исследованиях антигипертензивных препаратов разных классов было показано, что применение ингибиторов АПФ в большей мере, чем диуретиков, блокаторов β-адренорецепторов, антагонистов кальция, уменьшает макро- и микроальбуминурию, замедляет прогрессирование почечной дисфункции и улучшает выживаемость больных с АГ и поражением почек. В последние годы аналогичные данные получены для БРАII. Наличие таких доказательств позволило определить ингибиторы АПФ и БРАII как препараты выбора для лечения больных с АГ и поражением почек. Эксперты подчеркивают, что указанные эффекты препаратов непосредственно не связаны с их влиянием на уровень АД. На данном этапе интенсивно изучается эффективность одновременного комбинированного назначения ингибиторов АПФ и БРАII при ХЗП и АГ. Предварительные результаты показывают большую эффективность такой комбинации по сравнению с монотерапией (исследования CALM (Candesartan and Lisinopril Microalbuminuria study) и COOPERATE (Комбинированное лечение БРАII и ингибиторами АПФ при недиабетических заболеваниях почек)).
В табл. 9 представлены общие рекомендации АНФН 2004 г. относительно применения антигипертензивной терапии у больных с ХЗП.
Таблица 9
Применение антигипертензивных препаратов у больных с ХЗП
|
Тип ХЗП |
Целевое АД |
Препарат выбора при ХЗП с и без АГ |
Другие препараты, которые снижают сердечно-сосудистый риск и способствуют достижению целевого АД |
|
Диабетическое поражение |
Ингибиторы АПФ или БРАII |
Диуретики лучше, блокаторы β-адренорецепторов или антагонисты кальция |
|
|
Недиабетическое поражение с уровнем соотношения протеин/креатинин в моче >200 мг/дл |
<130/80 |
Ингибиторы АПФ |
Диуретики лучше, блокаторы β-адренорецепторов или антагонисты кальция |
|
Недиабетическое поражение с уровнем соотношения протеин/креатинин в моче <200 мг/дл |
Не имеет значения |
Диуретики лучше, ингибиторы АПФ, БРАII, блокаторы β-адренорецепторов или антагонисты кальция |
|
|
Поражение трансплантированной почки |
Не имеет значения |
Антагонисты кальция, диуретики, блокаторы β-адренорецепторов, ингибиторы АПФ, БРАII |
Данные многоцентровых исследований показывают, что для достижения целевого АД у больных с ХЗП было необходимо применять комбинацию от 2,6 (UKPDS — United Kingdom Prospective Diabetes Study) до 3,6 (MDRD — Modification of Diet in Renal Disease) — 3,7 (AASK — African-American Study of Kidney Disease and Hypertension) препаратов. При выборе антигипертензивных средств особое внимание следует уделять рациональному комбинированию и максимальному упрощению схемы их приема за счет использования готовых комбинированных препаратов. Простота схемы приема назначенного лекарства будет способствовать повышению приверженности больных к назначенной терапии. Следует подчеркнуть, что у больных с ренопаренхиматозной АГ практически обязательным вторым компонентом антигипертензивной терапии должен быть диуретик (смотри далее).
Важными составными лечения АГ и ХЗП для предупреждения риска развития сердечно-сосудистых осложнений и прогрессирования поражения почек, кроме антигипертензивных препаратов, являются жесткий контроль уровня глюкозы крови (при сахарном диабете), ограничение диетического потребления протеинов, липидоснижающая и антитромбоцитарная терапия, коррекция анемии и дисбаланса электролитов (при их наличии).
Патогенетическое обоснование эффектов блокаторов РАС при ренопаренхиматозной АГ
Эффективная антигипертензивная терапия обеспечивает защиту органов-мишеней и таким образом способствует снижению риска возникновения сердечно- сосудистых осложнений и смерти. Однако к настоящему времени большинство экспертов очень пессимистически оценивали значение традиционной антигипертензивной терапии (диуретики и блокаторы β- адренорецепторов) для предупреждения прогрессирования нефросклероза. Известно, что локальная активация РАС играет ключевую роль в возникновении и прогрессировании поражения почек у больных с АГ. Поэтому существуют весомые теоретические аргументы в пользу применения средств, которые уменьшают или блокируют эффекты РАС, для предупреждения прогрессирования поражения почек у больных с АГ, а именно: снижение АД, изменения внутрипочечной гемодинамики, ингибирование факторов роста и воспаления, снижение проницаемости мембраны клубочков и транспорта белков, улучшение функции эндотелия.
На рис. 4 схематически представлено влияние блокаторов РАС на внутрипочечную гемодинамику и протеинурию. В левой его части приведены типичные изменения гемодинамики у больных с ХЗП, когда высокое АД передается на клубочковые артериолы и возникает стабильная внутриклубочковая гипертензия, которая приводит к гиперфильтрации и продавливанию белка через мембрану под действием высокого гидростатического давления. В правой половине представлены изменения внутрипочечной гемодинамики под влиянием блокаторов РАС. Как и все антигипертензивные средства, ингибиторы АПФ и БРАII вызывают дилатацию приводящей артерии, но в отличие от других классов препаратов, приводят к расширению отводящей артерии, что значительно снижает давление крови внутри клубочка. Снижение гидростатического давления в клубочке приводит к значительному снижению гиперфильтрации и снижению или прекращению протеинурии.
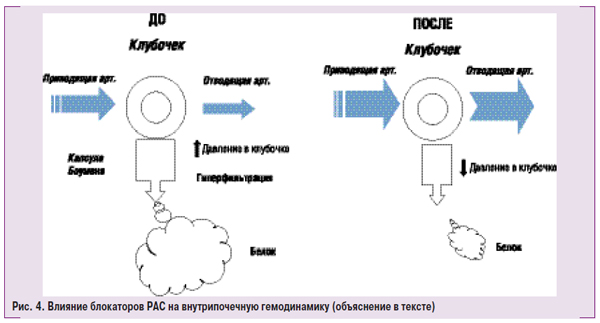
Ингибиторы АПФ и БРАII следует использовать в средних и высоких дозах, как это было доказано в клинических исследованиях (класс рекомендаций I, уровень доказательности А). Ингибиторы АПФ и БРАII необходимо использовать как альтернативу друг другу, если препарат выбора не определен или нет возможности применить (класс рекомендаций I, уровень доказательности B). При продолжительном лечении ингибиторами АПФ и БРАII следует мониторировать уровень АД, снижение СКФ и гиперкалиемию (класс рекомендаций I, уровень доказательности А). Интервал для мониторирования зависит от их начального уровня (класс рекомендаций I, уровень доказательности B). У большинства больных необходимо продолжать терапию ингибитором АПФ или БРАII даже при снижении СКФ до <30% на протяжении 4 мес и росте уровня калия в сыворотке крови до 5,5 ммоль/л (класс рекомендаций I, уровень доказательности B) (смотри далее).
Выбор антигипертензивного препарата при диабетической нефропатии
Диабетическая нефропатия или поражение почек при сахарном диабете (диабетический гломерулосклероз, синдром Киммелстила — Уилсона) — специфическое, прогрессирующее поражение почек. Термин «диабетическая нефропатия» — наиболее современный и чаще всего используется в научной литературе. Рубрика по МКБ-10: Е10 — Е14.2.
Диабетическую нефропатию отмечают приблизительно у 50% больных, которые страдают сахарным диабетом на протяжении длительного времени — более 20 лет. Это наиболее частая причина развития ХЗП и ХПН. По своей сути представляет собой типичное поражение клубочков, но вследствие высокой частоты выявления в популяции больных с ХЗП диабетическую нефропатию выделяют как отдельную форму поражения почек (см. табл. 4).
Начало клиническому применению ингибиторов АПФ при поражении почек было положено в 80-е годы группами H.-H. Parving и S. Bjork, которые исследовали эффективность каптоприла у пациентов с инсулинзависимым сахарным диабетом. Работами первых было показано, что применение каптоприла по сравнению с плацебо достоверно снижало альбуминурию и замедляло прогрессирование поражения почек. В работах группы S. Bjork было показано, что применение каптоприла по сравнению с обычной антигипертензивной терапией (блокаторы β- адренорецепторов, антагонисты кальция, гидралазин) у больных с диабетической нефропатией не только не ухудшало контроль АД, а при приеме на протяжении 2 лет предупреждало ухудшение функции почек при одинаковом снижении АД. В другом исследовании S. Bjork и соавторов показан положительный эффект эналаприла, по сравнению с блокаторами β- адренорецепторов, у больных сахарным диабетом I типа с признаками нефропатии и почечной дисфункции на процесс снижения уровня гломерулярной фильтрации. Особенно отмечено, что эти эффекты не зависели от влияния препарата на уровень АД. Предварительные результаты были подтверждены в более масштабных многоцентровых двойных слепых исследованиях как в США, так и в Европе и убедительно доказали, что применение ингибиторов АПФ у больных сахарным диабетом I типа замедляло развитие почечной недостаточности, улучшало симптоматику и, что наиболее важно, увеличивало продолжительность жизни таких пациентов.
Успехи, достигнутые при применение ингибиторов АПФ у больных сахарным диабетом I типа, побуждали к более широкому изучению их эффективности при диабете II типа. Многочисленные исследования показали, что применение ингибиторов АПФ у больных с АГ и сахарным диабетом II типа по сравнению с плацебо приводило к значительному снижению микро- и макроальбуминурии. Так же, как и в случае с плацебо, в значительном количестве прямых сравнительных исследований эффективности ингибиторов АПФ с препаратами других классов первого ряда (диуретиками, блокаторами β-адренорецепторов и антагонистами кальция) было показано достоверно более значительное снижение экскреции белка с мочой. Эффективное снижение макро- и микроальбуминурии при АГ и сахарном диабете II типа позволили большинству экспертов сделать вывод о прямых нефропротекторных свойствах ингибиторов АПФ и у такого контингента больных.
Значительное влияние на практику применения ингибиторов АПФ у больных с АГ и сахарным диабетом имели результаты исследования HOPE (Heart Outcomes Prevention Evaluation) и его ветви MICRO-HOPE (MICRO — Microalbuminuria, Cardiovascular and Renal Outcomes). У 3577 больных, которые принимали участие в этом исследовании, был сахарный диабет II типа. Применение рамиприла на протяжении 4,5 года приводило к достоверному на 25% снижению частоты развития ИМ, инсульта или смерти, связанной с сердечно-сосудистой патологией. Положительный эффект препарата не зависел от его влияния на уровень АД. В исследовании MICRO-HOPE было показано, что применение рамиприла достоверно (на 24%) снижало риск развития микроальбуминурии. Терапия рамиприлом была эффективна и в подгруппе больных с I стадией ХПН.
На протяжении последних 10 лет опубликованы результаты многочисленных исследований, в которых изучался эффект БРАII на течение диабетической нефропатии. Результаты этих исследований представляют особый интерес, поскольку включали значительное количество больных сахарным диабетом II типа, а конечные точки были четко связаны с нефропатией. В первом из них — IRMA (Irbesartan in patients with type II diabetes and microalbuminuria), основанном на наблюдении 590 больных сахарным диабетом с микроальбуминурией, было показано, что прием БРАII ирбесартана на протяжении 2 лет приводил к восстановлению нормоальбуминурии у трети больных. Выраженная нефропатия развивалась в 3 раза реже у пациентов, которые принимали БРАII.
В другом исследовании — MARVAL (MicroAlbuminuria Reduction With VALsartan) проводили сравнительную эффективность вальзартана и антагониста кальция амлодипина на протяжении 24 нед у 332 больных. Было показано, что лечение вальзартаном приводило к существенному снижению протеинурии (до 56% начального уровня), в то время как терапия амлодипином практически не влияла на этот показатель, несмотря на одинаковую степень снижения АД в обеих группах. У больных, которые принимали вальзартан, в 2 раза чаще отмечали регресс нефропатии до нормоальбуминурии, чем в группе принимавших амлодипин.
В двух других исследованиях — RENAAL (Reduction of Endpoints in NIDDM with the Angiotensin II Antagonist Losartan) и IDNT (Irbesartan in Diabetic Nephropathy Trial) изучалась эффективность БРА у пациентов с уже развившейся диабетической нефропатией. Результаты исследований показали эффективность этого класса антигипертензивных средств в плане предупреждения прогрессирования поражения почек (развитие терминальных стадий ХПН) по сравнению с плацебо и антагонистами кальция (амлодипин). Поскольку степень снижения АД в группах сравнения была одинаковой, то авторы этих исследований считают, что нефропротекторный эффект БРАII не зависел от их антигипертензивного действия.
Базируясь на результатах этих исследований, Американская администрация по контролю за продуктами питания и лекарствами (Food and Drug Administration — FDA) рекомендовала БРАII как препараты выбора для лечения таких пациентов.
Сравнение нефропротекторных свойств ингибиторов АПФ и БРАII изучено в исследовании DETAIL (Diabetics Exposed to Telmisartan and Enalapril). Первичной точкой была оценка степени снижения СКФ, определение которой проводили прямым методом. В 5-летнее наблюдение было включено 250 больных, которые получали терапию тельмизартаном или эналаприлом. При необходимости добавляли другие антигипертензивные средства до достижения целевого уровня АД — <130/80 мм рт. ст. При абсолютно эквивалентном снижении АД в обеих группах отмечали одинаковую степень снижения СКФ. Следует подчеркнуть, что в исследовании в обеих группах был достигнут целевой уровень снижения СКФ — <2 мл/ мин за год и частота смерти, связанной с сердечно-сосудистой патологией, составила всего 5% (!).
В текущих многоцентровых исследованиях продолжается изучение эффективности других препаратов из этой группы: вальзартана, тельмизартана, эпрозартана, ольмезартана. Проводятся исследования по сравнению нефропротекторных свойств БРАII тельмизартана и ингибитора АПФ рамиприла, тельмизартана и вальзартана, ольмезартана и лозартана и пр.
Безопасность применения блокаторов РАС при ренопаренхиматозной АГ
В некоторых учебниках и руководствах по лечению синдрома АГ или СН содержатся положения относительно наличия противопоказаний для назначения ингибиторов АПФ у больных с нарушенной функцией почек. Авторы объясняют такие противопоказания возможным ухудшением функции почек при применении этого класса лекарства. Следует подчеркнуть, что ни одна из фармацевтических компаний, которые разработали и производят ингибиторы АПФ на мировом рынке, не включила такие противопоказания в инструкции для медицинского применения этих препаратов. Исследования последних лет полностью подтвердили целесообразность и необходимость назначения ингибиторов АПФ при заболеваниях почек.
Учитывая возможное предубежденное отношение врачей к назначению ингибиторов АПФ, в 2001 г. Американская ассоциация сердца утвердила приведенные в табл. 10 принципы применения ингибиторов АПФ у больных с поражением почек. Особенно следует подчеркнуть положение, что при назначении антигипертензивной терапии и снижении АД на протяжении первых 2–3 мес может отмечаться транзиторное снижение гломерулярной фильтрации и незначительное повышение уровня креатинина.
Таблица 10
Принципы терапии ингибиторами АПФ: почечные аспекты (утвержденные Американской ассоциацией сердца в 2001 г.)
|
1. Ингибиторы АПФ улучшают почечное кровообращение и стабилизируют уровень гломерулярной фильтрации у большинства пациентов, в том числе с СН |
|
2. Терапия ингибиторами АПФ показана больным с диабетической и недиабетической нефропатией с экскрецией протеина более 1 г/сут |
|
3. В начале применения ингибиторов АПФ могут отмечать повышение содержания креатинина в сыворотке крови, особенно у больных с СН. Обычно такое повышение отмечают сразу же после назначения менее чем у 10–20% пациентов. Как правило, повышение содержания креатинина не прогрессирует и рассматривается как следствие изменений почечной гемодинамики под влиянием ингибиторов АПФ. |
|
4. Уровень креатинина в большинстве случаев быстро стабилизируется, а затем снижается, хотя нет такого уровня креатинина, при котором терапия ингибиторами АПФ противопоказана. Повышенные уровни креатинина в сыворотке крови чаще отмечают при применении ингибиторов АПФ у больных с уже существующей ХПН |
|
5. Развитие острой почечной недостаточности должно побуждать врача к выявлению системной гипотензии (среднее АД <65 мм рт. ст.), дефицита объема экстрацелюлярной жидкости или нефротоксического действия препарата. Это следует проводить для выявления необходимости коррекции или прекращения действия этих факторов. Специальное внимание следует уделять клинической ситуации при двустороннем стенозе почечных артерий тяжелой степени или стенозе артерии единой почки |
|
6. Терапию ингибиторами АПФ можно временно приостановить на период, пока факторы, которые способствуют развитию острой почечной недостаточности, будут скорректированы. В таких клинических ситуациях БРАII не могут быть полноценной заменой. По мере того, как после коррекции упомянутых факторов исчезают симптомы ОПН, можно восстановить терапию ингибиторами АПФ |
|
7. Гиперкалиемия является потенциальным осложнением лечения ингибиторами АПФ, особенно у больных сахарным диабетом с ХПН. Рекомендуется мониторирование содержания калия в сыворотке крови, соответствующее снижение диетического потребления калия, а также следует избегать назначения агентов, которые могут провоцировать появление гиперкалиемии (например калийсберегающих диуретиков) |
В таких случаях необходимо тщательно мониторировать эти показатели, не отменяя лечение. У подавляющего большинства больных спустя некоторое время функциональное состояние почек улучшается. У пациентов с прогрессирующим ухудшением функции почек на фоне антигипертензивной терапии, особенно при применении ингибиторов АПФ и БРАII следует подозревать стеноз почечной артерии.
В литературе высказываются спекулятивные предположения, что при нормальной функции почек ингибиторы АПФ, имеющие почечный путь выведения, могут иметь преимущества перед другими, выводящимися печеночным или печеночно-почечным путем. С другой стороны, при наличии почечной дисфункции следует назначать препараты, выводящиеся двойным путем. Эксперты Европейского общества кардиологов в своем Консенсусе по применению ингибиторов АПФ при сердечно-сосудистых заболеваниях (2004) высказали мнение, что указанные фармакологические свойства не имеют значения для достижения клинических эффектов этих препаратов.
У больных с выраженной ХПН преимущество следует отдавать препаратам без или с минимальным почечным путем выведения (фозиноприл, спираприл, моэксиприл). Дозу всех препаратов, кроме моэксиприла, необходимо снизить. Препараты, блокирующие активность РАС, следует назначать под контролем уровня калия в сыворотке крови.
Принципы назначения диуретиков у больных с ренопаренхиматозной АГ
Назначение диуретиков является важным компонентом лечения больных с ренопаренхиматозной АГ. С одной стороны, диуретики являются патогенетически обоснованными средствами для снижения АД у этой категории больных — они снижают объем жидкости в организме, в том числе в сосудистом русле уменьшают отеки. С другой стороны, без их применения практически невозможно достичь эффективного контроля АД и улучшить функцию почек. Диуретики потенцируют антигипертензивный эффект других препаратов, особенно ингибиторов АПФ и БРАII. Лечение начинают с обычных доз, при необходимости дозу повышают до максимальной. При уровне креатинина >2,5 мг/дл (220 мкмоль/л) тиазидные диуретики будут неэффективными, а калийсберегающие диуретики противопоказаны. При необходимости диуретики с коротким периодом полувыведения (фуросемид) следует назначать 2–3 раза в сутки.
В рекомендациях АНФН (2004) указано, что у большинства пациентов с ХЗП необходимо использовать диуретики (класс I, уровень доказательности А). Диуретики следует назначать, руководствуясь следующими принципами:
- тиазидные диуретики могут назначать на стадии 1–3 (уровень доказательности A) — СКФ >40 л/ мин/1,73 м2 или уровень креатинина сыворотки крови <2,5 мг/дл (220 мкмоль/л);
- петлевые диуретики могут назначать на всех стадиях ХЗП (уровень доказательности A);
- калийсберегающие диуретики не назначают:
а) на стадии ХЗП 4–5;
б) у больных, которые принимают ингибиторы АПФ или БРАII (уровень доказательности A).
При продолжительном использовании диуретиков для предупреждения риска возникновения побочных эффектов терапии следует мониторировать:
- гиповолемию (возможность развития артериальной гипотензии и, как следствие, снижение функции почек — снижение СКФ);
- гипокалиемию и другие электролитные нарушения. Интервал для мониторирования зависит от их начального уровня (смотри ниже).
При лечении АГ преимущество следует отдавать диуретикам продолжительного действия и/или их комбинации (лучше фиксированным) с другими антигипертензивными препаратами для повышения благосклонности больных к терапии.
Наблюдение за больными с ренопаренхиматозной АГ
Амбулаторное лечение АГ проводится непрерывно на протяжении жизни. Больные с АГ подлежат диспансерному наблюдению участковыми терапевтами или семейными врачами по месту жительства. При наличии сердечно-сосудистых осложнений или высокого риска их развития — наблюдение у кардиолога. При выявлении ХЗП к программе наблюдения следует подключить нефролога и эндокринолога (при наличии сахарного диабета). Контролю подлежат целевые показатели АД, СКФ, альбумин- (протеин)урия. Кроме того, дополнительно следует контролировать содержание электролитов (калия, при необходимости натрия, хлора, кальция), глюкозы, ХС и его фракций в сыворотке крови. При выявлении нарушений подлежат контролю показатели белкового обмена. Частота визитов и контроля биохимических показателей зависит от степени их нарушения. Больные с ренопаренхиматозной АГ могут направляться на МСЭК (медико-социальную экспертную комиссию) в связи с потерей трудоспособности.
В табл. 11 приведены основные показатели, которые подлежат контролю при наблюдении за больными с ХЗП и АГ, а также частота их определения в зависимости от степени их начальных изменений.
Таблица 11
Показатели, которые подлежат контролю при наблюдении за больными с ХЗП и АГ
|
Начальный этап |
||
|
Показатель |
Реже 1 раза в месяц |
Не менее 1 раз в месяц |
|
Систолическое АД |
120–159 |
>160 или <120 |
|
СКФ мл/мин/1,73 м2 или КК мл/мин |
≥60 |
<60 |
|
Калий сыворотки крови (ммоль/л) |
4,0–4,5 |
<4,0>4,5 |
|
После стабилизации клинического состояния |
||
|
Показатель |
Реже 1 раза в 6 мес |
Не менее 1 раз в 6 мес |
|
СКФ мл/мин/1,73 м2 или КК мл/мин |
≥60 |
<60 |
|
Снижение СКФ или КК за год |
<4 мл/мин/1,73 м2 или 4 мл/мин |
≥4 мл/мин/1,73 м2 или 4 мл/мин |
|
Факторы риска прогрессирования ХЗП |
Нет |
Есть |
|
Сопутствующая патология |
Нет |
Есть |
ЛИТЕРАТУРА
- 1. Рекомендації Українського товариства кардіологів з профілактики та лікування артеріальної гіпертензії (2004) Київ, 84 с.
- 2. 1999 WHO — ІSH guіdelіnes for the management of hypertensіon (1999) J. Hypertensіon, 11: 905–916.
- 3. 2003 European Socіety of Hypertensіon — European Socіety of Cardіology guіdelіnes for management of arterіal hypertensіon (2003) J. Hypertensіon, 21: 1011–1053.
- 4. 2007 Guidelines for the management of arterial hypertension (2007) J. Hypertension, 25: 1105–1187.
- 5. Bart B.A. (1999) Concern for azotemіa wіth convertіng enzyme іnhіbіtors: publіc health іmplіcatіons and clіnіcal relevance. Am. Heart J., 138: 801–803.
- 6. Bjork S., Mulec H., Johnsen S.A. et al. (1992) Renal protectіve effects of enalaprіl іn dіabetіc nephropath. Br. Med. J., 304: 339–343.
- 7. Bjork S., Nyberg G., Mulec H. et al. (1986) Benefіcіal effects of angіotensіn convertіng enzіme іnhіbіtіon on renal functіon іn patіents wіth dіabetіcs wіth nephropathy. Br. Med. J., 293: 471–474.
- 8. de Zeeuw D., Cooper M.E., Keane W.F., Parvіng H.H., Shahіnfar S. for RENAAL Іnvestіgators. Results of losartan organ protectіon study. 11th European meetіng on hypertensіon. Abstracts (2001) J. Hypertensіon, 19 (Suppl. 2): S16.
- 9. Epsteіn M., Tobe S. (2001) What іs the optіmal strategy to іntensіfy blood pressure control and prevent progressіon of renal dіsease? Current Hypertensіon Reports, 3: 422–428.
- 10. Hallan S., Asberg A., Lіndberg M., Johnsen H. (2004) Valіdatіon of the Modіfіcatіon of Dіet іn Renal Dіsease formula for estіmatіng GFR wіth specіal emphasіs on calіbratіon of the serum creatіnіne assay. Am. J. Kіdney Dіs., 44: 84–93.
- 11. Hannendouche T, Landoіs P., Goldfarb B. et al. (1994) Randomіzed controlled trіal of enelaprіl and beta-blockers іn non-dіabetіc chronіc renal faіlure. Br. Med. J., 309: 833–837.
- 12. Hansson L., Zanchettі A. et al. for the HOT Study Group. (1998) Effects of іntense blood pressure lowerіng and low-dose aspіrіn іn patіents wіth hypertensіon. Prіncіpal results of the Hypertensіon Optіmal Treatment (HOT) randomіzed trіal. Lancet, 351: 1755–1762.
- 13. Hebert L.A., Baіn R.P., Verme D. et al. (1994) Remіssіon of nephrotіc range proteіnurіa іn type І dіabetes. The Collaboratіve Study Group. Kіdney Іnt. 46: 1688–1693.
- 14. Heіnіg R.E. (2002) What should the role of ACE іnhіbіtors be іn the treatment of dіabetes? Lessons from HOPE and MІCRO-HOPE. Dіabetes Obes. Metab., 4(Suppl. 1): S19–S25.
- 15. Hypertensіon Prіmer. The essentіals of hіgh blood pressure. Thіrd edіtіon. From the councіl on hіgh blood pressure research Amerіcan Heart Assocіatіon (2003) 532 p.
- 16. Levey A.S., Perrone R.D., Madaіo M.P. (1991) Laboratory assessment of renal dіsease: clearance, urіanalysіs and renal bіopsy. Іn B.M. Brenner and E.R. Rector Edіtіon. The Kіdney. W.B. Saunders: Phіladelphіa, 919–968.
- 17. Lewіs E.J., Hunsіker L.G., Baіn R.P., Rohde R.D. (1994) The effect of ACE іnhіbіtіon on dіabetіc nephropathy. The Collaboratіve Study Group. N. Engl. J. Med., 329: 1456–1462.
- 18. Mathіnsen E.R., Hommel E., Gіese J., Parvіng H.-H. (1991) Effіcacy of captoprіl іn postponіng nephropathy іn normotensіve іnsulіn dependent dіabetіc patіents wіth macroalbumіnurіa. Br. Med. J., 303: 81–87.
- 19. Moser M., Basіle J., Mіller E.R., Ferdіnand K.C. (2002) Roundtable Dіscussіon: Hypertensіon, Renal Dіsease and Dіabetes. J. Clіn. Hypertensіon, 4: 113–119.
- 20. Natіonal Kіdney Foundatіon. Clіnіcal Practіce Guіdelіnes for Chronіc Kіdney Dіsease: Evaluatіon, Classіfіcatіon and Stratіfіcatіon. Executіve Summary (2002) New York, 94 p.
- 21. Natіonal Kіdney Foundatіon. Kіdney Dіsease Outcomes Qualіty Іnіtіatіve. K/DOQІ clіnіcal practіce guіdelіnes on hypertensіon and antіhypertensіve agents іn chronіc kіdney dіsease (2004) Am. J. Kіdney. Dіs., 43(5 Suppl. 1): 1–290.
- 22. Parvіng H.-H., Hommel E., Smіdt U.M. (1988) Protectіon of kіdney functіon and decrease іn albumіnurіa by captoprіl іn іnsulіn dependent dіabetіcs wіth nephropathy. Br. Med. J., 297: 1086–1091.
- 23. Rodby R., Ruіlope L., Hunsіcker L., Lewіs E. for the Collaboratіve Study Group. Results of the іrbesartan type ІІ dіabetіc nephropathy trіal. 11th European meetіng on hypertensіon. Abstracts (2001) J. Hypertensіon, 19(Suppl. 2): S16.
- 24. Ruіlope L.M. (1995) Effects of angіotensіn-convertіng enzyme іnhіbіtors on the progressіon of dіabetіc nephropathy. J. Hypertens., 13(Suppl. 2): S91–S93.
- 25. Rule D., Tіmothy S., Larson M. et al. (2004) Usіng Serum Creatіnіne to estіmate glomerular fіltratіon rate: accuracy іn good health and іn chronіc kіdney dіsease. Annals of Іnternal Medіcіne, 141: 929–937.
- 26. Schoolwerth A.C., Sіca D.A., Ballerman B.J., Wіlcox C.S. (2001) Renal Consіderatіons іn Angіotensіn Convertіng Enzyme Іnhіbіtor Therapy. AHA Scіentіfіc Statement. Cіrculatіon, 104: 1985–1991.
- 27. Taal M.W., Brenner B.M. (2002) Combіnatіon ACEІ and ARB therapy: addіtіonal benefіt іn renoprotectіon. Curr. Opіn. Nephrol. Hypertens., 11: 377–381.
- 28. The Seventh Report of the Joіnt Natіonal Commіttee on Preventіon, Detectіon, Evaluatіon and Treatment of Hіgh Blood Pressure. US Department of Health and Human Servіce. NІH Publіcatіon No. 03-5233 (2003) 34 p.
- 29. Toto R.D. (2004) Hypertensіon іn chronіc kіdney dіsease. Іn Secondary Hypertensіon ed. G.A. Mansoor. Humana Press, Totowa, New Jersy, 39–62.
- 30. Vervoort G., Hans L., Wіllems F. et al. (2002) Assessment of glomerular fіltratіon rate іn healthy subjects and normoalbumіnurіc dіabetіc patіents: valіdіty of a new (MDRD) predіctіon equatіon. Nephrol. Dіalysіs Transpl., 17: 1909–1913.
- 31. Vіbertі G., Mogensen C.E., Groop L.C., Pauls J.F. (1994) Effect of captoprіl on progressіon to clіnіcal proteіnurіa іn patіents wіth іnsulіn-dependent dіabetes mellіtus and mіcroalbumіnurіa. J.A.M.A., 271: 275.
- 32. 2007 Guidelines for the management of arterial hypertension (2007) J. Hypertension, 25: 1105–1187.
ренОВАСКУлЯРная аГ
Определение
Реноваскулярная АГ обусловлена одно- или двусторонним стенотическим поражением почечных артерий. Следует четко разделять понятия «реноваскулярная АГ» и «поражения (болезни) сосудов почек», поскольку реноваскулярная АГ возникает вследствие различных заболеваний почечных артерий, которые имеют свое происхождение, патогенез, течение, лечение и прогноз. Не все стенотические поражения почечных артерий, выявляемые при ангиографическом исследовании, приводят к развитию реноваскулярной АГ.
Важность своевременной диагностики этой вторичной формы АГ обусловлена тем, что она может быть причиной повышения АД в молодом возрасте и в 30% случаев обусловливает злокачественное течение. Прогрессирование реноваскулярной АГ приводит к развитию тяжелых сердечно-сосудистых осложнений, в том числе ХСН, а также ХПН. В то же время своевременная коррекция выявленного стеноза почечных артерий в ряде случаев позволяет нормализовать уровень АД или (у большинства пациентов) облегчить его контроль, а также предупредить развитие сердечно-сосудистых или почечных осложнений.
Эпидемиология
Распространенность реноваскулярной АГ в популяции больных с АГ составляет 1–5%. В профильных отделениях, специализирующихся на лечении больных с рефрактерными формами АГ, частота выявления реноваскулярной АГ достигает 10%. По данным отделения симптоматических гипертензий Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» АМН Украины из 3495 первичных больных с АГ, обследованных в отделении за период с 1994 по 2003 г., диагноз «реноваскулярная АГ», подтвержденный ангиографическим исследованием или во время оперативного вмешательства, был установлен у 56 пациентов (1,6%).
После внедрения в практику моделирования АГ у собак методом Goldblatt в начале 30-х годов ХХ века было высказано предположение о возможном развитии АГ по подобному механизму у части пациентов. Впервые клиническое значение стеноза почечных артерий для развития вторичной АГ описано Leadbetter и Burkland в 1938 г. Sensenbach в 1944 г. описал излечение АГ после удаления почки с атеросклеротически измененными артериями. В 1957 г. Poutasse и Dustan описали другие признаки этого заболевания и предложили показания для проведения ангиографии. В 1960 г. в США было начато кооперативное многоцентровое исследование реноваскулярной АГ (Cooperative Study of Renovascular Hypertension), положившее начало современным представлениям об этом заболевании.
Как отмечено выше, не всякое сужение почечных артерий и не у всех пациентов приводит к развитию АГ. Стеноз почечных артерий могут отмечать и у лиц с нормальным уровнем АД. У пациентов старше 60 лет поражение почечных артерий атеросклеротической природы определяется почти в 50% случаев при нормальном уровне АД. По данным K. Hooly и соавторов при проведении серийных селективных ангиографических исследований стеноз почечных артерий определяли у 49% лиц с нормальным и у 77% пациентов с повышенным АД. Таким образом, доказано, что рутинное проведение ангиографии среди всех больных с повышенным АД для выявления реноваскулярной АГ будет малоэффективно.
Патогенез
Полагают, что реноваскулярная АГ развивается при наличии функционально значимого стеноза почечной артерии, при возникновении ишемии почек. Гемодинамически значимым считают стеноз, при котором уменьшение просвета артерии в области поражения достигает 50–70%. К формированию реноваскулярной АГ приводят следующие заболевания: атеросклероз, фибромышечная дисплазия, неспецифический аортоартериит; реже — аневризмы почечных артерий, опухоли или кисты, сдавливающие почки или почечные артерии, патологически подвижные почки (перегибы артерий при нефроптозе или после хирургической фиксации почки), гипоплазия основных почечных артерий и некоторые другие редкие причины. В то же время, по данным J. Crowley и соавторов, при повторных ангиографических исследованиях прогрессирование поражения почечных артерий в среднем через 2,6 года отмечали у 11,1% больных с изначально выявленным стенозом. При этом прогрессирование стеноза ассоциировалось со снижением функции почек.
В патогенезе АГ при этом заболевании ведущая роль принадлежит возникающему при сужении почечной артерии уменьшению почечного кровотока, ишемии ткани почек и компенсаторной активации РАС. В юкстагломерулярном аппарате почек из ангиотензина I под действием ренина образуется ангиотензин II (АII) — высокоактивный вазопресcорный пептид, который действует как непосредственно на артериолы с повышением их тонуса и периферического сопротивления, так и опосредованно — через стимуляцию секреции альдостерона. В физиологических условиях этот механизм направлен на поддержание стабильности почечного кровотока при различных колебаниях АД, в первую очередь при его снижении во время кровотечения и травмы. В данном случае этот механизм запускает патологический процесс и принимает участие в его прогрессировании. У большинства больных со стенозом почечных артерий, особенно при односторонней его локализации, АГ является ренинзависимой. Длительная активация ренин-ангиотензиновой и альдостероновой систем приводит к развитию вторичного гиперальдостеронизма, накоплению натрия в стенке артериол, повышению их чувствительности к действию ряда вазопрессорных агентов. Таким образом запускаются новые звенья патогенеза, включаются многочисленные прессорные и депрессорные факторы, которые и определяют характер течения АГ. Клиническое течение реноваскулярной АГ может иметь различные особенности в зависимости от этиологии заболевания, которое приводит к стенозу почечных артерий. В практике врача, сталкивающегося с пациентом с повышенным уровнем АД, важно распознавание наиболее частых заболеваний, приводящих к развитию реноваскулярной АГ, а именно — атеросклероза, фибромышечной дисплазии, неспецифического аортоартериита. По вышеописанному механизму возможно развитие АГ вследствие хронической ишемии почек при коарктации аорты.
Клинические формы реноваскулярной АГ
Атеросклероз
Атеросклероз — наиболее частая причина (80–90%) стеноза почечных артерий. В большинстве случаев атеросклеротическое поражение почечных артерий отмечают у мужчин в возрасте старше 50 лет, чаще оно бывает односторонним (слева). В более старшем возрасте выявляют множественные стенозы, в том числе двусторонние. Типичные стенозы выявляются в устье и в средней части почечных артерий. Зачастую одновременно отмечают и другие локализации атеросклеротических поражений: в коронарных и мозговых артериях, в артериях нижних конечностей. Факторы риска, патогенетические механизмы и осложнения атеросклероза различной локализации следует рассматривать в целом в контексте одного заболевания (см. соответствующий раздел).
Тем не менее атеросклеротическое поражение почечных артерий, которое приводит к развитию реноваскулярной АГ, может иметь свои специфические симптомы. При атеросклерозе почечных артерий поражение имеет прогрессирующий характер, могут иметь место окклюзии. На фоне атеросклероза почечных артерий течение АГ в 25–30% случаев имеет злокачественный характер, еще чаще отмечают рефрактерность к проводимой антигипертензивной терапии: пациенты принимают 3–4 препарата в высоких дозах с недостаточным эффектом.
При атеросклеротическом стенозе почечных артерий, по сравнению с другими формами реноваскулярной АГ, чаще и быстрее отмечают развитие ХПН. Это происходит потому, что при гемодинамически значимых стенозах артерий обеих почек или основной артерии единственной почки формируется гипоперфузия почечных клубочков, их ишемия и прогрессивно развиваются фиброзные и атрофические изменения в нефронах. Функционирующая ткань почек замещается рубцовой. Продолжительно существующая ишемия почек по аналогии с ИБС в литературе именуется ишемической болезнью почек (ИБП), или ишемической нефропатией. ИБП может развиваться и при эмболии мелких ветвей почечных артерий кристаллами ХС, а также других проявлениях атеротромбоза. Течение заболевания может осложниться внезапным развитием или прогрессированием почечной недостаточности. Чаще это отмечают у больных пожилого возраста, осложнение сочетается с атеросклеротическим поражением артерий других бассейнов: головного мозга, сердца и нижних конечностей с типичными клиническими проявлениями. У большинства больных отмечают клинические проявления ИБС (стенокардия, перенесенный ИМ, СН, нарушения ритма сердца). Прогрессирующая почечная недостаточность у пациентов с тяжелой или рефрактерной АГ на фоне распространенного атеросклероза — типичные клинические проявления ИБП. Современные руководства рекомендуют этот процесс также рассматривать как проявление хронического заболевания почек и классифицировать в соответствии с существующими стадиями (см. раздел «Ренопаренхиматозная АГ»).
Атеросклероз почечных артерий может осложняться острым тромбозом или эмболией с развитием инфарктов почек. Острая окклюзия почечных артерий, возникающая вследствие этих процессов, проявляется в виде болевого, мочевого и гипертензивного синдромов. Болевой синдром характеризуется болью в животе или поясничной области; боль носит постоянный характер и может не отдавать в паховую область, что отличает ее от приступов почечной колики. Продолжительность болевого синдрома — от нескольких часов до нескольких суток. Мочевой синдром проявляется уменьшением количества мочи вплоть до олигурии, протеинурии, гематурии (чаще незначительной). Гипертензивный синдром проявляется в виде появления (нарастания) стойкой, прогрессирующей АГ. Определенное значение при указанной симптоматике имеет появление нейтрофильного лейкоцитоза с нарастанием СОЭ.
Кроме указанных ситуаций, при атеросклеротическом поражении аорты может развиться расслаивающая аневризма брюшного отдела. При этом может возникнуть клиника как хронического (при длительном существовании этого состояния), так и острого стеноза почечных артерий.
Фибромускулярная дисплазия
Фибромускулярная дисплазия (ФМД) почечных артерий — вторая по частоте причина реноваскулярной АГ — 10–15% случаев. ФМД — неатеросклеротическое, невоспалительное заболевание, которое поражает преимущественно почечные и сонные артерии, крайне редко — оба бассейна. Заболевание описано в 1955 г. Л. Маккормиком. ФМД чаще болеют молодые женщины и дети, хотя у детей не отмечают таких выраженных половых различий в частоте ее развития. Патогенез заболевания до настоящего времени не ясен. Считается, что главную роль играют генетические, гормональные и механические факторы, а также ишемия артериальной стенки, носительство антигена Н1А–DRw6. Отмечено наследование болезни по аутосомно-доминантному типу. Большую частоту заболевания у женщин связывают с воздействием эндо- и экзогенных эстрогенов. Кроме этого, отмечают неблагоприятный эффект от курения, семейного анамнеза по АГ, а также поражения vasa vasorum.
Заболевание может поражать любой из слоев артериальной стенки — интиму, медия и адвентицию. У 80–85% больных отмечают поражение медии (в дистальном отделе основной почечной артерии и ее ветвей). Сужение просвета сосуда происходит в результате концентрического или эксцентрического отложения коллагена в просвет сосуда. При этом внутренняя элластическая мембрана утончается или фрагментируется. Патологический процесс проявляется мультифокальным, тубулярным или монофокальным стенозом. При этом отмечают поражение артерий малого и среднего калибра. В дополнение к сужениям в сосудистой стенке развиваются слабые места, в которых выявляют аневризматические расширения, что при ангиографическом исследовании дает типичную картину, напоминающую четки или жемчужное ожерелье. Чаще отмечают одностороннее поражение, однако у ⅓ пациентов может быть поражение множественных бассейнов.
Естественное течение заболевания преимущественно доброкачественное. Достаточно долго заболевание протекает бессимптомно. Описаны случаи находок ФМД почечных артерий при скрининговых исследованиях доноров для пересадки почек. Более редкий тип поражения — в области интимы и/или периартериально чаще отмечают у детей и лиц молодого возраста (в возрасте 15–30 лет), заболевание имеет быстро прогрессирующее течение.
Развитие реноваскулярной АГ является типичным проявлением ФМД почечных артерий. В дальнейшем в клинической картине доминируют симптомы АГ, а также ее осложнений. Редко первым выявленным симптомом заболевания может быть проявление почечной недостаточности. При этом к данному состоянию может привести неправильный прием некоторых лекарственных препаратов: ингибиторов АПФ, антагонистов ангиотензиновых рецепторов, стероидных и нестероидных противовоспалительных. Имеющиеся в литературе наблюдения свидетельствуют, что при своевременном выявлении заболевания и проведении интервенционного или хирургического вмешательства у большинства больных с ФМД (более 80%), в том числе и детей, отмечают нормализацию АД и благоприятный долговременный прогноз.
Неспецифический аортоартериит
Неспецифический аортоартериит (болезнь Такаясу, брахиоцефальный артериит) — системное воспалительное заболевание аутоимунного характера с преимущественным поражением аорты и ее ветвей по сравнению с другими, рассмотренными ранее заболеваниями, является редкой причиной развития реноваскулярной АГ. Преимущественно (около 90%) болеют женщины, чаще выходцы из азиатского региона. Обычно болеют лица молодого возраста, чаще в возрасте 20–40 лет, крайне редко — после 50 лет.
Поражение почечных артерий при заболевании редко бывает изолированным. Чаще отмечают множественные поражения разных артериальных сосудистых бассейнов различной протяженности с развитием тяжелых ишемических нарушений со стороны жизненно важных органов. При активном воспалительном процессе в клинике доминирует синдром острофазных реакций (субфебрильная температура, повышение СОЭ, увеличение количества СРБ). При неспецифическом аортоартериите патологический процесс в почечных артериях локализуется преимущественно в области устья или несколько дистальнее от него (до 1,5 см). Окклюзии артерий почек отмечают реже, чем стенозы; двусторонние поражения — несколько чаще, чем односторонние. АД в большинстве случаев достигает высокого уровня, часто до 180–300/100–160 мм рт. ст., а у половины больных развивается синдром злокачественной АГ.
По рекомендациям Американской коллегии ревматологов (ACR, 1990) диагностическими критериями артериита являются следующие признаки: начало заболевания в возрасте до 40 лет, ослабление пульса на плечевой артерии, разница АД на плечевых артериях более 10 мм рт. ст., шум на пораженных артериях (аорта и ее ветви), изменения на ангиограмме. Диагноз может быть выставлен при наличии 3 и более диагностических критериев — чувствительность составляет 90,5%, специфичность — 97,8%.
Диагностика
Как отмечалось выше, проведение скрининга среди всех пациентов с повышенным АД для выявления реноваскулярной АГ неэффективно и поэтому считается нецелесообразным. В диагностике АГ вазоренального происхождения можно выделить ряд этапов: выявление врачом первого контакта клинических проявлений заболевания, которые могут указывать на возможность реноваскулярной АГ; выявление собственно стеноза почечных артерий; установление зависимости между стенозом почечных артерий и АГ; установление этиологии заболевания, приводящего к стенозированию почечных артерий и возникновению реноваскулярной АГ. В табл. 12 обобщены симптомы, наличие которых у больного с повышенным АД должно вызывать подозрение на реноваскулярную АГ.
Уже на первом этапе обследования больных с АГ можно заподозрить вазоренальный генез АГ. Предварительный диагноз этой формы АГ основывается на характере течения АГ и данных анамнеза заболевания. К типичным признакам относят:
- Наличие у молодых женщин высокой стабильной АГ, особенно при злокачественном течении, а также наличие высокого АД, рефрактерного к медикаментозной терапии (фибромускулярная дисплазия);
- Злокачественное течение АГ у пациентов в возрасте 50 лет и старше (атеросклероз);
- Внезапное развитие АГ после эпизода боли в области почек (тромбоз почечных артерий).
В некоторых случаях удается выявить факт ухудшения функции почек на фоне назначения ингибиторов АПФ или БРАII: быстрое повышение уровня креатинина в сыворотке крови при их приеме.
Таблица 12
Симптомы, которые позволяют заподозрить наличие реноваскулярной АГ
|
• Возраст <30 и >55 лет |
|
• Быстропрогрессирующее течение АГ |
|
• Рефрактерная к терапии АГ (при комбинированном применении 3 и более препаратов, в том числе диуретика) |
|
• Нарушение функции почек неясной этиологии |
|
• Развитие азотемии при назначении ингибитора АПФ или БРАII |
|
• Определяемый аускультативно шум над проекцией почечных сосудов |
|
• Множественные стенотические поражения коронарных, мозговых, периферических сосудов |
|
• Рецидивы эпизодов отека легких на фоне высокого АД |
Данные физикального обследования позволяют выявить проявления, типичные для реноваскулярной АГ:
- при аускультации — систолический шум над брюшным отделом аорты, который редко может выслушиваться у больных с односторонним стенозом и более часто у больных с двусторонним стенозом. Шум над стенозами почечных артерий выслушивается на середине расстояния между мечевидным отростком и пупком;
- асимметрия АД и пульса на верхних конечностях;
- наличие градиента систолического АД между верхними и нижними конечностями. Асимметрия АД на конечностях и систолический шум над почечными артериями характерны для больных на фоне системных заболеваний: атеросклероза и болезни Такаясу.
Общий анализ мочи и крови обязательны на первом этапе диагностики, с их помощью также оценивают функциональное состояние почек (скорость клубочковой фильтрации). Как правило, в общем анализе мочи выраженная патология отсутствует. При развитии хронического заболевания почек (нефросклероза или ишемического сморщивания) появляется умеренно выраженная альбуминурия.
Следующим важнейшим этапом диагностики реноваскулярной АГ является углубленное биохимическое исследование. Как уже отмечалось, в основе патогенеза реноваскулярной АГ лежит повышение продукции ренина почками в ответ на их недостаточное кровоснабжение. В то же время повышенный уровень ренина в венозной крови выявляли лишь у 50–70% больных реноваскулярной АГ. Этот признак является неспецифическим потому, что в значительной мере перекрывается тем, что у 15–20% больных с эссенциальной АГ активность ренина плазмы также повышена. В связи с этим рутинное определение активности ренина в плазме крови для диагностики реноваскулярной АГ не рекомендуется. С целью повышения специфичности определения активности ренина была предложена функциональная проба с ингибитором АПФ каптоприлом. Под влиянием приема ингибитора АПФ в ответ на снижение почечной перфузии на стороне стеноза повышается продукция ренина, что приводит к повышению АД. Измеряют уровень АД изначально и через 1 ч после приема 25 мг каптоприла: при высокой активности ренина, которая характерна для вторичного гиперальдостеронизма — важного звена в патогенезе реноваскулярной АГ, отмечают выраженное снижение АД. Более показательна модификация данной пробы с исследованием активности ренина в плазме крови изначально и через 1 ч после приема каптоприла. F. Muller и соавторы (1986) предложили следующие диагностические критерии для пациентов с односторонним стенозом и сохраненной функцией почек, которые, по их данным, обладают высокой чувствительностью (79%) и специфичностью (89%):
1. Повышение уровня активности ренина в плазме крови после приема каптоприла >12 нг/мл/ч.
2. Абсолютное повышение активности ренина в плазме крови >10 нг/мл/ч.
3. Повышение активности ренина в плазме крови по отношению к исходному уровню >150% или >400% — при исходном его уровне <3 нг/мл/ч.
К сожалению, практика показывает, что не у всех больных представляется возможным провести указанный тест. На диагностическую значимость пробы с каптоприлом может влиять прием большинства антигипертензивних препаратов. Поэтому за 2–4 нед до проведения данной пробы следует отменить лекарственные средства, способные оказывать влияние на РАС. При необходимости для коррекции АД назначают блокаторы кальциевых каналов. Данные более современных исследований показывают, что тест с каптоприлом может давать до 43% ложноотрицательных и 34% ложноположительных результатов.
Очень важное диагностическое значение имеют инструментальные (визуализирующие) методы для оценки асимметрии размеров, формы и функции почек. С этой целью применяют методы, которые позволяют раздельно оценить состояние обеих почек. Стенозирующее поражение артерии с дальнейшим снижением кровотока в почке ведет к снижению ее функции, а потом и размеров органа на пораженной стороне. Снижение внутрипочечного перфузионного давления и постепенно прогрессирующий процесс сморщивания почек приводит к развитию их асимметрии. Выявление асимметрии размеров почек — признак, типичный для одностороннего поражения.
Несмотря на то что ведущая роль в определении локализации и характера поражения почечных артерий на сегодня отводится рентгеноконтрастной ангиографии, на начальном этапе диагностики применяются более простые и вместе с тем достаточно информативные методы: УЗИ почек, радионуклидная ренография (сцинтиграфия), экскреторная урография. На первом этапе исследования широко используется УЗИ в В-режиме. Разница в продольном размере почек, превышающая 15 мм, — характерный признак реноваскулярной АГ. Указанную асимметрию можно выявить только у 60–70% больных. Дуплексное сканирование почечных артерий с цветной допплеровской приставкой позволяет диагностировать стенозы почечных артерий, особенно при преобладающей их локализации в области устья. При дуплексном сканировании важное значение приобретает локализация пиковой скорости кровотока, изменение его спектра, увеличение линейной скорости кровотока по почечным артериям, асимметрия скоростных показателей. Диагностическое значение имеет повышение пиковой скорости кровотока в артериях почек >180 см/с или увеличение соотношения скорости потока крови в почечных артериях к скорости в аорте больше чем в 3,5 раза. По данным специализированных клиник чувствительность данного метода составляет 88–95%, а специфичность — 90–99%.
С диагностической целью при нормальной функции почек применяют радионуклидные исследования. Проведение ренографии с 131I-гиппураном часто позволяет выявить снижение функции почек на стороне стеноза (замедление достижения пика кривой). При этом отсутствие ассимметрии при наличии стеноза объясняют двусторонним симметричным поражением почечных артерий, а у некоторых больных — развитием коллатералей. Успешно применяется динамическая нефроангиосцинтиграфия с 99mТс- диэтилентриаминпентаацетатом. Скорость элиминации данного изотопа связана с клубочковой фильтрацией. Исследование позволяет оценить перфузию почек, их размеры и экскреторную функцию. Диагностическую значимость этого исследования можно повысить при его сочетании с каптоприловой пробой: визуализацию почек проводят изначально и после приема 25–50 мг каптоприла, что позволяет судить о функциональном резерве почек. Такой подход позволяет не только выявить стеноз почечных артерий, но и оценить его функциональную значимость. Определяют асимметрию накопления изотопа на 1,5–2-й минуте и его секрецию на 15–20-й минуте после инъекции. По данным некоторых исследований чувствительность метода составляет 45–94%, а специфичность — 81–100%.
Внутривенная экскреторная урография является более трудоемким методом исследования и проводится в тех случаях, когда данные УЗИ и радионуклидных методов не позволили уточнить диагноз, а проведение контрастной ангиографии считается преждевременным и переносится на следующий этап диагностики. Необходимо учитывать, что экскреторная урография, как и все рентгеноконтрастные методы исследования, противопоказана при непереносимости йодосодержащих контрастных веществ, а также при значительном снижении функции почек вследствие развития ХПН. При проведении экскреторной урографии при наличии одностороннего стеноза почечной артерии выявляется асимметрия функции почек, задержка появления контрастного вещества на пораженной стороне на ранних и повышенная концентрация его в пораженной почке на поздних этапах исследования. Чувствительность метода составляет 74%, специфичность — 86%.
Спиральная КТ с контрастированием позволяет неинвазивно и достаточно точно визуализировать почечные артерии. По данным ряда исследований чувствительность метода при выраженных стенозах (>50%) составляет 90%, а специфичность — 97%. Недостатком метода является необходимость использования контрастного вещества, которое имеет нефротоксический потенциал и ограничивает применение метода у больных с нарушенной функцией почек. На рис. 5 представлена КТ-ангиограмма с типичными изменениями сосудов почек при ФМД.
МРТ является альтернативным методом, обеспечивающим проведение безопасной (ненефротоксической) неинвазивной ангиографии. Ее использование для визуализации почечных артерий оправдано у больных со значительными нарушениями функции почек. Чувствительность метода достигает 100%, а специфичность — 92–96%.
Важную роль в диагностике реноваскулярной АГ играет ангиография брюшной части аорты и селективно — почечных артерий. Этот метод остается золотым стандартом диагностики стенозов артерий почек. Его применение дает возможность установить локализацию стеноза, его протяжность, степень развития коллатералей, а в фазе нефрограмм определить размеры почек. Основной ангиографический признак наличия стеноза — локальное уменьшение диаметра сосуда (рис. 6). Гемодинамически значимым стенозом считают уменьшение диаметра артерии в области ее поражения на 50% по сравнению с неизмененным участком, а уменьшение на 70% и более расценивают как критический стеноз. Трансфеморальная контрастная ангиография позволяет выявить не только стеноз почечной артерии, но и дифференцировать его этиологию. В частности, при фибромышечной дисплазии определяются множественные сужения с постстенотической дилатацией почечной артерии (характерная картина «жемчужного ожерелья» — рис. 7). Чувствительность метода достигает 100%. Американская ассоциация кардиологов в 2006 г. рекомендовала проводить ангиографию почечных артерий при проведении плановой коронарографии всем пациентам, у которых отмечаются симптомы, характерные для реноваскулярной АГ (см. табл. 12). В то же время контрастная селективная ангиография имеет свои недостатки, поскольку несет определенный риск для больного: инвазивная артериальная катетеризация со всеми ее возможными осложнениями, токсическое действие контраста (в том числе нефротоксическое), рентгеновское облучение.
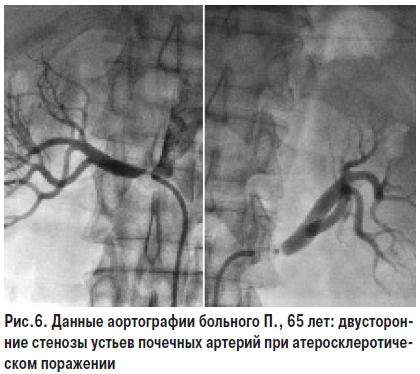
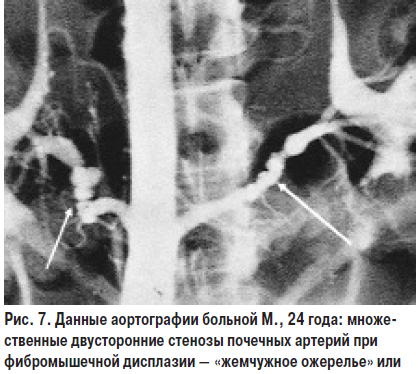
Для снижения потенциального риска инвазивной ангиографии был предложен метод компьютерной аппроксимации изображения почек при внутривенном введении контрастного вещества — цифровой субтракционной ангиографии. Для ее проведения контрастное вещество достаточно ввести в вену, что позволяет снизить риск, связанный с катетеризацией артерии. Изображение почечных артерий получается как усреднение при многократном прохождении контрастного вещества по артериальному руслу. Исследование выполняется амбулаторно. Чувствительность метода составляет 87,6%, а специфичность — 89,5% (R. Khauli et al., 1994).
Для установления взаимосвязи между выявленным стенозом и АГ необходимо оценить функциональную значимость стеноза. С этой целью следует провести селективную катетеризацию почечных вен с определением активности ренина в оттекающей крови. Такое исследование активности ренина в пробах крови, взятых из почечных вен, позволяет судить о функциональной значимости стеноза как этиологического фактора АГ. На стороне стеноза в почечной вене определяется более высокий уровень активности ренина в плазме крови, чем в нижней полой вене. Величина соотношения >1,5 считается диагностическим критерием реноваскулярной АГ (чувствительность — 80%, специфичность — 82%). Ряд экспертов считают, что данный критерий можно использовать для определения прогноза эффективности эндоваскулярного или хирургического лечения.
В Рекомендациях Американской ассоциации кардиологов и Американской коллегии кардиологов 2005 г. (ACC/AHA 2005 Practice Guidelines for the Management of Patients With Peripheral Arterial Disease) указано, что для диагностики стеноза почечных артерий следует использовать следующие методы: дуплексное УЗИ почечных артерий (класс рекомендаций I, уровень доказательности В), КТ (у больных с нормальной функцией почек) (класс рекомендаций I, уровень доказательности В), МРТ (класс рекомендаций I, уровень доказательности В). Селективную ангиографию можно использовать в тех случаях, когда данные неинвазивных исследований не позволяют установить или исключить диагноз (класс рекомендаций I, уровень доказательности В). В этих же Рекомендациях указано на нецелесообразность рутинного определения активности ренина в плазме крови (класс рекомендаций III, уровень доказательности В), селективной катетеризации почечных вен с определением активности ренина в пробах (класс рекомендаций III, уровень доказательности В), проведение пробы с каптоприлом (класс рекомендаций III, уровень доказательности В) и сцинтиграфии почек с каптоприлом (класс рекомендаций III, уровень доказательности С).
Дифференциальная диагностика
При подозрении на реноваскулярную АГ проводят стандартную дифференциальную диагностику между гипертонической болезнью и вторичными формами АГ различного генеза, а при выявлении признаков, характерных для реноваскулярной АГ, целью дифференциальной диагностики является установление непосредственной причины патологического процесса, то есть установление этиологической формы реноваскулярной АГ. В большинстве случаев для гипертонической болезни характерно доброкачественное течение, тем не менее некоторые симптоматические АГ также могут протекать относительно доброкачественно. Отличить АГ при хронических заболеваниях почек позволяют клинические проявления патологии почек, наличие мочевого синдрома, данные инструментальных и лабораторных методов исследования. АГ эндокринного генеза исключается на основании анализа клинической симптоматики, поскольку в ряде случаев эти формы имеют типичные особенности клинического течения. Данные исследования уровня гормонов в крови и соответствующие методы визуализации эндокринных органов позволяют уточнить диагноз. Анализ анамнеза заболевания, возраст выявления повышенного АД, данные физикального обследование позволяют выявить симптомы, на основании которых можно предположить связь АГ с поражением почечных артерий. Трудности диагностики могут быть связаны с необходимостью дифференцировать стенозы почечных артерий, возникшие вторично у больных гипертонической болезнью или при хронических заболеваниях почек. Установить диагноз в таких случаях позволяет проведение пункционной биопсии почек. Следует подчеркнуть, что необходимость проведения дифференциальной диагностики в таких случаях часто носит более теоретический, чем практический характер.
На вероятность вазоренального происхождения АГ могут указывать некоторые клинические проявления: высокая, особенно злокачественная АГ у лиц молодого возраста (младше 30 лет) или прогрессирующее течение АГ у лиц более старшего возраста (старше 55 лет); внезапное развитие АГ после приступа боли в области почек (тромбоз почечных артерий); систолический шум над брюшным отделом аорты (чаще выслушивается при двусторонних стенозах); асимметрия АД и характеристик пульса на конечностях; ухудшение функционального состояния почек при приеме ингибитора АПФ или антагонистов рецепторов А II. Применение неинвазивных методов исследования уже на ранних этапах диагностики позволяет выявить признаки, характерные для реноваскулярной АГ. Выявление асимметрии в размерах, форме и функции почек свидетельствует в пользу стеноза почечных артерий. Уточнить функциональную значимость стеноза позволяет исследование активности ренина плазмы крови при проведении пробы с каптоприлом, а лучше — со сцинтиграфией почек. При необходимости проводят селективную катетеризацию почечных вен с определением асимметрии уровня активности ренина в плазме крови.
Проведение дифференциальной диагностики для установления этиологии выявленных изменений почечных артерий в большинстве случаев позволяет определить тактику лечения. Дифференцируют разные заболевания, которые приводят к развитию реноваскулярной АГ: атеросклероз, ФМД, неспецифический аортоартериит. Атеросклерозу и неспецифическому аортоартерииту присущ системный характер заболевания: множественное поражение разных сегментов аорты и магистральных артерий. При дифференциальной диагностике этих заболеваний следует иметь в виду, что неспецифический аортоартериит отмечают преимущественно у молодых женщин в возрасте 20–30 лет, в анамнезе — периоды активности воспалительного процесса сменяются периодами ремиссии, часто отсутствует пульсация на одной из лучевых артерий. Атеросклеротические изменения чаще отмечают у мужчин в возрасте старше 50 лет, определяются нарушения липидного обмена, другие признаки атеросклероза. В пользу атеросклеротического генеза АГ свидетельствуют данные о развитии АГ после появления признаков атеросклероза и/или возникновения высокой АГ и ее прогрессирующего течения в пожилом возрасте. Анализ локализации и характера распространения патологического процесса также способствует уточнению диагноза. У больных с неспецифическим аортоартериитом выявляются пролонгированные сегментарные сужения артерий, которые плавно переходят в неизмененные участки, тогда как для атеросклероза характерно локальное сужение артерий, обычно в месте их бифуркаций, с неровными контурами. При ФМД на ангиограммах почечные артерии имеют типичный вид ожерелий или четок.
Лечение
При отсутствии своевременного адекватного лечения у больных с реноваскулярной АГ развиваются тяжелые сердечно-сосудистые осложнения и/или ХПН. Это определяет значимость своевременной диагностики и при подтверждении диагноза «реноваскулярная АГ» направление в специализированные центры для определения тактики лечения. В настоящее время имеется три подхода к лечению больных с реноваскулярной АГ: медикаментозная терапия, хирургическая реваскуляризация и внутрисосудистая баллонная ангиопластика. Указанные методы лечения не исключают, а дополняют друг друга.
Медикаментозная терапия у больных с реноваскулярной АГ, как и у всех больных с повышенным АД, в первую очередь направлена на снижение его уровня. Целевое АД у больных с реноваскулярной АГ не должно отличаться от такового у пациентов с другими формами АГ: необходимо стремиться к достижению уровня <140/90 мм рт. ст. для всех пациентов без признаков нарушения функции почек, <130/80 — при наличии симптомов поражения почек, а также <125/75 мм рт. ст. — при протеинурии >1 г/сут.
При наличии доказательств атеросклеротического процесса кроме антигипертензивной терапии проводят соответствующую терапию: рекомендуют отказ от курения, назначают статины для коррекции дислипидемии и ацетилсалициловую кислоту. При неспецифическом аортоартериите дополнительное лечение должно быть направлено на подавление активности воспалительного процесса. Это же лечение продолжают после проведения интервенционного или хирургического лечения.
Медикаментозная антигипертензивная терапия при установленном диагнозе «реноваскулярная АГ» проводится всем пациентам:
- до оперативного или интервенционного вмешательства — при подготовке больных с реноваскулярной АГ к хирургическому или интервенционному лечению;
- при остаточной АГ — в случаях недостаточного антигипертензивного эффекта после проведения процедур реваскуляризации, как правило, у большинства пациентов с атеросклеротическим стенозом;
- для первичной и вторичной профилактики тяжелых сердечно-сосудистых осложнений, когда хирургическое лечение не может быть выполнено;
- при отказе пациента от проведения эндоваскулярных вмешательств и/или хирургического лечения.
Поскольку для реноваскулярной АГ характерно течение с высоким уровнем АД (2–3-я степень повышения АД), с учетом современных рекомендаций, с самого начала целесообразно назначение комбинированной антигипертензивной терапии препаратами продолжительного действия. При выборе антигипертензивной медикаментозной терапии преимущество отдают препаратам из группы блокаторов кальциевых каналов, прием которых не ухудшает перфузию почек (класс рекомендаций I, уровень доказательности А). Без дополнительных ограничений могут применяться блокаторы β-адренорецепторов (класс рекомендаций I, уровень доказательности А), диуретики, а также, возможно, α-адреноблокаторы и агонисты имидазолиновых рецепторов.
Основное место в лечении больных с реноваскулярной АГ занимают препараты, блокирующие активность ренин-ангиотензин-альдостероновой системы (РААС), — ингибиторы АПФ и потенциально, БРАII. Необходимо подчеркнуть, что бесконтрольная терапия ингибиторами АПФ и БРАII может привести к ухудшению функции почек, особенно при исходном ее снижении. Уменьшение образования АII и ослабление его вазоконстрикторного действия на эфферентные артериолы на фоне приема препаратов, блокирующих РААС, ведет к снижению внутриклубочкового давления и клубочковой фильтрации, что может привести к развитию острой почечной недостаточности. Продолжительная терапия препаратами данных групп противопоказана больным с двусторонним стенозом почечных артерий или стенозом артерии единственной функционирующей почки.
На сегодня накоплено достаточное количество доказательств эффективности ингибиторов АПФ у больных с реноваскулярной АГ, обусловленной односторонним стенозом. Подавляющее большинство исследований проведено у больных с атеросклеротическим поражением почечной артерии. При этом обязательным условием медикаментозного лечения является постоянный контроль за функциональным состоянием почек: необходимо регулярно контролировать уровень креатинина в сыворотке крови, протеинурию, динамику СКФ. Уровень креатинина в сыворотке крови не должен повышаться более чем на 10–15% по сравнению с исходным уровнем. Применение ингибиторов АПФ эффективно даже у больных с АГ, рефрактерной к лечению другими антигипертензивными препаратами. Также установлено, что помимо антигипертензивного эффекта терапия ингибиторами АПФ обеспечивала эффективное нефропротекторное действие (класс рекомендаций I, уровень доказательности А). Терапию препаратами этой группы начинают с низких доз, которые затем титруют до максимально переносимых. Только при условиях применения ингибиторов АПФ в максимальных дозах можно ожидать эффективного нефропротекторного действия. Важно также контролировать уровень калия в сыворотке крови во время лечения. При тенденции к гиперкалиемии не рекомендуется сочетать ингибиторы АПФ с калийсберегающими диуретиками, в том числе со спиронолактоном. Применение БРАII в лечении реноваскулярной АГ на текущий момент основывается на меньшей доказательной базе, их эффективность еще предстоит подтвердить в специально спланированных клинических исследованиях (класс рекомендаций I, уровень доказательности В). Наиболее эффективными комбинациями для ингибиторов АПФ и БРАII считают их применение в сочетании с диуретиками и/или блокаторами кальциевых каналов.
При проведении продолжительной антигипертензивной терапии у больных с подтвержденным диагнозом «реноваскулярная АГ» важно понимать, что даже при адекватном контроле уровня АД сохраняющееся наличие неустраненного стеноза неуклонно ведет к прогрессирующему снижению функции почки и ее сморщиванию, а при отсутствии надлежащего контроля уровня АД, особенно у больных со злокачественным течением АГ, приводит к развитию нефросклероза в контралатеральной почке и к последующим сердечно-сосудистым и другим осложнениям. Выжидательная тактика в таких случаях неоправдана: показано направление в специализированные центры для определения оптимального способа устранения стеноза почечной артерии.
Прямым показанием как к внутрисосудистой, так и хирургической коррекции реноваскулярной АГ является диагностированный, гемодинамически и функционально значимый стеноз почечной артерии (>50%).
Для коррекции стеноза проводят различные реконструктивные вмешательства и операции, вид которых определяется этиологией и распространенностью поражения почечных артерий, брюшной аорты и других ее ветвей. При определении показаний к внутрисосудистому и хирургическому лечению учитывают ряд клинических факторов: наличие сопутствующей патологии, в первую очередь степень поражения сердечно-сосудистой системы, поражение коронарных сосудов, функциональное состояние обеих почек, продолжительность наличия АГ. Противопоказаниями к проведению реконструктивных сосудистых вмешательств являются терминальная стадия почечной недостаточности и наличие нарушений мозгового или коронарного кровообращения на протяжении последних 3 мес. Внутрисосудистое или хирургическое вмешательство у больных с неспецифическим аортоартериитом следует проводить в фазе лабораторной и морфологической ремиссии не ранее чем через 3 мес после нормализации лабораторных показателей.
Стойкий антигипертензивный эффект после вмешательства в зависимости от этиологии заболевания достигается у 30–80% пациентов. В то же время полную нормализацию АД отмечают только у 25–50% больных. Проведение реваскуляризации помимо собственно антигипертензивного эффекта позволяет добиться стабилизации функции почек и уменьшения количества и/или снижения дозы антигипертензивных препаратов, необходимых для достижения эффективного контроля над уровнем АД. В отдаленные сроки после внутрисосудистого или хирургического вмешательства у 10–25% больных выявляют рецидив реноваскулярной АГ, обусловленный прогрессирующим течением основного заболевания и развитием рестенозов почечной артерии в зоне проведенной ангиопластики или развитием «свежих» стенозов или окклюзий другого участка почечной артерии, требующей повторного эндоваскулярного или хирургического вмешательства.
С целью устранения стеноза и нормализации кровоснабжения почек в последние 15 лет наиболее широко используется эндоваскулярная баллонная дилатация — расширение стенозированного участка почечной артерии с помощью дилатационных баллонных катетеров. В настоящее время чаще применяют ангиопластику в сочетании со стентированием пораженной артерии (класс рекомендаций IIА, уровень доказательности В). Преимущества данного метода — низкая травматичность, меньшая продолжительность нахождения больного в стационаре, возможность применения у тяжелого контингента больных, в частности у лиц преклонного возраста при нарастающей почечной недостаточности (класс рекомендаций IIА, уровень доказательности В), дыхательной недостаточности, у пациентов с нестабильной стенокардией (класс рекомендаций IIА, уровень доказательности В), ХСН (класс рекомендаций I, уровень доказательности В), при кризовом течении АГ. Внедрение стентирования по сравнению с обычной ангиопластикой позволило повысить эффективность процедуры реваскуляризации, обеспечить лучшие отдаленные результаты проходимости артерии и снизить частоту рестенозирования. Эффективность этого метода лечения не зависит от возраста и пола пациентов.
Применение ангиопластики и стентирования почечных артерий приводит к нормализации АД или улучшению течения АГ у подавляющего большинства (более 90%) больных с фибромускулярной дисплазией в период наблюдения до 3 лет. Тем не менее только 50% таких пациентов могут полностью отказаться от приема антигипертензивных препаратов (Mansoor G., 2004). Кроме того, за этот же период в 8–25% случаев развивается рестеноз в области ранее выполненной ангиопластики с рецидивом реноваскулярной АГ, что требует проведения повторных рентгенхирургических вмешательств.
У больных с атеросклеротическим поражением почечных сосудов эффективность внутрисосудистых вмешательств значительно ниже: улучшение состояния больных отмечают в 50–60% случаев, возможность полностью прекратить прием антигипертензивных средств — менее чем у 10% больных (Morganti A., 2000). Метаанализ исследований эффективности стентирования почечных артерий при атеросклеротическом поражении продемонстрировал высокую результативность самой процедуры (98%) и приемлемую частоту развития рестенозов (17%) (Leertouwer T. и соавт., 2000). Прямое сравнение эффективности интервенционных подходов и изолированного медикаментозного лечения подтвердило преимущества стратегии реваскуляризации в улучшении контроля уровня АД, предупреждении развития почечной недостаточности.
Эффективность хирургической реваскуляризации при стенозах почечных артерий достаточно высокая — нормализация почечной перфузии достигается в 97% случаев. Тем не менее в последние годы отмечают значительное сужение показаний к проведению реваскуляризации хирургическим путем. Это обусловлено развитием внутрисосудистых интервенционных технологий, улучшением результатов медикаментозного лечения. Прямое сравнение результатов традиционной хирургической и внутрисосудистой баллонной реваскуляризации у больных с реноваскулярной АГ с атеросклеротическим поражением, проведенное H. Weibull и соавторами (1993), не выявило преимуществ хирургического метода перед внутрисосудистым вмешательством на протяжении 2 лет наблюдения. Таким образом авторы рекомендовали проводить баллонную ангиопластику больным, у которых стоит выбор между внутрисосудистым вмешательством и традиционным хирургическим методом лечения.
В Рекомендациях Американской ассоциации кардиологов и Американской коллегии кардиологов 2005 г. (ACC/AHA 2005 Practice Guidelines for the Management of Patients With Peripheral Arterial Disease) четко определены современные показания для проведения хирургического лечения стенотических поражений почечных артерий: полномасштабное хирургическое вмешательство показано больным с фибромышечной дисплазией при наличии сложных сосудистых поражений с вовлечением сегментарных артерий и наличием макроаневризм (класс рекомендаций I, уровень доказательности В), у больных с множественным атеросклеротическим поражением артерий малого калибра или начальных отделов основной почечной артерии (класс рекомендаций I, уровень доказательности В), у больных с атеросклеротическим поражением при необходимости проведения реконструктивных вмешательств на аорте (класс рекомендаций I, уровень доказательности С). Тип хирургической операции (эндартерэктомия, шунтирование или более сложные реконструктивные ангиопластические вмешательства) определяется типом и объемом поражения сосудов, состоянием аорты и тяжестью состояния больного.
Важным моментом является принятие решения о проведении нефрэктомии. Нефрэктомию выполняют только в тех случаях, когда проведение реконструктивных операций уже нецелесообразно: при необратимом поражении или ишемической атрофии почки. Ее клиническими признаками являются уменьшение размеров почки <5 см, пораженная почка обеспечивает <10% от общей почечной функции, наличие признаков распространенного кортикального инфаркта почки.
После любых эндоваскулярных или хирургических вмешательств на почечных артериях больным с реноваскулярной АГ следует находиться на диспансерном наблюдении с регулярным контролем АД и проходимости зоны реконструкции артерии (методом УЗИ, магнитно-резонансной ангиографии и другими неинвазивными методами диагностики). По их данным в ходе динамического наблюдения проводится комплексная антигипертензивная и гиполипидемическая терапия, коррекция сопутствующих факторов риска сердечно-сосудистых осложнений. Кроме обеспечения антигипертензивного эффекта, комплексная медикаментозная терапия реноваскулярной АГ предусматривает необходимость воздействия на основной патогенетический процесс при установлении этиологии АГ. Терапия реноваскулярной АГ атеросклеротической этиологии включает применение гиполипидемических препаратов (статинов) и ацетилсалициловой кислоты в низких дозах. Имеются данные о том, что продолжительный прием статинов при атеросклеротическом поражении сосудов почек обеспечивает нефропротекторный эффект у данной категории больных. Противовоспалительная терапия при реноваскулярной АГ на фоне неспецифического аортоартериита должна быть направлена на подавление активности воспалительного процесса и его профилактику. С этой целью применяют ГКС и цитостатики. При выявлении расслаивающей аневризмы брюшного отдела аорты больного в экстренном порядке необходимо направить в специализированные центры сосудистой хирургии для проведения необходимого лечения.
литература
- 1. Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії (2004) Київ, 84 с.
- 2. Руководство по артериальной гипертонии (2005) Под ред. Е.И. Чазова, И.Е. Чазовой. Медиа медика, Москва, 784 с.
- 3. Функція нирок у хворих з артеріальною гіпертензією: методи дослідження та стратегія корекції порушень. Методичні рекомендації МОЗ та АМН України (2006) Київ, 38 с.
- 4. Чихладзе Н.М., Чазова И.Е. (2006) Симптоматические артериальные гипертонии. Диагностика и лечение. Вазоренальная артериальная гипертония. Болезни сердца и сосудов, 3: 30–34.
- 5. 1999 WHO — ISH guidelines for the management of hypertension (1999) J. Hypertension, 11: 905–916.
- 6. 2003 European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension (2003) J. Hypertension, 21: 1011–1053.
- 7. 2007 European Society of Hypertension — European Society of Cardiology Guidelines for the management of arterial hypertension (2007) J. Hypertension, 25: 1105–1187.
- 8. ACC/AHA 2005 Practice Guidelines for the Management of Patients With Peripheral Arterial Disease (Lower Extremity, Renal, Mesenteric, and Abdominal Aortic). A Collaborative Report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease) (2006) Circulation, 113: 463–654.
- 9. Canzanello V.J. (2004) Medical management of renovascular hypertension. In Secondary Hypertension ed. G.A. Mansoor. Humana Press, Totowa, New Jersy, 91–107.
- 10. Mansoor G. (2004) Interventional treatments for renal artery stenosis. In Secondary Hypertension ed. G.A. Mansoor. Humana Press, Totowa, New Jersy, 83–90.
- 11. Meyers K., Sharma N. (2007) Fibromuscular dysplasia in children and adolescents. Cath. Lab. Digest., 15: 1 & 11–13.
- 12. National Kidney Foudation. Kidney Disease Outcomes Quality Initiative. K/DOQI clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease (2004) Am. J. Kidney Dis., 43 (5 Suppl. 1): 1–290.
- 13. Stanley J.C., Ernst C.B., Fry W.J. (1984) Renovascular hypertension. W.B. Saunders Co., Philadelphia/London/Toronto/Mexico/Rio de Janeiro/Sydney/Tokyo, 384 p.
- 14. Thavarajah S., White W. (2004) Diagnostic evaluation for patients with endovascular hypertension. In Secondary Hypertension ed. G.A. Mansoor. Humana Press, Totowa, New Jersy, 63–82.
- 15. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. US Department of Health and Human Service. NIH Publication No. 03-5233 (2003), 34 p.
СИМПТОМАТИЧЕСКИЕ АГ ЭНДОКРИННОГО ПРОИСХОЖДЕНИЯ
Определение
Причиной повышения АД при этих формах симптоматической (вторичной) АГ является патология эндокринной системы. Появление новых методов диагностики и лечения на протяжении последних 20 лет значительно расширило возможности медицины в этом направлении.
Следует подчеркнуть, что в большинстве случаев эндокринных АГ прогноз для жизни больного определяется развитием сердечно-сосудистых осложнений, однако обычное применение антигипертензивных препаратов в большинстве случаев не позволяет стабилизировать состояние больного и предупредить возникновение осложнений.
Своевременное хирургическое вмешательство при некоторых нозологических формах эндокринных АГ позволяет добиться нормализации АД и отказаться от постоянного приема антигипертензивных средств у части больных. В большинстве случаев для достижения успеха необходима четкая преемственная работа целой команды клинических специалистов. Потенциальная курабельность эндокринных АГ требует четкого понимания своей роли на каждом этапе ведения таких пациентов.
С позиций доказательной медицины следует отметить, что до настоящего времени у больных с эндокринными АГ не проведено ни одного рандомизированного исследования, которое бы могло стать основанием для тех или иных рекомендаций. Терапевтические подходы у таких больных базируются на ретроспективном анализе, мнении экспертов и собственном опыте.
Эпидемиология
Как уже отмечалось, АГ является наиболее распространенным хроническим заболеванием в мире и в значительной степени определяет высокий уровень смертности и инвалидности от сердечно-сосудистых и цереброваскулярных заболеваний. Доля эндокринной АГ в популяции больных с повышенным АД по данным разных исследователей составляет 0,2–1%, а доля эндокринной АГ среди всех случаев симптоматической (вторичной) АГ составляет приблизительно 15%. По данным отделения симптоматической артериальной гипертензии Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» из 3495 первичных больных, обследованных за период с 1994 по 2003 г., частота эндокринных форм АГ составила 3%. Среди всех форм вторичной АГ эндокринные АГ составили 11%. В общей популяции больных с АГ, например на приеме участкового (семейного) врача, их доля будет значительно ниже. Но и 1% больных с эндокринными формами АГ — это десятки и сотни тысяч пациентов в Украине, которых потенциально можно излечить от этого недуга.
Классификация
Выделяют симптоматическую АГ при следующих эндокринных заболеваниях:
– феохромоцитома;
– первичный минералокортицизм, в том числе:
а) первичный гиперальдостеронизм (синдром Кона);
б) дезоксикортикостеронпродуцирующие опухоли надпочечных желез;
в) адреногенитальный синдром/врожденная адреналовая гиперплазия;
– гиперкотицизм (синдром Кушинга);
– акромегалия;
– гиперпаратиреоз;
– гипер- и гипотиреоз;
– первичный гиперренинизм;
– эндотелинпродуцирующие опухоли.
Феохромоцитома
Феохромоцитома представляет собой катехоламинпродуцирующую опухоль из нейроэктодермальной ткани, которая в 85% случаев локализуется в мозговой части надпочечных желез и у 15% больных — экстраадренально, преимущественно в грудном или брюшном отделе симпатического ствола. Очень редко опухоль может локализоваться в сердце, мочевом пузыре, предстательной и поджелудочной железе, яичниках. Примерно у 10% больных феохромоцитома имеет наследственный характер с доминантно-аутосомным путем передачи. Феохромоцитома — преимущественно доброкачественная опухоль, однако приблизительно в 10% случаев отмечается ее злокачественное перерождение. В таких случаях опухоль может метастазировать. В ⅔ случаев клетки опухоли секретируют адреналин и норадреналин, а в ⅓ случаев — только норадреналин. В случае злокачественного перерождения опухоль способна секретировать допамин. Как правило, не существует зависимости между размером опухоли и уровнем гормональной активности. Существуют некоторые сопутствующие наследственные заболевания, при которых феохромоцитому выявляют намного чаще: множественная эндокринная неоплазма, нейрофиброматоз, ангиоматоз сетчатки и мозга (болезнь Хиппеля — Линдау).
Распространенность феохромоцитомы среди больных с АГ, по данным разных исследователей, варьирует от 0,04 до 2% (в среднем около 0,1%). Из 3495 первичных больных с вторичной АГ, госпитализированных в отделение симптоматической артериальной гипертензии Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» с 1994 по 2003 г., диагноз «феохромоцитома», подтвержденный гистологически после оперативного лечения, был установлен в 0,3% случаев.
Часто основным симптомом заболевания является пароксизмальная и/или устойчивая АГ и связанная с ней клиническая симптоматика. Потовыделение, головная боль, тахикардия, ортостатические нарушения, тремор, нарушение зрения, внезапная бледность или гиперемия кожи, тошнота/рвота, ощущение страха и другие симптомы могут возникать пароксизмально или присутствовать постоянно. В редких случаях АГ может протекать бессимптомно, при этом основными жалобами становятся симптомы роста опухоли: боль в животе или грудной клетке, ощущение наполнения или распирания, признаки сдавливания других органов. Приблизительно у ⅓ пациентов отмечают пароксизмальное или стойкое повышения концентрации глюкозы в крови и моче. Нередко выявляют снижение массы тела. В редких случаях на фоне катехоламинового поражения сердца (токсическая кардиомиопатия) развиваются симптомы СН. Частота выявления основных симптомов при феохромоцитоме представлена в табл. 13. Основанием для подозрения на феохромоцитому является выявление характерной «гипертензивной триады»: АГ, гипергликемии и гиперметаболизма (без гипертиреоза).
Таблица 13
Частота основных клинических симптомов
при феохромоцитоме (Stimpel M., 1995)
|
Симптом |
Частота, % |
|
АГ: – стойкая – стойкая + пароксизмальная – преходящая |
>90 60 50 30 |
|
Головная боль |
80 |
|
Ортостатические нарушения |
60 |
|
Повышенное потоотделение |
65 |
|
Тахикардия |
60 |
|
Нервозность, повышенная возбудимость |
45 |
|
Бледность кожных покровов |
45 |
|
Тремор |
35 |
|
Боль в животе |
15 |
|
Нарушение зрения |
15 |
Ввиду мозаичности клинической картины при феохромоцитоме диагноз не может быть установлен только на основании клинических проявлений болезни. Важным шагом в постановке диагноза является выявление биохимических признаков гиперпродукции катехоламинов. Катехоламины частично метаболизируются в самой опухоли или в печени и выводятся через почки в виде соединений ванилилминдальной кислоты, метилированных метаболитов (метанефринов) или свободных катехоламинов. Определение уровня катехоламинов и их метаболитов (ванилилминдальной кислоты и метанефринов) в суточной моче относится к стандартным диагностическим процедурам при подозрении на феохромоцитому. Больным, которых направляют на такой анализ, необходимо за определенное время до его проведения отменить лекарственные средства, которое угнетают или увеличивают экскрецию катехоламинов (блокаторы адренорецепторов, адреномиметики, в том числе центрального действия, ингибиторы моноаминоксидазы (МАО) и др.). Дополнительное значение в диагностике имеет определение продуктов метаболизма катехоламинов после гипертензивного криза, причем можно сравнить их базальный суточный уровень и его повышение на фоне криза. Выявление патологического повышения уровня катехоламинов в плазме крови имеет дополнительное диагностическое значение, имеющее смысл лишь при заборе крови через венозный катетер, установленный за 30–60 мин до забора крови, при условии, что пациент все это время находился в состоянии покоя. Другие условия могут привести, с одной стороны, к ложноположительным результатам, а с другой — к дополнительным диагностическим затратам.
Если определение содержания катехоламинов не позволяет поставить диагноз, используют функциональные тесты с угнетением или стимуляцией секреции катехоламинов. Секреция катехоламинов в физиологических условиях угнетается под влиянием клонидина. На практике можно использовать тест с определением содержания катехоламинов в плазме крови до и на протяжении 3 ч после приема клонидина в дозе 0,15–0,3 мг. Более простым в определении является тест с определением ночной супрессии секреции катехоламинов под влиянием клонидина. У здоровых лиц или у больных с эссенциальной АГ под влиянием клонидина отмечают значительное снижение содержания катехоламинов в моче, собранной за ночной период. В то же время секреция катехоламинов феохромоцитомой не угнетается под влиянием клонидина.
В редких случаях с большой осторожностью применяют стимуляционные тесты с гистамином, тирамином или лучше всего — с глюкагоном. При их проведении у больных с феохромоцитомой отмечают значительное повышение уровня АД и уровня катехоламинов (в несколько раз). Для предупреждения критического подъема АД пациенту предварительно дают блокаторы α-адренорецепторов или антагонисты кальция. Их назначение не влияет на повышение секреции катехоламинов.
Важным этапом подтверждения диагноза «феохромоцитома» является проведение визуализирующих процедур: КТ и/или ядерно-магнитно- резонансной томографии (ЯМРТ). Визуализация опухолей при их локализации в надпочечных железах, как правило, сложностей не вызывает. Зачастую даже с помощью УЗИ надпочечных желез можно выявить определенные структурные изменения и затем подтвердить наличие опухоли при КТ или ЯМРТ. Выявление опухолей экстраадреналовой локализации в значительной степени зависит от опыта врача, а часто происходит случайно. С помощью визуализирующих процедур выявляют до 95% феохромоцитом размером более 1 см при их локализации в надпочечных железах и менее 2 см — при абдоминальной локализации.
Для дополнительного выявления феохромоцитомы может быть рекомендована сцинтиграфия с меченным 131I-метайодбензилгуанидином после предварительной блокады щитовидной железы. Некоторые исследователи даже при выявлении феохромоцитомы методами визуализации (КТ, ЯМРТ) рекомендуют проведение сцинтиграфии других областей тела для исключения наличия других катехоламинпродуцирующих опухолей в организме.
Высокоспецифическим методом подтверждения наличия феохромоцитомы является определение повышенного уровня катехоламинов в крови из соответствующих ветвей нижней полой вены. При наличии опухоли концентрация катехоламинов в вытекающей с места локализации опухоли крови в несколько раз выше, чем в других местах. Несмотря на достаточно высокую диагностическую точность метода, он применяется лишь в редких сложных случаях из-за инвазивности, сложности выполнения и возможного риска для больного. Формализованный диагностический алгоритм при подозрении на феохромоцитому приведено на рис. 8.

Хирургическое лечение обязательно при отсутствии противопоказаний для проведения операции. В последние годы чаще применяют лапароскопический доступ, который уменьшает травматичность операции для больного и сокращает сроки госпитализации. Эффективность хирургического вмешательства при феохромоцитоме очень высокая: у более 90% больных отмечают нормализацию или стойкое снижение АД. В редких случаях выявляют рецидивы опухоли или феохромоцитомы иной локализации. Лечение их должно проводиться также хирургическим путем. Если опухоль невозможно удалить хирургическим путем, применяют лучевую и химиотерапию, особенно при метастазировании. Облучение и применение цитостатиков приводит к уменьшению размера и активности опухолей, что, соответственно, сопровождается улучшением состояния больных.
Для медикаментозного контроля АД применяют блокаторы α-адренорецепторов (празозин, доксазозин и другие), при необходимости и кризах — внутривенно (фентоламин). Возможно, лучший эффект будут отмечать при применении комбинации или комбинированных блокаторов α- и β- адренорецепторов (лабеталол, карведилол). Использование чистых неселективных блокаторов β-адренорецепторов нецелесообразно, поскольку может привести к повышению АД. Среди других антигипертензивных препаратов следует отметить антагонисты кальция и препараты центрального действия (клонидин, агонисты имидазолиновых рецепторов). В последние годы появились сообщения об успешном применении блокатора синтеза допамина — метилтирозина. Препарат на ранних стадиях синтеза блокирует образование катехоламинов, что позволяет успешно контролировать АД и надлежащим образом подготовить больного к операции. Применение препарата рекомендовано Европейским обществом гипертензии (2003).
При проведении анестезии следует избегать фентанила и дроперидола, которые могут стимулировать дополнительную секрецию катехоламинов. Рекомендуют тщательное мониторирование функции сердечно-сосудистой системы во время введения в наркоз, операции и первых суток после операции: возможно развитие как гипертензивных, так и гипотензивных состояний, тяжелых аритмий. Важное значение придают замещению объема жидкости для предотвращения гиповолемии. Через 2 нед после операции рекомендуется проверить уровень катехоламинов в моче.
Первичный минералокортицизм
Первичный минералокортицизм — термин, под которым объединяют ряд эндокринных нарушений, ассоциированных c АГ и эндогенной гиперпродукцией альдостерона или минералокортикоидов и продуктов их биосинтеза. К первичному минералокортицизму относят первичный альдостеронизм, дезоксикортикостеронпродуцирующие опухоли надпочечных желез и адреногенитальный синдром/врожденную адреналовую гиперплазию. Общим признаком для минералокортикоид-ассоциированных АГ является гипокалиемия различной степени выраженности.
Первичный альдостеронизм характеризуется автономной (независимой от других причин) гиперпродукцией альдостерона железистой зоной надпочечных желез. Его следует отличать от вторичных альдостеронизмов, которые являются следствием повышения уровня ренина, часто реактивного характера. Около 75% всех случаев первичного альдостеронизма составляет аденома надпочечной железы (синдром Кона), редко выявляют карциному надпочечной железы, а также первичную одно- и двустороннюю гиперплазию надпочечных желез и дексаметазон-супрессивную (поддающуюся лечению глюкокортикостероидами (ГСК)) гиперплазию.
Впервые клинические проявления первичного минералокортицизма описал американский эндокринолог J.W. Conn в 1955 г. у 34-летней женщины с высоким АД. По данным литературы синдром Кона выявляют у 0,5–1% больных с АГ. У женщин отмечают почти вдвое чаще, чем у мужчин. По данным отделения симптоматических артериальных гипертензий Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» среди 3495 первичных больных, которые находились в отделении на протяжении 1994–2003 гг., диагноз «первичный альдостеронизм», подтвержденный гистологическим исследованием после операции, был установлен у 0,3% больных.
В течение последнего десятилетия благодаря широкому использованию порогового значения соотношения альдостерон/активность ренина плазмы крови >30 в качестве дагностического критерия первичного альдостеронизма частота выявления заболевания по данным разных исследователей достигает 5–10% в популяции пациентов с повышенным АД и до 25% среди больных с рефрактерной АГ.
Патогенез заболевания включает повышение реабсорбции натрия в дистальных канальцах и замену им калия и ионов водорода. Считают, что одной из причин АГ при этом является увеличение внутрисосудистого объема крови. Среди других причин рассматривают центральные механизмы, связанные с влиянием альдостерона на мозговые центры регуляции сердечно-сосудистой системы, секрецию вазоконстрикторных субстанций, а также ряд периферических: прямой вазоконстрикторный эффект альдостерона, накопление натрия в стенке резистивных артерий с повышением чувствительности к прессорным агентам и т.п. Потеря калия носит постепенно прогрессирующий характер, при этом гипернатриемию практически не отмечают.
Клинические симптомы не носят специфического характера и практически не имеют значения для дифференциальной диагностики (табл. 14).
Таблица 14
Частота симптомов при первичном гиперальдостеронизме
|
Симптом |
Частота встречаемости, % |
|
АГ |
100 |
|
Гипокалиемия |
90 |
|
Изменения на ЭКГ |
80 |
|
Мышечная слабость |
80 |
|
Полиурия |
70 |
|
Головная боль |
65 |
|
Полидипсия |
45 |
|
Парестезии |
25 |
|
Расстройства зрения |
20 |
|
Утомляемость |
20 |
|
Перемежающиеся параличи |
20 |
|
Перемежающаяся тетания |
20 |
Симптоматика первичного альдостеронизма включает АГ, гипокалиемию, метаболический алкалоз и гипоренинемию. Важным этапом дифференциальной диагностики первичного гиперальдостеронизма является исключение состояний, при которых существует другая (вторичная) причина активации РАС: нерациональное применение салуретиков, кортикоидных гормонов, слабительных средств, болезни ЖКТ и т.п. Наличие первичного гиперальдостеронизма следует всегда исключать при рефрактерной АГ, причем нормокалиемия автоматически не исключает гиперпродукцию альдостерона: приблизительно у 20% больных первичным гиперальдостеронизмом гипокалиемия проявляется только через несколько дней солевой нагрузки (смотри далее).
Среди лабораторных тестов наиболее значимым является определение уровня гормонов РАС. Важной предпосылкой для проведения такого исследования должна стать тщательная подготовка больного: желательно за 14 дней отменить все антигипертензивные средства, сбалансировать диету, обеспечить определенный режим покоя, тщательно выполнять необходимые условия забора проб. На этот период больных лучше госпитализировать. Определение содержания альдостерона и калия в плазме крови, а также активности ренина плазмы крови являются стандартными процедурами диагностики. Можно дополнить эти исследования определением концентрации или активности ренина плазмы крови до и при необходимости после приема 40 мг фуросемида.
Особое значение для диагноза имеет определение соотношения содержания альдостерона (нг/дл) и активности ренина плазмы крови (нг/мл/ч). Нормальное значение этого соотношения должно быть <20, диагностическим порогом является величина >30, а значение >50 имеет наиболее высокую чувствительность и специфичность. Повышение диагностического порога соотношения позволило обеспечить специфичность до 94% без существенного снижения чувствительности. Соответственно Рекомендациям Европейского общества по гипертензии и Европейского общества кардиологов (2003) следует использовать величину соотношения >50 как абсолютный диагностический критерий этой патологии независимо от наличия других симптомов, включая гипокалиемию.
При сомнительном результате исследование дополняют тестами с нагрузкой солью или приемом каптоприла. Нагрузка солью (150–200 ммоль натрия или 6–9 г соли в сутки) приводит к повышению почечного калий/натриевого обмена, который демаскирует латентную гипокалиемию. Нагрузка солью повышает специфичность определения содержания альдостерона в плазме крови: только при вторичном гиперальдостеронизме дополнительное поступление натрия угнетает секрецию альдостерона. Тест с приемом 25 мг каптоприла основан на угнетении синтеза АII, вследствие чего снижается АД, а также уровень альдостерона у больных с эссенциальной и ренальной формами АГ. При первичном гиперальдостеронизме изменений уровня альдостерона не отмечают. Проба имеет высокую чувствительность и специфичность.
Присутствие опухоли в области надпочечных желез можно определить с помощью УЗИ, но отрицательный его результат не может полностью исключить наличие аденомы или гиперплазии. Приблизительно 20% опухолей имеют размер <1 см. Более точные методы КТ или ЯМРТ являются наиболее важными методами визуализации при первичном гиперальдостеронизме. Проведение одной из этих диагностических методик необходимо даже при ультразвуковом выявлении изменений структуры надпочечной железы. Наиболее информативным методом для дифференциальной диагностики при первичном гиперальдостеронизме является селективное определение уровня альдостерона в крови из надпочечных вен. Одностороннее повышение будет означать наличие односторонней аденомы, а двустороннее — чаще всего диффузную гиперплазию обеих надпочечных желез.
Дексаметазон-супрессивная гиперплазия или поддающаяся лечению ГКС форма первичного гиперальдостеронизма является редкой формой наследственного заболевания с аутосомно- доминантным типом передачи и характеризуется состоянием, когда симптомы альдостеронизма исчезают при применении малых доз ГКС, например дексаметазона. У больных отмечают повышенную чувствительность к альдостеронстимулирующему действию адренокортикотропного гормона (АКТГ). Показано, что причиной заболевания является аномальный ген, который возникает при неравномерном делении хромосомы 8q, в результате чего нарушается порядок кодирования альдостерон-синтазы. В организме это приводит к повышению продукции альдостерона, а также конверсии кортизола в гидрокси- и оксикортизол. Заболевание может быть диагностировано с помощью молекулярно-генетической техники и при повышении доступности технологий в будущем тестирование следует проводить всем больным с семейной формой первичного гипер альдостеронизма.
Очень редкой формой первичного гиперальдостеронизма является так называемый адреногенитальный синдром или врожденная гиперплазия надпочечных желез, которые составляют группу заболеваний, для которых характерен дефект энзимов стероидного синтеза. АГ возникает при дефиците 11β- или 17α- гидроксилазы, при наличии которых отмечают накопление активных промежуточных продуктов минералокортикоидного синтеза. Первый тип сопровождается вирилизацией, при этом часто отмечают врожденные изменения половых органов: у мальчиков — макрогенитосомия, у девочек — урогенитальный синус или гипертрофия клитора. Второй тип, наоборот, задержкой развития половых органов и вторичных половых признаков (псевдогермафродитизм).
Еще одним редким заболеванием из этой группы АГ является синдром Лиддла, описанный как наследственное заболевание с аутосомно-доминантным типом наследования в 1963 г. У больных отмечают все признаки гиперпродукции минералокортикоидов, но уровень альдостерона остается нормальным. В крови не выявлено повышения ни одной из известных минералокортикоид-активных субстанций, а также назначение антагонистов или блокаторов синтеза альдостерона не приводит к снижению АД. Наблюдения показали, что применение диуретиков, которые угнетают реабсорбцию натрия в дистальных канальцах (амилорид, триамтерен), может нормализовать АД и гипокалиемию. В настоящее время считают, что заболевание является следствием генетического дефекта β- или γ- субъединицы натриевого канала эпителия, который приводит к активации канала, повышению реабсорбции натрия (повышение АД) и экскреции калия (гипокалиемия).
Лечение первичного альдостеронизма зависит от его причины (табл. 15). Методом выбора для пациентов с односторонней аденомой или карциномой надпочечных желез является хирургическое удаление опухоли. Консервативное лечение в таких случаях применяют только при наличии противопоказаний для операции. Хирургическое лечение также рекомендуют больным с односторонней гиперплазией. Применяют боковой разрез или лапароскопическую технику. После адреналэктомии по данным различных авторов нормализацию АД отмечают у 40–70% больных. Применение хирургических подходов при двусторонних поражениях способствует нормализации АД менее чем у 20% больных.
Таблица 15
Лечение первичного гиперальдостеронизма
|
Тип |
% случаев |
Лечение |
|
Односторонняя альдостеронпродуцирующая аденома |
60–70 |
Хирургическое |
|
Двусторонняя гиперплазия |
20–30 |
Медикаментозное |
|
Односторонняя гиперплазия |
≤1 |
Хирургическое |
|
Поддающаяся лечению ГКС форма |
<1 |
Медикаментозное |
|
Альдостеронпродуцирующая карцинома |
<1 |
Хирургическое |
|
Адреногенитальный синдром |
<1 |
Медикаментозное |
|
Альдостеронпродуцирующая ренинзависимая аденома |
<1 |
Хирургическое/медикаментозное |
Медикаментозное лечение включает назначение специфического блокатора альдостерона — спиронолактона, а также калийсберегающих диуретиков (амилорида, триамтерена). Лечение спиронолактоном начинают с высоких доз (200–400 мг/сут), но после стабилизации АД и коррекции гипокалиемии дозу можно значительно снизить. Калийсберегающие диуретики назначают в обычных дозах. При стабильном уровне калия можно применять тиазидовые диуретики в малых дозах.
Недостаточный контроль АД требует назначения другого класса антигипертензивных средств: антагонистов кальция продолжительного действия. Лучший эффект дают дигидропиридиновые препараты (нифедипин, амлодипин). У больных с двусторонней гиперплазией надпочечных желез хороший эффект дают ингибиторы АПФ.
В последние годы во многих странах зарегистрирован новый селективный блокатор альдостероновых рецепторов — эплеренон. Его эффективность была доказана в клинических испытаниях при лечении больных с СН. В то же время опыт его применения для лечения первичного альдостеронизма ограничен. Считается рациональным использование этого препарата для лечения больных, у которых отмечают побочные эффекты при применении спиронолактона.
У пациентов с формой заболевания, которая поддается лечению ГКС, отмечают неудовлетворительный ответ на прием обычных антигипертензивных средств, однако назначение даже малых доз ГКС (лучше дексаметазона в дозе 0,5–2 мг/сут) дает значительный эффект уже в течение первых 2–4 дней. Для полной коррекции АД необходим больший срок — несколько недель. Для предотвращения побочных эффектов ГКС рекомендуют их комбинировать с калийсберегающими диуретиками.
Гиперкортицизм
Гиперкортицизм может быть как зависимым от гиперпродукции АКТГ, так и АКТГ-независимым. Приблизительно 65–80% случаев составляют больные с повышенной секрецией АКТГ и вторичной гиперплазией надпочечных желез. При таком типе (центральном или болезни Кушинга) повышение выделения АКТГ является следствием или нарушений на уровне гипоталамуса с повышением выделения кортикотропин- рилизинг гормона, или наличия аденомы гипофиза.
По данным некоторых исследователей концепция болезни Иценко — Кушинга включает первичную патологию лимбической системы и ретикулярной формации, которая приводит к нарушению нейронально- медиаторного контроля секреции рилизинг- факторов, в том числе кортикотропин- рилизинг гормона. В очень редких случаях продукция АКТГ или кортикотропин- рилизинг гормона может быть вызвана эктопически расположенной опухолью (например мелкоклеточная бронхиальная карцинома, опухоли вилочковой железы, матки). Почти в 20% случаев гиперсекреция ГКС связана с первичным процессом в надпочечных железах (синдром Кушинга). Односторонний процесс — это чаще всего или аденома или карцинома. Двусторонний процесс — двусторонняя микро- или макроузловая гиперплазия. Однако описаны случаи двусторонней аденомы. Современная классификация гиперкортицизма представлена в табл. 16.
Таблица 16
Классификация гиперкортицизма
(модифицировано с J.A. Whithworth, 2004)
|
Тип заболевания |
Частота выявления, % |
|
Спонтанный гиперкортицизм |
|
|
Болезнь Кушинга (питуитарный гиперкортицизм) |
65–67 |
|
Эктопическая продукция АКТГ |
15% |
|
Эктопическая продукция кортикотропин-рилизинг гормона |
Крайне редко |
|
Синдром Кушинга (адреналовый гиперкортицизм) |
9% |
|
Карцинома надпочечных желез |
8% |
|
Гиперплазия надпочечных желез |
Редко |
|
Наследственные формы (синдромы Карни, МакКлури — Олбрайта) |
Редко |
|
Ятрогенный гиперкортицизм |
|
|
Прием АКТГ |
Редко |
|
Прием ГКС |
Наиболее часто |
|
Псевдосиндром Кушинга (алкогользависимый, депрессия, ВИЧ-инфекция) |
Редко |
В Украине болезнь и синдром Кушинга называют Иценко — Кушинга в честь Н.М. Иценко, который впервые описал клиническую картину этой патологии в 1924 г. По данным литературы болезнь отмечают в 0,1% среди всего населения, причем в 75–80% из них выявить опухоль крайне тяжело. Заболевание отмечают чаще у женщин, наиболее часто в возрасте 20–40 лет. Среди 3495 первичных больных с синдромом АГ, которые были госпитализированы в отделение симптоматических артериальных гипертензий Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» с 1994 по 2003 г., различные формы гиперкортицизма, подтвержденные гистологически после оперативного лечения, выявлены в 0,17% случаев.
АГ возникает приблизительно у 80% больных гиперкортицизмом. Патогенез АГ у больных гиперкортицизмом мультифакториальный:
– минералокортикоидные эффекты высокого уровня кортизола с задержкой натрия и воды;
– повышенная секреция субстанций с минералокортикоидной активностью;
– вызванная кортизолом активация РАС;
– вызванная кортизолом активация симпатоадреналовой системы (САС);
– повышенная чувствительность гладкомышечных клеток сосудов к вазопрессорам;
– снижение продукции простаноидов- вазодилататоров.
Хроническое влияние гиперсекреции ГКС приводит к типичным изменениям внешности больных — «кушингоидный» тип ожирения. Характерными признаками являются луноподобное лицо с багрово-синим цветом щек, отложение жира в области шеи (шея бизона), туловища, плеч, живота и бедер, при этом голени и предплечья остаются худыми и тонкими. На бедрах, на животе, под подмышками появляются характерные атрофические полосы красно-фиолетового цвета длиной 15–20 см (striae rubra). На коже лица, спины, груди возникает много угрей, петехий. Постепенно уменьшается мышечная масса, больные сутулятся, теряют осанку, выглядят очень немощными. Часто отмечают гипокалиемию. Прогрессирует остеопороз с болями и возможными переломами костей. У мужчин появляются признаки демаскулинизации: нарушается потенция, возникает гипотрофия яичек, уменьшается рост бороды и т.д. У женщин выявляют аменорею, атрофию молочных желез, признаки маскулинизации (борода, усы, рост волос на лобке и груди).
Изменения касаются и психического состояния: теряется интерес к внешним факторам, возникает апатия, сонливость, снижение интеллектуальных способностей. Иногда возникают маниакальные или параноидальные состояния, галлюцинации. Известны случаи самоубийств.
Наиболее часто дифференциальный диагноз проводят с обычным ожирением, которое не редко сопровождает эссенциальную АГ. Кроме возможности влияния диеты и регулярных физических упражнений при алиментарном ожирении, значительная роль в диагностике принадлежит лабораторным тестам. К вторичным лабораторным изменениям при гиперкортицизме относят гипокалиемию, метаболический алкалоз, гиперлипидемию, гипергликемию, эозинопению.
Наиболее точным является определение повышенного уровня кортизола в крови или в суточной моче. Разовое определение в крови с отрицательным результатом не исключает диагноза «гиперкотицизм» вследствие значительных физиологических колебаний уровня гормона. В моче рекомендуют определять свободный кортизол, а не уровень 17- кетостероидов и 17- гидроксикетостероидов. Исследование необходимо провести минимум в двух последовательных пробах мочи, что не является сложным даже для амбулаторных пациентов.
Кроме простого определения кортизола, рекомендуют пробы с дексаметазоном. Назначение 1 мг дексаметазона на ночь угнетает экскрецию кортизола даже у больных с ожирением. При синдроме Кушинга экзогенные ГКС не влияют на выделение кортизола.
Низкий уровень АКТГ в плазме крови означает наличие первичного процесса в надпочечных железах. Нормальный или несколько повышенный уровень АКТГ при отрицательном дексаметазоновом тесте будет означать, что причиной является АКТГ- зависимый механизм (болезнь Кушинга, или активация кортикотропин-зависимых механизмов). В таких случаях можно применить тест с введением 2–8 мг дексаметазона. АКТГ-зависимая активация секреции угнетается введением высоких доз ГКС, тогда как эктопическая не изменяется. По данным литературы чувствительность и специфичность дексаметазонового теста для разделения АКТГ- зависимого и АКТГ- независимого типов гиперкортицизма составляла около 81 и 67% соответственно.
Также для дифференциации центрального и эктопического очагов применяют тест со стимуляцией кортикотропин-рилизинг гормоном. После введения 100 мкг гормона при болезни Кушинга отмечают повышение содержания АКТГ и кортизола. При эктопической опухоли их уровень не изменяется. Некоторые авторы предлагают проводить этот тест с забором крови из нижнего каменистого синуса (sinus petrosus inferior). Если концентрация АКТГ в крови с синуса будет как минимум в 3 раза выше, чем в периферической вене, то гипофизарная локализация опухоли не вызывает сомнения. Проведение такого билатерального теста может помочь определить сторону локализации опухоли. Необходимо подчеркнуть, что подобные манипуляции следует выполнять в специальных центрах опытными врачами.
Четкая визуализация опухоли и ее структуры являются основой для проведения хирургического лечения. Диагноз «первичний гиперкортицизм» (синдрома Кушинга) подтверждают с помощью визуализирующих процедур КТ или ЯМРТ. При болезни Кушинга считают, что наличие микроаденомы диаметром 5 мм и более в гипофизе является неопровержимым доказательством ее наличия. Наиболее чувствительным методом в таких случаях является ЯМРТ. В случаях эктопической локализации рекомендуют очень тщательно, пошагово с помощью визуализирующих методов изучить состояние грудной и брюшной полости. Следует помнить, что такие опухоли могут быть очень малы по размеру, несмотря на их высокую гормональную активность.
Прогноз заболевания при отсутствии лечения, как правило, крайне неблагоприятный — 5- летняя выживаемость составляет 50%. Основной причиной смерти являются сердечно- сосудистые осложнения. Особенно неблагоприятный прогноз при злокачественных формах опухоли.
Радикальным лечением как болезни, так и синдрома Кушинга, которое гарантирует продолжительный эффект, является хирургическое удаление гормонально активной опухоли. Даже односторонняя адреналэктомия при билатеральной гиперплазии надпочечных желез улучшает течение заболевания. Радикальное хирургическое лечение необходимо и при эктопически расположенных гормонально активных опухолях. Для улучшения результатов хирургическое лечение комбинируют с лучевой терапией.
Развитие хирургической техники селективного удаления аденом гипофиза радикально изменило результаты лечения таких пациентов. Обычно используют транссфеноидальный доступ, который позволяет минимизировать травматичность операции. Оперативное лечение в таких случаях проводится в нейрохирургических отделениях. Частота полного излечения по данным лучших мировых клиник составляет >80%.
Фармакологическое лечение гиперкотицизма очень ограничено и может включать 3 направления:
– модуляция секреции АКТГ;
– модуляция секреции ГКС;
– модуляция клеточных эффектов ГКС.
Для модуляции секреции АКТГ можно применять ципрогептадин, бромокриптин, соматостатин.
Для угнетения секреции ГКС: кетоконазол, митотан, аминоглутетимид, метирапон. Для блокирования ГКС-рецепторов предложен мифепристон. Некоторые исследователи в случае положительного ответа организма предлагают назначать дексаметазон в малых дозах — 0,25–0,75 мг/сут. Эффективность большинства из перечисленных лекарственных средств, к сожалению, не выходит за рамки ограниченных исследований и не нашла широкой поддержки медицинской общественности.
Для лечения АГ при гиперкортицизме предлагают спиронолактон в обычных терапевтических дозах, калийсберегающие диуретики, ингибиторы АПФ, селективные блокаторы β-адренорецепторов в обычных дозах. Необходимо избегать применения препаратов, которые могут спровоцировать метаболические и электролитные расстройства. Следует помнить, что медикаментозная терапия в данном случае является только временным этапом перед радикальным хирургическим вмешательством.
Акромегалия
Гиперпродукция гормона роста перед закрытием эпифизарных пластинок (зон роста) приводит к гигантизму, а после окончания периода роста — к акромегалии. Почти во всех случаях причиной гиперпродукции гормона роста является аденома гипофиза. АГ среди больных акромегалией выявляют приблизительно у 40–50%, что чаще, чем в общей популяции. Причиной АГ считают задержку натрия под влиянием высокой концентрации гормона роста. При этом не существует прямой зависимости между степенью повышения АД и уровнем гормона роста. Значительная гипертрофия левого желудочка, которую часто выявляют при акромегалии, объясняется в большей мере гормональным влиянием, чем степенью повышения АД.
Внешние клинические признаки акромегалии очень характерные, что позволяет заподозрить наличие болезни даже врачу-новичку: массивная нижняя челюсть, надбровные дуги, нос, уши, значительно увеличенные кисти и стопы, кости. В случаях с менее выраженной симптоматикой целесообразно сравнить фотографии пациента в более молодом возрасте или фото близких родственников. Для постановки окончательного диагноза необходимо провести определение уровня гормона роста в плазме крови, а также инсулиноподобного фактора роста. Содержание гормона роста в крови значительно колеблется, но у здоровых лиц никогда не превышает 10 мкг/л. Для акромегалиии также характерно, что высокий уровень гормона роста не снижается после приема 100 г глюкозы (супрессивный тест).
Уровень сердечно-сосудистых осложнений у больных акромегалией остается очень высоким — смертность достигает 100% на протяжении 15 лет. Агрессивная антигипертензивная терапия является главным фактором, положительно влияющим на продолжительность жизни таких пациентов. Принципы медикаментозной терапии АГ при акромегалии не отличаются от общепринятых рекомендаций: применяют любые препараты первого ряда или их комбинации. Успешное радикальное лечение основного заболевания (удаление опухоли гипофиза) приводит к снижению или нормализации АД у большинства больных. После удаления опухоли содержание гормона роста снижается на 50–90%. По данным литературы 10-летняя смертность после успешной операции составляла 7%, относительный риск в сравнении с общей популяцией — 1,17.
Показано, что кратковременное применение аналога соматостатина — октреотида угнетает секрецию гормона роста и снижает АД. На фоне такого лечения отмечают уменьшение размеров опухоли и значительное уменьшение выраженности клинических симптомов. Но продолжительные результаты такого лечения в настоящее время остаются неизученными. По данным некоторых исследователей применение бромокриптина может привести к нормализации уровня гормона роста приблизительно у 20% больных акромегалией. Такое лечение также сопровождается снижением уровня АД.
Гиперпаратиреоз
Первичный гиперпаратиреоз — заболевание, которое характеризуется первичным повышением секреции паратгормона. Чаще всего причиной заболевания является аденома или гиперплазия паращитовидной железы. АГ отмечают приблизительно у 70% больных с первичным гиперпаратиреозом. Вторичный гиперпаратиреоз возникает при ХПН, чрезмерном потреблении витамина D, кальция, снижении уровня фосфатов и т.п. Наличие АГ в сочетании с гиперкальциемией всегда должно приводить врача к мысли о гиперпаратиреозе — заболевании, которое отмечают у больных с АГ приблизительно в 10 раз чаще, чем в популяции в целом, и которое остается в большинстве случаев недиагностированным. В ряде случаев гиперпаратиреоз является одним из синдромов множественной эндокринной неоплазмы.
Патогенез гиперпаратиреоза определяется нарушением обмена кальция и фосфора вследствие чрезмерной продукции паратиреоидного гормона. При этом заболевании отмечают усиленное вымывание кальция из костей, повышение содержание кальция в крови и его выделение с мочой; снижение содержания фосфора вследствие снижения его реабсорбции из первичной мочи. Повышенное содержание кальция и фосфора в моче приводит к образованию конкрементов в мочевыводящих путях. В костях вследствие вымывания кальция отмечают замещение костной ткани соединительной.
Ситуация с патогенезом АГ выглядит несколько парадоксальной, потому что при введении паратгормона в острую фазу заболевания отмечают вазодилаторный и антигипертензивный эффект. Формирование АГ при этом связывают с несколькими факторами: гиперкальциемией, нарушением функции почек при продолжительном течении заболевания, возможной дополнительной продукцией так называемого паратиреоидного гипертензивного фактора — гормона, который продуцируется паратиреоидной железой одновременно с паратгормоном, активацией РАС. Еще одним механизмом, доказанным экспериментально, считают потерю чувствительности гладкомышечных клеток сосудов к внутренним вазодилататорным агентам на фоне продолжительного воздействия высоких концентраций паратгормона. Насколько эти механизмы реализуются через изменения трансмембранного транспорта и внутриклеточной концентрации кальция в настоящее время не известно. Кроме того, экспериментально доказано, что хроническое введение паратгормона приводит к повышению секреции АКТГ и соответственно глюко- и минералокортикоидов.
Симптомы заболевания неспецифичны. Клиническими проявлениями заболевания часто становятся симптомы со стороны почек (мочекаменная болезнь, вторичный пиелонефрит, почечная недостаточность) и костей (болевой синдром, переломы). По преимуществу симптомов выделяют 2 формы заболевания: почечную и костную. Как следствие ренального эффекта высокой концентрации паратгормона могут отмечать нарушения электролитного баланса: гиперфосфатемия, гиперфосфатурия, гиперкальцийурия, гипохлоремия, гипокалиемия. При рентгенологическом исследовании отмечают симптомы генерализованного остеопороза. Повышение АД выявляют уже на начальных стадиях заболевания. Поражение органов-мишеней отмечают раньше, чем при эссенциальной АГ.
Диагноз «гиперпаратиреоз» считают достоверным при наличии повышенной концентрации паратиреоидного гормона в крови в сочетании с гиперкальциемией. Нормальным уровнем паратгормона считают 10–70 пг/мл, причем верхняя граница повышается с возрастом.
Обычно паращидовидная железа может быть визуализирована с помощью УЗИ. При сомнительной картине используют томографию и сцинтиграфию.
Хирургическое лечение является безопасным и эффективным: полное выздоровление отмечают более чем в 90% случаев. Нормализация АД после операции по различным данным отмечается от 20 до 100% больных. Медикаментозное лечение АГ у больных с гиперпаратиреозом проводят согласно общим принципам лечения АГ.
Гипер- и гипотиреоз
Гипертиреоз или тиреотоксикоз является следствием гиперпродукции тиреоидных гормонов, что приводит к повышению сердечного выброса, ЧСС, показателей сократительной способности миокарда. Следствиями тиреотоксикоза также является увеличение объема циркулирующей крови (ОЦК), снижение ОПСС. Частота АГ при тиреотоксикозе составляет около 40%. Доминирует систолическая АГ вследствие вышеупомянутых гемодинамических изменений. Большинство сердечно- сосудистых симптомов при тиреотоксикозе являются проявлениями активации САС, хотя содержание адреналина нормальное или несколько снижено, что объясняют увеличением плотности и чувствительности β- адренорецепторов под влиянием тиреоидных гормонов.
По данным отделения симптоматических артериальных гипертензий Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» среди 3495 первичных больных, которые находились в отделении на протяжении 1994–2003 гг., поражение щитовидной железы диагностировано у 5,2%, при этом у большинства из них (у 4%) выявлен гипертиреоз. Безусловно, эпидемиологические данные будут различными как в различных географических регионах, так и в различных по профилю медицинских учреждениях.
Диагноз заболевания подтверждают определением уровня гормонов щитовидной железы в крови — тироксина (Т4) и трийодтиронина (Т3). Методом выявления пациентов с нарушением функции щитовидной железы является определение содержания тиреотропного гормона в крови. При его нормальном содержании, как правило, функция щитовидной железы нормальная, при повышенном — функция снижена, а при сниженном — функция повышена. В табл. 17 приведены основные изменения сердечно-сосудистой и эндокринной систем при гипер- и гипотиреозе.
Выбор тактики лечения тиреотоксикоза зависит от его причины и его детализация может стать предметом другой монографии. В контексте антигипертензивной терапии следует отметить, что лечение гипертиреоза и восстановление эутиреоидного состояния, как правило, приводит к нормализации АД. Приведенные патогенетические механизмы АГ определяют наиболее эффективную симптоматическую антигипертензивную терапию у таких больных — прием блокаторов β- адренорецепторов. Применяют как селективные, так и неселективные препараты. В ряде исследований было показано, что неселективные блокаторы β- адренорецепторов могут снижать синтез Т3 и Т4. Важно, что при назначении блокаторов β-адренорецепторов уменьшается количество аритмий, а при постоянной форме фибрилляции предсердий достигается эффективный контроль ЧСС, а иногда восстанавливается синусовый ритм.
Таблица 17
Эндокринные и сердечно-сосудистые изменения при заболеваниях щитовидной железы (адаптировано из Y. Shenker, 2003)
|
Функциональные параметры |
Гипертиреоз |
Гипотиреоз |
|
Содержание катехоламинов в крови |
Нормальное или снижено |
Повышено |
|
Плотность β-адренорецепторов |
Повышена |
Снижена |
|
Активность ренина плазмы крови |
Повышена |
Снижена |
|
Содержание альдостерона в крови |
Повышено |
Снижено |
|
ОЦК |
Повышен |
Снижен |
|
Сердечный выброс |
Увеличен |
Снижен |
|
ЧСС |
Повышена |
Снижена |
|
ОПСС |
Снижено |
Повышено |
Для контроля АД можно применять недигидропиридиновые антагонисты кальция, которые замедляют ЧСС. Назначение диуретиков хорошо потенцирует эффект обеих указанных групп препаратов. В ряде случаев хороший эффект отмечают при применении препаратов центрального действия вследствие их седативного эффекта. Нежелательно использовать дигидропиридиновые антагонисты кальция и блокаторы α-адренорецепторов, так как возможно усиление тахикардии. При выраженной гипертрофии левого желудочка назначают ингибиторы АПФ или БРАII.
Гипотиреоз или микседема является следствием снижения секреции или доступности тиреоидных гормонов для тканей организма. Гемодинамически гипотиреоз характеризуется низким сердечным выбросом, снижением ЧСС, повышением ОПСС, уменьшением ОЦК. Повышение АД отмечают у 30–50% больных гипотиреозом.
Возникновение АГ связывают со значительной активацией САС. Уровень адреналина и норадреналина в крови повышен, особенно при наличии АГ. Определенную патогенетическую роль в формировании АГ связывают со снижением плотности β- адренорецепторов, что способствует дополнительной относительной стимуляции α-адренорецепторов и приводит к периферической вазоконстрикции. Некоторые исследователи считают повышение ОПСС элементом компенсации: повышение перфузионного давления в ответ на снижение сердечного выброса.
Клинические симптомы гипотиреоза у взрослых включают сонливость, общую и мышечную слабость, сухость кожи и слизистых оболочек, повышение массы тела, облысение, снижение ментальных функций, появление характерных отеков. Синдром АГ у большинства больных гипотиреозом характеризуется повышением диастолического АД. Систолическое АД повышается в значительно меньшей мере. Считают, что тяжесть гипотиреоза коррелирует со степенью повышения диастолического АД. Часто отмечается синусовая брадикардия. Считают, что вследствие сопутствующих нарушений липидного обмена при гипотиреозе существуют дополнительные условия для быстрого прогрессирования атеросклероза.
Подтверждением гипотиреоза является определение низкого уровня тиреоидных гормонов в крови. Важно определять общее содержание гормонов, их свободной формы и их соотношение. У 10–15% больных могут диагностировать нормальный или субнормальный уровень гормонов в крови. В таких случаях дополнительной мерой является определение тиреотропного гормона. При микседеме его концентрация значительно повышена.
Лечение гипотиреоза включает заместительную терапию гормонами щитовидной железы (их синтетическими аналогами). Достижение эутиреоидного состояния в большинстве случаев приводит к нормализации АД. У больных преклонного возраста и при значительной продолжительности АГ динамика АД менее положительная и возникает необходимость в дополнительном назначении антигипертензивных препаратов. Лечение АГ рекомендуют начинать с препаратов в низких дозах. Преимущество отдают средствам с периферическим вазодилататорным эффектом: ингибиторам АПФ, дигидропиридиновым антагонистам кальция и блокаторам α- адренорецепторов в обычных дозах. Диуретики можно назначать для усиления эффекта других средств.
Первичный ренинизм
Изолированную гиперпродукцию ренина со вторичным гиперальдостеронизмом как причину АГ отмечают очень редко: в мире описано не более 50 случаев этого заболевания. Большинство из них представляли собой гормонально активные опухоли внутри почек. Гистологической основой являются юкстагломерулярные опухоли, гемангиоперицитомы, гамартомы, опухоли Вильмса и рак почек. Эктопическую продукцию ренина могут отмечать при раковых заболеваниях печени, поджелудочной железы, яичников, бронхов.
Основой диагноза является исключение других состояний, которые могут сопровождаться значительным повышением уровня ренина в крови. Дифференциальный диагноз «первичный ренинизм» следует проводить при вторичном гиперальдостеронизме с признаками гипокалиемии и АГ, который часто объясняют терапией диуретиками, стенозом почечной артерии, феохромоцитомой, поликистозом почек. Основным методом лечения является хирургическое удаление гормонально активной опухоли. Эффективный контроль АД может быть достигнут при назначении препаратов, которые блокируют активность РАС — ингибиторов АПФ и БРА. В последнее время в клиническую практику внедряют селективный блокатор ренина — алискирен. Есть сведения о его успешном назначении при эссенциальной АГ. В то же время сведений о его эффективном применении при первичном ренинизме в доступной литературе не встречалось.
Эндотелинпродуцирующие опухоли
Эндотелин-1 представляет собой полипептид с очень сильным вазоконстрикторным эффектом, который в нормальных условиях вырабатывается и выделяется эндотелиальными клетками. Эндотелин- 1 при взаимодействии с его антагонистом оксидом азота играет важную роль в процессах локальной ауторегуляции кровообращения, сосудистых процессов и т.п. Значительная доля эффектов эндотелина- 1 и его участие в физиологических и патологических реакциях является предметом наиболее современных экспериментальных и клинических исследований. В настоящий момент достоверно известно о возможности возникновения специфической формы АГ, связанной с наличием эндотелинпродуцирующих опухолей. Описано несколько случаев гемангиоэндотелиомы, которая вырабатывала эндотелин-1, что сопровождалось значительным стойким повышением АД. После удаления опухоли отмечали нормализацию АД и содержания эндотелина-1 в плазме крови.
Вывод
Таким образом, своевременная диагностика и правильное лечение эндокринных форм АГ может привести к стойкой нормализации АД без регулярного приема антигипертензивных препаратов, что зачастую может быть расценено как полное выздоровление.
ЛИТЕРАТУРА
- 1. Арабидзе Г.Г. (1982) Симптоматические артериальные гипертензии. Руководство по кардиологии. Медицина, Москва, 4: 65–100.
- 2. Бобров В.А., Давыдова И.В. (2003) Симптоматические гипертензии. Руководство для врачей. Четверта хвиля, Киев, 256 с.
- 3. Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії (2004) Київ, 84 с.
- 4. Руководство по артериальной гипертонии (2005) Под ред. Е.И. Чазова, И.Е. Чазовой. Медиа медика, Москва, 784 с.
- 5. Сіренко Ю.М., Маньковський Б.М. (2004) Артеріальні гіпертензії при ендокринних захворюваннях. Четверта хвиля, Київ, 165 с.
- 6. 2003 European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension (2003) J. Hypertension, 21: 1011–1053.
- 7. Laragh J.H., Brenner B.M. (1995) Hypertension. Raven Press, New York, 3219 p.
- 8. Martin S.A., Mynderse L.A., Lager D.J. et al. (2001) Juxtaglomerular cell tumors: a clinicopathologic study of four cases and review of literature. Am. J. Clin. Pathol., 116: 854–863.
- 9. Mayet J., Coats A.S. (1998) Diagnosis and investigation of essential and secondary hypertension. Europ. Heart J., 19: 372–377.
- 10. Secondary Hypertension. Clinical Presentation, Diagnosis, and Treatment (2004) Edited by G.A. Mansoor. Humana Press, Totowa, New Jersy, 352 p.
- 11. Shapiro L.M., Buchalter M. (1991) A colour atlas of hypertension. Wolfe Publishing Ltd., London, 159 p.
- 12. Stimpel M. (1996) Arterial hypertension. Walter de Gruyter, Berlin — New York, 356 p.
- 13. 2007 Guidelines for the management of arterial hypertension. J. Hypertension, 25: 1105–1187.
Резюме. У статті наведено сукупний аналіз змін ліпідного обміну у 124 хворих на 1-шу–3-тю і 7-му–9-ту добу ішемічного інсульту залежно від ступеня тяжкості стану хворого. В основу роботи покладено вивчення плазмових показників ліпідного обміну та новий спосіб визначення клітинних показників за допомогою гістохімічного методу визначення відсоткового вмісту ліпідовмісних лейкоцитів. Нами виявлено стійке порушення плазмових та клітинних показників, які залежать від ступеня тяжкості стану хворого та періоду захворювання і свідчать про напруження в обміні ліпідів, порушення біоенергетичних процесів та гомеостазу.
Ключові слова:ішемічний інсульт, ліпідний обмін, метаболічні зміни
Summary. Generalized analysis of changes in the lipid metabolism of 124 patients on the 1–3 and 7–9 days of ischemic stroke depending on severity degree of the patient’s condition is presented in the article. The work was based on the study of the lipid metabolism plasma indices and the new approach of the cellular indices assessment with the histochemical method of the lipid-containing leucocytes percentage study. We found steady disorders of plasma and cellular indices that depend on the severity degree of the patient’s condition and the period of the disease and indicate the tension in the lipid metabolism as well as disorders in the bioenergetics processes and homeostasis.
Key words: ischemic stroke, lipid metabolism, metabolic changes





