Введение
 Артериальная гипертензия (АГ) — один из самых распространенных факторов кардиоваскулярного риска, оказывающих независимое негативное влияние в отношении выживаемости в общей популяции (Law M.R. et al., 2009). Хотя распространенность АГ в разных странах существенным образом различается, в европейской популяции ожидаемая частота этого заболевания колеблется в пределах 23–36% (Mozaffarian D. et al., 2016; Timmis A. et al., 2017), в США — 27–43% (Muntner P. et al., 2017; Reboussin D.M. et al., 2017). По мнению многих экспертов, эти данные значительно занижены, а с учетом новых рекомендаций Американской ассоциации сердца/Американского кардиологического колледжа (American Heart Association/American College of Cardiology — AHA/ACC), изменивших дефиницию АГ и обозначивших новый уровень для I стадии заболевания как 130/80 мм рт. ст., распространенность АГ будет еще повышаться (Flack J.M. et al., 2017).
Артериальная гипертензия (АГ) — один из самых распространенных факторов кардиоваскулярного риска, оказывающих независимое негативное влияние в отношении выживаемости в общей популяции (Law M.R. et al., 2009). Хотя распространенность АГ в разных странах существенным образом различается, в европейской популяции ожидаемая частота этого заболевания колеблется в пределах 23–36% (Mozaffarian D. et al., 2016; Timmis A. et al., 2017), в США — 27–43% (Muntner P. et al., 2017; Reboussin D.M. et al., 2017). По мнению многих экспертов, эти данные значительно занижены, а с учетом новых рекомендаций Американской ассоциации сердца/Американского кардиологического колледжа (American Heart Association/American College of Cardiology — AHA/ACC), изменивших дефиницию АГ и обозначивших новый уровень для I стадии заболевания как 130/80 мм рт. ст., распространенность АГ будет еще повышаться (Flack J.M. et al., 2017).
Учитывая эпидемиологическую и медицинскую значимость проблемы АГ, многочисленные медицинские ассоциации с высоким уровнем репутации настаивают на как можно более раннем выявлении, качественной профилактике и эффективном лечении пациентов, что, в свою очередь, позитивно скажется на общем состоянии здоровья населения (Jaques H., 2013; Mancia G. et al., 2013; James P.A. et al., 2014; Flack J.M. et al., 2017). Одним из актуальных направлений в улучшении приверженности антигипертензивной терапии и повышении ее эффективности является применение фиксированных/нефиксированных комбинаций лекарственных средств для пациентов с умеренной и среднетяжелой АГ, а также больных АГ с высоким/очень высоким кардиоваскулярным риском (Березин А.Е., 2009).
Настоящий обзор посвящен обсуждению основных направлений комбинированной терапии.
АГ и кардиоваскулярный риск
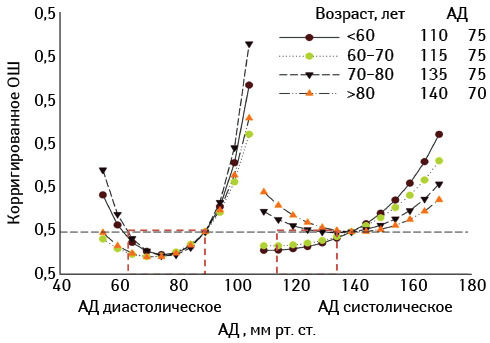
В ранних клинических и обсервационных исследованиях установлено, что уровень как систолического, так и диастолического артериального давления (АД), превышающий 117/77 мм рт. ст., тесно ассоциирован с величиной кардиоваскулярного риска и риска смерти от всех причин (Grossman E., 1998; Simon A., Levenson J., 1998; Levy D., 1999). Соотношение между уровнем АД, возрастом пациента и кардиоваскулярным риском представлено на рис. 1. При этом повышение АД >140/90 мм рт. ст. превращает эту зависимость в линейную, тогда как при величинах АД <140/90 мм рт. ст. и >117/77 мм рт. ст. указанная ассоциация носит экспоненциальный характер (Ibsen H., 1998).
Кроме того, установлено, что не только уровень офисного АД, АД в ранние утренние часы, характер суточного профиля АД, но и вариабельность АД (колебания его уровня, измеряемые между последовательными суточными периодами) можно рассматривать в качестве независимых предикторов неблагоприятных клинических исходов при АГ (Cheng H.M. et al., 2017). Действительно, вариабельность АД независимо ассоциируется с риском развития инсульта (отношение шансов (ОШ) 1,47; 95% доверительный интервал (ДИ) 1,12–1,91; р=0,005) и любых кардиоваскулярных событий (ОШ 1,41; 95% ДИ 1,08–1,83; р=0,01) (Webb A.J.S. et al., 2017). Кроме того, АГ является независимым фактором риска предиабета/сахарного диабета 2-го типа, сердечной недостаточности, ишемической болезни сердца, хронической болезни почек, мультифокального атеросклероза (Jaques H., 2013; James P.A. et al., 2014; Mancia G. et al., 2014).
Отметим, что поражения органов-мишеней при АГ, такие как гипертрофия левого желудочка или дисфункция эндотелия, перестали рассматриваться как облигатный атрибут прогрессирования АГ как таковой, а укладываются в концепцию «мультимодального поражения органов мишеней при АГ» (Acevedo M. et al., 2017; Van den Berg M.J. et al., 2017). Действительно, эти структурные и функциональные изменения, описываемые при АГ, часто предшествуют ее возникновению и ассоциируются с иными факторами кардиоваскулярного риска, включая сахарный диабет, абдоминальное ожирение, дислипидемию, курение, низкую физическую активность (Tadic M. et al., 2017). Тем не менее это не умаляет их негативного влияния на твердые клинические конечные точки у пациентов с АГ различной степени тяжести, что нашло свое отражение в формировании концепции «пациента высокого/очень высокого кардиоваскулярного риска» (Kendir C. et al., 2017). Таким образом, АГ оказывает влияние в отношении риска кардиоваскулярной и общей смерти через множество патогенетических механизмов, иногда непосредственно не связанных с элевацией АД. Все это привносит в стратегию лечения пациентов с АГ дополнительные требования, связанные не только с антигипертензивной эффективностью лекарственных средств, но и с их способностью демонстрировать клинически значимые органопротекторные качества.
Достижение целевого уровня АД и кардиоваскулярный риск
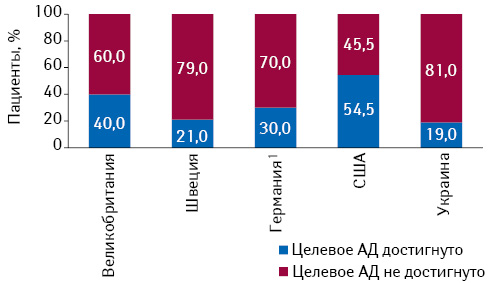
Несмотря на широкое внедрение в рутинную клиническую практику современных рекомендаций по профилактике и лечению АГ, лишь 1/5 всех пациентов достигают и поддерживают целевой уровень АД (Costa F.V. et al., 2009; Esposti L.D. et al., 2011) и отличаются приемлемой приверженностью назначенной терапии (Psaty B.M. et al., 2003). На рис. 2 приведено сопоставление частоты достижения целевого уровня АД в Украине и некоторых других странах.
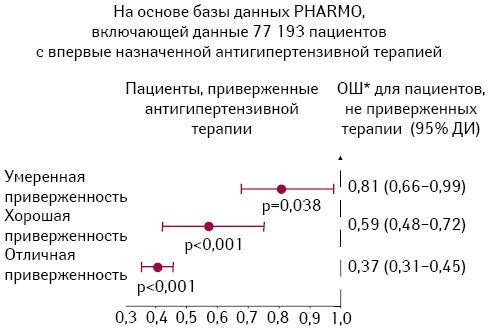
Отметим, что повышение приверженности лечению, вероятно, — один из наименее затратных способов повышения эффективности антигипертензивной терапии в популяционном аспекте. Действительно, по данным L.D. Esposti и соавторов (2011), низкая приверженность антигипертензивной терапии является независимым предиктором высокого риска общей смерти, инфаркта миокарда и инсульта (рис. 3). При этом отказ от антигипертензивной терапии сопровождается внезапным удвоением величины кардиоваскулярного риска (Elliott W.J. et al., 2007).
При этом для системы здравоохранения неоптимальное лечение АГ в целом обходится дороже, чем эффективное вмешательство, имеющее целью снижение риска общей и кардиоваскулярной смерти, предотвращение поражений органов-мишеней и улучшение качества и продолжительности жизни (Hansson L. et al., 2002; Gaziano T.A. et al., 2009).
Терапевтические преимущества антагонистов рецепторов ангиотензина II
Антагонисты рецепторов ангиотензина ІІ (АРА) реализуют свой терапевтический потенциал путем непосредственной неконкурентной блокады рецепторов 1-го субтипа ангиотензина II и, возможно, за счет косвенной стимуляции рецепторов 2-го субтипа эндогенным ангиотензином II (табл. 1). В целом для АРА, кроме основного антигипертензивного эффекта, описаны множество дополнительных (плейотропных) эффектов, таких как ангиопоэтический, антипролиферативный, антивоспалительный, антипротеинурический и антиапоптозный (Laurent S., 2017). Кроме того, широко известна способность АРА благоприятно влиять на «жесткость» сосудистой стенки, индуцировать реверсию дисфункции эндотелия и гипертрофии миокарда, повышать чувствительность тканей к инсулину (преимущественно за счет стимуляции синтеза GLUT-1 и GLUT-4) (Flaten H.K., Monte A.A., 2017; Tsoi B. et al., 2017).
| Рецепторы ангиотензина II | |
|---|---|
| 1-го субтипа | 2-го субтипа |
| Вазоконстрикция | Вазодилатация |
| Ретенция жидкости | Натрийурез/диурез |
| Внутриклубочковая гипертензия | Антипротеинурический эффект |
| Активация апоптоза | Антиапотозный эффект |
| Провоспалительная активация | Антивоспалительный эффект |
| Стимуляция клеточной дифференциации и пролиферации | Антипролиферативный эффект |
| Прокоагулянтный эффект | Антикоагулянтный эффект |
| Стимуляция агрегации тромбоцитов и активация эндотелиоцитов | Антиагрегантный эффект |
В клиническом аспекте все эти эффекты реализованы в снижении риска общей и кардиоваскулярной смерти, включая риски инсульта, впервые выявленной сердечной недостаточности, возникновения и прогрессирования атеросклероза, а также уменьшение количества новых случаев сахарного диабета, хронической болезни почек и удлинение времени додиализного периода (Cheng J. et al., 2014; Palmer S.C. et al., 2015; Catalá-López F. et al., 2016; Shen J.I. et al., 2017).
Несмотря на то что АРА как и ингибиторы ангиотензинпревращающего фермента (иАПФ) относятся к блокаторам ренин-ангиотензиновой системы, существуют сведения, касающиеся ряда преимуществ АРА перед иАПФ (рис. 4).

Так, в результате анализа данных 40 625 пациентов из реестра REACH выявлено, что применение АРА по сравнению с иАПФ сопровождалось более низкой частотой значимых кардиоваскулярных событий у амбулаторных пациентов с высоким риском кардиоваскулярных заболеваний (Potier L. et al., 2017). Кроме того, АРА достоверно более эффективны в предотвращении новых случаев сахарного диабета 2-го типа и хронической болезни почек, чем иАПФ (Wu H.Y. et al., 2017). Более того, применение АРА при АГ не менее чем на 20% более эффективно, чем любая другая стратегия, не основанная на хронической блокаде ренин-ангиотензиновой системы, именно за счет реализации клинически значимой кардио-, церебро- и ренопротекции (Romero C.A. et al., 2015).
Необходимо отметить отличную переносимость АРА, сопровождающуюся низкой частотой нежелательных побочных реакций и отказов от лечения по этим причинам (сопоставимым с плацебо), а также приемлемую стоимость (Flaten H.K., Monte A.A., 2017; Mazza A. et al., 2017). Эти преимущества позитивно отразились на частоте назначения АРА по поводу АГ и высокого кардиоваскулярного риска. Действительно, за последние 20 лет структура назначаемых антигипертензивных лекарственных препаратов существенным образом изменилась. По данным Датского регистра за период 1999–2015 гг., количество применяемых ежедневно доз препаратов класса АРА возросло на 520%, иАПФ — на 260%, дигидропиридиновых антагонистов медленных кальциевых каналов — на 140%, блокаторов β-адренорецепторов — на 100%, тогда как применение антагонистов минералокортикоидных рецепторов практически не изменилось, а диуретиков даже сократилось на 10% (Sundbøll J. et al., 2017).
Таким образом, АРА — один из наиболее часто назначаемым классов антигипертензивных лекарственных средств с доказанным дозозависимым антигипертензивным эффектом, благоприятным влиянием в отношении предотвращения поражения органов-мишеней и снижением кардиоваскулярного риска и смерти от всех причин.
Значение фиксированных/нефиксированных комбинаций в терапии АГ
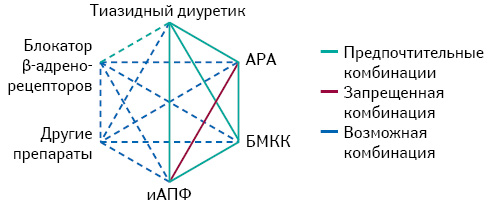
Установлено, что лечение при АГ в режиме монотерапии эффективно не более чем у 60% пациентов с АГ (Reboldi G. et al., 2011), а, по данным исследования HONEST, высокая приверженность антигипертензивному лечению через 6 мес постоянного применения препаратов сохраняется лишь у половины опрошенных (Kario K. et al., 2016). Комбинирование антигипертензивных лекарственных средств является одним из способов повышения их результативности за счет реализации истинного синергичного эффекта как в отношении снижения офисного/суточного АД, так и органопротекторных качеств (Березин А.Е., 2007; Березін О.Є., 2016). Принято считать, что фиксированная/нефиксированная комбинация из двух антигипертензивных препаратов наиболее предпочтительна для инициальной терапии у больных АГ 2-й или 3-й степени тяжести или у пациентов с АГ высокого или очень высокого кардиоваскулярного риска (Zanchetti A. et al., 2009; Mancia G. et al., 2014; Weber M.A. et al., 2014). Более того, комбинации из ≥2 препаратов упрощают достижение целевого уровня АД и повышают приверженность пациента лечению без существенного ухудшения профиля безопасности и переносимости (Zanchetti A. et al., 2009). В табл. 2 представлены данные об основных принципах проведения комбинированной антигипертензивной терапии. При этом выбор наиболее предпочтительной комбинации основывается на результатах рандомизированных контролируемых исследований (РКИ) и в формализованном виде представляет собой гексагональную диаграмму (рис. 5). В практическом аспекте у больных АГ с очень высоким АД или имеющих высокий/очень высокий кардиоваскулярный риск целесообразно начинать антигипертензивную терапию с двойной комбинации (Smith D.H., 2007).
| Показатель | Действующие клинические рекомендации по профилактике и лечению АГ | |||||
|---|---|---|---|---|---|---|
| Canadian Hypertension Society (2012) |
NICE (2013) | JNC-8 (2014) | ESH/ESC (2013) | AHA/ACC (2017) | ASH/ISH (2003) | |
| Инициальная терапия двойной комбинацией | АД ≥160/100 мм рт. ст. | АД ≥160/100 мм рт. ст. | АД ≥160/100 мм рт. ст. | АД ≥140/90 мм рт. ст. у пациентов высокого/очень высокого риска или превышение на 20/10 мм рт. ст. целевого уровня систолического и диастолического АД соответственно в остальных популяциях | Превышение на 20/10 мм рт. ст. целевого уровня систолического и диастолического АД | АД ≥160/100 мм рт. ст. |
| Поддерживающая терапия тройной комбинацией | Не достигнут целевой уровень АД при применении монотерапии или двойной комбинации | |||||
| Блокаторы ренин-ангиотензиновой системы как инициальный компонент комбинированной терапии | Да | Да | Да (для представителей европеоидной расы) | Да | Да | Да |
| Блокатор β-адренорецепторов как препарат выбора | Да | Нет | Нет | Да | Нет | Нет |
| Диуретик как обязательный компонент двойной комбинации | Нет | Нет | Да | Нет | Нет | Нет |
Эффективность комбинации валсартан + гидрохлоротиазид
Среди наиболее часто применяемых комбинаций АРА с тиазидным диуретиком является валсартан в сочетании с гидрохлоротиазидом, клиническая эффективность и безопасность которой достаточно подробно изучена в ходе многочисленных РКИ с высокой статистической мощностью.
Так, в раннем исследовании L.M. Ruilope и соавторов (2005) установлено, что фиксированная комбинация валсартан/гидрохлоротиазид в дозе 160/25 мг, применяемая однократно утром, обладала способностью эффективно снижать офисное АД, а также среднесуточное, среднее дневное и среднее ночное АД, реверсируя вариабельность АД у пациентов со среднетяжелой АГ и высоким кардиоваскулярным риском. В многоцентровом двойном слепом РКИ EVALUATE оценивали эффективность двух режимов антигипертензивной терапии, основанных на применении АРА валсартана или блокатора медленных кальциевых каналов амлодипина в сочетании с гидрохлоротиазидом (Lacourcière Y. et al., 2009). Анализ полученных данных показал, что через 10 нед лечения среднее офисное систолическое и диастолическое АД достоверно (р<0,0001) снизилось как в группе валсартана/гидрохлоротиазида (Δ% –34,2 и –14,2 мм рт. ст. соответственно), так и в группе амлодипина/гидрохлоротиазида (Δ% –34,1 и –14,7 мм рт. ст. соответственно). Достоверное (р<0,0001) снижение среднесуточного систолического и диастолического АД также отмечено в обеих группах пациентов (Δ% –21,1 и –12,5 мм рт. ст. в группе валсартана/гидрохлоротиазида, Δ% –18,1/–9,9 в группе амлодипина/гидрохлоротиазида соответственно). Тем не менее именно у пациентов, получавших в качестве основной терапии комбинацию валсартан + гидрохлоротиазид, зарегистрировано наибольшее дополнительное снижение систолического (Δ% –3,8 мм рт. ст.; р=0,0042) и диастолического (Δ% –2,7 мм рт. ст.; р=0,0002) АД по сравнению с группой применявших амлодипин + гидрохлоротиазид. Доля пациентов, достигших целевого уровня офисного АД <140/80 мм рт. ст. в группах валсартан + гидрохлоротиазид (55,3%) и амлодипин + гидрохлоротиазид (54,9%) имела сопоставимый характер. Вместе с тем целевой уровень АД <130/80 мм рт. ст. был достигнут достоверно чаще (р=0,0170) в группе валсартан + гидрохлоротиазид (54,3%) по сравнению с группой амлодипин + гидрохлоротиазид (42,7%). Отмечена достаточно высокая приверженность терапии обеими стратегиями и схожая переносимость и безопасность на протяжении периода наблюдения (Lacourcière Y. et al., 2009).
В двойном слепом РКИ PROMPT (n=1285) на протяжении 14 нед проводили сравнение эффективности и безопасности различных доз валсартана в сочетании с гидрохлоротиазидом по сравнению с амлодипином в сочетании с гидрохлоротиазидом у больных АГ (Zappe D. et al., 2009). Пациентов, ранее не получавших антигипертензивных препаратов и имевших мягкую АГ (33,9%), распределяли в группы валсартана 160 мг/сут или амлодипина 5 мг/сут. Пациентов с умеренной АГ (13,5%) или с отсутствием достижения целевого уровня АД <140/90 мм рт. ст. (52,6%) распределяли в группы валсартана 160 мг/гидрохлоротиазида 12,5 мг или амлодипина 10 мг/сут. Все пациенты, у которых через 4; 8 и 11 нед терапии не удалось достичь целевого уровня АД, получали максимальные суточные дозы фиксированной комбинации валсартан + гидрохлоротиазид (320/25 мг) или амлодипин + гидрохлоротиазид (10/25 мг). По завершению исследования оказалось, что 78,8% пациентов группы валсартан +/– гидрохлоротиазид достигли целевого уровня АД (офисное АД <140/90 мм рт. ст.), тогда как в группе амлодипин +/– гидрохлоротиазид этот показатель составил 67,8% (р<0,0001). В группе амлодипина по сравнению с группой валсартана достоверно чаще отмечали отеки нижних конечностей (22,4 и 2,2% соответственно) и отказ от лечения в связи с побочными эффектами (7,3% и <1,0% соответственно).
Таким образом, в условиях РКИ валсартан в комбинации с гидрохлоротиазидом продемонстрировал высокую антигипертензивную эффективность и достаточно хороший уровень переносимости и безопасности в широком диапазоне доз.
Комбинированный антигипертензивный препарат Тиара Дуо
В Украине фиксированная комбинация на основе валсартана и гидрохлоротиазида представлена препаратом Тиара Дуо («Фармацевтическая фирма «Дарница»). В клиническом исследовании подтверждена биоэквивалентность Тиара Дуо оригинальному препарату (Державний експертний центр МОЗ України, 2016). Тиара Дуо выпускается в широком диапазоне возможных сочетаний действующих веществ, а именно:
- валсартан 80 мг/гидрохлоротиазид 12,5 мг;
- валсартан 160 мг/гидрохлоротиазид 12,5 мг;
- валсартан 160 мг/гидрохлоротиазид 25,0 мг.
Это позволяет осуществлять индивидуальный подбор доз для различных категорий пациентов с АГ. Высокая антигипертензивная эффективность комбинации обусловлена синергическим действием компонентов Тиара Дуо на различные звенья патогенеза АГ. Дополнительным преимуществом препарата являются клинически значимые кардио-, церебро- и ренопротекторный эффекты.
Все это дает возможность применять препарат Тиара Дуо как у пациентов с умеренной и тяжелой систоло-диастолической АГ без сопутствующих кардиоваскулярных и метаболических заболеваний, так и у лиц с достаточно широким спектром коморбидных состояний, включая асимптомный атеросклероз, ишемическую болезнь сердца, сахарный диабет, нефропатию любой этиологии, сердечную недостаточность. При этом доказанный органопротекторный эффект позволяет повысить эффективность комбинированной терапии в предотвращении поражения органов-мишеней, а также уменьшения прогрессирования уже существующих органопатий.
В заключение необходимо отметить, что фиксированная комбинация на основе валсартана и гидрохлоротиазида имеет достаточно широкую доказательную базу высокой эффективности. Препарат отличается высоким профилем безопасности и переносимости.
Список использованной литературы
- Березин А.Е. (2007) Оценка глобального кардиоваскулярного риска. Преимущества и ограничения мультифакториального подхода. Укр. мед. часопис, 3(59): 37–44.
- Березин А.Е. (2009) Клиническая эффективность и безопасность применения олмесартана — нового антагониста рецепторов к ангиотензину II — у пациентов с артериальной гипертензией. Укр. мед. часопис, 4(72): 25–30 (http://www.umj.com.ua/article/2803).
- Березін О.Є. (2016) Фіксовані комбінації в лікуванні пацієнтів із артеріальною гіпертензією. Укр. мед. часопис, 4(114): 57–61 (http://www.umj.com.ua/article/100420).
- Державний експертний центр МОЗ України (2016) Перелік протоколів клінічних випробувань лікарських засобів та суттєвих поправок до протоколів клінічних випробувань, розглянутих на засіданнях Науково-експертної ради № 05 від 26.05.16 та Науково-технічної ради № 10 від 26.05.2016, на які були отримані позитивні висновки експертів та протокол клінічного випробування на який було отримано негативні висновки експертів (http://www.dec.gov.ua/site/files/klinika/33.docx).
- Міністерство охорони здоров’я України (2012) Наказ Міністерства охорони здоров’я України від 24.05.2012 р. № 384 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при артеріальній гіпертензії».
- Acevedo M., Valentino G., Kramer V. et al. (2017) Evaluation the American College of Cardiology and American Heart Association Predictive score for cardiovascular diseases. Rev. Med. Chil., 145(3): 292–298.
- Catalá-López F., Macías Saint-Gerons D., González-Bermejo D. et al. (2016) Cardiovascular and Renal Outcomes of Renin-Angiotensin System Blockade in Adult Patients with Diabetes Mellitus: A Systematic Review with Network Meta-Analyses. PLoS Med., 13(3): e1001971.
- Cheng H.M., Wu C.L., Sung S.H. et al. (2017) Prognostic Utility of Morning Blood Pressure Surge for 20-Year All-Cause and Cardiovascular Mortalities: Results of a Community-Based Study. J. Am. Heart Assoc., 6(12): e007667.
- Cheng J., Zhang W., Zhang X. et al. (2014) Effect of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers on all-cause mortality, cardiovascular deaths, and cardiovascular events in patients with diabetes mellitus: a meta-analysis. JAMA Intern. Med., 174(5): 773–785.
- Costa F.V., D’Ausilio A., Bianchi C. et al. (2009) Adherence to anti-hypertensive medications: a review and update. High Blood Pres. Cardiovascular. Prevent., 16: 101–110.
- Elliott W.J., Plauschinat C.A., Skrepnek G.H., Gause D. (2007) Persistence, adherence, and risk of discontinuation associated with commonly prescribed antihypertensive drug monotherapies. J. Am. Board Fam. Med., 20: 72–80.
- Esposti L.D., Saragoni S., Benemei S. et al. (2011) Adherence to antihypertensive medications and health outcomes among newly treated hypertensive patients. Clinicoecon. Outcomes Res., 3: 47–54.
- Flack J.M., Calhoun D., Schiffrin E.L. (2017) The New ACC/AHA Hypertension Guidelines for the prevention, detection, evaluation, and management of high blood pressure in adults. Am. J. Hypertens., Dec 7. [Epub. ahead of print].
- Flaten H.K., Monte A.A. (2017) The Pharmacogenomic and Metabolomic Predictors of ACE Inhibitor and Angiotensin II Receptor Blocker Effectiveness and Safety. Cardiovasc. Drugs Ther., 31(4): 471–482.
- Gaziano T.A., Bitton A., Anand S. et al. (2009) The global cost of non optimal blood pressure. J. Hypertens., 27: 1472–1477.
- Grossman E. (1998) Does the «J-curve» still hold in the post «HOT» era? J. Hum. Hypertens., 12(11): 729–730.
- Hansson L., Lloyd A., Anderson P. et al. (2002) Excess morbidity and cost of failure to achieve targets for blood pressure control in Europe. Blood Press., 11: 35–45.
- Ibsen H. (1998) Intensive blood pressure lowering warranted. Results of the HOT study: an epitaph for the J-curve concept in hypertension. J. Hum. Hypertens., 12(11): 731–732.
- James P.A., Oparil S., Carter B.L. et al. (2014) 2014 evidence-based guideline for the management of high blood pressure in adults: report from the panel members appointed to the Eighth Joint National Committee (JNC 8). JAMA, 311(5): 507–520.
- Jaques H.; National Institute for Health and Clinical Excellence (NICE) (2013) NICE guideline on hypertension. Eur. Heart J., 34(6): 406–408.
- Kario K., Saito I., Kushiro T. et al. (2016) Morning Home Blood Pressure Is a Strong Predictor of Coronary Artery Disease: The HONEST Study. J. Am. Coll.Cardiol., 67(13): 1519–1527.
- Kendir C., van den Akker M., Vos R., Metsemakers J. (2017) Cardiovascular disease patients have increased risk for comorbidity: A cross-sectional study in the Netherlands. Eur. J. Gen. Pract., 23: 1–6.
- Lacourcière Y., Wright J.T.Jr., Samuel R. et al.; EVALUATE study (2009) Effects of force-titrated valsartan/hydrochlorothiazide versus amlodipine/hydrochlorothiazide on ambulatory blood pressure in patients with stage 2 hypertension: the EVALUATE study. Blood Press. Monit., 14(3): 112–120.
- Laurent S. (2017) Antihypertensive drugs. Pharmacol. Res., 124: 116–125.
- Law M.R., Morris J.K., Wald N.J. (2009) Use of blood pressure lowering drugs in the prevention of cardiovascular disease: meta-analysis of 147 randomised trials in the context of expectations from prospective epidemiological studies. BMJ, 338: b1665.
- Levy D. (1999) The role of systolic blood pressure in determining risk for cardiovascular disease. J. Hypertens., 17(1): S15–S18.
- Mancia G., Fagard R., Narkiewicz K. et al; Task Force for the Management of Arterial Hypertension of the European Society of Hypertension and the European Society of Cardiology (2014) 2013 ESH/ESC Practice Guidelines for the Management of Arterial Hypertension. Blood Press., 23(1): 3–16.
- Mazza A., Sacco A.P., Townsend D.M. et al. (2017) Cost-benefit effectiveness of angiotensin-II receptor blockers in patients with uncomplicated hypertension: A comparative analysis. Biomed Pharmacother., 90: 665–669.
- Mozaffarian D., Benjamin E.J., Go A.S. et al. (2016) American Heart Association Statistics Committee; Stroke Statistics Subcommittee. Heart Disease and Stroke Statistics-2016 Update: A Report From the American Heart Association. Circulation, 133: e38–e360.
- Muntner P., Carey R.M., Gidding S. et al. (2017) Potential U.S. Population Impact of the 2017 American College of Cardiology/American Heart Association High Blood Pressure Guideline. J. Am. Coll. Cardiol., Nov. 6 [Epub. ahead of print].
- Palmer S.C., Mavridis D., Navarese E. et al. (2015) Comparative efficacy and safety of blood pressure-lowering agents in adults with diabetes and kidney disease: a network meta-analysis. Lancet, 385: 2047–2056.
- Potier L., Roussel R., Elbez Y. et al.; REACH Registry Investigators (2017) Angiotensin-converting enzyme inhibitors and angiotensin receptor blockers in high vascular risk. Heart, 103(17): 1339–1346.
- Psaty B.M., Lumley T., Furberg C.D. et al. (2003) Health outcomes associated with various antihypertensive therapies used as first-line agents: a network meta analysis. JAMA, 289: 2534–2544.
- Reboldi G., Gentile G., Angeli F. et al. (2011) Effects of intensive blood pressure reduction on myocardial infarction and stroke in diabetes: a meta-analysis in 73,913 patients. J. Hypertens., 29: 1253–1269.
- Reboussin D.M., Allen N.B., Griswold M.E. et al. (2017) Systematic Review for the 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J. Am. Coll. Cardiol., Nov. 7 [Epub. ahead of print].
- Romero C.A., Orias M., Weir M.R. (2015) Novel RAAS agonists and antagonists: clinical applications and controversies. Nat. Rev. Endocrinol., 11(4): 242–252.
- Ruilope L.M., Heintz D., Brandão A.A. et al. (2005) 24-hour ambulatory blood-pressure effects of valsartan and hydrochlorothiazide combinations compared with amlodipine in hypertensive patients at increased cardiovascular risk: a VAST sub-study. Blood Press Monit., 10(2): 85–91.
- Shen J.I., Saxena A.B., Montez-Rath M.E. et al. (2017) Comparative effectiveness of angiotensin receptor blockers vs. angiotensin-converting enzyme inhibitors on cardiovascular outcomes in patients initiating peritoneal dialysis. J. Nephrol., 30(2): 281–288.
- Simon A., Levenson J. (1998) Hypertension Optimal Treatment (HOT) trial. Lancet, 352(9127): 571.
- Smith D.H. (2007) Fixed-dose combination antihypertensives and reduction in target organ damage: are they all the same? Am. J. Cardiovasc. Drugs, 7(6): 413–422.
- Sundbøll J., Adelborg K., Mansfield K.E. et al. (2017) Seventeen-Year Nationwide Trends in Antihypertensive Drug Use in Denmark. Am. J. Cardiol., 120(12): 2193–2200.
- Tadic M., Cuspidi C., Bombelli M., Grassi G. (2017) Hypertensive heart disease beyond left ventricular hypertrophy: are we ready for echocardiographic strain evaluation in everyday clinical practice? J. Hypertens., Dec. 7 [Epub. ahead of print].
- Timmis A., Townsend N., Gale C. et al.; Atlas Writing Group (2017) European Society of Cardiology: Cardiovascular Disease Statistics 2017. Eur. Heart J., Nov. 27 [Epub. ahead of print].
- Tsoi B., Akioyamen L.E., Bonner A. et al. (2017) Comparative Efficacy of Angiotensin II Antagonists in Essential Hypertension: Systematic Review and Network Meta-analysis of Randomised Controlled Trials. Heart Lung Circ., Jul. 14 [Epub. ahead of print].
- Van den Berg M.J., Bhatt D.L., Kappelle L.J. et al.; SMART study group; REACH Registry investigators (2017) Identification of vascular patients at very high risk for recurrent cardiovascular events: validation of the current ACC/AHA very high risk criteria. Eur. Heart J., Nov. 14 [Epub. ahead of print].
- Webb A.J.S., Mazzucco S., Li L., Rothwell P.M. (2017) Prognostic Significance of Blood Pressure Variability on Beat-to-Beat Monitoring After Transient Ischemic Attack and Stroke. Stroke, Dec. 11 [Epub. ahead of print].
- Weber M.A., Schiffrin E.L., White W.B. et al. (2014) Clinical practice guidelines for the management of hypertension in the community a statement by the American Society of Hypertension and the International Society of Hypertension. J. Hypertens., 32: 3–15.
- Wolf-Maier K., Cooper R.S., Kramer H. et al. (2004) Hypertension treatment and control in five European countries, Canada, and the United States. Hypertension, 43(1): 10–17.
- Wu H.Y., Peng C.L., Chen P.C. et al. (2017) Comparative effectiveness of angiotensin-converting enzyme inhibitors versus angiotensin II receptor blockers for major renal outcomes in patients with diabetes: a 15-year cohort study. PLoS One, 12(5): e0177654.
- Zanchetti A., Grassi G., Mancia G. (2009) When should antihypertensive drug treatment be initiated and to what levels should systolic blood pressure be lowered? A critical reappraisal. J. Hypertens., 27: 923–934.
- Zappe D., Papst C.C., Ferber P.; PROMPT Investigators (2009) Randomized study to compare valsartan +/– HCTZ versus amlodipine +/– HCTZ strategies to maximize blood pressure control. Vasc. Health Risk Manag., 5: 883–892.
Резюме. Стаття присвячена оптимальному вибору комбінацій антигіпертензивних лікарських засобів у пацієнтів з артеріальною гіпертензією. Обговорюються питання взаємозв’язку кардіоваскулярного ризику, віку і тяжкості артеріальної гіпертензії. Наведено результати найважливіших рандомізованих досліджень, що стосуються оцінки ефективності різних комбінацій антигіпертензивних препаратів. Описано переваги комбінованого лікування артеріальної гіпертензії на основі антагоністів рецепторів ангіотензину II, що включають антигіпертензивну ефективність, органопротекторні властивості, безпеку і переносимість.
Ключові слова: кардіоваскулярні захворювання, артеріальна гіпертензія, антигіпертензивна терапія, фіксовані та нефіксовані комбінації.
Адрес для переписки:
Березин Александр Евгеньевич
69121, Запорожье, а/я 6323
Запорожский государственный
медицинский университет,
кафедра внутренних болезней № 2
Получено 18.12.2017





