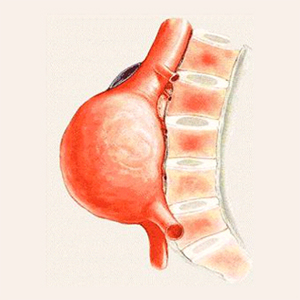
 Термін «аневризма черевної аорти» (АЧА) зазвичай передбачає її розширення у діаметрі понад 3 см. Лише в Сполучених Штатах Америки за оцінками експертів поширеність захворювання становить 1,4% серед людей віком 50–84 роки. В абсолютних цифрах — 1,1 млн носіїв серед дорослих [10]. Основними факторами ризику аневризмоутворення є похилий вік, сімейний анамнез, довготривале паління тютюну, гіперхолестеринемія, артеріальна гіпертензія, ішемічна хвороба серця [12]. Основна небезпека довготривалого існування АЧА — підвищений ризик її розриву при збільшенні розмірів і значний ризик раптової смерті. За даними проспективного дослідження [4], ризик гострого розриву залежно від розмірів АЧА у річному вимірі становить не вище 1% для малих аневризм розмірами 5,0–5,9 см в діаметрі та 14,1% на рік при розмірах ≥6 см.
Термін «аневризма черевної аорти» (АЧА) зазвичай передбачає її розширення у діаметрі понад 3 см. Лише в Сполучених Штатах Америки за оцінками експертів поширеність захворювання становить 1,4% серед людей віком 50–84 роки. В абсолютних цифрах — 1,1 млн носіїв серед дорослих [10]. Основними факторами ризику аневризмоутворення є похилий вік, сімейний анамнез, довготривале паління тютюну, гіперхолестеринемія, артеріальна гіпертензія, ішемічна хвороба серця [12]. Основна небезпека довготривалого існування АЧА — підвищений ризик її розриву при збільшенні розмірів і значний ризик раптової смерті. За даними проспективного дослідження [4], ризик гострого розриву залежно від розмірів АЧА у річному вимірі становить не вище 1% для малих аневризм розмірами 5,0–5,9 см в діаметрі та 14,1% на рік при розмірах ≥6 см.
Виникає питання, що є доцільнішим — відповідне спостереження у судинного хірурга, визначення ступеня ризику розвитку ускладнень чи безпосереднє хірургічне лікування для усунення аневризми. Разом з тим час та критичний стан, що передбачає своєчасне хірургічне втручання, а також вид оперативного лікування — залишаються дискусійними. Саме на ці питання намагаються дати відповідь автори наведеної публікації, яка надрукована у виданні «Медичний журнал Нової Англії» («The New England Journal of Medicine»[2]) у жовтні поточного року.
А. Клінічні питання, які варто брати до уваги при плануванні лікування аневризм черевного відділу аорти наразі є такими:
- фактори ризику, які спричиняють формування АЧА, добре відомі і включають похилий вік, чоловічу стать, обтяжений сімейний анамнез, куріння в минулому або тютюнопаління на час огляду, гіперхолестеринемію, артеріальну гіпертензію та ішемічну хворобу серця. Водночас ризик аневризмоутворення є нижчим у пацієнтів з цукровим діабетом;
- оперативне лікування необхідно пропонувати пацієнтам чоловічої статі, у яких максимальний діаметр аневризми становить ≥5,5 см, і жінкам, у яких максимальний діаметр становить ≥5,0 см;
- результати рандомізованих контрольованих досліджень показують, що ендоваскулярне протезування аорти при аневризмах (EVAR) супроводжується нижчим ризиком розвитку періопераційних ускладнень та нижчою летальністю, ніж традиційне відкрите хірургічне лікування;
- безпосередні та ранні переваги EVAR порівняно із відкритим хірургічним втручанням відмічають протягом 2–3 років з моменту проведення процедури. Натомість у довгостроковій перспективі щодо виживання перевага відсутня;
- процедура EVAR асоціюється з більш високим ризиком необхідності повторних втручань, однак у більшості вони передбачають незначні ендоваскулярні процедури, які не несуть загрози для життя. Водночас пацієнти, яким виконано традиційне відкрите хірургічне втручання, мають високий ризик повторних хірургічних втручань, зумовлених розрізом черевної порожнини (лапаротомією);
- необхідно також брати до уваги довготривале спостереження за станом пацієнтів після EVAR із обов’язковим виконанням діагностичних обстежень із застосуванням дуплексної ультрасонографії або комп’ютерної томографії.
Б. Стратегія лікування
- Пацієнти із АЧА розміром ≤5,5 см не потребують оперативного лікування і мають знаходитися під ретельним спостереженням. Така тактика є безпечною й економічно обґрунтованою [9, 13, 16]. Водночас тактика лікування/спостереження може бути змінена, якщо швидкість збільшення розмірів аневризми буде вищою, ніж 1 см на рік [15].
В. Особливості спостереження
- Пацієнти з АЧА, розмір якої 3,0–3,9 см (мала аневризма), потребують динамічного спостереження із застосуванням ультразвукової діагностики (УЗД) черевної порожнини раз на 3 роки.
- Пацієнти, які мають розмір АЧА 4,0–4,9 см, потребують проведення УЗД-обстеження один раз на рік, а у разі її діаметру ≥5,0 см таке обстеження виконують кожні 6 міс [6].
- Із додаткових порад, які можуть суттєво вплинути на ризик розвитку ускладнень, варто виконувати наступне: припинити куріння, додати до лікування прийом статинів, блокаторів бета-адренорецепторів та інших антигіпертензивних препаратів (однак ці рекомендації не мали статистично доведеного впливу на зменшення/збільшення аневризми в діаметрі, хоч і суттєво зменшували вираженість інших серцево-судинних ускладнень.
Г. Варіанти хірургічного лікування
Для пацієнтів, які мають великі АЧА передбачається (рекомендовано) оперативне лікування. З часу впровадження в клінічну практику малоінвазивного лікування аневризм аорти у 1991 р. [1] та розробки технології EVAR лікування хворих із АЧА на сьогодні проводять із застосуванням малоінвазивного та традиційного відкритого хірургічного втручання. Однак зауважимо, що в Сполучених Штатах 80% втручань з приводу АЧА виконуються з використанням EVAR [5, 8, 11]. Багато лікувальних закладів широко використовують EVAR як бажаний варіант лікування у пацієнтів з відповідною анатомією АЧА.
Д. Клінічні рішення відповідно до настанов
Рекомендації щодо лікування АЧА опубліковані Товариством судинної хірургії (SVS, США) [7] та Європейським товариством судинної хірургії (ESVS) [17]. В обох документах щодо якості доказів вона помірна (B, SVS) або низька (C, ESVS) і має слабкий рівень (2) при плановому хірургічному лікуванні аневризм черевного відділу аорти діаметром ≥5,5 см для чоловіків та 5,0 см і більше у жінок.
Натомість настанови не містять рекомендацій щодо переваг відкритого хірургічного втручання порівняно з EVAR. Разом із тим настанови ESVS рекомендують EVAR у більшості пацієнтів з відповідною анатомією АЧА, якщо очікувана тривалістю життя є не меншою ніж 2 роки [3].
В обох рекомендаціях зазначено також, що не доведено впливу на сповільнення швидкості розширення аневризми у відповідь на призначення специфічного медикаментозного лікування.
Список використаної літератури
- Volodos N.L., Karpovich I.P., Troyan V.I. et al. (1991) Clinical experience of the use of self-fixing synthetic prostheses for remote endoprosthetics of the thoracic and the abdominal aorta and iliac arteries through the femoral artery and as intraoperative endoprosthesis for aorta reconstruction. Vasa Suppl.; 33: 93–95.
- Björck M., Earnshaw J.J., Acosta S. et al. (2020) Editor’s choice — European Society for Vascular Surgery (ESVS) 2020 clinical practice guidelines on the management of acute limb ischaemia. Eur. J. Vasc. Endovasc. Surg.; 59: 173–218.
- Brown P.M., Zelt D.T., Sobolev B. (2003) The risk of rupture in untreated aneurysms: the impact of size, gender, and expansion rate. J. Vasc. Surg.; 37: 280–284.
- Buck D.B., van Herwaarden J.A., Schermerhorn M.L. et al. (2014) Endovascular treatment of abdominal aortic aneurysms. Nat. Rev. Cardiol.; 11: 112–123.
- Chaikof E.L., Brewster D.C., Dalman R.L. et al. (2009) SVS practice guidelines for the care of patients with an abdominal aortic aneurysm: executive summary. J. Vas.c Surg.; 50: 880–896.
- Chaikof E.L., Dalman R.L., Eskandari M.K. et al. (2018) The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J. Vasc. Surg.; 67(1): e2–77.e2.
- Dua A., Kuy S., Lee C.J. et al. (2014) Epidemiology of aortic aneurysm repair in the United States from 2000 to 2010. J. Vasc. Surg.; 59: 1512–1517.
- Filardo G., Powell J.T., Martinez M.A.-M. et al. (2015) Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst. Rev.; 2: CD001835–CD001835.
- Kent K.C., Zwolak R.M., Egorova N.N. et al. (2010) Analysis of risk factors for abdominal aortic aneurysm in a cohort of more than 3 million individuals. J. Vasc. Surg.; 52: 539–548.
- Lederle F.A., Freischlag J.A., Kyriakides T.C. et al. (2009) Outcomes following endovascular vs open repair of abdominal aortic aneurysm: a randomized trial. JAMA; 302: 1535–1542.
- Lederle F.A., Johnson G.R., Wilson S.E. et al. (1997) Prevalence and associations of abdominal aortic aneurysm detected through screening. Ann. Intern. Med.; 126: 441–449.
- Lederle F.A., Wilson S.E., Johnson G.R. et al. (2002) Immediate repair compared with surveillance of small abdominal aortic aneurysms. N. Engl. J. Med.; 346: 1437–1444.
- Schanzer A. and Oderich G.S. (2021) Management of Abdominal Aortic Aneurysms. N. Engl. J. Med.; 385: 1690–1698. DOI: 10.1056/NEJMcp2108504.
- Sharp M.A., Collin J. (2003) A myth exposed: fast growth in diameter does not justify precocious abdominal aortic aneurysm repair. Eur. J. Vasc. Endovasc. Surg.; 25: 408–411.
- The UK Small Aneurysm Trial Participants (1998) Mortality results for randomised controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic aneurysms. Lancet; 352: 1649–1655.
- Wanhainen A., Verzini F., Van Herzeele I. et al. (2019) Editor’s choice — European Society for Vascular Surgery (ESVS) 2019 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur. J. Vasc. Endovasc. Surg.; 57: 8–93.





