Вступ
Метаболічний синдром (МС) — поняття, що об’єднує низку факторів серцево-судинного ризику (ССР), а саме: артеріальну гіпертензію (АГ), абдомінальне ожиріння, дисліпідемію та інсулінорезистентність (ІР). Поширеність МС, за даними американських дослідників, становить 23,7%. Розвиток МС залежить від маси тіла і корелює з індексом маси тіла (ІМТ) як у чоловіків, так і у жінок. Серед осіб з надмірною масою тіла поширеність МС становить 22–28%, серед осіб з ожирінням — 50–60% (Мищенко Л.А., 2007). За даними Фремінгемського дослідження, вірогідність розвитку серцево-судинної патології у осіб з ожирінням на 50% вища, ніж у осіб з нормальною масою тіла (Levy D. et al., 1992). Встановлено, що у пацієнтів з АГ та ожирінням ризик розвитку ішемічної хвороби серця підвищений у 2–3 рази, а ризик інсульту — у 7 разів. Також відомо, що у пацієнтів з ожирінням за рахунок збільшення ударного об’єму збільшується серцевий викид. Це призводить до розвитку гіпертрофії лівого шлуночка (ГЛШ) та діастолічної, а у подальшому — систолічної його дисфункції та розвитку серцевої недостатності на фоні збільшеного об’єму циркулюючої крові (Vasan R.S., 2003). Доведено, що ГЛШ має більш суттєве значення як фактор ризику, ніж рівень артеріального тиску (АТ), як згідно з показаннями добового моніторування, так і при офісному вимірюванні (Benjamin E.J., Levy D. 1999; Brown D.W. et al., 2000). Ступінь ГЛШ зумовлений віком, статтю, расою, масою тіла, типом і ступенем ожиріння, рівнем інсулінемії, іншими метаболічними та гуморальними порушеннями, рівнем АТ, тривалістю захворювання на АГ та генетичними факторами. Але точні механізми, за допомогою яких ожиріння може викликати збільшення маси лівого шлуночка (МЛШ), повністю не з’ясовані (Lang R.M. et al., 2006; Grassi G., Diez J., 2009). Для пацієнтів з ожирінням та АГ характерне одночасне підвищення як перед-, так і постнавантаження серця (Chirinos J.A. et al., 2010; Armstrong A.C. et al., 2012). При цьому переднавантаження в основному пов’язане зі збільшенням об’єму циркулюючої крові, а постнавантаження — з факторами, що підвищують опір артеріального кровотоку. Крім того, негемодинамічні чинники, такі як збільшення адипокінів (лептину та кардіотрофіну-1), активація симпатичної нервової системи (СНС), ренін-ангіотензинової системи та ІР можуть сприяти розвитку ГЛШ (Sader S. et al., 2003; Vasan R.S., 2003; Norton G.R. et al., 2009).
Лептин — гормональний пептид, який синтезується білими адипоцитами. Його основним біологічним ефектом є контроль вмісту жиру в організмі шляхом регуляції балансу апетит/термогенез. У більшості осіб з аліментарним ожирінням рівень лептину підвищений у 2–7 разів, вміст його у плазмі крові зростає пропорційно ступеню ожиріння. При досягненні певної концентрації лептину в плазмі крові (25–30 нг/мл) подальше її підвищення не супроводжується одночасним підвищенням в головному мозку, спинномозковій рідині. Цей феномен може відігравати певну роль у розвитку резистентності до лептину і ожиріння (Чубриева С.Ю. и соавт., 2008; Gorska E. et al., 2010). Однак сьогодні механізми формування резистентності до лептину не до кінця з’ясовані, є окремі дані про те, що в її основі може лежати блокада рецепторів або дефекти переносу цього цитокіну через гематоенцефалічний бар’єр. Не виключено, що низький рівень розчинного рецептора лептину (sOB-R) і низька частка зв’язаного лептину є маркерами лептинорезистентності, незалежно пов’язаними з ІР і абдомінальним ожирінням (Owecki M. et al., 2010). Також лептин стимулює NO-опосередковану вазодилатацію. Гіперлептинемія — один із ймовірних факторів, що пов’язує активацію СНС з підвищенням АТ при ожирінні. Оскільки ожиріння сприяє появі ендотеліальної дисфункції, вважають, що реакція АТ у відповідь на гіперлептинемію вища у пацієнтів з ожирінням, ніж у осіб з нормальною масою тіла. Останнім часом з’являються відомості про патологічний зв’язок лептину з ГЛШ (East M.A. et al., 2003; Ковальова О.М. та ін., 2011).
Тому мета дослідження — вивчення взаємозв’язку між лептинорезистентністю, профілем АТ і структурно-функціональними характеристиками міокарда у осіб із гіпертонічною хворобою (ГХ) та МС.
Об’єкт і методи дослідження
На базі відділу дисліпідемій ДУ «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України» обстежено 160 пацієнтів з ГХ II стадії та МС. У 84 пацієнтів визначено рівень sOB-R, серед них 43 жінки та 41 чоловік. Верифікацію діагнозу проводили згідно з критеріями Європейського товариства з вивчення гіпертензії/Європейського товариства кардіологів (European Society of Hypertension (ESH)/European Society of Cardiology (ESC), 2013) та рекомендацій Української асоціації кардіологів (2008), із переглядом клінічної настанови у 2012 р.
У групі пацієнтів із ГХ помірного та високого ССР реєстрували АГ 1-го та 2-го ступеня (м’яка та помірна АГ). МС встановлювали згідно з Консенсусом з МС (2009) та Рекомендаціями ESC щодо профілактики серцево-судинних захворювань (2012).
Проведено загальноклінічні дослідження, вимірювання маси тіла, зросту та розрахунок ІМТ за формулою Кетле відповідно до Рекомендацій Всесвітньої організації охорони здоров’я (1997).
Аналіз даних проводили окремо у групах жінок та чоловіків, із врахуванням статевих відмінностей. Беручи до уваги гендерні норми рівнів лептину, визначено такі клінічні групи окремо для жінок та чоловіків: 1-ша група — пацієнти з ГХ та МС без порушень вуглеводного обміну, 2-га група — пацієнти з ГХ, МС та ІР без цукрового діабету (ЦД) та порушеної толерантності до вуглеводів, 3-тя група — пацієнти з ГХ, МС та порушеною толерантністю до вуглеводів, 4-та група — пацієнти з ГХ, МС та ЦД.
Середній вік пацієнтів становив 47,50±2,89 року. До 1-ї групи увійшли 11 жінок з ІМТ 27,4±1,4 кг/м² і 11 чоловіків з ІМТ 27,2±1,7 кг/м², до 2-ї — 12 жінок з ІМТ 28,4±1,7 кг/м² та 10 чоловіків з ІМТ 31,9±2,0 кг/м², до 3-ї — 10 жінок з ІМТ 32,3±4,0 кг/м² та 10 чоловіків з ІМТ 34,0±2,3 кг/м², та до 4-ї — 10 жінок з ІМТ 33,0±1,5 кг/м² і 10 чоловіків з ІМТ 35,7±0,9 кг/м². При аналізі враховували величини норми ІМТ, показника інсуліну натще, НОМА-індексу, рівнів лептину, sOB-R та вільного лептинового індексу (ВЛІ), що становив відношення лептину до sOB-R. Референтною величиною рівня лептину для жінок вважали 16,3±3,3 нг/мл, для чоловіків — 3,5±0,3 нг/мл.
Усім пацієнтам вимірювали офісний систолічний (САТ) і діастолічний АТ (ДАТ) і проводили добове моніторування АТ (АВРМ-04 «Медитек», Угорщина) з оцінкою рівня САТ і ДАТ, варіабельності АТ вдень і вночі, ступеня нічного зниження АТ. Критерій включення до аналізу — вірогідність результатів ≥85%. Залежно від величини добового індексу (ДІ) САТ і ДАТ виділяли чотири типи добових кривих АТ: over dipper — ДІ >20%, dipper — ДІ 10–20%, non-dipper — ДІ 0–10%, night peaker — ДІ <0%.
Ультразвукове дослідження серця виконували на ультразвуковому апараті «SIM 5000 Plus» («Біомедика», Італія) у стандартних позиціях відповідно до рекомендацій Американського ехокардіографічного товариства (American Society of Echocardiography — ASE). Визначали товщину міжшлуночкової перегородки (ТМШП) та задньої стінки лівого шлуночка (ТЗС ЛШ) у кінці діастоли, кінцево-систолічний та кінцево-діастолічний розміри (КДР) лівого шлуночка (ЛШ). Визначали індекс відносної товщини стінок (ВТС) лівого шлуночка (ЛШ) за формулою A. Ganau:
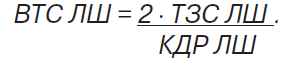
МЛШ підраховували за формулою Penn Convention:
МЛШ=1,0⋅((КДРЛШ + ТЗС ЛШ + ТМШП)3 – КДР3) – 13,6.
Індекс МЛШ (ІМЛШ) розраховували як:
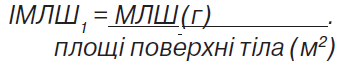
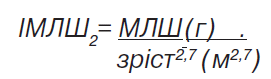
МЛШ аналізували окремо у жінок та чоловіків, використовуючи гендерні норми для діагностики ГЛШ:
- ≥115 г/м2 для чоловіків і ≥95 г/м2 для жінок (при використанні ІМЛШ1);
- ≥48 г/м2,7 для чоловіків і ≥44 г/м2,7 для жінок (ІМЛШ2).
Згідно з рекомендаціями 2013 р. ESH/ESC (Mancia G. et al., 2013), ІМЛШ2 варто використовувати у пацієнтів із надмірною масою тіла та ожирінням з метою уникнення гіподіагностики ГЛШ.
Для визначення типу ремоделювання ЛШ користувалися класифікацією A. Ganau та співавторів: нормальна геометрія (ІМЛШ не підвищений, ВТС <0,42), концентричне ремоделювання ЛШ (ІМЛШ не підвищений, ВТС >0,42), ексцентрична ГЛШ (ІМЛШ підвищений, ВТС <0,42), концентрична ГЛШ (ІМЛШ підвищений, ВТС >0,42).
Отримані результати статистично оброблені за стандартними методами варіаційної статистики з використанням пакета програм Statistica 6.0. Достовірність відмінностей між показниками визначали за допомогою двовибіркового критерію Стьюдента.
Результати
та їх обговорення
Результати аналізу рівнів лептину та sOB-R у жінок з ГХ та МС свідчили, що найвищі рівні лептину (61,96±9,51 нг/мл) відзначають у представниць 4-ї групи, до якої увійшли пацієнтки з ГХ, МС та ЦД з найвищими значеннями ІМТ, на відміну від рівнів лептину пацієнток 1-ї групи, без зазначених проявів порушень вуглеводного обміну (27,99±5,65 нг/мл). При цьому рівень sOb-R був найвищим у жінок 1-ї групи (19,14±1,94 нг/мл) і знижувався пропорційно до збільшення проявів порушень вуглеводного обміну та зі збільшенням маси тіла. Таким чином, найнижчий рівень sOb-R виявлено у жінок 4-ї групи (14,44±1,60 нг/мл), з найвищим ІМТ (33,03±1,52 кг/м²), на відміну від жінок 1-ї групи, показник ІМТ в яких мав найнижчі значення серед порівнюваних груп і становив відповідно (27,44±1,41кг/м²). При аналізі даних добового моніторингу АТ зростання рівнів лептину та зниження sOb-R асоціювалось із підвищенням САТ і ДАТ.
Деякі дослідники вважають лептин одним із засобів регуляції АТ. Це підтверджує наявність sOB-R у клітинах мозкової речовини надниркових залоз, що може свідчити про регуляцію лептином синтезу вазопресорів катехоламінів. Водночас високий рівень катехоламінів зменшує виділення лептину шляхом активації β-адренергічних рецепторів. Іншим механізмом підвищення АТ під дією лептину є активація СНС, що призводить не лише до збільшення теплоутворення і використання енергії, але й до підвищення АТ (Pladevall M. et al., 2003). Так, у жінок 1-ї групи середній офісний АТ становив 143/87 мм рт. ст., тоді як у пацієнток 4-ї групи — 162/90 мм рт. ст. (табл. 1). За результатами добового моніторингу АТ у представниць 4-ї групи відзначено зростання САТ і ДАТ, що асоціювалося зі зростанням рівнів лептину, ВЛІ та зниженням рівнів sOb-R. Виявлено корелятивний зв’язок між рівнем лептину та САТ (r=0,50; p=0,05) і ДАТ (r=0,41; p=0,05). Корелятивний зв’язок між ВЛІ та САТ становив (r=0,46; p=0,05), між ВЛІ та ДАТ (r=0,39, p=0,05).
| Група | Лептин, нг/мл | sOb-R, нг/мл | ВЛІ, ум. од. | САТ офісний, мм рт. ст. | ДАТ офісний, мм рт. ст. | САТ добовий, мм рт. ст. | ДАТ добовий, мм рт. ст. | САТ день, мм рт. ст. | ДАТ день, мм рт. ст. | САТ ніч, мм рт. ст. | ДАТ ніч, мм рт. ст. | DIS, % | DID, % |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1-ша | 27,99±5,65 | 19,14±1,94 | 1,67±0,33 | 143,0±1,4 | 87,5±2,5 | 137,4±1,3 | 81,6±1,9 | 138,6±1,5 | 76,6±2,3 | 122,9±2,4 | 73,5±3,0 | 13,7±1,5 | 20,8±0,2 |
| 2-га | 39,84±9,04 | 17,50±2,58 | 2,47±0,57 | 148,8±2,3 | 85,4±2,9 | 141,6±1,8 | 80,3±2,7 | 141,2±1,9 | 78,1±2,9 | 133,5±4,9 | 68,5±3,5 | 2,9±2,5 | 8,5±2,2 |
| 3-тя | 46,46±7,56 | 17,32±1,91 | 2,85±0,58 | 152,0±2,1 | 87,5±2,2 | 147,3±2,3 | 84,2±2,8 | 142,6±4,2 | 80,7±3,8 | 137,7±3,5 | 73,1±3,7 | 2,6±1,8 | 7,5±2,6 |
| 4-та | 61,96±9,51* | 14,44±1,60 | 4,77±0,83* | 162,5±4,2 | 90,5±2,2 | 152,0±3,3 | 87,9±1,6 | 146,7±2,9 | 80,2±3,3 | 140,4±7,9 | 72,2±3,3 | 0,5±3,1 | 3,5±2,7 |
У пацієнток зі значними проявами порушень вуглеводного обміну виявлено порушення добового ритму АТ, у структурі якого переважали випадки недостатнього зниження (non-dipper) і підвищенням (night-peaker) САТ і ДАТ вночі. Так, у 1-й групі виявлено лише 18% пацієнток зі змінами САТ за типом non-dipper, а у 4-й групі у 30% жінок реєстрували зміни САТ і у 70% ДАТ за типом non-dipper, і за типом night- peaker — 30 і 40% відповідно (табл. 2). Несприятливими у прогностичному відношенні вважають такі типи добового профілю, як non-dipper і night-peaker, оскільки недостатнє зниження АТ у нічний період асоціюється з підвищеним ризиком інсульту, частішим розвитком ГЛШ, мікроальбумінурії та вищим ступенем тяжкості останньої (Brown D.W. et al., 2000). Таким чином, у жінок 4-ї групи достовірно частіше діагностують несприятливий добовий профіль АТ порівняно з пацієнтками без порушень вуглеводного обміну, що асоціюється зі зростанням лептинорезистентності.
| Група | Лептин, нг/мл | sOb-R, нг/мл | ВЛІ, ум. од. | Over dipper, % | Dipper, % | Non-dipper, % | Night-peaker, % | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| САТ | ДАТ | САТ | ДАТ | САТ | ДАТ | САТ | ДАТ | ||||
| 1-ша | 27,99±5,65 | 19,14±1,94 | 1,67±0,33 | – | 55 | 82 | 45 | 18 | – | – | – |
| 2-га | 39,84±9,04 | 17,50±2,58 | 2,47±0,57 | – | 8 | 25 | 25 | 58 | 59 | 17 | 8 |
| 3-тя | 46,46±7,56 | 17,32±1,91 | 2,85±0,58 | – | 10 | 20 | 30 | 50 | 50 | 30 | 10 |
| 4-та | 61,96±9,51* | 14,44±1,60 | 4,77±0,83* | – | – | – | 30 | 70 | 30 | 30 | 40 |
Подібну тенденцію встановлено у групах чоловіків, де спостерігали зворотню залежність між рівнями sOb-R і проявами гіперлептинемії, рівнями АТ. Найвищу концентрацію лептину виявлено у пацієнтів 4-ї групи (52,52±12,24 нг/мл), яка достовірно відрізнялася від рівнів лептину у 1-й групі (12,42±2,73 нг/мл). Прогресування ознак гіперлептинемії також асоціювалось із тенденцією до зниження рівнів sOb-R, які були найнижчими у пацієнтів 4-ї групи (15,6±1,25 нг/мл), а найвищими — у 1-й групі (20,09±4,02 нг/мл). У чоловіків 4-ї групи відзначали найвищий ІМТ (35,70±0,91 кг/м²), найнижчий — у 1-й групі (27,27±1,69 кг/м²). Зростання рівнів лептину та зниження рівнів sOb-R асоціювалось із підвищенням САТ і ДАТ. У чоловіків 1-ї групи середній офісний АТ становив 145/87 мм рт. ст., у пацієнтів 4-ї групи — 165/91 мм рт. ст. (табл. 3).
| Група | Лептин,нг/мл | sOb-R, нг/мл |
ВЛІ, ум. од. | САТофісний, мм рт. ст. | ДАТ офісний, мм рт. ст. | САТ добовий, мм рт. ст. | ДАТ добовий, мм рт. ст. | САТ день,мм рт. ст. | ДАТ день,мм рт. ст. | САТ ніч, мм рт. ст. | ДАТ ніч, мм рт. ст. | DIS, % | DID, % |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1-ша | 12,42±2,73 | 20,09±4,02 | 0,73±0,19 | 145,4±1,2 | 86,8±2,1 | 140,8±1,6 | 84,2±1,6 | 137,0±1,1 | 82,1±0,8 | 121,7±2,1 | 76,3±1,6 | 11,6±1,3 | 18,8±1,9 |
| 2-га | 38,52±11,06 | 16,80±2,56 | 2,30±0,41 | 151,6±2,7 | 86,7±1,4 | 142,5±2,5 | 81,0±1,8 | 142,7±3,4 | 84,3±2,2 | 124,5±4,5 | 72,3±2,6 | 6,4±1,3 | 12,5±2,6 |
| 3-тя | 40,48±6,37 | 16,07±1,28 | 2,55±0,69* | 152,8±2,6 | 87,7±2,3 | 143,4±2,2 | 82,3±3,2 | 140,3±3,2 | 81,4±2,8 | 135,7±3,7 | 76,4±3,6 | 2,5±1,1 | 2,7±1,5 |
| 4-та | 52,52±12,24* | 15,60±1,25 | 3,93±1,27* | 165,7±3,6 | 91,4±3,5 | 157,1±2,3 | 86,1±3,1 | 152,1±2,6 | 82,1±0,9 | 146,8±8,4 | 74,0±8,4 | -5±2,8 | 2,5±2,8 |
При аналізі показників добового моніторингу АТ відзначено підвищення САТ і ДАТ у пацієнтів 4-ї групи, що асоціювалося зі зростанням рівнів лептину, ВЛІ та зниженням рівнів sOb-R. Як і у жінок, виявлено кореляційний зв’язок між рівнем лептину та рівнями САТ (r=0,55; p=0,05) і ДАТ (r=0,32; p=0,05), а також між ВЛІ та рівнями САТ (r=0,59; p=0,05) і ДАТ (r=0,31; p=0,05). При визначенні ДІ САТ і ДАТ у чоловіків із 4-ї групи встановлено порушення добового профілю АТ, у структурі якого також переважали пацієнти зі змінами САТ і ДАТ за типом non-dipper та night-peaker. У 27% пацієнтів 1-ї групи встановлено зміни САТ за типом non-dipper. У 4-й групі зміни САТ і ДАТ за типом non-dipper зареєстровано у 71 і 57% пацієнтів відповідно, а за типом night-peaker — у 29% (САТ) і 29% (ДАТ) (табл. 4). Отже, у чоловіків із ГХ, МС та ЦД, так як і у жінок, достовірно частіше відзначали несприятливий добовий профіль АТ, що асоціюється зі зростанням ознак лептинорезистентності, порівняно з пацієнтами без порушень вуглеводного обміну. За даними деяких авторів гіперлептинемія при ожирінні порушує регуляцію АТ, що призводить до розвитку АГ. A. Shankar і J. Xiao (2010) виявили позитивні кореляції між вмістом лептину та рівнем АТ у чоловіків і жінок. Вони вважають, що гіперлептинемію можна розглядати як предиктор АГ.
| Група | Лептин, нг/мл |
sOb-R, нг/мл) |
ВЛІ, ум. од. | Over dipper, % | Dipper, % | Non-dipper, % | Night-peaker, % | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| САТ | ДАТ | САТ | ДАТ | САТ | ДАТ | САТ | ДАТ | ||||
| 1-ша | 12,42±2,73 | 20,09±4,02 | 0,73±0,19 | – | 36 | 73 | 64 | 27 | – | – | – |
| 2-га | 38,52±11,06 | 16,80±2,56 | 2,30±0,41 | – | 23 | 23 | 44 | 77 | 33 | – | – |
| 3-тя | 40,48±6,37 | 16,07±1,28 | 2,55±0,69* | – | – | – | – | 78 | 78 | 22 | 22 |
| 4-та | 52,52±12,24* | 15,60±1,25 | 3,93±1,27* | – | – | – | 14 | 71 | 57 | 29 | 29 |
Згідно з даними літератури, гіперлептинемію спостерігають у пацієнтів із ГЛШ, але конкретний механізм впливу лептину на розвиток гіпертрофії кадіоміоцитів залишається нез’ясованим. З одного боку, введення екзогенного лептину призводить до зменшення маси тіла та реверсії гіпертрофії міокарда, з іншого — при наявності резистентності до лептину та інсуліну в осіб з АГ відбувається збільшення товщини стінок ЛШ (Ковальова О.М. та співавт., 2011).
За допомогою двох індексацій МЛШ та підрахованої ВТС ЛШ визначено різні типи ремоделювання ЛШ у осіб із ГХ та МС. (табл. 5 і 6). Так, серед пацієнток 1-ї групи ГЛШ при ІМЛШ1 діагностували у 36% випадків, при ІМЛШ2 — у 45%. При цьому ГЛШ виявлено у всіх учасниць 4-ї групи: при ІМЛШ1 ексцентрична ГЛШ — у 10% та концентрична ГЛШ — у 90% жінок, при ІМЛШ2 — у 20 і 80% відповідно. У чоловіків 1-ї групи ГЛШ при ІМЛШ1 діагностували у 19%, при ІМЛШ2 — у 27%, у пацієнтів 4-ї групи — у 86 та 100% відповідно. При ІМЛШ1 ексцентричну ГЛШ ідентифіковано у 14% пацієнтів 4-ї групи, а концентричну ГЛШ — у 72% пацієнтів, та при ІМЛШ2: 29 і 71% відповідно. Нормальну геометрію ЛШ при ІМЛШ1 визначали рідше, ніж при ІМЛШ2 як у жінок, так і у чоловіків. Отримані дані підтверджують, що визначення ГЛШ з використанням індексації МЛШ до зросту2,7 порівняно з використанням індексації МЛШ до площі поверхні тіла, дозволяє оптимізувати виявлення зазначеного фактора ризику у пацієнтів з ожирінням. Серед осіб із ГХ та МС переважали концентрична та ексцентрична гіпертофія, найменш сприятливі за прогнозом розвитку серцево-судинних ускладнень. ГЛШ у обстежуваних групах асоціювалася з проявами лептинорезистентності.
| Група | Нормальна геометрія ЛШ | Концентричне ремоделювання ЛШ | Ексцентрична ГЛШ |
Концентрична ГЛШ |
||||
|---|---|---|---|---|---|---|---|---|
| ІМЛШ1 | ІМЛШ2 | ІМЛШ1 | ІМЛШ2 | ІМЛШ1 | ІМЛШ2 | ІМЛШ1 | ІМЛШ2 | |
| 1-ша | 64 | 55 | 9 | 9 | 18 | 27 | 9 | 9 |
| 2-га | 8 | 8 | 17 | 8 | 50 | 42 | 25 | 42 |
| 3-тя | 20 | 10 | 40 | 30 | 10 | 20 | 30 | 40 |
| 4-та | – | – | – | – | 10 | 20 | 90 | 80 |
| Група | Нормальна геометрія ЛШ | Концентричне ремоделювання ЛШ | Ексцентрична ГЛШ |
Концентрична ГЛШ |
||||
|---|---|---|---|---|---|---|---|---|
| ІМЛШ1 | ІМЛШ2 | ІМЛШ1 | ІМЛШ2 | ІМЛШ1 | ІМЛШ2 | ІМЛШ1 | ІМЛШ2 | |
| 1-ша | 81 | 73 | 9 | 9 | 10 | 18 | – | – |
| 2-га | 44 | 33 | 11 | 22 | 11 | 12 | 34 | 33 |
| 3-тя | 34 | 33 | 11 | 11 | 11 | 11 | 44 | 45 |
| 4-та | 14 | – | – | – | 14 | 29 | 72 | 71 |
В обстежуваних групах як серед жінок, так і серед чоловіків з ГХ та МС, поряд із порушеннями вуглеводного обміну, що асоціювалося зі зростанням рівнів лептину та ВЛІ, зниженням концентраціїї sOb-R, виявлено зв’язок з ехокардіографічними параметрами, які відображають геометрію ЛШ. У результаті проведення кореляційного аналізу встановлено позитивний҆ зв’язок лептину, ВЛІ з товщиною задньої стінки ЛШ, ВТС, ІМЛШ2 у жінок та чоловіків. Так, у перших корелятивний зв’язок між лептином і товщиною задньої стінки ЛШ становив r=0,52; p=0,05, із ВТС — r=0,46; p=0,05, з ІМЛШ2 r=0,39; p=0,05. Подібну тенденцію відзначали і в групі чоловіків. При проведенні кореляційного аналізу встановлено зв’язок між рівнем лептину та ІМЛШ2 (r=0,48; p=0,05). Визначено кореляцію лептину із ВТС (r=0,28; p=0,05) і товщиною задньої стінки ЛШ (r=0,38; p=0,05). Згідно з даними літератури, відомо, що концентрація лептину та інсуліну в плазмі крові натще асоціюється з ехокардіографічними параметрами, які відображають геометрію ЛШ. Гіперлептинемія та гіперінсулінемія позитивно корелювали з індикатором ГЛШ — ІМЛШ2. Також підвищення рівнів цих гормонів асоціювалося зі збільшенням ВТС ЛШ.
Серед пацієнтів із ГХ та МС зі зростанням порушень вуглеводного обміну достовірно частіше діагностували несприятливий добовий профіль АТ, переважали концентрична та ексцентрична гіпертрофія міокарда. Оскільки ГЛШ — суттєвий фактор ризику виникнення серцево-судинних захворювань та асоціюється з гіперлептинемією та лептинорезистентністю, визначення цих показників можна використовувати для своєчасного виявлення хворих із високим ССР.
Висновки
1. Встановлено позитивний корелятивний зв’язок між рівнями лептину, ВЛІ та показниками САТ і ДАТ у групах жінок і чоловіків, що дозволяє розглядати гіперлептинемію та лептинорезистентність як предиктор розвитку АГ.
2. Визначено, що у осіб із ГХ, МС та ЦД ознаки лептинорезистентності асоціюються з несприятливим добовим профілем АТ.
3. Встановлено паралелізм між розвитком лептинорезистентності й формуванням гіпертрофії міокарда: виявлено середній корелятивний зв’язок із ВТС ЛШ і ІМЛШ2 у жінок та чоловіків, що свідчить про можливість використання ознак лептинорезистентності для виявлення хворих кардіометаболічного ризику.
Список використаної літератури
- Ковальова О.М., Потабенко С.В., Пітецька Н.І. (2011) Ремоделювання міокарда лівого шлуночка у хворих на гіпертонічну хворобу з гіперлептинемією і гіперінсулінемією. Галиц. лікар. вісн., 18(1): 51–53.
- Мищенко Л.А. (2007) Метаболический синдром. Здоров’я України, 10: 24–25.
- Чубриева С.Ю., Глухов Н.В., Зайчик А.М. (2008) Жировая ткань как эндокринный регулятор (обзор литературы). (Вестн. СПбГУ) Вестник Санкт-Петербургского университета, 11(1): 32–44.
- Armstrong A.C., Gidding S., Gjesdal O. et al. (2012) LV mass assessed by echocardiography and CMR, cardiovascular outcomes, and medical practice. JACC Cardiovasc. Imaging., 5(8): 837–848.
- Benjamin E.J., Levy D. (1999) Why is left ventricular hypertrophy so predictive of morbidity and mortality? Am. J. Med. Sci., 317(3): 168–175.
- Brown D.W., Giles W.H., Croft J.B. (2000) Left ventricular hypertrophy as a predictor of coronary heart disease mortality and the effect of hypertension. Am. Heart J., 140(6): 848–856.
- Chirinos J.A., Segers P., De Buyzere M.L. et al. (2010) Left ventricular mass: allometric scaling, normative values, effect of obesity, and prognostic performance. Hypertension., 56(1): 91–98.
- East M.A., Jollis J.G., Nelson C.L. et al. (2003) The influence of left ventricular hypertrophy on survival in patients with coronary artery disease: do race and gender matter? J. Am. Coll. Cardiol., 41(6): 949–954.
- Gorska E., Popko K., Stelmaszczyk-Emmel A. et al. (2010) Leptin receptors. Eur. J. Med. Res., 15 Suppl 2: 50–54.
- Grassi G., Diez J. (2009) Obesity-related cardiac and vascular structural alterations: beyond blood pressure overload. J. Hypertens., 27(9): 1750–1752.
- Lang R.M., Bierig M., Devereux R.B. et al.; American Society of Echocardiography’s Nomenclature and Standards Committee; Task Force on Chamber Quantification; American College of Cardiology Echocardiography Committee; American Heart Association; European Association of Echocardiography, European Society of Cardiology (2006) Recommendations for chamber quantification. Eur. J. Echocardiogr., 7(2): 79–108.
- Levy D., Murabito J.M., Anderson K.M. et al. (1992) Echocardiographic left ventricular hypertrophy: clinical characteristics. The Framingham Heart Study. Clin. Exp. Hypertens. A., 14(1–2): 85–97.
- Mancia G., Fagard R., Narkiewicz K. et al.; Task Force Members (2013) 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J. Hypertens, 31(7): 1281–1357.
- Norton G.R., Majane O.H., Libhaber E. et al. (2009) The relationship between blood pressure and left ventricular mass index depends on an excess adiposity. J. Hypertens., 27(9): 1873–1883.
- Owecki M., Nikisch E., Miczke A. et al. (2010) Leptin, soluble leptin receptors, free leptin index, and their relationship with insulin resistance and BMI: high normal BMI is the threshold for serum leptin increase in humans. Horm. Metab. Res., 42(8): 585–589.
- Pladevall M., Williams K., Guyer H. et al. (2003) The association between leptin and left ventricular hypertrophy: a population-based cross-sectional study. J. Hypertens., 21(8): 1467–1473.
- Sader S., Nian M., Liu P. (2003) Leptin: a novel link between obesity, diabetes, cardiovascular risk, and ventricular hypertrophy. Circulation, 108(6): 644–646.
- Shankar A., Xiao J. (2010) Positive relationship between plasma leptin level and hypertension. Hypertension, 56(4): 623–628.
- Vasan R.S. (2003) Cardiac function and obesity. Heart, 89(10): 1127–1129.
Лептинорезистентность, профиль артериального давления и структурно-функциональные характеристики миокарда у пациентов с гипертонической болезнью и метаболическим синдромом
Резюме. Установлена корреляционная связь между уровнями лептина, свободного лептинового индекса и показателями систолического и диастолического артериального давления у женщин и мужчин, что позволяет рассматривать гиперлептинемию и лептинорезистентность как предиктор развития артериальной гипертензии. Выявлен параллелизм между развитием лептинорезистентности и формированием гипертрофии миокарда, что указывает на возможность использования признаков лептинорезистентности для выявления больных кардиометаболического риска.
Ключевые слова: лептин, метаболический синдром, гипертоническая болезнь, артериальное давление, гипертрофия левого желудочка.
Summary. The correlation between leptin levels, free leptin index, and systolic and diastolic blood pressure in men and women, that allows to consider hyperleptinemia and leptin resistance as a predictor of hypertension was established. The parallelism between the development of leptin resistance and the formation myocardial hypertrophy, which indicates the possibility of using leptin resistance traits to identify patients with cardiometabolic risk was revealed.
Key words: leptin, metabolic syndrome, hypertension, blood pressure, left ventricular hypertrophy.
Адреса для листування:
Кулик Оксана Юріївна
03680, Київ,
вул. Народного ополчення, 5
ДУ «ННЦ «Інститут кардіології
імені М.Д. Стражеска» НАМН України»,
відділ дисліпідемії
E-mail: [email protected]





