Вступ
Упродовж життя жінки проходять кілька критичних гормональних періодів, кожен з яких пов’язаний зі складною взаємодією між гіпоталамо-гіпофізарною системою та продукцією гормонів яєчниками. Прийнято розподіляти такі фази змін жіночого організму: репродуктивну, клімактеричний перехід та постменопаузу (Sipilä S. et al., 2015). Циклічність екскреції гормонів гіпофіза та яєчників (естрогену та прогестерону) протягом репродуктивної фази триває в середньому до 45 років (Prior J.C. et al., 2014). За 1 рік до та через 1 рік після останнього менструального циклу відбувається різке зниження продукції естрадіолу. Циклічність вироблення естрогенів змінюється їх постійним вивільненням у низьких дозах яєчниками та перетворенням із тестостерону та андростендіону похідного прогестерону — естрону, другого за значимістю після естрадіолу естрогену.
Відомо, що у віці <45 років частота серцево-судинних захворювань (ССЗ) у жінок є нижчою, ніж у чоловіків, проте вже у віці ≈55 років ці показники вирівнюються, а, за даними окремих авторів, поширеність ССЗ в осіб жіночої статі в період постменопаузи є навіть вищою, ніж у чоловіків цієї самої вікової категорії. Зростання серцево-судинного ризику в постменопаузі пов’язано з різким зниженням рівня естрогенів в організмі жінки, а значить — і їхнього захисного впливу, що проявляється порушенням ліпідного обміну та гіперхолестеринемією, розладом обміну глюкози та цукровим діабетом (ЦД), появою надлишкової маси тіла та ожиріння, зниженням чутливості до інсуліну та метаболічним синдромом (Shufelt C. et al., 2015).
Дані, які свідчать про несприятливий вплив менопаузи на атерогенез, отримані в основному в експериментальних дослідженнях або у жінок із хірургічною менопаузою. Дослідження щодо призначення гормонозамісної терапії у жінок в менопаузі науковці розпочали ще на початку 70-х років, проте до єдиної згоди стосовно корекції гормональних змін та її доцільності в практичній медицині ще не дійшли (Чазова И.Е. и соавт., 2009). Взаємозв’язок між станом плазмово-коагуляційного гемостазу та рівнем ендогенних гормонів репродуктивної системи організму жінки недостатньо висвітлений в літературних джерелах, особливо в перименопаузальний період. Проте дослідження, мета яких полягала у вивченні медикаментозної корекції гормональних порушень під час та після менопаузи, виявили прямі кореляційні зв’язки між рівнем естрогену та ризиком виникнення артеріальних і венозних тромбозів, а також зростання ризику розвитку ССЗ атеротромботичного генезу, зокрема інфаркту міокарда (ІМ) у жінок у постменопаузальний період (Берковская М.А., Бутрова С.А., 2010).
Менопауза у жінок викликана естрогендефіцитним станом, який розвивається на тлі вікового зниження функції яєчників. Слід також згадати і про зменшення продукції прогестерону, роль якого щодо розвитку ССЗ є менш вивченою. Відомо, що основними механізмами впливу прогестерону на серцево-судинну систему є зниження тонусу артеріол, проліферація гладком’язових клітин коронарних артерій, блокада повільних кальцієвих каналів, зменшення реабсорбції іонів натрію в нирках, зниження рівня тригліцеридів та холестерину ліпопротеїдів дуже низької щільності (Чазова И.Е и соавт., 2009). Важливість аналізу комбінованого впливу знижених рівнів як естрадіолу, так і прогестерону на ризик розвитку ССЗ та їх ускладнень є очевидною. Необхідною є також оцінка показників коагуляційної, антикоагуляційної та фібринолітичної ланок системи гемостазу в пацієнток з ІМ в ранній постменопаузальний період та їхній зв’язок зі зниженими рівнями гормонів. Це дозволило б з’ясувати потребу в корекції зазначених показників та виявленні пацієнтів із високим ризиком несприятливих серцево-судинних подій. Проте, за нашими даними, таких досліджень не проводили.
Мета роботи — оцінити зміни плазмово-коагуляційного гемостазу у жінок з ІМ з елевацією сегмента ST у ранній постменопаузальний період та встановити взаємозв’язок виявлених порушень із рівнями естрадіолу та прогестерону у плазмі крові.
Об’єкт і методи дослідження
В основу роботи покладено проспективний аналіз даних 48 жінок (середній вік 58,3±3,3 року), які були госпіталізовані у відділення кардіологічної реанімації Олександрівської клінічної лікарні м. Києва з діагнозом «гострий коронарний синдром з елевацією сегмента ST», встановленим на основі критеріїв чинних рекомендацій (Steg P.G et al., 2012). У дослідження включали пацієнтів жіночої статі віком 45–65 років у ранній (<5 років після 12 послідовних місяців природної аменореї) постменопаузальний період. За наявності нижченаведених критеріїв пацієнтів не залучали до подальшого спостереження: хірургічна або передчасна менопауза (<35 років), наявність інших об’єктивних патологічних або фізіологічних причин настання менопаузи (Goodman N. et al., 2011), застосування замісної гормональної терапії, наявність ознак тяжкої серцевої недостатності ІІІ–IV функціонального класу, фракція викиду лівого шлуночка <45%, вроджені та набуті вади серця, міокардит, кардіоміопатії, перикардит, легенева гіпертензія, геморагічний або ішемічний інсульт в анамнезі, ЦД 1-го та 2-го типу, порушення гормонпродукуючої функції щитоподібної залози, тяжкі хронічні захворювання нирок (із розрахованою швидкістю клубочкової фільтрації <30 мл/хв/1,73 м2) і печінки з порушенням їхньої функції та інші тяжкі супутні захворювання, що ймовірно зменшують тривалість життя протягом наступних 12 міс.
Окрім стандартного дослідження, на 1-шу добу госпіталізації хворої, але не раніше 12 год після закінчення фібринолізу, визначали такі показники системи гемостазу: активований частковий тромбопластиновий час (АЧТЧ), тромбіновий час (ТЧ), концентрацію фібриногену за методом Клауса, кількість розчинних фібрин-мономерних комплексів (РФМК), час ХІІа-залежного фібринолізу (ХІІа-ЗФ), активність плазмового антитромбіну ІІІ (АТ ІІІ), протеїну С (Баркаган З.С., Момот А.П., 2008). Для досліджень використовували коагулометр «Amellung» КС 4А («Eko-Med-Poll», Австрія) та набір реагентів фірми «Технология-Стандарт» та «Ренам» (Росія). Згідно з поставленою метою у всіх жінок оцінювали імуноферментним методом вміст загального 17β-естрадіолу (набір реагентів «Estradiol ELISA» виробництва «DRG Instruments GmbH», Німеччина) та загального прогестерону (набір реагентів «ДС-ИФА-Стероид-Прогестерон» виробництва «НПО «Диагностические системы», Росія) у плазмі крові.
Лікування основного захворювання та його ускладнень здійснювали відповідно до рекомендацій Європейського товариства кардіологів (European Society of Cardiology — ESC) (Steg P.G et al., 2012). Усім пацієнтам була проведена тромболітична терапія (100%) із застосуванням стрептокінази, призначена терапія антикоагулянтами (фондапаринукс натрію), ацетилсаліциловою кислотою (АСК), клопідогрелем та статинами. У 83,3% випадків призначали блокатори бета-адренорецепторів, у 87,5% — інгібітори ангіотензинперетворювального ферменту (ІАПФ), у 81,2% — нітрати та в 35,4% — діуретики.
Статистичний аналіз результатів дослідження виконували за допомогою пакета програм IBM SPSS Statistics v22. Безперервні змінні виражені у вигляді середнього значення (М) та стандартного відхилення (σ). Значення р=0,05 вважали статистично значущим. Відмінності безперервних змінних були оцінені за допомогою дисперсійного аналізу або непарного t-тесту, критерій χ2 застосовували для категоріальних змінних. Для аналізу виживаності використовували методи описової статистики: виживаність оцінювали за допомогою методу Каплана — Мейєра, для порівняння кривих виживаності застосовували лог-ранговий тест. Метод регресійного аналізу за Коксом із використанням моделей однофакторних та багатофакторних покрокових процедур з оцінкою відношення шансів (ВШ) та 95% довірчого інтервалу (ДІ) дозволив визначити вплив окремих змінних на протромботичні зміни плазмового гемостазу, які включали гіперфібриногенемію, виснаження природних антикоагулянтів (АТ ІІІ та протеїну С) та пригнічення ХІІа-ЗФ.
Результати та їх обговорення
Серед обстежених пацієнток з ІМ з елевацією сегмента ST у ранній постменопаузі 25 (52,8%) осіб знали про наявність у себе артеріальної гіпертензії (АГ), 12 (25,0%) — гіперхолестеринемії, 6 (12,5%) — ЦД 2-го типу та хронічної серцевої недостатності (ХСН). Розвитку ІМ у 14,6% випадків передувала стенокардія напруження. Лікування пацієнтів полягало у 35,4% випадків у призначенні ІАПФ, у 20,8% — блокаторів бета-адренорецепторів, у 16,7% — АСК та статинів (табл. 1).
| Клінічна характеристика | Пацієнти (n=48), n (%) |
|---|---|
| Вік, років (M±σ) | 58,3±3,3 |
| Індекс маси тіла (M±σ) | 26,3±2,0 |
| ЦД 2-го типу | 6 (12,5) |
| АГ | 25 (52,8) |
| Куріння | 3 (6,2) |
| Дисліпідемія | 12 (25,0) |
| ХСН | 6 (12,5) |
| Тривалість ішемічної хвороби серця (ІХС), років (M±σ) | 2,2±1,4 |
| Стенокардія ІІ–ІV функціонального класу | 7 (14,6) |
| Локалізація ІМ: передня стінка лівого шлуночка | 22 (45,8) |
| Лікування до виникнення гострого коронарного синдрому | |
| АСК | 8 (16,7) |
| Клопідогрел | 3 (6,2) |
| ІАПФ | 17 (35,4) |
| Блокатори бета-адренорецепторів | 10 (20,8) |
| Діуретики | 6 (12,5) |
| Блокатори кальцієвих каналів | 5 (10,4) |
| Нітрати | 4 (8,3) |
| Статини | 8 (16,7) |
На попередніх етапах дослідження нами встановлено критичні порогові значення рівнів естрадіолу та естрадіол-прогестеронового співвідношення (ЕПС), які мали негативне прогностичне значення щодо розвитку несприятливих серцево-судинних подій впродовж госпітального періоду ІМ з елевацією сегмента ST. Виживаність пацієнток із рівнем естрадіолу <45,14 пг/мл та ЕПС <12,117 пг/нг була достовірно нижчою, ніж із вмістом естрадіолу >45,14 пг/мл та ЕПС >12,117 пг/нг відповідно. Вплив прогестерону на перебіг ІМ виявився достовірно незначущим. Водночас рівень прогестерону >5 нг/мл у жінок у постменопаузі асоціювався зі зростанням залишкової реактивності тромбоцитів до аденозиндифосфату, що є додатковим чинником ризику несприятливого прогнозу ІМ.
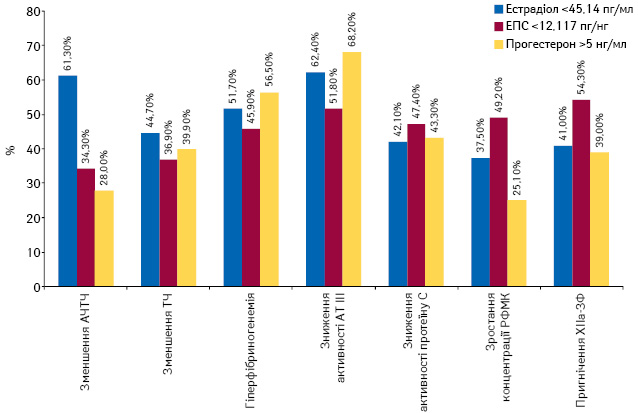
Враховуючи зазначені результати, ми проаналізували частоту порушень або зсувів плазмово-коагуляційної ланки системи гемостазу серед пацієнток із рівнями естрадіолу <45,14 пг/мл, прогестерону >5 нг/мл та ЕПС <12,117 пг/нг.
Як свідчать дані рисунку, у жінок у ранній постменопаузальний період із загальним рівнем естрадіолу у плазмі крові <45,14 пг/мл відзначено найбільш виражені протромбогенні зміни, що характеризувалися зменшенням АЧТЧ (61,3%) та ТЧ (44,7%), гіперфібриногенемією (51,7%), зниженням активності АТ ІІІ (62,4%) та протеїну С (42,1%), зростанням концентрації РФМК (37,5%) та пригніченням ХІІа-ЗФ (41,0%). Вміст загального прогестерону >5 нг/мл супроводжувався зростанням рівнів фібриногену вище референтних значень у 56,5% та зниженням концентрації АТ ІІІ — у 68,2% випадків. Зниження ЕПС <12,117 пг/нг асоціювалося зі зниженням активності протеїну С у 47,4%, зростанням концентрації РФМК — у 49,2% та пригніченням ХІІа-ЗФ — у 54,3% пацієнтів.
регресійного аналізу за методом Кокса
| Змінна (коваріата) | Однофакторний аналіз | Багатофакторний аналіз | ||
|---|---|---|---|---|
| ВШ (95% ДІ) | р | ВШ (95% ДІ) | р | |
| Вік (>55 і <55 років) | 0,74 (0,21–0,99) | 0,03 | 0,32 (0,11–0,66) | 0,035 |
| Тривалість постменопаузи <3 років та >3 років | 2,1 (1,05–4,6) | 0,041 | 1,66 (1,15–2,22) | 0,048 |
| Тривалість ІМ | 2,0 (1,99–3,4) | 0,67 | − | − |
| Локалізація ІМ | 0,54 (0,21–1,9) | 0,69 | − | − |
| АГ | 2,74 (1,85–2,01) | 0,13 | − | − |
| ЦД | 2,9 (1,96–3,92) | 0,22 | − | − |
| Рівень креатиніну | 3,32 (1,46–4,35) | 0,022 | − | − |
| Фракція викиду | 2,4 (1,35–2,9) | 0,25 | − | − |
| Естрадіол, пг/мл | 3,44 (2,01–4,4) | 0,00 | 2,3 (1,55–3,4) | 0,02 |
| Прогестерон, нг/мл | 1,56 (0,94–3,3) | 0,01 | 1,4 (0,43–2,35) | 0,033 |
| ЕПС | 3,1 (1,8–4,6) | 0,03 | 2,3 (1,7–4,8) | 0,04 |
| Акушерсько-гінекологічний анамнез | ||||
| Невиношуваність в анамнезі | 4,4 (2,12–5,44) | 0,01 | − | − |
| Аборт | 1,34 (1,1–3,6) | 0,81 | − | − |
| Нерегулярність менструального циклу до перименопаузи | 2,8 (1,6–5,1) | 0,04 | − | − |
| Передменструальний синдром | 3,3 (1,7–4,9) | 0,03 | 1,9 (0,8–3,4) | − |
| Прееклампсія | 1,0 (0,5–1,4) | 0,15 | − | − |
| Передчасні пологи | 0,99 (0,4–1,02) | 0,45 | − | − |
| Мала для гестаційного віку маса новонародженого | 1,6 (0,5–0,87) | 0,37 | − | − |
При застосуванні регресійного аналізу моделі Кокса (табл. 2) ми не виявили зв’язку між виникненням сукупних протромботичних змін у плазмі крові у пацієнток з ІМ з елевацією сегмента ST та такими змінними: надлишковою масою тіла й ожирінням; локалізацією та тривалістю ІМ; АГ; ЦД; значенням фракції викиду. Жінки віком <55 років мали більш сприятливий прогноз щодо змін плазмово-коагуляційного гемостазу. Ймовірність тромбофілічних зсувів зростала у віці >55 років (ВШ 0,32; 95% ДІ 0,11–0,66; р=0,03). Тривалість постменопаузального періоду теж мала достовірну значущість, за даними багатофакторного аналізу (ВШ 1,66; 95% ДІ 1,15–2,22; р=0,048).
Вплив на кумулятивні тромбофілічні зміни плазмового гемостазу одночасно мали рівні естрадіолу, прогестерону та ЕПС. Наявність в анамнезі передменструального синдрому в 1,9 (0,8–3,4) раза збільшувала ймовірність протромботичних ускладнень.
Незважаючи на те що у світі ІХС є провідною причиною смерті жінок у постменопаузі, ця проблема є недостатньо висвітленою та залишається без належної уваги. Жінки в пременопаузі з ІХС мають несприятливий подальший прогноз порівняно з жінками в постменопаузі. Смертність від ІМ серед осіб жіночої статі (особливо молодого віку) є значно вищою порівняно з чоловіками. Виживаність пацієнтів обох статей впродовж 1 року після ІМ є також різною. Так, смертність протягом вказаного періоду становить 44% у жінок проти 27% — у чоловіків. Пожиттєвий ризик летального випадку від ІХС серед жінок в 10 раз вищий, ніж від раку молочної залози. Згідно з останніми даними Національного дослідження здоров’я і харчування (National Health and Nutrition Examination Survey), США, встановлено зростання поширеності ІМ серед жінок середнього віку (35–54 років), в той час як серед чоловіків того самого віку зареєстровано її зниження. Також відзначено, що молоді жінки з дефіцитом ендогенних естрогенів мають у 7 разів вищий ризик розвитку ІХС. Новими нетрадиційними чинниками виникнення ІХС у жінок стали високі рівні ліпопротеїну (а), аполіпопротеїну B, тригліцеридів і ліпопротеїдів низької щільності, низький рівень ліпопротеїдів високої щільності і підвищений рівень гомоцистеїну у плазмі крові та такі маркери, як інгібітор активатора плазміногену і С-реактивний білок (Aruna S. et al., 2015).
Період постменопаузи у жінок асоціюється з вираженими змінами тромбоцитарно-плазмового гемостазу, які призводять до підвищення ризику ССЗ та їх ускладнень. Передусім це пов’язано з природним дефіцитом загального естрадіолу та зменшенням його антиатеротромботичного впливу. В той час як у жінок у період пременопаузи в середньому на добу вивільняється 400 мкг естрадіолу і 180 мкг естронів, після менопаузи ці значення зменшуються до 6 і 40 мкг/добу відповідно (Purohit A., Reed M.J., 2002). Позитивний вплив прогестерону, зокрема його антикоагуляційний ефект, теж мінімізується з віком. Однак його роль у зростанні серцево-судинного ризику та несприятливого впливу на перебіг ІМ практично нівельована, а рутинне визначення рівня гормонів у жінок в постменопаузі взагалі не рекомендоване. Вивчення показників коагуляційного гемостазу у жінок з ІМ в постменопаузальний період та зв’язку їхніх змін з рівнем репродуктивних гормонів проведено в рамках цього дослідження вперше.
Порогові значення естрадіолу, прогестерону та ЕПС, які несприятливо впливали на перебіг ІМ з елевацією сегмента ST та показники функціональної активності тромбоцитів, були встановлені нами раніше і використовувалися в цьому дослідженні для визначення предикторів тромбофілічного стану плазми крові. Зниження вмісту загального естрадіолу <45,14 пг/мл, ЕПС <12,117 пг/нг та прогестерону >5 нг/мл супроводжувалося зменшенням тривалості АЧТЧ і ТЧ, гіперфібриногенемією, виснаженням природних антикоагулянтів та пригніченням фібринолітичної активності крові. Слід зауважити, що за рівних умов лікування пацієнтів (всім була проведена тромболітична терапія, призначені антикоагулянти та антиагрегаційна терапія) виражені прокоагуляційні зміни були отримані саме у хворих із критичними значеннями зазначених гормонів та їх співвідношення.
В наявному консенсусі щодо ведення жінок в пери- та постменопаузі наголошується на обов’язковій оцінці чинників серцево-судинного ризику, оскільки сама по собі менопауза, незалежно від віку жінки, є додатковим фактором виникнення серцево-судинних захворювань (Чазова И.Е. и соавт., 2009). За даними нашого дослідження, вплив менопаузи на зміни плазмово-коагуляційного гемостазу виявився несприятливим. Однак попри загальноприйняту думку щодо несприятливого впливу менопаузи в цілому, ми виявили негативний асоціативний зв’язок прокоагуляційних змін саме з ранньою менопаузою, при цьому ймовірність тромбофілічних зсувів у віці >55 років зменшувалася (ВШ 0,32; 95% ДІ 0,11–0,66; р=0,03).
Окрім клінічних чинників, у роботі оцінено дані акушерсько-гінекологічного анамнезу жінок. Наявність в анамнезі передчасних пологів, народження дитини з малою масою тіла відповідно до гестаційного віку та прееклампсія підвищують ризик ССЗ у жінок. Проте в нашій роботі лише передменструальний синдром в 1,9 раза збільшував ймовірність тромбофілічного стану плазми крові у пацієнток з ІМ в ранній постменопаузі.
Важливим напрямом у сучасній кардіології є вибір персоніфікованої терапії пацієнта з дотриманням чинних стандартів лікування. Визначення рівня гормонів у жінок в постменопаузі, особливо з ІМ, дозволить виявити пацієнтів високого ризику тромботичних ускладнень за даними оцінки плазмового гемостазу, а з цим і вибрати можливу подальшу корекцію антитромботичного лікування.
Висновки
ІМ з елевацією сегмента ST у жінок в ранній постменопаузальний період на тлі повноцінної антитромботичної терапії асоціюється з тромбофілічним станом плазмово-коагуляційного гемостазу, що проявляється зменшенням тривалості АЧТЧ та ТЧ, гіперфібриногенемією, виснаженням природних антикоагулянтів та пригніченням фібринолітичної активності крові.
Незалежними предикторами кумулятивних протромботичних змін коагуляційної, атикоагуляційної та фібринолітичної ланок гемостазу у жінок з ІМ з елевацією сегмента ST виявилися вік <55 років, тривалість <3 років постменопаузи, зниження вмісту загального естрадіолу <45,14 пг/мл, ЕПС <12,117 пг/нг, прогестерону >5 нг/мл та наявність передменструального синдрому.
Список використаної літератури
- Баркаган З.С., Момот А.П. (2008) Диагностика и контролируемая терапия нарушений гемостаза. Ньюдиамед, Москва, 292 с.
- Берковская М.А., Бутрова С.А. (2010) Распространенность нарушений свертывающей и противосвертывающей систем крови у женщин с метаболическим синдромом в постменопаузе. Ожирение и метаболизм, 3: 21–27.
- Чазова И.Е., Сметник В.П., Балан В.Е. и др. (2009) Ведение женщин с сердечно-сосудистым риском в пери- и постменопаузе: консенсус российских кардиологов и гинекологов. Практическая медицина, 34: 5–18.
- Aruna S., Srinivasa Rao D., Reddy G. (2015) A comparative study of coronary artery disease in premenopausal with postmenopausal women. JEBMH, 2(21): 3120–3126.
- Goodman N., Cobin R., Ginzburg S. et al. (2011) American Association of Clinical Endocrinologists medical guidelines for clinical practice for the diagnosis and treatment of menopause. Endocrine Practice, 17(6): 1–25.
- Prior J.C., Elliott T.G., Norman E. et al. (2014) Progesterone therapy, endothelial function and cardiovascular risk factors: a 3-month randomized, placebo-controlled trial in healthy early postmenopausal women. PLoS One, 9(1): 1–9.
- Purohit A., Reed M.J. (2002) Regulation of estrogen synthesis in postmenopausal women. Steroids, 67(12): 979–983.
- Shufelt C., Waldman T., Wang E., Merz C.N. (2015) Female-specific factors for IHD: across the reproductive lifespan. Curr. Atheroscler Rep., 17(2): 1–9.
- Sipilä S., Finni T., Kovanen V. (2015) Estrogen influences on neuromuscular function in postmenopausal women. Calcif. Tissue Int., 96(3): 222–233.
- Steg P.G., James S.K., Atar D. et al. (2012) Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC) ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur. Heart J., 33(20): 2569–2619.
Резюме. Оценено состояние плазменно-коагуляционного гемостаза и его взаимосвязь со сниженными уровнями общего эстрадиола и прогестерона в плазме крови у женщин в ранний постменопаузальный период с инфарктом миокарда (ИМ) с элевацией сегмента ST. Установлено, что у пациентов с уровнем эстрадиола <45,14 пг/мл, прогестерона >5 нг/мл и эстрадиол-прогестеронового соотношения <12,117 пг/нг была высокой частота протромбогенных сдвигов плазменно-коагуляциного гемостаза, что проявлялось сокращением длительности активированного частичного тромбопластинового времени, тромбинового времени, гиперфибриногенемией, снижением активности протеина С и антитромбина III, повышением концентрации растворимых фибрин-мономерных комплексов и угнетением ХIIа-зависимого фибринолиза. Дополнительными предикторами прокоагуляционных изменений стали также возраст <55 лет, продолжительность менопаузы <3 лет и предменструальный синдром в анамнезе. Таким образом, у женщин с ИМ с элевацией сегмента ST в ранний постменопаузальный период на фоне физиологически сниженной продукции репродуктивных гормонов возникает тромбофилическое состояние, которое при применении антитромботической терапии сопровождается гиперкоагуляцией, снижением активности фибринолитического и антикоагулянтного звеньев системы гемостаза.
Ключевые слова: инфаркт миокарда, женский пол, тромбозы, гемостаз.
Summary. Among women who were in the early postmenopausal period of myocardial infarction with elevation segment ST (IMwST) was estimated state-plasma coagulation hemostasis and their correlation with reduced levels of total serum estradiol and progesterone. It was found that among patients with levels of estradiol5 ng/ml and estradiol-progesterone ratio (EPS) <12.117 pg/ng was high frequency protrombotic displacement in coagulation hemostasis, which manifested shortening activated partial thromboplastin time, thrombin time, fibrinosis, decreased activity of protein C and antithrombin III, increasing concentration of soluble fibrin monomer complexes and inhibition of Hageman-dependent fybrinolys. Additional predictors were also age <55, menopause duration <3 years, premenstrual syndrome in history. Thus, women with IMwST in early postmenopause against the background of a physiologically reduced production of reproductive hormones occurs protrombotic condition that on the background of antithrombotic therapy accompanied by hypercoagulation, decreasing anticoagulant and fibrinolytic links of hemostasis.
Key words: myocardial infarction, female, thrombosis, hemostasis.
Адреса для листування:
Нетяженко Нонна Василівна
03049, Київ, просп. Повітрофлотський, 9
Національний медичний університет
імені О.О. Богомольця,
кафедра терапії № 2
E-mail: [email protected]





