Вступ
Фібриляція передсердь (ФП) — найчастіший тип аритмії у клінічній практиці, причому її поширеність протягом останніх десятиліть неухильно зростає (Zoni-Berisso M. et al., 2014). Більшість досліджень спрямовані на прогнозування ризику ускладнень ФП, у той час як питання первинної та вторинної профілактики ФП залишаються невирішеними (Menezes A. et al., 2013). Формування ФП зумовлене прогресивним структурним і електричним ремоделюванням передсердь. Відомо, що в передсердях зазначений процес характеризується проліферацією та диференціюванням фібробластів і міофібробластів із подальшим збільшенням синтезу колагенових волокон з утворенням фіброзної тканини. Як можливі маркери фіброзу при різноманітних серцево-судинних захворюваннях розглядаються продукти синтезу та розпаду колагену, матриксної металопротеїнази (ММП) та тканинного інгібітору металопротеїнази (ТІМП) (Wang W. et al., 2013).
В останні роки значну увагу приділяють вивченню функціонального стану нирок у хворих на хронічну серцеву недостатність (ХСН), оскільки саме він багато в чому визначає виживаність і смертність цих пацієнтів (Sud M. et al., 2014). Зниження швидкості клубочкової фільтрації (ШКФ) у хворих на ХСН III–IV функціонального класу (ФК) і фракція викиду (ФВ) <35%, включених у дослідження PRIME-II, були більш потужним предиктором смертності, ніж ФВ лівого шлуночка (ЛШ) і ФК за класифікацією NYHA (Hillege H.L. et al., 2000). Підвищення концентрації креатиніну в плазмі крові під час госпіталізації пов’язано з підвищенням внутрішньолікарняної летальності, частоти госпіталізацій і смертності у віддалений період (Smith G.L. et al., 2003).
Взаємозв’язок ФП та функціонального стану нирок при ХСН вивчено недостатньо. Показано, що ФП у хворих на ХСН є незалежним предиктором підвищення концентрації креатиніну в плазмі крові під час госпіталізації (Cowie M.R. et al., 2006). Дані про інші аспекти взаємозв’язку ФП і проявів дисфункції нирок при ХСН суперечливі.
Мета дослідження — дослідити зміни стану колагенового обміну, ниркову функцію та їх взаємозв’язки зі структурно-функціональними параметрами серця у хворих на ХСН ішемічного генезу (ІГ) залежно від наявності ФП.
Об’єкт і методи дослідження
Дослідження проведене на базі відділення аритмій та серцевої недостатності Комунальної установи «Обласний медичний центр серцево-судинних захворювань» Запорізької обласної ради. Дослідження виконано відповідно до стандартів належної клінічної практики (Good Clinical Practice) і принципів Гельсінської Декларації. Обстежено 113 хворих (94 чоловіки та 19 жінок) на ХСН, що зумовлена ішемічною хворобою серця (ІХС), серед яких 80 осіб — із синусовим ритмом (середній вік — 58,3±9,5 року) та 33 — із ФП (середній вік — 63,9±8,9 року). ХСН діагностували й оцінювали згідно з Рекомендаціями з діагностики та лікування хронічної серцевої недостатності (2012) Асоціації кардіологів України та Української асоціації фахівців із серцевої недостатності (Воронков Л.Г. та співавт., 2012). Етіологічними факторами розвитку ХСН у 95 (84,1%) хворих визнано поєднаний перебіг ІХС та артеріальної гіпертензії (АГ), у 18 (15,9%) хворих — ІХС. ХСН ІІ ФК діагностовано у 33 (29,2%) хворих, ІІІ ФК — у 72 (63,7%), ІV ФК — у 8 (7,1%) пацієнтів. Інфаркт міокарда в анамнезі зазначений у 84 (74,3%) осіб, цукровий діабет — у 23 (20,4%) хворих. ШКФ розраховували за формулою MDRD (Modification of Diet in Renal Disease).
Допплер-ехокардіографічне дослідження проводили на апараті «VIVID 3 Expert» («General Electric», США) за стандартною методикою. Визначали передньозадній розмір лівого передсердя (ЛП), індекс об’єму лівого передсердя (ІОЛП), передньозадній розмір ЛШ в систолу — кінцевий систолічний розмір (КСР) і в діастолу — кінцевий діастолічний розмір (КДР), товщину міжшлуночкової перетинки (ТМШП) і задньої стінки (ТЗС) ЛШ в діастолу. Розраховували ФВ ЛШ, масу міокарда (ММ) ЛШ. Індекс ММ (ІММ) ЛШ визначали як співвідношення ММ ЛШ до площі поверхні тіла. Обчислювали відносну товщину стінок (ВТС) міокарда ЛШ за формулою:
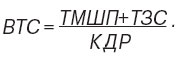
В імпульсному допплерівському режимі вивчали показники трансмітрального потоку: максимальну швидкість швидкого раннього діастолічного наповнення (Е) і максимальну швидкість (А) наповнення ЛШ у систолу ЛП (см/с), їх співвідношення (Е/А). Співвідношення максимальної швидкості раннього діастолічного наповнення до максимальної швидкості ранньої діастолічної хвилі руху фіброзного кільця мітрального клапана (E/Eann) за даними тканинної допплерографії.
Зразки крові для подальшого визначення рівнів N-кінцевого фрагмента натрійуретичного пептиду (NT-proBNP), цистатину С (ЦисС), ММП-9, ТІМП-1, С-термінального проколагену пропептиду І типу (PICP) відбирали безпосередньо після верифікації діагнозу, центрифугували, а потім заморожували та зберігали при температурі 70 °С до проведення лабораторних досліджень. Вміст NT-proBNP, ЦисС, ММП-9, ТІМП-1, PICP вимірювали за допомогою методики ELISA (імуноферментний аналіз) із використанням наборів компаній виробників «Biomedica Slovakia s.r.o.» (Словаччина), «BioVendor» (Чеська Республіка), «Bender MedSystems» (Австрія), «Uscn Life Science Inc.» (Китайська Народна Республіка) в Навчальному медико-лабораторному центрі Запорізького державного медичного університету. Калібрування виконано відповідно до заводських рекомендацій і нормалізовано за стандартною кривою.
Статистичну обробку проводили з використанням пакета статистичних програм «Statistica 6.0». Дані представлені у вигляді середнього значення (М), стандартного відхилення (±SD), медіани (Ме), міжквартильного інтервалу (МКІ). Гіпотезу про нормальність розподілу досліджуваних показників перевіряли з використанням критерію Шапіро — Уїлка. Для порівняння статистичних характеристик у різних групах використовували множинне порівняння за однофакторним дисперсійним аналізом Крускала — Уолліса, з попарним зіставленням за критерієм Манна — Уїтні. Для аналізу таблиць спряженості 2×2 при порівнянні категоризованих змінних застосовували двосторонній точний критерій Фішера або χ2-тест. Для аналізу спрямованості й сили зв’язку між певними показниками використовували метод кореляційного аналізу з обчисленням коефіцієнтів Спірмена. Відмінності вважали достовірними при значеннях p<0,05.
Результати та їх обговорення
Клініко-анамнестичні, лабораторні та структурно-функціональні показники хворих на ХСН ІГ наведено в таблиці. Групи зіставні за статтю та наявністю АГ в анамнезі. Середній вік хворих на ХСН ІГ із супутньою ФП перевищував середній вік у групі пацієнтів із синусовим ритмом на 8,8% (р=0,006), з більш високою частотою ІІІ–ІV ФК (за класифікацією NYHA) на 23,3% (р=0,03).
| Показник | ХСН з ФП (n=33) | ХСН без ФП (n=80) | р |
|---|---|---|---|
| Демографічні та анамнестичні дані | |||
| Вік, років | 63,9±8,9 | 58,3±9,5 | 0,006 |
| Чоловіки, n (%) | 27 (81,8) | 67 (83,8) | 0,81 |
| АГ (%) | 28 (84,8) | 67 (83,8) | 0,88 |
| Інфаркт міокарда в анамнезі, n (%) | 20 (60,6) | 64 (80) | 0,03 |
| Клініко-лабораторні дані | |||
| СН І–ІІ ФК, n (%) | 5 (15,2) | 28 (35) | 0,03 |
| СН ІІІ–ІV ФК, n (%) | 28 (84,8) | 52 (65) | 0,03 |
| ШКФ, мл/хв/1,73 м2 | 67,7 [60,7–77,2] | 79,3 [70,9–88] | 0,0002 |
| Креатинін, ммоль/л | 105,6 [89,7–116,1] | 89,7 [84,5–100,3] | 0,0001 |
| ЦисС, нг/мл | 1375 [1111–1867] | 1136 [955–1386] | 0,01 |
| NT-proBNP, нг/мл | 541 [317–1095] | 252 [47–744] | 0,02 |
| ММП-9, нг/мл | 10,1 [8,3–11,3] | 9,1 [7,4–10,0] | 0,05 |
| ТІМП-1, нг/л | 347 [284–451] | 284 [198–451] | 0,04 |
| PICP, нг/л | 0,46 [0,42–0,49] | 0,44 [0,39–0,54] | 0,39 |
| Гемодинамічні показники | |||
| ІОЛП, см3/м2 | 20,3 [15,2–23,4] | 13,8 [10,3–17,0] | 0,0001 |
| ІММ ЛШ, г/м2 | 166 [144–199] | 143 [123–174] | 0,0001 |
| ФВ, % | 40,2 [33,6–51,2] | 52,8 [40,7–62,5] | 0,0001 |
| Е/Еann | 8,2 [6,4–11,1] | 8,3 [6,1–10,3] | 0,55 |
| ТЛАсист. мм рт. ст. | 34,7 [27,4–46,9] | 27,6 [22,2–38,8] | 0,001 |
ФП у хворих на ХСН ІГ супроводжувалася більш низькою ШКФ (рис. 1) — на 14,6% нижче порівняно з пацієнтами без ФП (р=0,0002), підвищенням рівня креатиніну в плазмі крові — на 15,1% (р=0,0001) та ЦисС — на 17,4% (р=0,01).

Рівень маркера серцевої недостатності NT-proBNP у хворих на ХСН ІГ з ФП був вищий на 53,4% (р=0,02).
При аналізі вмісту маркерів міокардільного фіброзу у хворих на ХСН ІГ з ФП порівняно з групою хворих без ФП встановлено більш високі рівні ТІМП-1 — на 18,2% (р=0,04), ММП-9 — на 9,9% (р=0,05) і тенденцію до підвищення PICP — на 4,3% (р=0,39).
Наявність ФП у хворих на ХСН ІГ супроводжується змінами структурно-функціональних параметрів серця: суттєвим збільшенням ІОЛП — на 32,1% (р=0,0001), ІММ ЛШ — на 13,9% (р=0,0001), ТЛАсист. — на 20,5% (р=0,001) та зниженням ФВ на 23,9% (р=0,0001).


Кореляційний аналіз у групі хворих на ХСН ІГ з ФП (рис. 2 та 3) визначив взаємозв’язки різної направленості між ШКФ та ТІМП-1 (r=0,52; p=0,007), ІОЛП (r=–0,53; p=0,03), ЦисС та NT-proBNP (r=0,56; p=0,009), ТІМП-1 (r=0,51; p=0,03), ММП-9 та ІОЛП (r=–0,66; p=0,03), ТЛАсист. (r=–0,65; p=0,004), ТІМП-1 та креатиніном (r=–0,49; p=0,01), альдостероном (r=–0,42; p=0,04).
Отже, формування ФП зумовлене прогресивним структурним і електричним ремоделюванням передсердь. У передсердях зазначений процес характеризується проліферацією та диференціюванням фібробластів і міофібробластів із подальшим збільшенням синтезу колагенових волокон з утворенням фіброзної тканини. Колаген I і III типу синтезується із проколагенових попередників (PIP — Procollagen Type I C-peptide, TIMП-1), що містять PICP і N-термінальний пропептид з проколагену III типу (PIIINP) (Драпкина О.М., Емельянов А.В., 2013). Відома роль ренін-ангіотензин-альдостеронової системи, трансформуючого фактора росту-β1, запалення і окисного стресу, а також вплив профібротичних сигналів на баланс ММП. Молекулярною основою передсердного фіброзу у хворих із ФП є селективне підвищення регуляції MMП-9 і зниження регуляції TIMП-1 у передсерді, що, в свою чергу, проявляється підвищеним синтезом колагену I типу (Сipollone F. et al., 2004).
Результати проведеного нами дослідження зіставні з результатами O. Sonmez та співавторів (2014), згідно з якими наявність неклапанної ФП асоціюється з більш високими рівнями ММП-9, PIIINP, галектину-3, що корелюють з ІОЛП. В іншому дослідженні (Huxley R. et al., 2013) виявлено, що підвищення вмісту ММП-9 є незалежним предиктором розвитку ФП.
Можливо, недостатнє розуміння патофізіологічних механізмів аритмії обмежує можливості клініцистів у прогнозуванні виникнення та рецидивування ФП. Показано, що фактори ризику та патогенетичні механізми розвитку ФП і дисфункції нирок багато в чому збігаються (Watanabe H. et al., 2009). Проведено велику кількість досліджень, спрямованих на вивчення взаємозв’язку ФП та функціонального стану нирок. Показано, що наявність дисфункції нирок у загальній популяції зумовлена вищою ймовірністю розвитку ФП, а наявність ФП, навпаки, більшою ймовірністю зниження ШКФ <60 мл/хв/1,73 м2 і розвитку протеїнурії (Watanabe H. et al., 2009). В іншому популяційному дослідженні також показано, що поширеність ФП зростає в міру зниження ШКФ (Iguchi Y. et al., 2008). Причому наявність у хворих із ФП протеїнурії чи зниження ШКФ підвищує ризик розвитку тромбоемболічних епізодів (Go A.S. et al., 2009). Серед хворих на ІХС, за даними дослідження Heart and Soul Study, при ШКФ <62 мл/хв/1,73 м2 поширеність ФП у 3 рази вища, ніж при ШКФ >79 мл/хв/1,73 м2, у хворих із відношенням альбумін/креатинін у сечі >15 мг/г частота розвитку ФП у 4 рази вища, ніж при відношенні альбумін/креатинін <7 мг/г (McManus D.D. et al., 2009).
Отже, взаємозв’язок між ФП та нирковою дисфункцією у хворих на ХСН ІГ потребує особливої уваги. В основі зазначених зв’язків, з одного боку, може бути активізація ренін-ангіотензин-альдостеронової системи із затримкою натрію, рідини, дилатацією передсердь та розвитком ФП (McManus D.D. et al., 2009). З іншого боку, при ФП у нирках знижується експресія нейтральних ендопептидаз та збільшується виділення фактора некрозу пухлини-β, що може стимулювати розвиток фіброзу, запалення і призводити до порушення функції (Bukowska A. et al., 2008). Окрім того, згідно з проведеним нами дослідженням, зниження кровотоку у хворих на ХСН з ФП може пояснювати і зниження ниркової функції.
Висновки
У хворих на ХСН ІГ наявність ФП супроводжується більш вираженим зниженням ШКФ, суттєвим підвищенням рівнів NT-proBNP, ММП-9, ТІМП-1, ЦисС. Структурно-геометричне ремоделювання серця характеризується підвищенням ІОЛП, ІММ ЛШ, ТЛАсист. та зниженням ФВ ЛШ. Встановлено взаємозв’язки між ІОЛП та маркерами фіброзу (ТІМП-1, ММП-9), а також між ТІМП-1 та ШКФ, ЦисС.
Перспективним є подальше вивчення прогностичного значення виявлених порушень, оцінка динамічних змін під впливом сучасного медикаментозного лікування з метою розроблення стратегії уповільнення розвитку ХСН та хронічної хвороби нирок.
Список використаної літератури
- Воронков Л.Г., Амосова К.М., Багрій А.Е. та ін. (2012) Рекомендації з діагностики та лікування хронічної серцевої недостатності. Серцева недостатність, 3: 60–96.
- Драпкина О.М., Емельянов А.В. (2013) Предсердный фиброз — морфологическая основа фибрилляции предсердий. Рацион. фармакотер. кардиол., 9(4): 417–419.
- Сipollone F., Fazia M., Mincione G. et al. (2004) Increased expression of transforming growth factor-beta1 as a stabilizing factor in human atherosclerotic plaques. Stroke, 35(10): 2253–2257.
- Bukowska A., Lendeckel U., Krohn A. et al. (2008) Atrial fibrillation down-regulates renal neutral endopeptidase expression induces profibrotic pathways in kidney. Europace, 10(10): 1212–1217.
- Cowie M.R., Komajda M., Murray-Thomas T. et al. (2006) Prevalenceandimpactof worsening renal functioninpatientshospitalizedwith decompensatedheartfailure: results of the prospective outcomes study in heart failure (POSH). Eur. Heart J., 27(10): 1216–1222.
- Go A.S., Fang M.C., Udaltsova N. et al. (2009) Impact of proteinuria and glomerular filtration rate on riskof thromboembolism in atrial fibrillation: the anticoagulation and risk factors in atrial fibrillation (ATRIA) study. Circulation, 119(10): 1363–1369.
- Hillege H.L., Girbes A.R., de Kam P.J. et al. (2000) Renal function, neurohormonal activation, and survival in patients with chronic heart failure. Circulation, 102(2): 203–210.
- Huxley R., Lopez F., MacLehose R. et al. (2013) Novel Association between Plasma Matrix Metalloproteinase-9 and Risk of Incident Atrial Fibrillation in a Case-Cohort Study: The Atherosclerosis Risk in Communities Study. Plos ONE, 8(3): e59052.
- Iguchi Y., Kimura K., Kobayashi K. et al. (2008) Relation of atrial fibrillation to glomerular filtration rate. Am. J. Cardiol., 102(8): 1056–1059.
- McManus D.D., Corteville D.C., Shlipak M.G. et al. (2009) Relation of kidney function and albuminuria with atrial fibrillation (from the Heart and Soul Study). Am. J. Cardiol., 104(11): 1551–1555.
- Menezes A., Lavie C., Dinicolantonio J. et al. (2013) Atrial fibrillation in the 21st century: a current understanding of risk factors and primary prevention strategies. Mayo Clin. Proc., 88(4): 394–409.
- Smith G.L., Vaccarino V., Kosiborod M. et al. (2003) Worsening renal function: what is a clinically meaningful change in creatinine during hospitalization with heart failure? J. Card. Fail., 9(1): 13–25.
- Sonmez O., Ertem F.U., Vatankulu M.A. et al. (2014) Novel fibro-inflammation markers in assessing left atrial remodeling in non-valvular atrial fibrillation. Med. Sci. Monit., 20: 463–470.
- Sud M., Tangri N., Pintilie M. et al. (2014) ESRD and death after heart failure in CKD. J. Am. Soc. Nephrol., 26(3): 715–722.
- Wang W., Zhang H.T., Yang X.L. (2013) Effect of matrix metalloproteinase and their inhibitors on atrial myocardial structural remodeling. J. Cardiovasc. Med. (Hagerstown), 14(4): 265–269.
- Watanabe H., Watanabe T., Sasaki S. et al. (2009) Close bidirectional relationship between chronic kidney disease and atrial fibrillation: the Niigata preventive medicine study. Am. Heart J., 158(4): 629–636.
- Zoni-Berisso M., Lercari F., Carazza T., Domenicucci S. (2014) Epidemiology of atrial fibrillation: European perspective. Clin. Epidemiol., 6: 213–220.
Резюме. У больных хронической сердечной недостаточностью ишемического генеза (ХСН ИГ) изучена активность маркеров коллагенового обмена (матриксная металлопротеиназа (ММП)-9, тканевой ингибитор металлопротеиназы (ТИМП)-1, С-терминальный проколлаген пропептида І типа), цистатина С, структурно-функциональные параметры сердца. При ХСН ИГ наличие фибрилляции предсердий сопровождается более выраженным снижением скорости клубочковой фильтрации, существенным повышением уровней N-конечного фрагмента натрийуретического пептида, ММП-9, ТИМП-1, цистатина С. Структурно-геометрическое ремоделирование сердца характеризуется увеличением индекса объема левого предсердия (ИОЛП), индекса массы миокарда левого желудочка, систолического давления в легочной артерии и снижением фракции выброса левого желудочка. Установлены взаимосвязи между ИОЛП и маркерами фиброза (ТИМП-1, ММП-9), а также между ТИМП-1 и скоростью клубочковой фильтрации, цистатином С.
Ключевые слова: сердечная недостаточность, фибрилляция предсердий, фиброз, почки.
Summary. In patients with ischemic chronic heart failure there has been studied the activity of collagen metabolism markers (MMP-9, TIMP-1, РІСР), cystatin C and echocardiography parameters of the heart. Atrial fibrillation in ischemic chronic heart failure patients is associated with a pronounced decline in glomerular filtration rate, significant increase of N terminal pro-brain natriuretic peptide, MMP-9, TIMP-1, cystatin C levels. Structural and geometric heart remodeling is characterized by increased left atrial volume index (LAVi), index of left ventricular mass, systolic pulmonary artery pressure and reduced left ventricular ejection fraction. There have been established the relationships between LAVi and markers of fibrosis (TIMP-1, MMP-9), as well as between TIMP-1 and glomerular filtration rate, cystatin C.
Key words: heart failure, atrial fibrillation, fibrosis, kidney.
Адреса для листування:
Лашкул Дмитро Андрійович
69000, Запоріжжя, вул. Перемоги, 78
Запорізький державний медичний
університет, кафедра внутрішніх хвороб № 1
E-mail: [email protected]
Одержано 03.03.2015





