Научный форум, проходивший в стенах конференц-зала отеля «Рэдиссон Блу», стал площадкой высокопрофессиональной дискуссии, в фокусе которой удалось сконцентрировать основные аспекты и технологию достижения конечной цели — снижения риска развития фатальных и нефатальных сердечно-сосудистых событий, и соответственно, смертности населения. В обсуждении проблемы приняли участие ведущие эксперты и лидеры мнений Украины, доклады которых транслировались в режиме видеоконференции во все регионы страны. Выступления докладчиков получали продолжение в формате активных дискуссий с признаками воркшопов и детализацией ведения конкретных категорий больных.
 Модератор форума, профессор Юрий Сиренко, заведующий отделом симптоматических артериальных гипертензий ГУ «ННЦ «Институт кардиологии имени Н.Д. Стражеско» Национальной академии медицинских наук (НАМН) Украины», в приветственной речи к участникам конференции отметил, что растущая доказательная база и обновляемые международные рекомендации, полиморбидность маркеров кардиоваскулярного риска требуют от медицинского сообщества тесного взаимодействия по вопросам согласованного и клинически эффективного ведения больных с высоким риском развития жестких кардио- и цереброваскулярных событий.
Модератор форума, профессор Юрий Сиренко, заведующий отделом симптоматических артериальных гипертензий ГУ «ННЦ «Институт кардиологии имени Н.Д. Стражеско» Национальной академии медицинских наук (НАМН) Украины», в приветственной речи к участникам конференции отметил, что растущая доказательная база и обновляемые международные рекомендации, полиморбидность маркеров кардиоваскулярного риска требуют от медицинского сообщества тесного взаимодействия по вопросам согласованного и клинически эффективного ведения больных с высоким риском развития жестких кардио- и цереброваскулярных событий.
 Открывая рабочую часть конференции, профессор Борис Маньковский, доктор медицинских наук, член-корреспондент НАМН Украины, в докладе «Коррекция дислипидемии у больных сахарным диабетом» изложил современные подходы к тактике ведения пациентов с сахарных диабетом (СД) с позиций стратификации кардиоваскулярного риска и мероприятий по его минимизации. Основные акценты доклада сфокусированы на клинически адекватной трактовке СД в качестве маркера высокого кардиоваскулярного риска и необходимости применения статинов независимо от показателей дислипидемии. Оценивая наличие СД в качестве предиктора развития кардиоваскулярных осложнений, докладчик отметил, что 7-летний риск развития инфаркта миокарда (ИМ) у больных СД значительно превышает таковой в сравнении с пациентами без СД как при ИМ в анамнезе (3,5% — без СД; 20,2% — с СД), так и без него (18,5% — без СД; 45,0% — с СД), что характеризует СД как самостоятельный мощный фактор кардиоваскулярного риска независимо от наличия ишемической болезни сердца (ИБС). По данным исследования MRFIT, в ходе которого изучали возможности коррекции множественных факторов риска, при одинаковой выраженности каждого из классических факторов риска заболеваемость сердечно-сосудистой патологией у больных СД в 3–4 раза выше, чем у лиц без данного заболевания.
Открывая рабочую часть конференции, профессор Борис Маньковский, доктор медицинских наук, член-корреспондент НАМН Украины, в докладе «Коррекция дислипидемии у больных сахарным диабетом» изложил современные подходы к тактике ведения пациентов с сахарных диабетом (СД) с позиций стратификации кардиоваскулярного риска и мероприятий по его минимизации. Основные акценты доклада сфокусированы на клинически адекватной трактовке СД в качестве маркера высокого кардиоваскулярного риска и необходимости применения статинов независимо от показателей дислипидемии. Оценивая наличие СД в качестве предиктора развития кардиоваскулярных осложнений, докладчик отметил, что 7-летний риск развития инфаркта миокарда (ИМ) у больных СД значительно превышает таковой в сравнении с пациентами без СД как при ИМ в анамнезе (3,5% — без СД; 20,2% — с СД), так и без него (18,5% — без СД; 45,0% — с СД), что характеризует СД как самостоятельный мощный фактор кардиоваскулярного риска независимо от наличия ишемической болезни сердца (ИБС). По данным исследования MRFIT, в ходе которого изучали возможности коррекции множественных факторов риска, при одинаковой выраженности каждого из классических факторов риска заболеваемость сердечно-сосудистой патологией у больных СД в 3–4 раза выше, чем у лиц без данного заболевания.
Согласно Рекомендациям Европейского общества по артериальной гипертензии и Европейского кардиологического общества 2013 г., наличие у пациента СД является маркером высокого кардиоваскулярного риска, а сочетание СД с клиническими проявлениями сердечно-сосудистых заболеваний — маркером очень высокого кардиоваскулярного риска. Представлены также данные о специфике взаимосвязи сердечно-сосудистого риска и выраженности дислипидемии у больных СД. В частности, по данным исследования UKPDS, повышение содержания в крови холестерина (ХС) липопротеидов низкой плотности (ЛПНП) на1 ммоль/л увеличивает риск развития кардиоваскулярной патологии на 57%, и, напротив, повышение концентрации данной фракции липидов крови на 1 ммоль/л — способствует снижению указанного риска на 36%. Кроме того, снижение содержания ХС липопротеидов высокой плотности (ЛПВП) на 0,1 ммоль/л способствует повышению кардиоваскулярного риска на 15%.
Значимость дислипидемии в качестве маркера кардиоваскулярного риска у больных СД в сравнении с классическими факторами риска наглядно демонстрируют данные, свидетельствующие, что гипергликемия, в частности возрастание уровня гликозилированного гемоглобина на 1,0%, способствует повышению смертности на 11%; увеличение артериального давления (АД) при СД, в частности повышение систолического АД на 10 мм рт. ст., ассоциируется с повышением риска развития ИБС на 15%; курение — с повышением риска развития кардиоваскулярной патологии на 41%. Особенности дислипидемии у больных СД характеризуются повышенным содержанием триглицеридов (ТГ), снижением уровня ЛПВП, увеличением количества мелких, плотных атерогенных ЛПНП, наличием гликозилированных ЛПНП, повышенным содержанием аполипопротеинов В. По данным ряда исследований, сравнительную эффективность коррекции факторов риска в снижении риска развития сердечно-сосудистой патологии можно представить следующим образом (табл. 1):
| Фактор риска | Степень снижения риска, % | Тип вмешательства (медикаментозная коррекция риска) |
|---|---|---|
| Повышенные уровни ХС ЛПНП | ≈20–50 | Статины |
| Гипергликемия | 3921 | Метформин Препараты сульфонилмочевины |
| Пониженные уровни ХС ЛПВП Повышенные уровни ТГ |
≈25 | Фибраты |
| Тромботический риск | ≈15–20 | Ацетилсалициловая кислота |
| Артериальная гипертензия | ≈25–44 | Препараты классов иАПФ*, БКК**, БРА# |
Метаанализ 12 рандомизированных контролируемых исследований эффективности гиполипидемической терапии (с применением статинов и гемфиброзила) у лиц с СД и без СД свидетельствует о существенном снижении кардиоваскулярного риска как при первичной, так и при вторичной профилактике в обеих группах пациентов (в особенности на фоне применения статинов) с более выраженной эффективностью у лиц с СД — с большим количеством предотвращенных крупных коронарных событий у больных СД (смерть от коронарных причин, нефатальный ИМ и вмешательства по поводу реваскуляризации миокарда) (Costa J. et al., 2006). Относительно возможного риска применения статинов у больных СД докладчик процитировал заключение Управления по контролю за пищевыми продуктами и лекарственными средствами США (Food Drug Administration) — «Польза статинотерапии у пациентов с сахарным диабетом с точки зрения предотвращения сердечно-сосудистых катастроф существенно превышает незначительные риски повышения гликемии и уровня гликозилированного гемоглобина в плазме крови».
В докладе «Современные возможности эффективной профилактики и лечения сердечно-сосудистых заболеваний у пациентов с артериальной гипертензией и дислипидемией» Ю. Сиренко продолжил тематику рациональных клинических подходов к снижению кардиоваскулярного риска у больных группы высокого риска.

Несмотря на продолжительный период реализации в Украине Национальных программ по лечению и профилактике артериальной гипертензии, их результативность в большей степени проявилась в повышении уровня выявляемости АГ среди населения. Так, по данным 2013 г., АГ выявлена у 30% жителей страны. Вместе с тем доля лиц, осведомленных о наличии АГ, составила лишь 63%, доля получающих антигипертензивную терапию — 38%, доля пациентов с эффективным контролем АГ — лишь 14%. Основная цель лечения при АГ заключается в достижении и поддержании целевого уровня АД. Национальные стандарты диагностики и лечения пациентов с АГ базируются на рекомендациях Европейского общества по артериальной гипертензии (European Society of Hypertension — ESH) и Европейского общества кардиологов (European Society of Cardiology — ESC) 2013 г. Новые рекомендации, представленные в июне 2013 г. на Ежегодной европейской конференции по артериальной гипертензии, являются продолжением рекомендаций от 2003 и 2007 г., обновленных и дополненных на промежуточном этапе в 2009 г. Рекомендации сохраняют преемственность с предыдущими руководствами и приверженность принципам доказательной медицины. Кроме того, учтены обновленные рекомендации Объединенного национального комитета США по предупреждению, выявлению, оценке и лечению повышенного артериального давления (Joint National Committee on Prevention, Evaluation, and Treatment of Hypertension — JNC) — JNC 8, вышедшие в конце 2013 г. и заменившие документ 2003 г. (JNC 7). Эффективный контроль АГ, согласно обновленным рекомендациям, обеспечивается комбинированным применением препаратов первого ряда, который включает такие равноправные классы антигипертензивных препаратов, как блокаторы β- адренорецепторов, тиазидные диуретики, иАПФ, БРА и БКК. Анализ рынка антигипертензивных препаратов в Украине, по данным 2014 г., продемонстрировал, что половину всех назначений составляют иАПФ (29%) и их комбинированные формы (21%). Блокаторы β-адренорецепторов занимают сегмент продаж в объеме 16%, БКК — 11%, диуретики — 13%, БРА и их комбинации — 4%, другие классы — 6%. Отмечен неоправданно небольшой объем применения в клинической практике отечественными врачами БКК, хотя препараты этого класса являются одними из базовых средств эффективной фармакотерапии при АГ.
Комплексный механизм действия БКК представлен на схеме 1.
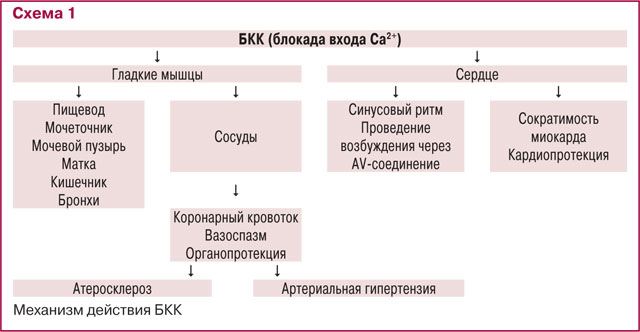

Отмечены следующие преимущества БКК последних поколений, в частности амлодипина:
- медленная ассоциация и диссоциация, обеспечивающие постепенное начало и продолжительный период фармакологического эффекта;
- продолжительный период полувыведения (30–50 ч), высокая биодоступность при пероральном применении и низкий уровень почечного клиренса (7 мл/мин/мг);
- поддержание плавной и стойкой дилатации резистентных сосудов и системных артериол;
- сохранение продолжительной эффективной концентрации в плазме крови и поддержание антигипертензивного эффекта даже в условиях пропущенного приема препарата.
Клинически благоприятные варианты комбинации БКК с другими классами антигипертензивных препаратов 1-го ряда представлены в соответствии с рекомендациями ESH/ESC 2013 г.
Докладчиком проанализированы данные крупных исследований, подтвердивших антиатерогенный эффект БКК. Так, в исследовании INTACT показано замедление прогрессирования атеросклероза коронарных артерий у лиц с ИБС при применении нифедипина в сравнении с плацебо, в исследовании PREVENT — замедление прогрессирование атеросклероза сонных артерий без воздействия на коронарные сосуды у пациентов с ИБС при применении амлодипина в сравнении с плацебо, в исследовании ELSA — замедление прогрессирования атеросклероза сонных артерий у пациентов с АГ при применении лацидипина в сравнении с атенололом. Отмечено также, что всем больным АГ с установленными кардиоваскулярными заболеваниями либо с СД 2-го типа следует принимать статинотерапию с целью достижения снижения концентраций общего ХС и ХС ЛПНП в плазме крови до уровней <4,5 ммоль/л (175 мг/дл) и <2,5 ммоль/л (100 мг/дл) соответственно, а также до возможно более низких уровней. Пациентам с АГ без сердечно-сосудистых заболеваний, но относящимся к группе высокого кардиоваскулярного риска, также следует принимать статины даже при референтных значениях общего ХС либо ХС ЛПНП. Отмечен дозозависимый характер липидстабилизирующего и вазо-/органопротекторного эффектов аторвастатина. Так, максимальное снижение концентраций ХС ЛПНП в плазме крови на 60% достигается при суточной дозе 80 мг. При этом же дозовом режиме риск развития кардиоваскулярных событий в сравнении с умеренным дозовым режимом (аторвастатин 10 мг/сут) снижается дополнительно: для нефатального ИМ — на 22%; для фатального и нефатального инсульта — на 25%; для необходимости проведения реваскуляризации — на 28%; для госпитализации по поводу хронической сердечной недостаточности (СН) — на 26%; для нестабильной стенокардии — на 12%.
 В докладе профессора Александра Пархоменко, руководителя отдела реанимации и интенсивной терапии ГУ «ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины», члена-корреспондента НАМН Украины, члена правления Европейского общества кардиологов, «Острый коронарный синдром: практические аспекты диагностики и лечения» раскрыто современное видение патогенеза сосудистых катастроф и клинических подходов к их предупреждению и эффективному лечению. Представлены основные типы «уязвимых» бляшек — наиболее предрасположенных к разрыву и тромбообразованию с высокой вероятностью быстрого прогрессирования сосудистого тромбоза. Отмечено, что 70% всех бляшек данного типа составляют виды сосудистого поражения с формированием отложений в толщу интимы без существенного стенозирования просвета сосуда. Формирующаяся фиброатерома не визуализируется в качестве коронароангиографически значимого нарушения, сохраняя при этом высокий риск дестабилизации бляшки и тромбообразования. В настоящее время у больных с острым коронарным синдромом (ОКС) без подъема сегмента ST применяют двойную антитромбоцитарную терапию — ацетилсалициловую кислоту (75–325 мг/сут) в комбинации с клопидогрелем (300 мг нагрузка, затем — 75 мг/сут). Эффективность данного подхода подтверждена результатами исследования CURE c участием 12 562 больных с ОКС без подъема сегмента ST в сравнении с монотерапией ацетилсалициловой кислотой (75–325 мг/сут). Эффективность двойной антитромбоцитарной терапии в сравнении с монотерапией ацетилсалициловой кислотой при ИМ с подъемом сегмента ST подтверждена в исследованиях COMMIT, CLARITY. Эффективность клопидогреля (300–600 мг нагрузки, затем — 75 мг/сут) в сравнении с тикагрелором (180 мг нагрузки, затем — 90 мг 2 раза в сутки) в течение 12 мес у больных с ОКС умеренного и высокого риска подтверждена в исследовании PLATO с участием 18 624 пациентов. Эффективность двойной антитромбоцитарной терапии с применением производных тиенопиридина (65% пациентов — клопидогрель, 35% — прасугрель) в сравнении с терапией ацетилсалициловой кислотой + плацебо в предупреждении смерти, ИМ либо инсульта у больных после стентирования по поводу ОКС подтверждена в исследовании DAPT. В частности, продемонстрировано, что частота развития острого ИМ на фоне указанной двойной антитромбоцитарной терапии снижалась в 2 раза относительно терапии сравнения. Докладчик отметил также, что современная стратегия снижения кардиоваскулярного риска и предупреждения развития сосудистых катастроф предполагает обязательное применение статинов. Данная стратегия базируется на гипотезе, представленной на схеме 2.
В докладе профессора Александра Пархоменко, руководителя отдела реанимации и интенсивной терапии ГУ «ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины», члена-корреспондента НАМН Украины, члена правления Европейского общества кардиологов, «Острый коронарный синдром: практические аспекты диагностики и лечения» раскрыто современное видение патогенеза сосудистых катастроф и клинических подходов к их предупреждению и эффективному лечению. Представлены основные типы «уязвимых» бляшек — наиболее предрасположенных к разрыву и тромбообразованию с высокой вероятностью быстрого прогрессирования сосудистого тромбоза. Отмечено, что 70% всех бляшек данного типа составляют виды сосудистого поражения с формированием отложений в толщу интимы без существенного стенозирования просвета сосуда. Формирующаяся фиброатерома не визуализируется в качестве коронароангиографически значимого нарушения, сохраняя при этом высокий риск дестабилизации бляшки и тромбообразования. В настоящее время у больных с острым коронарным синдромом (ОКС) без подъема сегмента ST применяют двойную антитромбоцитарную терапию — ацетилсалициловую кислоту (75–325 мг/сут) в комбинации с клопидогрелем (300 мг нагрузка, затем — 75 мг/сут). Эффективность данного подхода подтверждена результатами исследования CURE c участием 12 562 больных с ОКС без подъема сегмента ST в сравнении с монотерапией ацетилсалициловой кислотой (75–325 мг/сут). Эффективность двойной антитромбоцитарной терапии в сравнении с монотерапией ацетилсалициловой кислотой при ИМ с подъемом сегмента ST подтверждена в исследованиях COMMIT, CLARITY. Эффективность клопидогреля (300–600 мг нагрузки, затем — 75 мг/сут) в сравнении с тикагрелором (180 мг нагрузки, затем — 90 мг 2 раза в сутки) в течение 12 мес у больных с ОКС умеренного и высокого риска подтверждена в исследовании PLATO с участием 18 624 пациентов. Эффективность двойной антитромбоцитарной терапии с применением производных тиенопиридина (65% пациентов — клопидогрель, 35% — прасугрель) в сравнении с терапией ацетилсалициловой кислотой + плацебо в предупреждении смерти, ИМ либо инсульта у больных после стентирования по поводу ОКС подтверждена в исследовании DAPT. В частности, продемонстрировано, что частота развития острого ИМ на фоне указанной двойной антитромбоцитарной терапии снижалась в 2 раза относительно терапии сравнения. Докладчик отметил также, что современная стратегия снижения кардиоваскулярного риска и предупреждения развития сосудистых катастроф предполагает обязательное применение статинов. Данная стратегия базируется на гипотезе, представленной на схеме 2.
Среди значительного числа клинических исследований по применению статинов при сердечно-сосудистой патологии особое место занимают такие исследования, как MIRACL, PRPOVE-IT, A TO Z, IMPROVE-IT, в рамках которых изучали эффективность статинов в качестве вторичной профилактики при ОКС. Результаты исследований подтвердили достоверную эффективность применения статинов (аторвастатина, симвастатина в средних и высоких дозах, правастатина) в предупреждении развития повторного ИМ, кардиальной смертности, процедур реваскуляризации либо инсульта. Продемонстрировано, что интенсивная статинотерапия в ранние сроки ОКС обеспечивает существенное снижение частоты кардиоваскулярных осложнений при длительном (24–30 мес) наблюдении. Внимание аудитории акцентировано на резидуальном сердечно-сосудистом риске, минимизация которого достигается вследствие эффективной статинотерапии. Структура резидуального кардиоваскулярного риска включает модифицируемые и немодифицируемые факторы риска. К модифицируемым относят повышенные уровни ТГ, снижение концентрации ХС ЛПВП в плазме крови, артериальную гипертензию, ожирение, табакокурение, инсулинорезистентность, наличие маркеров хронического воспаления и др. Немодифицируемыми факторами риска считают возрастной фактор, пол и генетическую детерминированность.
В целом Рекомендации по фармакотерапии пациентов с острым инфарктом миокарда с элевацией сегмента ST 2012 г. с соответствующим классом рекомендаций и уровнем доказательности представлены в табл. 2.
с элевацией сегмента ST 2012 г.
| Рекомендации | Класс | Уровень |
|---|---|---|
| В кратчайшие сроки после поступления в клинику необходимо исследовать липидный профиль натощак | I | C |
| Рекомендовано назначение либо продолжение статинотерапии в высоких дозах сразу после госпитализации при отсутствии противопоказаний либо непереносимости в анамнезе, независимо от исходных уровней ХС в крови | I | A |
| Повторное исследование уровня ХС ЛПНП в крови через 4–6 нед. Целевой уровень ХС ЛПНП ≤1,8 ммоль/л (70 мг/дл) | IIa | C |
| Возможное рассмотрение назначения верапамила с целью вторичной профилактики пациентам с абсолютными противопоказаниями к применению блокаторов β-адренорецепторов при отсутствии проявлений СН | IIb | B |
| Применение иАПФ с первых суток развития острого ИМ у пациентов с проявлениями СН, систолической дисфункции левого желудочка (ЛЖ), СД и передней локализацией ИМ | I | A |
| Препараты класса БРА являются альтернативой иАПФ у пациентов с СН либо систолической дисфункцией ЛЖ | I | B |
| Целесообразность назначения иАПФ следует рассматривать у всех пациентов, не имеющих противопоказаний | IIa | A |
| Антагонисты альдостерона (эплеренон) показаны пациентам с фракцией выброса ЛЖ ≤40% либо СД при отсутствии почечной недостаточности либо гиперкалиемии | I | B |
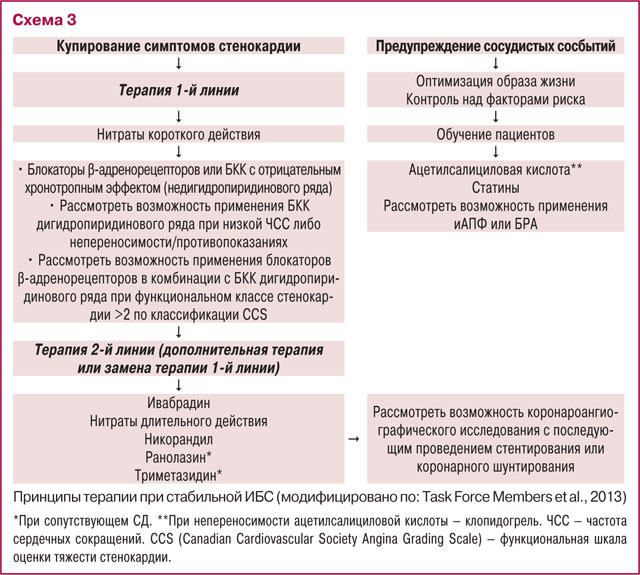
 В заключительном докладе профессора Олега Жаринова, заведующего кафедрой функциональной диагностики Национальной медицинской академии последипломного образования имени П.Л. Шупика, «Как активно модифицировать повышенные риски у пациентов с сердечно-сосудистой патологией» представлены данные о структуре смертности вследствие сердечно-сосудистой патологии. Так, в США в 2010 г. 46,2% кардиоваскулярной смертности обусловлено коронарной болезнью сердца, 16,4% — инсультом, 8,0% — осложнениями артериальной гипертензии, 7,3% — СН, 3,4% — заболеваниями периферических артерий, 16,7% — другой сосудистой патологией. Поскольку практически половина летальных исходов обусловлена коронарной болезнью сердца, или (как принято в отечественной терминологии) — ИБС, оптимизация терапевтических подходов в лечении пациентов с данной патологией представляет наибольший клинический интерес. Схематически эти подходы можно представить в соответствии с Рекомендациями ESC 2013 г. по лечению стабильной болезни коронарных артерий (схема 3).
В заключительном докладе профессора Олега Жаринова, заведующего кафедрой функциональной диагностики Национальной медицинской академии последипломного образования имени П.Л. Шупика, «Как активно модифицировать повышенные риски у пациентов с сердечно-сосудистой патологией» представлены данные о структуре смертности вследствие сердечно-сосудистой патологии. Так, в США в 2010 г. 46,2% кардиоваскулярной смертности обусловлено коронарной болезнью сердца, 16,4% — инсультом, 8,0% — осложнениями артериальной гипертензии, 7,3% — СН, 3,4% — заболеваниями периферических артерий, 16,7% — другой сосудистой патологией. Поскольку практически половина летальных исходов обусловлена коронарной болезнью сердца, или (как принято в отечественной терминологии) — ИБС, оптимизация терапевтических подходов в лечении пациентов с данной патологией представляет наибольший клинический интерес. Схематически эти подходы можно представить в соответствии с Рекомендациями ESC 2013 г. по лечению стабильной болезни коронарных артерий (схема 3).
В докладе представлены результаты рандомизированного клинического исследования PROMISE по сравнительной оценке эффективности анатомических и функциональных диагностических стратегий у клинически манифестных пациентов с предположительным диагнозом болезни коронарных артерий. В качестве функциональных диагностических методик применяли стресс-радиоизотопное исследование (67%), стресс- эхокардиографию (23%), нагрузочную электрокардиографию (10%). Наблюдение участников в течение 1 года продемонстрировало статистически сопоставимую информативность обоих методов, что позволяет активно имплементировать функциональные неинвазивные методики в клиническую практику и, тем самым, способствовать выбору наиболее оптимального терапевтического подхода, в том числе — проведения реваскуляризации. К общим показаниям для проведения реваскуляризации, согласно Рекомендациям Европейского кардиологического общества и Европейской ассоциации кардиоторакальных хирургов по реваскуляризации миокарда 2014 г., можно отнести следующие (Windecker S. et al., 2015):
- Стеноз ствола левой коронарной артерии >50% (ІА).
- Проксимальный стеноз левой нисходящей артерии >50% (ІА).
- Двух- или трехсосудистый стеноз с дилатацией ЛЖ (ІА).
- Наличие участка ишемии ЛЖ >10% (ІВ).
- Стеноз единственного проходимого сосуда >50%.
- Стеноз >50% любой локализации с симптомами стенокардии либо ее эквивалента при отсутствии эффекта медикаментозной терапии (ІА).
В отношении принципов вторичной профилактики ИМ отмечены необходимость стратификации риска и рациональной фармакотерапии, включающей применение ацетилсалициловой кислоты, статинов, иАПФ (неопределенно длительная терапия), клопидогреля, блокаторов β-адренорецепторов (≥6–12 мес).
Представленные на конференции доклады актуализировали проблему междисциплинарного взаимодействия при отработке единых подходов к ведению пациентов высокого кардиоваскулярного риска. Высокая коморбидная нагрузка и полиморфизм факторов риска в данной группе пациентов способствует объединению усилий клиницистов различных специальностей с целью минимизации риска развития сосудистых катастроф и предупреждения кардиальной смертности. Проведенная межрегиональная конференция продемонстрировала возможности прямого диалога ведущих экспертов страны и практических врачей в области диабетологии, ургентной кардиологии, гипертензиологии и терапии в вопросах гармонизации тактики ведения пациентов с различной патологией и высоким риском развития кардиоваскулярных осложнений.
Список использованной литературы
- Costa J., Borges M., David C., Vaz Carneiro A. (2006) Efficacy of lipid lowering drug treatment for diabetic and non-diabetic patients: meta-analysis of randomised controlled trials. BMJ, 332(7550): 1115–1124.
- Task Force Members, Montalescot G., Sechtem U. et al. (2013) 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur. Heart J., 34(38): 2949–3003.
- Windecker S., Kolh P., Alfonso F. et al. (2015) 2014 ESC/EACTS guidelines on myocardial revascularization. Rev. Esp. Cardiol. (Engl. Ed.), 68(2): 144.
Ольга Федорова,
фото автора





