ВСТУП
Антифосфоліпідний синдром (АФС) — це гетерогенний розлад і за клінічними проявами, і за рівнем антитіл (Cervera R. et al., 2002). Головною клінічною ознакою АФС є судинний тромбоз (Fessler B.J., 1997). Тромбоз може відбуватись у судинній системі мозку, коронарних артеріях, легеневій системі (емболія чи тромбоз), артеріальній або венозній системах кінцівок, венах печінки, нирок, очних артеріях або венах, надниркових залозах (Asherson R.A., Cervera R., 1997). Критерієм АФС є також часті спонтанні аборти або передчасні пологи.
Клінічні ознаки, які, хоча і не включені у критерії класифікації, можуть вказувати на АФС — це нетромботичні неврологічні симптоми, такі як мігренозний головний біль, хорея, непритомність, поперечний мієліт, синдром Гійєна — Барре та (рідше) деменція, наявність шумів у серці або клапанних вегетацій, гематологічні порушення, такі як тромбоцитопенія чи гемолітична анемія, сітчасте ліведо (livedo reticularis) (у 30%), надниркова недостатність нез’ясованого генезу, аваскулярний некроз кістки за відсутності інших факторів ризику та легенева гіпертензія (Shoenfeld Y., 2003).
АФС можуть провокувати такі інфекції, як сифіліс, гепатит В, ВІЛ-інфекція, інфекція, спричинена Т-клітинним лімфотропним вірусом типу 1, малярія та бактеріальна септицемія (Asherson R.A, Cervera R., 2003; Cervera R. et al., 2004).
Антифосфоліпідні антитіла (АФЛА) можливі при таких широко розповсюджених аутоімунних і ревматичних захворюваннях, як системний червоний вовчак, синдром Сйогрена, ревматоїдний артрит, аутоімунна тромбоцитопенічна пурпура, аутоімунна гемолітична анемія, псоріатичний артрит, системна склеродермія, ревматична поліміалгія чи гігантоклітинний артеріїт, синдром Бехчета (Shoenfeld Y., Cervera R., 1999).
Виявлено причинно-наслідкові зв’язки АФС із застосуванням деяких лікарських засобів, наприклад кардіологічних — прокаїнаміду, хінідину, пропранололу, гідралазину, нейролептичних або психіатричних — фенітоїну, хлорпромазину, та інших — інтерферону альфа, хініну, амоксициліну (Zandman-Goddard G. et al., 2002). Встановлено певну генетичну схильність пацієнтів до АФС (Asherson R.A., Cervera R., 1997).
Лабораторні дані, що можуть частково свідчити про АФС, — це виявлення АФЛА або порушення у фосфоліпідозалежних коагуляційних тестах. АФЛА реагують первинно з мембранними фосфоліпідами, такими як кардіоліпін і фосфатидилсерин (Petri M., 1997). У перших дослідженнях АФЛА як антиген використовували очищений кардіоліпін, ці антитіла отримали назву «антитіла до кардіоліпіну» (аКЛ) (Loizou S. et al., 1985). Їх часто виявляли у хворих на системний червоний вовчак, виявлено їх асоціацію з ризиком розвитку тромбозів. Однак пізніше встановлено, що роль антигену у цих випадках виконував не сам кардіоліпін, а комплекс плазмового β2-глікопротеїну I (β2-ГПI) з кардіоліпіном (McNeil H.P. et al., 1990). Іноді такі АФЛА взаємодіяли з імобілізованим β2-ГПI за відсутності кардіоліпіну. Згодом було досліджено та описано цілу низку протеїнів плазми крові, які у комплексі з фосфоліпідами можуть виступати антигеном для АФЛА. Такі протеїни отримали назву «фосфоліпідні кофактори» (Abuaf N. et al., 1997).
Серед 3 відомих ізотипів аКЛ (IgG, IgM, IgA) IgG корелює найбільш потужно з тромботичними явищами (Gharavi A.E. et al., 2002). Якнайменше один із наступних лабораторних критеріїв є необхідним для класифікації АФС. Це — наявність аКЛ (IgG або IgM) у сироватці крові в ≥2 аналізів із проміжком якнайменше 6 тиж один від одного, наявність вовчакового антикоагулянту (ВА) в ≥2 аналізах із проміжком якнайменше 6 тиж один від одного (Meroni P.L., Riboldi P., 2001).
Для значної популяції АФЛА антигеном є не сама фосфоліпідна молекула, а складний комплексний епітоп, утворений фосфоліпідом (ФЛ) та ФЛ-зв’язувальним білком (кофактором), або навіть лише кофактором (Sorice M. et al., 1996). Після відкриття того факту, що більшість аутоімунних АФЛА специфічні не до самої фосфоліпідної молекули, а до комплексу кофактор-ФЛ, з’явилася можливість поділити АФЛА на дві групи за їх належністю до аутоімунних процесів. АФЛА, що взаємодіють із ФЛ лише за наявності кофакторів, називають кофактор-залежними АФЛА (КЗ АФЛА) (Thiagarajan P. et al., 1997).
Натомість неаутоімунні (алоімунні) АФЛА, які можуть з’являтися при хронічних інфекціях (малярія, сифіліс, лепра, туберкульоз та парвовірусні інфекції (Ordi-Ros J. et al., 2004), а також при репродуктивних порушеннях (Balasch J. et al., 1999), специфічні до самих фосфоліпідних молекул і не потребують кофакторів для взаємодії (Hunt J.E. et al., 1992). У більшості такі АФЛА є менш афінними і не беруть участі в розвитку тромботичних ускладнень (Monestier M. et al., 1996). Однак деякі роботи свідчать про те, що такі антитіла також можуть бути високоафінними і здатні подовжувати час згортання плазми крові у коагуляційних тестах завдяки тому, що можуть приводити в дію ВА. Моноклональний IgМλ з аКЛ- та ВА-активністю у сироватці крові виявлено у пацієнта з лімфомою, у цього хворого не було тромботичних явищ (Gallart T. et al., 2002). А за даними інших авторів ці справжні (кофактор-незалежні) АФЛА іноді беруть участь у розвитку гіперкоагуляційних станів (von Landenberg C. et al., 1999), тобто відбувається парадоксальна реакція — подовження часу згортання плазми крові та розвиток тромбозу.
Важливість анти-β2ГПI все більше визнається і це може у майбутньому зробити внесок у специфічні тести для виявлення АФС (Blank M. et al., 2002).
Антинуклеарні антитіла можуть бути у низькому титрі й не обов’язково означають наявність супутнього захворювання — системного червоного вовчаку (McNeil H.P. et al., 1991).
Підрахунок формених елементів крові може виявити тромбоцитопенію, гемолітичну анемію чи обидва порушення (Blank M. et al., 2004b). Тромбоцитопенію досить часто виявляють у осіб з АФС (приблизно у 30%), вона асоціюється з парадоксальним тромбозом (Blank M., Shoenfeld Y., 2004). Однак при рівні тромбоцитів <50 000 у 1 мкл є ризик виникнення кровотечі (Fischetti F. et al., 2005). Гемолітична анемія була добре описана у пацієнтів з АФЛА і асоціюється з наявністю аКЛ класу IgM (Meroni P.L., Riboldi P., 2001).
Інструментальні дослідження можуть допомогти підтвердити тромботичні ускладнення. Хорошим прикладом цього є використання комп’ютерної томографії чи ядерного магнітного резонансу для дослідження мозку (порушення мозкового кровообігу), грудної клітки (легенева емболія) або живота (синдром Бадда — Кіарі). Допплєровські ультразвукові дослідження рекомендують для виявлення глибокого венозного тромбозу. Дані двопроекційної ехокардіографії можуть продемонструвати асимптоматичне потовщення клапана, вегетації та недостатність клапана (Hojnik M. et al., 1996; Blank M. et al., 2004a).
АФС може викликати досить серйозні ускладнення. Перманентна функціональна інвалідність може виникати у досить ранньому віці. Вона може включати гостре порушення коронарного кровообігу, інфаркт міокарда, легеневу гіпертензію, ниркову недостатність, летальний кінець (Asherson R.A. et al., 2001).
Прогноз у більшості випадків сприятливий. З правильним лікуванням і способом життя більшість індивідів з первинним АФС живуть нормальним здоровим життям. Однак у деяких пацієнтів і далі відзначають тромботичні явища, незважаючи на інтенсивну терапію. Для них перебіг захворювання може бути виснажливим, призводячи до істотної захворюваності й ранньої смертності (Shoenfeld Y., 2003).
Згідно з існуючим положенням пацієнти з АФС можуть обстежуватися і лікуватися амбулаторно. Стаціонарне лікування необхідне, якщо у пацієнта розвинулися клінічні прояви. Пацієнти з «катастрофічним» АФС потребують інтенсивного нагляду і лікування, часто — у реанімаційному відділенні. Взагалі режими лікування при АФС мають бути індивідуалізовані згідно з існуючим клінічним статусом і за наявності тромботичних випадків в анамнезі (Asherson R. et al., 2003).
Профілактична терапія полягає у видаленні інших факторів ризику, таких як пероральні контрацептиви, тютюнопаління, гіпертензія та гіперліпідемія. Ацетилсаліцилову кислоту у низьких дозах широко застосовують, однак ефективність її для первинного запобігання АФС залишається не доведеною (Shoenfeld Y. et al., 2003).
Лікарські засоби, запропоновані для терапії при АФС, включають гепарин, варфарин, ацетилсаліцилову кислоту і рідко гідроксихлорохін, внутрішньовенні імуноглобуліни та кортикостероїди. Кортикостероїди іноді застосовують для лікування з приводу звичної втрати плода у зв’язку з підвищеною материнською захворюваністю. Взагалі застосування кортикостероїдів є резервом для лікування специфічних нетромботичних проявів, таких як асоційована тромбоцитопенія, аутоімунна гемолітична анемія чи лікування супутнього захворювання сполучної тканини. За потреби призначають також антигіперліпідемічні агенти. У разі необхідності пацієнта госпіталізують у стаціонар або у відділення інтенсивної терапії, де може бути виконаний плазмаферез або призначено внутрішньовенні імуноглобуліни або циклофосфамід (Crowther M.A. et al., 2003).
У попередній роботі (Чернишов А.В. та співавт., 2006) показано високу частоту виявлення АФЛА в учасників ліквідації наслідків аварії (УЛНА) на Чорнобильській атомній електростанції (ЧАЕС). Однак не визначали антитіла до кофакторів.
Мета даної роботи — визначити можливість виникнення антифосфоліпідного синдрому в УЛНА на ЧАЕС, досліджуючи паралельно з АФЛА антитіла проти основного кофактору β2-GPI.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Обстеження на АФЛА було проведено у 75 УЛНА на ЧАЕС (особи чоловічої статі у віці 37–77 років), які знаходилися на лікуванні у відділенні радіоіндукованої загальної та ендокринної патології Наукового центру радіаційної медицини (НЦРМ) АМН України. Проаналізовано клінічні діагнози у пацієнтів із виявленими АФЛА і без них. У УЛНА на ЧАЕС, які перебувають на лікуванні у відділі радіоіндукованої загальної та ендокринної патології НЦРМ такі неврологічні синдроми, як дисциркуляторна енцефалопатія, пірамідна і екстрапірамідна патологія, дуже часті. Крім того, у 39,5% виявлено пневмосклероз, у 63,2% — ішемічну хворобу серця, у 50% — гіпертонічну хворобу, у 42,1% — обструктивний бронхіт. Практично у всіх пацієнтів були скарги на мігренозний головний біль, у 1/3 — на запаморочення.
Досліджували венозну кров, взяту натще.
Визначали такі АФЛА: аКЛ класу IgG та IgМ, антитіла до фосфатидилсерину класу G та М. aКЛ та антитіла до фосфатидилсерину визначали прямим твердофазним імуноферментним методом ELISA при довжині хвилі 450 нм (Чернишов В.П. и соавт., 2004). Показники оптичної щільності реєстрували на приладі Multiskan (Labsystems). Значення АФЛА у GPL одиницях (GPL = IgG phospholipid units) підраховували відповідно до стандартів Antiphospholipid Standartization Laboratory. Позитивними вважали такі значення АФЛА, що перевищували 10 GPL. Нормальними показниками вважали індекс імуноферментної реакції <10 умовних одиниць (<10 GPL для АФЛА класу IgG та <10 MPL для АФЛА класу IgМ).
Антитіла класу IgG, специфічні до β2-GPІ людини, визначали в сироватці крові пацієнтів за допомогою тест-системи («Orgentec», Німеччина). Позитивним вважали значення >10 умовних одиниць.
Проводили визначення анти-ДНК антитіл (до одно- та двоспіральних ДНК) за допомогою імуноферментного аналізу.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Серед 78 обстежених пацієнтів АФЛА виявлено у 24 (30,8%) осіб, тобто у кожного 3-го УЛНА на ЧАЕС. У здорових людей АФЛА виявляють лише в 5–8% випадків (Galli M., 2000), тобто різниця між вищезазначеними когортами досить вражаюча.
Слід зазначити, що у половини АФЛА-позитивних пацієнтів — УЛНА на ЧАЕС — виявлено одночасно як аКЛ, так і антифосфадилсеринові антитіла. Лише аКЛ виявлено у 6 обстежених пацієнтів, лише антифосфатидилсеринові анититіла — у 5 пацієнтів. Розподіл АФЛА за ізотипами імуноглобулінів наведено на рисунку.
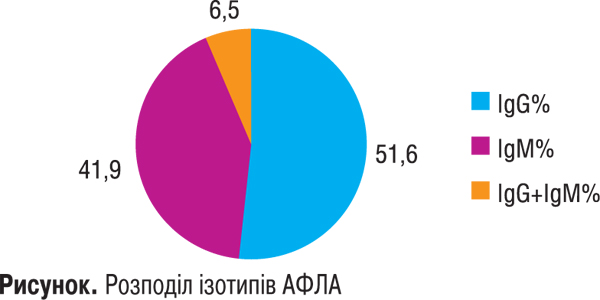
З діаграми видно, що АФЛА у УЛНА дещо частіше були класу ІgG, але й антитіла класу IgМ виявляли нерідко.
Продукція аКЛ обох класів (IgG та IgM) мала прямий кореляційний зв’язок із продукцією антифосфатидилсеринових антитіл цих же класів імуноглобулінів (p<0,0001). Але був відсутній зв’язок між продукцією АФЛА одного класу з іншим, наприклад аКЛ класу IgG з такими ж антитілами класу IgM. Ці дані підтверджують положення, що у пацієнтів — УЛНА на ЧАЕС — виникає продукція аутоантитіл проти багатьох фосфоліпідів одного класу.
Класичної клінічної картини АФС, яку описано в літературі (Shoenfeld Y., 2003), не виявлено в жодного пацієнта. Але така патологія, як пневмосклероз, ішемічна хвороба серця, гіпертонічна хвороба, обструктивний бронхіт, які були майже у всіх пацієнтів, ангіопатія сітківки (відзначали у 1/3 пацієнтів з АФЛА), скарги практично у всіх пацієнтів на мігренозний головний біль, у 1/3 — на запаморочення також вважаються, хоча і опосередковано, але можливими клінічними проявами АФС (Asherson R.A., Cervera R., 1997). Серед пацієнтів з АФЛА лише один палив, ще один отримував лікування інтерфероном альфа, інших можливих причин виникнення синдрому не встановлено. Беручи до уваги, що інших можливих причин появи АФЛА не встановлено у пацієнтів, не виключається вплив саме радіаційного опромінення на їх виникнення.
Хоча в попередніх дослідженнях нами не виявлено кореляції між дозою опромінення і рівнем АФЛА (Чернишов А.В. та співавт., 2006), але виключити його вплив повністю неможливо, тому що аналіз проводили без урахування ізотипів АФЛА та їх різновидів. Частота різних ізотипів АФЛА залежно від отриманих доз радіації під час ліквідації наслідків аварії на ЧАЕС наведено в таблиці.
Таблиця
Середній рівень отриманих доз опромінення в УЛНА на ЧАЕС залежно від наявності АФЛА різних ізотипів
|
№ за/п |
Ізотип АФЛА |
Кількість, n |
Середня доза опромінення в берах (M±m) |
р |
|
1 |
IgG |
16 |
186,6±16,5 |
1–2=0,02 |
|
2 |
IgM |
13 |
108,4±11,8 |
2–3=0,04 |
|
3 |
Без АФЛА |
46 |
148,6±13,4 |
1–3=0,09 |
Відзначимо, що найбільші дози опромінення були в УЛНА, в яких виявилися АФЛА класу IgG. Середня доза опромінення, яку отримали УЛНА на ЧАЕС, у пацієнтів із наявністю АФЛА класу IgG була достовірно вищою, ніж у пацієнтів із формуванням АФЛА класу IgM, і вищою, хоча і не сягала ступеня достовірності (р=0,09), ніж у групі пацієнтів, у яких не було АФЛА. Можливо, відсутність математично достовірної різниці в середніх дозах, які отримали УЛНА на ЧАЕС, у групі пацієнтів з АФЛА класу IgG і без них пов’язана з невеликою кількістю пацієнтів. Таким чином, не можна повністю виключити дозозалежний ефект формування АФЛА класу IgG і, враховуючи відсутність інших причин для їх виникнення, вважати можливим формування АФС. На користь формування саме АФС може свідчити поява АФЛА у пацієнтів відносно молодого віку (84% пацієнтів були молодше 60 років). Не виключено, що АФС виник після радіаційного опромінення у людей, можливо, генетично схильних до таких реакцій. Незалежно від того, чи виникає АФС у УЛНА на ЧАЕС, чи ні, висока частота появи у них АФЛА потребує уваги, тому що не можна виключати внесок АФС у розвиток клінічних проявів у УЛНА на ЧАЕС.
Як відомо, антитіла класу IgM частіше свідчать про досить свіжий патологічний процес. Саме у пацієнтів з таким ізотипом АФЛА відзначали найменші дози опромінення під час ліквідації аварії на ЧАЕС. Тому поява АФЛА класу IgM у віддалений період клінічних наслідків у УЛНА на ЧАЕС навряд чи пов’язана з опроміненням. У цих пацієнтів не виключаються інші причини виникнення АФЛА.
Різновиди АФЛА суттєво не відрізнялися залежно від отриманих доз опромінення УЛНА на ЧАЕС. При формуванні антитіл класу IgG майже в 2 рази рідше виявляли анититіла до фосфатидилсерину, ніж аКЛ. Тому для встановлення АФС все ж таки бажано визначати обидва субтипи АФЛА.
Рівень анти-β2-ГПІ класу IgG був у всіх обстежених пацієнтів нижчим за 10 умовних одиниць, тобто АФЛА, які визначали у УЛНА на ЧАЕС були кофакторнезалежними щодо цього кофактора. Хоча у більшості такі АФЛА не спричиняють розвитку тромботичних ускладнень (Monestier M. et al., 1996), але за даними інших авторів іноді вони можуть брати участь у розвитку гіперкоагуляційних станів (von Landenberg C. et al., 1999).
У наших спостереженнях не виявлено позитивних результатів на визначення анти-ДНК антитіл до одно- та двоспіральних ДНК.
Таким чином, у хворих УЛНА на ЧАЕС досить часто виявляють АФЛА частіше ізотипу IgG, переважно кофакторнезалежні, але не виключається, що вони можуть брати участь у гіперкоагуляційних процесах і ускладнювати стан пацієнта. УЛНА на ЧАЕС, які мали АФЛА класу IgG, отримали достовірно більшу дозу опромінення, аніж ті, у яких були антитіла класу IgM. Тобто нами виявлено залежність виникнення АФЛА класу IgG від дози отриманого іонізуючого опромінення. Можна припустити, що підвищення формування АФЛА у УЛНА на ЧАЕС є наслідком впливу іонізуючого опромінення на імунорегуляторні механізми. Порушення контролюючої ланки імунітету у віддалений період після опромінення може призводити до активації супресованих клонів лімфоцитів, які є продуцентами АФЛА.
Хоча наявна у пацієнтів клінічна картина не є класичною для АФС, наявна низка ознак і симптомів, які дозволяють припустити розвиток АФС у цих пацієнтів. Слід зазначити, що відсутність анти-β2-GPІ класу IgG не виключає можливості участі інших кофакторів, які також можуть мати значення у розвитку АФС. Тому при оцінці клінічного статусу і виборі тактики ведення пацієнтів УЛНА на ЧАЕС необхідно враховувати наявність АФЛА.
ВИСНОВКИ
1. У кожного 3-го УЛНА на ЧАЕС визначають АФЛА, що потребує включення в перелік лабораторних обстежень при диспансерному нагляді визначення АФЛА.
2. Відсутність анти-β2-ГПІ за наявності АФЛА свідчить про формування кофакторнезалежних АФЛА, тобто неаутоімунних антитіл у УЛНА на ЧАЕС.
3. Поява АФЛА класу IgG у пацієнтів УЛНА на ЧАЕС у віддалений період після ліквідації аварії на ЧАЕС, особливо у віці молодше 60 років, може свідчити про порушення імунної регуляції, можливість формування АФС з участю інших кофакторів, пов’язаного з опроміненням (за відсутності інших причин).
4. Наявність АФЛА як IgG, так і IgM ізотипів, у УЛНА на ЧАЕС потребує підключення відповідних препаратів для профілактики АФС.
ЛІТЕРАТУРА
- Чернишов А.В., Талько В.В., Коваленко О.М. та ін. (2006) Антифосфоліпідні антитіла і показники ліпідного обміну в учасників аварії на ЧАЕС у віддалений період після опромінення. Імунологія та алергологія, 2: 35–38.
- Чернышов В.П., Дахно Ф.В., Донской Б.В. и др. (2004) Антифосфолипидные антитела и результаты оплодотворения in vitro. Здоровье женщины, 18(2): 137–139.
- Abuaf N., Laperche S., Rajoely B. et al. (1997) Autoantibodies to phospholipids and to the coagulation proteins in AIDS. Thromb. Haemost., 77(5): 856–861.
- Asherson R.A., Cervera R. (1997): Antiphospholipid syndrome. In: W.R. Kelly, E.D. Harris, S. Ruddy, C.B. Sledge (Eds.) Textbook of Rheumatology. W.B. Saunders, Philadelphia, pp. 1057–1064.
- Asherson R.A., Cervera R. (2003) Antiphospholipid antibodies and infections. Ann. Rheum. Dis., 62(5): 388–393.
- Asherson R.A., Cervera R., de Groot P.G. et al. Catastrophic Antiphospholipid Syndrome Registry Project Group (2003) Catastrophic antiphospholipid syndrome: international consensus statement on classification criteria and treatment guidelines. Lupus, 12(7): 530–534.
- Asherson R.A., Cervera R., Piette J.C. et al. (2001) Catastrophic antiphospholipid syndrome: clues to the pathogenesis from a series of 80 patients. Medicine (Baltimore), 80(6): 355–377.
- Balasch J., Reverter J.C., Creus M. et al. (1999) Human reproductive failure is not a clinical feature associated with beta(2) glycoprotein-I antibodies in anticardiolipin and lupus anticoagulant seronegative patients (the antiphospholipid/cofactor syndrome). Hum. reprod., 14(8): 1956–1959.
- Blank M., Asherson R.A., Cervera R., Shoenfeld Y. (2004а) Antiphospholipid syndrome infectious origin. J. Clin. Immunol., 24(1): 12–23.
- Blank M., Krause I., Fridkin M. et al. (2002) Bacterial induction of autoantibodies to beta2-glycoprotein-I accounts for the infectious etiology of antiphospholipid syndrome. J. Clin. Invest., 109(6): 797–804.
- Blank M., Shani A., Goldberg I. et al. (2004b) Libman-Sacks endocarditis associated with antiphospholipid syndrome and infection. Thromb. Res., 114(5–6): 589–592.
- Blank M., Shoenfeld Y. (2004) Beta-2-glycoprotein-I, infections, antiphospholipid syndrome and therapeutic considerations. Clin. Immunol., 112(2): 190–199.
- Cervera R., Asherson R.A., Acevedo M.L. et al. (2004) Antiphospholipid syndrome associated with infections: clinical and microbiological characteristics of 100 patients. Ann. Rheum. Dis., 63(10): 1312–1317.
- Cervera R., Piette J.C., Font J. et al. (2002) Antiphospholipid syndrome: clinical and immunologic manifestations and patterns of disease expression in a cohort of 1,000 patients. Arthritis Rheum., 46(4): 1019–1027.
- Crowther M.A., Ginsberg J.S., Julian J. et al. (2003) A comparison of two intensities of warfarin for the prevention of recurrent thrombosis in patients with the antiphospholipid antibody syndrome. N. Engl. J. Med., 349(12): 1133–1138.
- Fessler B.J. (1997): Thrombotic syndromes and autoimmune diseases. Rheum. Dis. Clin. North. Am., 23(2): 461–479.
- Fischetti F., Durigutto P., Pellis V. et al. (2005) Thrombus formation induced by antibodies to beta2-glycoprotein I is complement-dependent and requires a priming factor. Blood, 106(7): 2340–2346.
- Gallart T., Benito C., Reverter J.C. et al. (2002) True anti-anionic phospholipid immunoglobulin M antibodies can exert lupus anticoagulant activity. Brit. J. Haematol., 116(4): 875–886.
- Galli M. (2000) Which antiphospholipid antibodies should be measured in the antiphospholipid syndrome? Haemostasis., 30(suppl. 2): 57–62.
- Gharavi A.E., Pierangeli S.S., Espinola R.G. et al. (2002) Antiphospholipid antibodies induced in mice by immunization with a cytomegalovirus-derived peptide cause thrombosis and activation of endothelial cells in vivo. Arthritis Rheum., 46(2): 545–552.
- Hojnik M., George J., Ziporen L., Shoenfeld Y. (1996) Heart valve involvement (Libman-Sacks endocarditis) in the antiphospholipid syndrome. Circulation, 93(8): 1579–1587.
- Hunt J.E., McNeil H.P., Morgan G.J. et al. (1992) A phospholipid-beta 2-glycoprotein I complex is an antigen for anticardiolipin antibodies occurring in autoimmune disease but not with infection. Lupus, 1(2): 75–81.
- Loizou S., McCrea J.D., Rudge A.C. et al. (1985) Measurement of anti-cardiolipin antibodies by an enzyme-linked immunosorbent assay (ELISA): standardization and quantitation of results. Clin. Exp. Immunol., 62(3): 738–745.
- McNeil H.P., Chesterman C.N., Krilis S.A. (1991) Immunology and clinical importance of antiphospholipid antibodies. Adv. Immunol., 49: 193–280.
- McNeil H.P., Simpson R.J., Chesterman C.N., Krilis S.A. (1990) Anti-phospholipid antibodies are directed against a complex antigen that includes a lipid-binding inhibitor of coagulation: beta 2-glycoprotein I (apolipoprotein H). Proc. Natl. Acad. Sci. USA, 87(11): 4120–4124.
- Meroni P.L., Riboldi P. (2001) Pathogenic mechanisms mediating antiphospholipid syndrome. Curr. Opin. Rheumatol., 13(5): 377–382.
- Monestier M., Kandiah D.A., Kouts S. et al. (1996) Monoclonal antibodies from NZW x BXSB F1 mice to beta2 glycoprotein I and cardiolipin. Species specificity and charge-dependent binding. J. Immunol., 156(7): 2631–2641.
- Ordi-Ros J., Selva-O’Callaghan A., Monegal-Ferran F. et al. (2004) Prevalence, significance, and specificity of antibodies to phospholipids in Q fever. Clin. Infect. Dis., 18(2): 213–218.
- Petri M. (1997) Pathogenesis and treatment of the antiphospholipid antibody syndrome. Med. Clin. North. Am. 81(1): 151–177.
- Shoenfeld Y. (2003) Systemic antiphospholipid syndrome. Lupus, 12(7): 497–498.
- Shoenfeld Y., Cervera R. (1999) Innovations in autoimmunity in the last decade. In: Y. Shoenfeld (Ed.) The Decade of Autoimmunity. Elsevier, Amsterdam, p. 7–18.
- Shoenfeld Y., Krause I., Kvapil F. et al. (2003) Prevalence and clinical correlations of antibodies against six beta2-glycoprotein-I-related peptides in the antiphospholipid syndrome. J. Clin. Immunol., 23(5): 377–383.
- Sorice M., Circella A., Griggi T. (1996) Anticardiolipin and anti-beta 2-GPI are two distinct populations of autoantibodies. Thromb. Haemost., 75(2): 303–308.
- Thiagarajan P., Le A., Shapiro S.S. (1997) Characterization of beta2-glycoprotein I-dependent and -independent «antiphospholipid» antibodies from lupus-prone NZW/BXSB F1 hybrid male mice. Am. J. Hematol. 56(2): 86–92.
- von Landenberg C., Lackner K.J., von Landenberg P. et al. (1999) Isolation and characterization of two human monoclonal antiphospholipid IgG from patients with autoimmune disease. J. Autoimmun., 13(2): 215–223.
- Zandman-Goddard G., Blank M., Shoenfeld Y. (2002) Antiphospholipid antibodies and infections-drugs. In: R.A. Asherson, R. Cervera, J.C. Piette, Y. Shoenfeld (Eds.) The antiphospholipid syndrome II. Autoimmune thrombosis. Elsevier, Amsterdam, p. 343–358.
Резюме. Выявлено, что у участников ликвидации последствий аварии (УЛПА) на Чернобыльской атомной электростанции (ЧАЭС) спустя 20 лет после аварии антифосфолипидные антитела (АФЛА) определяют значительно чаще, чем в норме. Ряд симптомов, отмечаемых у УЛПА на ЧАЭС, имеющих АФЛА, может свидетельствовать о наличии у них антифосфолипидного синдрома. Выявлено, что доза облучения, полученная УЛПА на ЧАЭС, у которых обнаружены АФЛА класса IgG, достоверно выше дозы облучения УЛПА на ЧАЭС, имеющих АФЛА класса IgM. Показано, что повышение уровня АФЛА у УЛПА на ЧАЭС чаще всего происходит в пределах одного изотипа иммуноглобулинов, при этом, как правило, повышаются как антикардиолипиновые, так и антифосфатидилсериновые антитела одного изотипа.
Ключевые слова: антифосфолипидные антитела, антифосфолипидный синдром, участники ликвидации последствий аварии на ЧАЭС
Summary. It has been revealed that antiphospholipid antibodies (aPL) occur significantly more frequent in Chernobyl clean-up workers 20 years after accident than in general population. Series of symptoms in these patients can suggest presence of antiphospholipid syndrome. Radiation doses of clean-up workers were significantly higher in those patients who had aPL IgG than in those who had aPL IgM. Increase of aPL in clean-up workers takes place more often inside one immunoglobulin isotype of both anticardiolipin and antiphosphotidylserine antibodies.
Key words: antiphospholipid antibodies, antiphospholipid syndrome, Chernobyl clean-up workers
Адреса для листування:
Чернишов Андрій Вікторович
04050, Київ, вул. Мельникова, 53
Науковий центр радіаційної медицини
АМН України, Інститут експериментальної
радіології, лабораторія радіаційної біохімії
E-mail: [email protected]





