Вступ
Синдром діабетичної стопи (СДС) — виразка та/чи деструкція глибоких тканин, що пов’язані з неврологічними патологічними змінами, погіршенням магістрального кровообігу в артеріях нижніх кінцівок різного ступеня тяжкості, остеоартропатією та дисфункцією нейтрофілів. Оскільки поширеність виразок стопи серед хворих на цукровий діабет (ЦД) становить 4–10% з великою часткою рецидивів, а смертність серед пацієнтів із виразками в анамнезі вдвічі вища порівняно із хворими, у яких це ускладнення раніше не зафіксоване, то профілактика й лікування при цьому ускладненні ЦД має важливе медичне та соціальне значення (Французов В.Н. и соавт., 2005).
Загоєння епідермальних ран становить собою складний процес, який регулюється та координується за рахунок численних міжклітинних та міжмолекулярних взаємодій. Ключовою подією у процесі загоєння є ремоделювання екстрацелюлярного матриксу (РЕМ), яке забезпечують протеази (Хрупкин В.И. и соавт., 2009). Доведено, що головну роль у деградації протеїнів РЕМ відіграють ензими родини матриксних металопротеаз (ММП), в основному ММП-2/-9, відомі як желатинази (Armstrong D.G., Jude E.B., 2002). Чітка регуляція активаторно-інгібіторного балансу протеаз є необхідною умовою для адекватного перебігу репаративних процесів у пошкодженій тканині. Зміни активності ММП, наявні при ЦД, негативно відображаються на синхронізації подій на окремих етапах загоєння внаслідок дисбалансу між деградацією/відкладанням колагену (Derosa G. et al., 2007).
Визначення активності протеаз за умов ранового процесу може бути використане для вибору ефективної стратегії лікування проблемних ран, у тому числі асоційованих із ЦД. Слід зауважити, що, крім протеаз — продуктів власних клітин організму — на перебіг загоєння значною мірою впливають також екзогенні ензими (Peters E.J., Lipsky B.A., 2013). Проте у більшості робіт, присвячених визначенню ролі протеолітичних ензимів у загоєнні діабетичних ран, дослідники не врахували внеску, який роблять протеази контамінуючої мікрофлори, а діагностика виразок при СДС найчастіше проводиться за клінічними ознаками без залучення мікробіологічних та ензимологічних досліджень. Однак відомо, що бактеріальне інфікування ран у хворих на ЦД ускладнюється дисемінацією інфекції до більш глибоко розміщених тканин і структур. Тому інфекційне ураження гнійних виразок стопи при ЦД становить одну з найголовніших причин розвитку ускладнень, що призводять до необхідності ампутації нижніх кінцівок.
Протеази, які секретуються бактеріями (Staphylococcus aureus (S. aureus), Proteus spp., Pseudomonas aeruginosa (P. аeruginosa), Listeria monocytogenes, Serratia marcescens тощо) у локусі пошкодження, деградують не лише структурні білки, але й здійснюють процесинг факторів росту та їх рецепторів, сприяють релізингу мембранозв’язаних протеїнів, впливаючи таким чином на процеси клітинного сигналінгу (McCarty S.M. et al., 2012). Втручання мікроорганізмів у процеси загоєння може бути ускладнене формуванням на рановій поверхні бактеріальних асоціатів — біофільмів. Для мікроорганізмів, що знаходяться у складі біофільму, характерним є високий метаболічний потенціал, вони стимулюють запальні реакції, спричиняють підвищення проникності судин, утворення ранового ексудату, формування фіброзного струпу (Винник Ю.С. и соавт., 2010). У міру репродукції бактерій зростає імовірність їх інвазії з міста ураження до здорових тканин, проникнення до системи кровообігу та сепсису. При цьому саме мікробні протеази відіграють ключову роль у процесі бактеріальної інвазії.
На сьогодні ідентифіковано обмежену кількість ензимів, які розглядають як основні фактори патогенності мікрофлори ранової поверхні. Бактерії-контамінанти продукують еластазу В (цинковмісна металопротеаза — 33 кДа), лужну протеазу, фосфоліпазу С; гриби — кислі, нейтральні (металоензими) та лужні протеази (Häse C.C., Finkelstein R.A., 1993). Враховуючи той факт, що більшість бактерій біофільму набуває резистентності до антибіотиків, хіміотерапевтичних речовин та антисептиків внаслідок утворення позаклітинних полісахаридів, одним із терапевтичних заходів, спрямованих на поліпшення динаміки загоєння ран, може бути використання специфічних інгібіторів мікробних протеаз.
Таким чином, дослідження особливостей спектра екзопротеаз, продукованих мікробами — патогенами ранової поверхні, є необхідним як для розробки ефективних підходів лікування гнійних та проблемних ран, так і щодо прогнозування розвитку інфекційного процесу.
Мета дослідження — вивчити мікробний пейзаж поверхні гнійних виразок стопи хворих на ЦД та охарактеризувати основні групи бактерій за здатністю продукувати колагенолітичні протеази.
Об’єкт і методи дослідження
Дослідження проводили на базі хірургічного відділення № 2 Київської міської клінічної лікарні № 4 (клінічна база кафедри хірургії № 2 Національного медичного університету імені О.О. Богомольця). Матеріал для дослідження одержали від 40 пацієнтів (22 чоловіки та 18 жінок, середній вік — 40±2,3 року) із гнійними процесами стопи на фоні ЦД (флегмона стопи, стопа Шарко, остеомієліт кісток стопи, трофічні виразки стоп). Пацієнти підписали письмову згоду на участь у дослідженні.
В усіх пацієнтів діагностовано нейроішемічну форму СДС. Усі учасники прооперовані (розкриття флегмон, некро- та секвестректомія, санація трофічних виразок), рани не зашивали. Показник середнього ліжко-дня становив 19,6±0,8 доби. У післяопераційний період хворі отримували перев’язки, антибіотикотерапію, інсулінотерапію, інфузійну терапію та знеболювальні препарати. Усі пацієнти обстежені за таким планом: проведено загальноклінічні аналізи, біохімічні та гематологічні тести, мікробіологічне дослідження вмісту виразки.
Для проведення цитологічного дослідження ранових відбитків за методом Покровської — Макарова з рани попередньо видаляли некротичний шар та залишки медикаментів, потім з однієї й тієї ж ділянки послідовно робили 2–3 відбитки. Матеріал фарбували за методом Романовського — Гімзе. Для більш точного уявлення про динаміку цитологічних змін, клітинний склад виражали у відсотках, рахуючи 100–300 клітин у різних місцях препарату, залежно від однорідності клітинного складу.
Для бактеріологічного дослідження відбір матеріалу проводили у стерильних умовах із дотриманням правил асептики та антисептики. Матеріал, взятий із тампонів, наносили на предметне скло, фарбували за Грамом та досліджували під мікроскопом. Матеріал, взятий іншим ватним стерильним тампоном з тієї самої ділянки рани, висівали на чашку з агаром за методом «тампон — петля» (Блохина И.Н. и соавт., 1986).
При виявленні росту бактерій проводили відсів ізольованих колоній на окремі середовища з метою їх ідентифікації. Кількість мікроорганізмів визначали за кількістю колонієутворювальних одиниць (КО) на одиницю площі чашки Петрі. За наявності КО ≤10 ріст бактерій вважали мізерним, 10–25 — помірним, 25–50 — рясним, ≥50 КО — значним.
Активність колагенолітичних ензимів бактерій в отриманих білкових екстрактах виявляли за допомогою желатинової зимографії (Соловьева Н.И., Рыжакова О.С., 2010). Для проведення аналізу проби готували, змішуючи екстракти білків із буфером Леммлі (Laemmli U.K., 1970). Присутність активних колагенолітичних ензимів визначали за наявністю світлих смуг на темнозабарвленому фоні, при цьому збільшення площі таких ділянок вважали пропорційним активності ензимів. Кількісний аналіз ензим-форезу проводили за допомогою денситометрії із застосуванням програми TotalLab.
Результати та їх обговорення
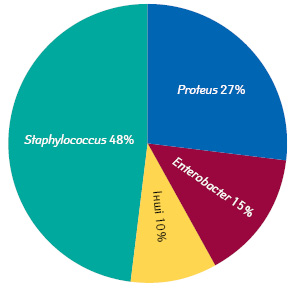
Для клінічної картини ранової інфекції при СДС характерний поліморфізм ознак та численні нозологічні форми різного ступеня тяжкості. Аналіз мікробного пейзажу виразкових ран показав, що найчастішими представниками грамнегативної мікрофлори на поверхні ран були Proteus vulgaris (P. vulgaris) (27±5,4% загальної кількості бактерій) і Enterobacter spp. (15±0,7%). Серед грампозитивних бактерій переважав S. aureus (48±3,8%). Решта бактерій (P. aeruginosa, Escherichia coli (E. сoli), Klebsiella spp., Acinetobacter spp. тощо), виявлені у ранах хворих, становили <10% загальної кількості мікроорганізмів (рис. 1).
Як правило, бактерії утворювали асоціації, в яких знаходилися у різних комбінаціях. На 1-шу добу вміст мікроорганізмів перевищував 50 КО. Із джерел літератури відомо, що найбільш розповсюдженими бактеріальними патогенами ран, крім S. aureus, P. aeruginosa і E. coli, визначеними в ході нашого дослідження, є також S. epidermidis, Listeria monocytogenes, Serratia marcescens, Bacillus subtilis, Enterococcus spp. Слід зауважити, що S. aureus, P. aeruginosa, E. coli виявляють властивість утворювати біоплівки (McCarty S.M. et al., 2012).
Дані щодо бактеріального пейзажу діабетичних виразок, отримані в нашій роботі, певною мірою відповідають результатам мікробіологічного дослідження опікових ран (Cахаров С.П. и соавт., 2013).
Встановлено, що у 56% випадків на термічно ураженій поверхні шкіри утворювалися мікробні асоціати, причому в ранах розвивалася мікст-інфекція, спричинена 2–4 різними мікроорганізмами. Цілком очевидно, що інфікування ран може відбуватися різними шляхами: зараженням через повітря та предмети побуту, інфікуванням власною умовно-патогенною мікрофлорою, від бактеріоносіїв (медичного персоналу та відвідувачів), а також під час лікувальних маніпуляцій, перев’язок, переважно у разі тривалого лікування пацієнтів із СДС. Тому видовий спектр мікрофлори ранової поверхні може варіювати залежно від вищенаведених чинників, що необхідно враховувати при проведенні подібних скринінгових досліджень у різних лікарнях.
Результат желатинової зимографії колагенолітичних протеаз, що виділялися у живильне середовище при культивуванні P. vulgaris, Enterobacter spp. та S. aureus, представлено на рис. 2.
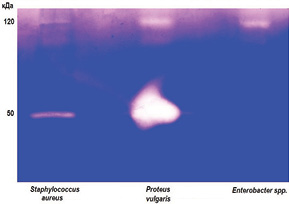
Метод ензим-форезу дозволив візуалізувати дві групи колагенолітичних екзоензимів із молекулярними масами у межах 120 та 50 кДа. Виявлено, що S. aureus та P. vulgaris секретують обидва ензими, тоді як Enterobacter spp. — лише високомолекулярну гідролазу. Досліджувані мікроорганізми, виділені з ранової поверхні виразок пацієнтів із ЦД, відрізнялися також за величиною протеїнолітичної активності колагенолітичних екзопротеаз. Цей параметр оцінювали за допомогою денситометричного аналізу відповідних поліпептидних зон, результати якого наведено на рис. 3. Встановлено, що найбільш високу загальну активність проявляють желатинази, які секретує P. vulgaris.
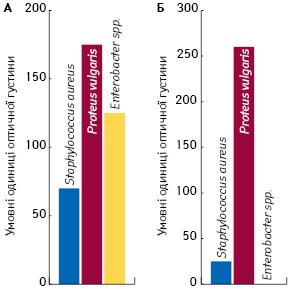
Активність желатинази P. vulgaris з молекулярною масою 120 кДа у 1,4 раза перевищувала цей показник, властивий відповідному ензиму Enterobacter spp., і у 2,4 раза — протеазі S. aureus. Однак превалюючий внесок до екзогенної желатинолітичної активності P. vulgaris робить протеаза, яка за величиною молекулярної маси (50 кДа) відповідає металопротеазі ZapA. Активність цієї протеази на порядок перевищувала показник відповідного ензиму S. aureus. Важливо зазначити, що активності протеази 50 кДа у пробах Enterobacter spp. не виявлено. Таким чином, встановлені якісні та кількісні відмінності між колагенолітичними екзопротеазами мікрофлори, ідентифікованої у гнійних виразках стопи при ЦД, що носять видоспецифічний характер.
Роль мікробних протеаз у процесі загоєння ран активно досліджується, однак на сьогодні ідентифіковано та детально охарактеризовано обмежену кількість екзоензимів, які синтезуються та секретуються бактеріями до пошкодженої тканини. Ензимологічні дослідження мікробних асоціатів, що викликають рановий інфекційний процес, мають велике науково-практичне значення, оскільки протеази бактерій відносять до числа найголовніших факторів їх вірулентності.
Протеази виконують переважно протекторну і трофічну функцію, забезпечуючи захист бактерій від імунної системи організму та постачають їх поживними речовинами — продуктами гідролізу тканинних протеїнів. Екзоцелюлярні бактеріальні протеази також сприяють колонізації та дисемінації бактерій. Позаклітинні протеолітичні ензими розщеплюють секреторні та плазмові імуноглобуліни, компоненти міжклітинного матриксу, плазмові компоненти захисту (протеїни системи комплементу), фактори лімфоцитів (лімфокіни, цитокіни), порушують цілісність ендотелію, порушують гемостатичний баланс крові та фібриноліз.
У S. aureus досліджено декілька екзопротеаз (ауреолізин, протеаза V8, низка тіолових протеаз), які здатні розщеплювати широке коло протеїнів, таких як імуноглобуліни, колаген, еластин, фібронектин, компоненти комплементу та захисні ендогенні пептиди, які утворюються у шкірі та слизовій оболонці (Yager D.R., Nwomeh B.C., 1999). Встановлено, що більшість видів стрептококів групи А та В продукують С5А-пептидази родини субтилізинових серинових протеаз, які розщеплюють С5а у його N-кінцевому регіоні і, таким чином, інгібують фагоцитарний кліренс мікроорганізмів (Ji Y. et al., 1996).
Протеаза PgtE, виділена із Salmonella enterica, виявилася здатною розщеплювати декілька компонентів системи комплементу (С3b, C4b и С5), таким чином впливаючи на активування конвертазного комплексу, що захищає ці бактерії від дії комплементу (Ramu P. et al., 2007).
Класичним прикладом бактеріальних екзоензимів є представники родини IgA-протеаз, які виділено з деяких видів грамнегативних ентеробактерій, зокрема роду Proteus. Одним із факторів вірулентності представників роду Proteus є висока активність його екзогенних желатинолітичних ензимів. Наприклад металопротеаза ZapA Proteus mirabilis є необхідним фактором вірулентності патогенних штамів протея (Tóth V., Emódy L., 2000). Ця протеаза інактивує захисні білки LL-37 і β-дефензин (hBD1), причому руйнування останнього є важливою умовою утворення колоній бактерій роду Proteus.
Однак із бактеріальних позаклітинних металозалежних протеаз найбільш дослідженою є еластаза з молекулярною масою 33 кДа, яка продукується P. аeruginosa. Це Zn-залежна металопротеаза, яка разом із екзотоксином А є потужним фактором, який зумовлює вірулентність цього мікроба. Еластаза P. аeruginosa — потужний індуктор запальної реакції, що володіє широкою субстратною специфічністю, розщеплює імуноглобуліни (як плазми крові, так і секреторні), компоненти системи комплементу, цитокіни та низку плазмових інгібіторів (Matsumoto K. et al., 1992). Желатиназа GelЕ, виділена з Enterococcus faecalis, інактивує систему комплементу шляхом деградації С3-компоненту, що зумовлює вірулентність цих бактерій (Park S.Y. et al., 2008).
При проведенні ензимологічних досліджень ранових інфекцій слід також враховувати внесок, який роблять грибні екзоензими до загальної протеолітичної активності, що спостерігають у локусі інфікування. Так, у ході дослідження факторів вірулентності Aspergillus fumigatus ізольовано серинову протеазу, що активно розщеплює білкові компоненти міжклітинного матриксу (колаген, еластин) (Okumura Y. et al., 2004).
Загоєння ран є складним, чітко скоординованим процесом, в якому провідну роль відіграють різні протеази, секретовані до ранового ложа власними клітинами організму (кератиноцитами, ендотеліоцитами, фібробластами, нейтрофілами). Ендогенні протеази зумовлюють автолітичне очищення рани. Протеолітична деградація РЕМ, яку здійснюють переважно ММП, має виключно важливе значення для нормального перебігу загоєння, оскільки забезпечує, як РЕМ, так і міграцію клітин. Тому порушення активаторно-інгібіторного балансу протеолітичних систем може призвести до ускладнень загоєння та хронізації рани (Протасов М.В. и соавт., 2009).
Відомо, що надмірна активність ММП є одним із ключових патогенетичних чинників розвитку виразкових уражень шкіри при ЦД. У дослідженнях останніх років виявлено, що бактеріальна колонізація діабетичних ран та хронічний запальний стан відображені у сталій активації клітин імунної системи, які продукують ММП у надмірній кількості. Інтригує також здатність мікробних протеаз активувати ММП організму хазяїна (Kernacki K.A. et al., 1997). У дослідах з мишами, імунізованими лужною протеазою P. aeruginosa, встановлено, що їх клітини продукують ММП-2/-9 у значно меншій кількості у відповідь на інфікування. Крім того, з’ясовано, що еластаза тієї ж бактерії розщеплює неактивну форму ММП-2 фібробластів людини з утворенням біологічно активного ензиму (Matsumoto K. et al., 1992).
Гемостаз — важлива ланка нормальних репаративних процесів, а вплив екзогенних ензимів на регуляцію процесів згортання/фібринолізу може негативно відображатися на загоєнні рани. Бактерії продукують цілу низку протеаз, які здатні активувати плазміногеннеактивний попередник ключового ензиму фібринолітичної системи плазміну. Запальна відповідь на бактеріальну інфекцію може призводити до локального тромбозу та блокади системи мікроциркуляції, що необхідно для ізолювання бактерій, локалізації інфекційного вогнища та запобігання дисемінації мікроорганізмів (Sanderson-Smith M.L. et al., 2008). Активуючи плазміноген, більшість патогенних бактерій перешкоджають утворенню стабільного фібринового згустка, легко дисемінують і тому уникають знешкодження. У багатьох грамнегативних бактерій, включаючи Yersinia enterocolitica, Shigella spp., Salmonella spp., Vibrio fischeri, Legionella pneumophila, E. coli, Enterobacter spp., Mesorhizobium spp., Erwinia spp., Agrobacterium tumefaciens, активатори плазміногену відносять до родини аспартилзалежних протеаз (Hritonenko V., Stathopoulos C., 2007).
З іншого боку, еластази та металопротеази, секретовані бактеріями до ранового ложа, каталізують обмежений протеоліз плазміногену з утворенням низки фізіологічно активних фрагментів — ангіостатинів, які є одними з найбільш потужних ендогенних інгібіторів утворення нових кровоносних судин (ангіогенезу) (Tykhomyrov A.A. et al., 2014). Оскільки неоваскуляризація та ангіогенез є абсолютно необхідними умовами відновлення кровотоку у пошкодженій тканині, то дія мікробних протеаз може перешкоджати нормальному кровопостачанню та репарації пошкодження.
Отже, протеолітичні ензими патогенних та умовно-патогенних мікроорганізмів, які індукують інфекційний та запальний процеси при загоєнні виразок шкіри при ЦД, є одними з чинників їх хронізації. Отримані експериментальні результати обґрунтовують доцільність комплексного мікробіологічного та ензимологічного дослідження хронічних ран у пацієнтів із ЦД, які б дозволили вибирати не лише певні антибіотичні засоби, але й препарати, що пригнічують активність мікробних протеаз.
Висновки
1. Досліджено склад патогенної мікрофлори гнійних виразок стопи у 40 пацієнтів із ЦД. Встановлено, що частка S. aureus, P. vulgaris та Enterobacter spp. становить 48; 27 і 15% відповідно від загальної кількості бактерій ранової поверхні.
2. Виявлено два типи бактеріальних колагенолітичних протеаз, секретованих мікрофлорою ранової поверхні, з молекулярною масою 120 та 50 кДа. Показано, що S. aureus і P. vulgaris продукують обидві протеази, тоді як Enterobacter spp. — лише ензим 120 кДа.
3. Для протеази 50 кДа P. vulgaris характерна найвища колагенолітична активність. За активністю протеази 120 кДа бактерії-продуценти розміщуються таким чином: P. vulgaris > Enterobacter spp. > S. aureus.
4. Ензимологічні особливості мікрофлори хронічних виразок нижніх кінцівок у хворих на ЦД можна використовувати як додатковий критерій при виборі ефективної стратегії лікування.
Список використаної літератури
- Блохина И.Н., Ладыгина Г.Н., Соколова К.Я. и др. (1986) Методы идентификации бактерий. Учеб. пособие. Изд. ГГУ, Горький, 76 с.
- Винник Ю.С., Перьянова О.В., Онзуль Е.В., Теплякова О.В. (2010) Микробные биопленки в хирургии: механизмы образования, лекарственная устойчивость, пути решения проблемы. Новости хирургии, 18(6): 115–125.
- Протасов М.В., Смагина Л.В., Юдинцева Н.М. и др. (2009) Возможность прогнозирования эпителизации ран у крыс по изменению активности матриксных металлопротеиназ в раневом экссудате. Цитология, 51(4): 311–314.
- Сахаров С.П., Козлов Л.Б., Иванов В.В. (2013) Анализ микробного пейзажа раневой инфекции при тяжелой термической травме у детей. Мед. науки, 9(3): 468–471.
- Соловьева Н.И., Рыжакова О.С. (2010) Методы определения активности матриксных металлопротеиназ. Клин. лабор. диагностика, 2: 17–21.
- Французов В.Н., Хайкина Е.В., Решедько Г.К. (2005) Диагностика и лечение хирургических инфекций стопы при сахарном диабете. Клин. микробиол. антимикроб. химиотер., 7(3): 235–244.
- Хрупкин В.И., Зубрицкий В.Ф., Ивашкин А.Н. и др. (2009) Дерматопластика раневых дефектов. ГЭОТАР-Медиа, Москва, 192 с.
- Armstrong D.G., Jude E.B. (2002) The role of matrix metalloproteinases in wound healing. J. Am. Podiatr. Med. Assoc., 92(1): 12–18.
- Derosa G., D’Angelo A., Tinelli C. et al. (2007) Evaluation of metalloproteinase 2 and 9 levels and their inhibitors in diabetic and healthy subjects. Diabetes Metab., 33(2): 129–134.
- Häse C.C., Finkelstein R.A. (1993) Bacterial extracellular zinc-containing metalloproteases. Microbiol. Rev., 57(4): 823–837.
- Hritonenko V., Stathopoulos C. (2007) Omptin proteins: an expanding family of outer membrane proteases in Gram-negative Enterobacteriaceae. Mol. Membr. Biol., 24(5–6): 395–406.
- Ji Y., McLandsborough L., Kondagunta A., Cleary P.P. (1996) C5a peptidase alters clearance and trafficking of group A streptococci by infected mice. Infect. Immun., 64(2): 503–510.
- Kernacki K.A., Fridman R., Hazlett L.D. et al. (1997) In vivo characterization of host and bacterial protease expression during Pseudomonas aeruginosa corneal infections in naive and immunized mice. Curr. Eye Res., 16(4): 289–297.
- Laemmli U.K. (1970) Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 227(5259): 680–685.
- Matsumoto K., Shams N.B., Hanninen L.A., Kenyon K.R. (1992) Proteolytic activation of corneal matrix metalloproteinase by Pseudomonas aeruginosa elastase. Curr. Eye Res., 11(11): 1105–1109.
- McCarty S.M., Cochrane C.A., Clegg P.D., Percival S.L. (2012) The role of endogenous and exogenous enzymes in chronic wounds: a focus on the implications of aberrant levels of both host and bacterial proteases in wound healing. Wound Repair Regen., 20(2): 125–136.
- Okumura Y., Ogawa K., Nikai T. (2004) Elastase and elastase inhibitor from Aspergillus fumigatus, Aspergillus flavus and Aspergillus niger. J. Med. Microbiol., 53(Pt. 5): 351–354.
- Park S.Y., Shin Y.P., Kim C.H. et al. (2008) Immune evasion of Enterococcus faecalis by an extracellular gelatinase that cleaves C3 and iC3b. J. Immunol., 181(9): 6328–6336.
- Peters E.J., Lipsky B.A. (2013) Diagnosis and management of infection in the diabetic foot. Med. Clin. North. Am., 97(5): 911–946.
- Ramu P., Tanskanen R., Holmberg M. et al. (2007) The surface protease PgtE of Salmonella enterica affects complement activity by proteolytically cleaving C3b, C4b and C5. FEBS Lett., 581(9): 1716–1720.
- Sanderson-Smith M.L., Dinkla K., Cole J.N. et al. (2008) M protein-mediated plasminogen binding is essential for the virulence of an invasive Streptococcus pyogenes isolate. FASEB J., 22(8): 2715–2722.
- Tóth V., Emódy L. (2000) Proteus virulence: involvement of the pore forming alpha-hemolysin (a short review). Acta Microbiol. Immunol. Hung., 47(4): 457–470.
- Tykhomyrov A.A., Shram S.I., Grinenko T.V. (2014) The role of angiostatins in diabetic complications. Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry, 8(2): 94–107.
- Yager D.R., Nwomeh B.C. (1999) The proteolytic environment of chronic wounds. Wound Repair Regen., 7(6): 433–441.
Резюме. В работе проанализирован состав бактериальной микрофлоры поверхности гнойных язв стопы у 40 больных сахарным диабетом, а также выделены особенности спектра бактериальных коллагенолитических экзопротеаз. Установлено, что доля Staphylococcus aureus, Proteus vulgaris и Enterobacter spp. составляет 48; 27 и 15% соответственно от общего количества патогенов раневой поверхности. Методом желатиновой зимографии выявлены две группы бактериальных коллагенолитических энзимов с молекулярной массой 120 и 50 кДа. Staphylococcus aureus и Proteus vulgaris секретировали обе протеазы, тогда как Enterobacter spp. — только высокомолекулярный энзим. Proteus vulgaris синтезировал экзоэнзим с наиболее мощной коллагенолитической активностью. Установлена роль экзогенных желатиназ как одного из ключевых факторов вирулентности патогенной микрофлоры, а также их участие в процессах хронизации язв нижних конечностей при сахарном диабете. На основе полученных результатов предложено проведение комплексного микробиологического исследования и энзимодиагностики проблемных ран у больных сахарным диабетом с целью повышения эффективности лечения и мониторинга раневого процесса для указанной категории пациентов.
Ключевые слова: сахарный диабет, гнойные язвы стопы, инфекции, бактериальные коллагенолитические протеазы, желатиновая зимография.
Summary. In the article the composition of bacterial flora of surface purulent foot ulcers in 40 patients with diabetes and peculiarirties of bacterial collagenolytic exoproteases spectrum were analysed. It was established that the percentage of Staphylococcus aureus, Proteus vulgaris and Enterobacter spp. were 48; 27 and 15% respectively of the total amount of wound bacterial microflora. Two groups of bacterial collagenolytic enzymes with molecular weights 120 and 50 kDa were found with using of gelatinase zymography. Staphylococcus aureus and Proteus vulgaris secrated both protease, while Enterobacter spp. — only high molecular enzyme. Proteus vulgaris demonstrated to exhibit the most powerful collagenolytic activity. The role of exogenic gelatinases as one of the key factors of pathogenic microflora virulence and how they contribute to foot ulcer chronization at diabetes mellitus were established. Based on the obtained results, comprehensive microbiological and enzymological studies of diabetic ulcers of lower extremities were recommended to improve efficacy of either treatment or monitoring of wound healing process for this category of patients.
Key words: diabetes mellitus, purulent foot ulcers, infections, bacterial collagenolytic proteases, gelatinase zymography.
Адреса для листування:
Петренко Олег Миколайович
01601, Київ, бульв. Тараса Шевченка, 13
Національний медичний університет
імені О.О. Богомольця,
кафедра хірургії № 2
E-mail: [email protected]





