Вступ
Артеріальна гіпертензія (АГ) — найбільша в історії людства пандемія, що визначає структуру серцево-судинної захворюваності та смертності. Поширеність АГ у світі серед дорослого населення становить >30% (>1 млрд). В Україні зареєстровано майже 12 млн хворих (Ахметзянова Э.Х., Аллабердина Э.Х., 2006; Горбась І.М., 2007). У 90% випадків АГ визначається як первинна (есенціальна, ідіопатична), або гіпертонічна хвороба (ГХ), коли причина АГ невідома. Водночас очевидним є взаємозв’язок ГХ із різними патологічними станами, які багато в чому визначають її прогресування, а також розвиток серцево-судинних ускладнень, зумовлених АГ (Ермолаева А.С. и соавт., 2001; Ахметзянова Э.Х., Аллабердина Э.Х., 2006; Изможерова Н.В. и соавт., 2006; Волков В.И., Серик С.А., 2010).
Інсулінорезистентність (ІР) — порушення метаболізму, яке частіше асоціюється з ГХ (Ratner R. et al., 2005; Григорян О.Р., 2006; Бабак О.Я. и соавт., 2010). Цей стан характеризується зниженням чутливості тканин до дії інсуліну і як результат — зменшенням утилізації глюкози цими тканинами. Наслідком ІР є гіперінсулінемія (ГІ), яка може розглядатися як реакція адаптації та носить компенсаторний характер. ГІ покликана подолати тканинну нечутливість до інсуліну. Виснаження β-клітин підшлункової залози призводить до неможливості секреції достатньої кількості інсуліну для подолання ІР, рівень глюкози у плазмі крові підвищується — розвивається гіперглікемія (Дражнин Б.Б., 2009). ГІ призводить до цілого ланцюга негативних наслідків (Задионченко B.C. и соавт., 2005; Schianca G.P. et al., 2006; Звенигородская Л.А., 2007), одним з яких є активація симпатоадреналової (САС) і ренін-ангіотензинової системи (РАС) з підвищенням вмісту в крові реніну, ангіотензину II і катехоламінів: адреналіну та норадреналіну (Lee D.S. et al., 2009; Нальотова О.М., 2011).
Наслідком ІР є також порушення обміну ліпідів, що сприяє розвитку гіпертригліцеридемії, підвищенню утворення ліпопротеїдів низької (ЛПНЩ) та дуже низької щільності (ЛПДНЩ), а також зниженню рівня холестерину (ХС) ліпопротеїдів високої щільності (ЛПВЩ) (Звенигородская Л.А., 2007; Дражнин Б.Б., 2009). Подібні порушення обміну вуглеводів і ліпідів посилюють перебіг атеросклеротичного процесу, що, у свою чергу, веде до підвищення ригідності судин і зниження ефективності антигіпертензивної терапії (Звенигородская Л.А., 2007; Lau C.H., Muniandy S., 2011).
Водночас поширеність ІР у пацієнтів із ГХ не встановлена (Ахметзянова Э.Х., Аллабердина Э.Х., 2006; Appel L.J. et al., 2006). Медикаментозне лікування осіб із ГХ, асоційованою з ІP, часто не включає метаболітотропних препаратів, які забезпечували б подолання ІР (Gundewar S. et al., 2009). Для корекції ІР у хворих на цукровий діабет (ЦД) 2-го типу досить широко застосовують метформін, однак можливість його застосування у хворих із ІР у період переддіабету досі не з’ясовано (Зилов А.И., 2004; Ratner R. et al. 2005; Gundewar S. et al., 2009). Питання застосування тіазолідиндіонів як засобів корекції ІР залишається відкритим, хоча такий потенціал у цієї групи лікарських засобів є (Задионченко B.C. и соавт., 2005; Fabris B. et al., 2005). Не до кінця вивчені у контексті лікування ГХ і тому не отримали широкого практичного застосування плейотропні (ендотелійпротекторний, антиагрегантний, ліпідознижувальний) ефекти тіотриазоліну (Волошин Н.А. и соавт., 2008).
Все це визначає наукову і практичну необхідність з’ясування медикаментозних підходів до лікування пацієнтів із ГХ, асоційованою з ІP, які можуть забезпечити не лише адекватний контроль артеріального тиску (АТ), а й пов’язаних із ІP змін метаболізму, що зумовлюють прогресування ГХ і визначають розвиток кардіоваскулярних катастроф (Зилов А.И., 2004; Fabris B. et al., 2005; Волошин Н.А. и соавт., 2008).
Мета дослідження — клінічне і математичне обґрунтування доцільності включення метаболітотропних препаратів до складу базисної медикаментозної терапії пацієнтів із ГХ II стадії, асоційованою з ІР.
Об’єкт і методи дослідження
На I етапі проводили скринінгове обстеження 625 хворих на АГ з метою виявлення пацієнтів, які відповідають критеріям включення у дослідження і не мають критеріїв виключення.
Умовами включення в дослідження були:
- наявність есенціальної (первинної) АГ, тобто ГХ II стадії, асоційованої з ІP;
- добровільна письмова згода хворого на участь.
Усі хворі добровільно підписали «Інформовану згоду», в якій викладені: основна мета лікування, його тривалість і права пацієнта.
ГХ II стадії діагностували на підставі наявності як мінімум однієї з таких ознак ураження органів-мішеней:
- гіпертрофії лівого шлуночка (за даними електрокардіографії чи ехокардіографії);
- генералізованого звуження артерій сітківки;
- мікроальбумінурії чи протеїнурії;
- підвищення концентрації креатиніну в плазмі крові (≥177 мкмоль/л).
З метою виявлення ІР усім пацієнтам із ГХ визначали рівень глюкози натще в капілярній крові. Якщо цей показник становив ≥6,1 ммоль/л, розглядали питання щодо наявності ЦД 2-го типу та проводили консультацію ендокринолога. При рівні глюкози <6,1 (але >5,6 ммоль/л) визначали рівень глікозильованого гемоглобіну (glycated hemoglobin — HbA1c) і оцінювали постпрандіальну гіперглікемію. При рівні постпрандіальної глікемії ≥7,8 ммоль/л визначали вміст інсуліну в крові й розраховували індекс HOMA-IR. Значення індексу останнього ≥3,0 свідчило про наявність ІР. Хворих без ІР у дослідження не включали.
Причинами виключення хворих із досліджуваної когорти були:
- ГХ I і III стадії;
- симптоматична (вторинна) АГ;
- ЦД;
- тяжкі супутні захворювання печінки, нирок, шлунково-кишкового тракту, захворювання щитоподібної залози, тромбофлебіт;
- алкоголізм, наркотична залежність;
- наявність протипоказань до застосування лікарських засобів, що призначали в дослідженні;
- відмова від участі у дослідженні з різних причин, включаючи матеріальні.
Загалом 302 (48,3±2,2%) пацієнти виключено з дослідження.
У II етапі взяли участь 323 пацієнти із ГХ II стадії, яка асоційована з ІP. Таким чином, ІP виявлена в 51,7±1,9% загальної кількості обстежених, серед яких 167 (53,4±3,6%) чоловіків, 156 (46,6±3,6%) жінок. Обстежувані мали додатковий ризик серцево-судинних ускладнень і віднесені до групи високого та дуже високого ризику. Ступінь ризику встановлювали за таблицями та моделлю SCORE (Systemic Coronary Risk Evaluation).
асоційованою з ІР, до початку лікування,
| Група | ||||
|---|---|---|---|---|
| 1-ша (n=64) | 2-ша (n=64) | 3-тя (n=65) | 4-та (n=65) | 5-та (n=65) |
| Офісний САТ, мм рт. ст. | ||||
| 168,2±1,0 | 168,1±1,0 | 167,9±1,1 | 167,4±1,0 | 167,2±1,1 |
| Офісний ДАТ, мм рт. ст. | ||||
| 99,7±0,7 | 99,0±0,7 | 99,9±0,7 | 99,2±0,7 | 99,4±0,7 |
| Частота серцевих скорочень, уд./хв | ||||
| 91,3±1,5 | 92,6±0,9 | 95,6±1,7 | 93,1±0,9 | 94,4±1,7 |
| Хвилинний об’єм кровообігу, мл/хв | ||||
| 3618,0±96,8 | 3662,0±95,1 | 3728,0±83,7 | 3659,0±93,1 | 3719,0±85,7 |
| Глікемія натще, ммоль/л | ||||
| 5,83±0,02 | 5,92±0,02 | 5,87±0,02 | 5,82±0,01 | 5,88±0,01 |
| Глікемія через 2 год після «стандартного сніданку», ммоль/л | ||||
| 7,99±0,03 | 7,97±0,03 | 8,07±0,03 | 7,97±0,02 | 8,09±0,02 |
| Рівень інсуліну в плазмі крові, мкОд/мл | ||||
| 18,45±0,67 | 18,61±0,53 | 19,22±0,81 | 19,31±0,41 | 19,89±0,62 |
| Індекс HOMA-IR | ||||
| 4,79±0,19 | 4,89±0,13 | 5,01±0,22 | 4,99±0,13 | 5,19±0,21 |
| Показник Hb1Ac, % | ||||
| 5,73±0,03 | 5,78±0,02 | 5,77±0,02 | 5,79±0,02 | 5,81±0,02 |
| Загальний ХС, ммоль/л | ||||
| 5,8±0,1 | 6,9±0,1* | 6,4±0,1*# | 6,5±0,1*# | 6,6±0,1*# |
| ТГ, ммоль/л | ||||
| 3,6±0,1 | 3,7±0,1 | 3,7±0,2 | 3,6±0,1 | 3,6±0,2 |
| ЛПВЩ, ммоль/л | ||||
| 0,95±0,02 | 0,95±0,02 | 0,87±0,03 | 0,89±0,02 | 0,88±0,02 |
| ЛПНЩ, ммоль/л | ||||
| 3,21±0,1 | 4,28±0,1 | 3,84±0,2 | 3,98±0,1 | 4,11±0,1 |
| ЛПДНЩ, ммоль/л | ||||
| 1,64±0,08 | 1,67±0,03 | 1,69±0,10 | 1,63±0,05 | 1,61±0,04 |
| ІА | ||||
| 5,2±0,2 | 6,3±0,2* | 6,5±0,2* | 6,3±0,2* | 6,5±0,2* |
| Рівень альдостерону в плазмі крові, пкмоль/л | ||||
| 209,3±7,7 | 208,5±7,8 | 214,2±6,9 | 211,5±7,2 | 212,2±5,9 |
| Рівень активності реніну плазми крові (нг/мл)/год | ||||
| 6,5±0,1 | 6,2±0,2 | 6,7±0,2 | 6,4±0,2 | 6,6±0,2 |
| Добова екскреція норадреналіну з сечею, нмоль/добу | ||||
| 682,8±12,9 | 667,1±10,1 | 688,5±15,7 | 677,1±12,1 | 681,5±12,1 |
Хворих, які брали участь у II етапі дослідження, методом рандомізації розподілили на 5 груп. Групи спостереження були однорідними за віком (різниця між групами не є статистично значущою; p=0,80) та статтю (p=0,93).
Пацієнти отримували такі варіанти медикаментозної терапії:
- 1-ша група (n=64) — базисна антигіпертензивна фармакотерапія (периндоприл 4–5 мг/добу в один прийом + кандесартан 8 мг в один прийом);
- 2-га група (n=64) — базисна антигіпертензивна фармакотерапія + розиглітазон 4 мг/добу в один прийом;
- 3-тя група (n=65) — базисна антигіпертензивна фармакотерапія + розиглітазон 4 мг/добу в один прийом і тіотриазолін 300 мг/добу (по 100 мг 3 рази на добу);
- 4-та група (n=65) — базисна антигіпертензивна фармакотерапія + метформін 1000 мг/добу (по 500 мг 2 рази на добу);
- 5-та група (n=65) — базисна антигіпертензивна фармакотерапія + метформін 1000 мг/добу (по 500 мг 2 рази на добу) і тіотриазолін у дозі 300 мг/добу (по 100 мг 3 рази на добу).
З метою усунення порушень обміну ліпідів хворі всіх груп отримували аторвастатин у дозі 20 мг/добу. Оскільки всі пацієнти мали додатковий високий і дуже високий ризик серцево-судинних ускладнень, до складу медикаментозної терапії включено ацетилсаліцилову кислоту в дозі 75–150 мг/добу. Лікування здійснювали протягом 16 тиж. Візити, під час яких проводили заплановані процедури дослідження хворих, здійснювали на 2-; 4-; 8-; 12- і 16-му тижні.
Усім хворим проводили: опитування, обстеження, вимір систолічного (САТ) і діастолічного АТ (ДАТ).
Для аналізу результатів дослідження використано методи біостатистики (Казаков В.Н. и соавт., 2007; Лях Ю.Е., Гурьянов В.Г., 2012). У роботі наведено значення середнього арифметичного (![]() ) і помилки середнього (m) показників, що вимірювали у пацієнтів протягом лікування. У разі якісних ознак розраховували частоту її прояву (%) та її стандартну похибку (m%), крім того наводили 95% довірчий інтервал (ДІ) частоти (Казаков В.Н и соавт., 2007).
) і помилки середнього (m) показників, що вимірювали у пацієнтів протягом лікування. У разі якісних ознак розраховували частоту її прояву (%) та її стандартну похибку (m%), крім того наводили 95% довірчий інтервал (ДІ) частоти (Казаков В.Н и соавт., 2007).
Для оцінки впливу лікування на показники, що характеризують стан пацієнтів, використано дисперсійний аналіз (у разі нормального закону розподілу), критерій Крускала — Уолліса (у разі відмінності закону розподілу від нормального), для проведення попарних порівнянь — методи множинних порівнянь (Лях Ю.Е., Гурьянов В.Г., 2012).
Для визначення динаміки змін показників використовували критерії порівнянь для пов’язаних вибірок: критерій Стьюдента (у разі нормального закону розподілу), T-критерій Вілкоксона (у разі відмінності закону розподілу від нормального). Для порівняння якісних ознак використано критерій χ2. Відмінність вважали статистично значущою при р<0,05.
Для виявлення наявності й оцінки сили парних зв’язків між ознаками, що характеризують стан хворого, використано методи кореляційного аналізу. Для кількісної оцінки клінічного ефекту в роботі розраховували показник відношення ризиків та його 95% ДІ.
Для оцінки ефективності методів фармакотерапії у багатовимірному просторі показників, що оцінюють стан хворого, застосовували кластерний аналіз результатів спостереження пацієнтів протягом 16 тиж. Кластерний аналіз проведено за методом побудови нейромережевих карт Кохонена (Лях Ю.Е., Гурьянов В.Г., 2012). Застосування цього методу зумовлено тим, що карта Кохонена сприймає саму структуру багатовимірних вхідних даних. Нейронна мережа Кохонена може розпізнати кластери в даних, а також визначати їх близькість і таким чином поліпшити розуміння структури даних. При проведенні аналізу результатів фармакотерапії пацієнтів із ГХ, що асоційована з ІР, для виявлення впливу варіанту терапії на результат лікування та ознак, що визначають ефективність терапії, виділення найбільш значимих ознак, використаний метод побудови багатофакторних математичних моделей прогнозування (Казаков В.Н. и соавт., 2007; Лях Ю.Е., Гурьянов В.Г., 2012).
Для оцінки адекватності моделі всі випадки (з використанням генератора випадкових чисел) розподілені на 3 множини:
- навчальна (використовувалася для побудови моделі);
- контрольна (використовувалася разом з навчальною для вибору порогу ухвалення рішення);
- тестова (використовувалася для перевірки прогностичної здатності моделі на нових даних).
Прогностичну якість моделі оцінювали за її чутливістю та специфічністю; для цих величин розраховано відповідний 95% ДІ. Адекватність математичних моделей оцінювали також методом побудови та аналізу кривих операційних характеристик (Receiver Operating Characteristic (ROC) curve analysis). При цьому розраховували площу під ROC-кривою (Area under the curve — AUC) і її 95% ДІ (Казаков В.Н. и соавт., 2007; Лях Ю.Е., Гурьянов В.Г., 2012). Модель вважали адекватною при статистично значимій відмінності величини AUC від величини 0,5. Метод аналізу ROC-кривої використовували також для вибору оптимального значення порогу прийняття/відкидання моделі, для якого визначається її чутливість і специфічність (Казаков В.Н. и соавт., 2007). Оцінку якості моделей класифікації проводили за показниками відношення правдоподібності позитивних (LR+) та негативних (LR–) прогнозів. Для оцінки ступеня впливу окремих факторних ознак на ефективність терапії використано метод побудови логістичних моделей регресії. Вплив ознак оцінено за величиною відношення шансів (ВШ) ризику неефективності терапії при зміні значення ознаки (розраховували за значенням коефіцієнтів моделі).
Розрахунки статистичних критеріїв проводили в пакеті «Medstat» (Казаков В.Н. и соавт., 2007; Лях Ю.Е., Гурьянов В.Г., 2012). Побудову карт Кохонена та їх аналіз проводили в пакеті «Statistica Neural Networks» («StatSoft Inc.», 1999). Побудову та аналіз математичних моделей проводили в пакетах «Statistica Neural Networks» («StatSoft Inc.», 1999) та «MedCalc» («MedCalc Software», 2010).
Результати та їх обговорення
До початку лікування у пацієнтів усіх груп рівень офісного САТ був вищий за норму на 20,9±0,2%; за цільовий (130 мм рт. ст.) — на 28±1,0%. Рівень офісного ДАТ був вищий за норму (89 мм рт. ст.) на 11,5±0,9%; за цільовий (80 мм рт. ст.) — на 24,0±0,9% (таблиця). Статистично значущої відмінності між групами за цими показниками не виявлено (p>0,05).
У пацієнтів із ГХ ІІ стадії ІР проявляється погіршенням показників стану обміну вуглеводів. Наявність ІР у них сприяла погіршенню показників обміну ліпідів, надмірній активації САС і РАС (див. таблицю).
Оцінка антигіпертензивної ефективності всіх варіантів лікування свідчить, що усі фармакотерапевтичні заходи протягом 16 тиж були ефективні. Базисна антигіпертензивна фармакотерапія (периндоприл + кандесартан) за період спостереження сприяла достовірним (p<0,05) змінам: зниженню офісного САТ на 19,7±0,8% і офісного ДАТ — на 18,5±1,2%, а також забезпечувала досягнення нормотонічних показників (офісний САТ <140 мм рт. ст.; офісний ДАТ <90 мм рт. ст.) після 4 тиж лікування (див. таблицю).
Найбільш ефективним варіантом фармакотерапії у цього контингенту було поєднання з базисним лікуванням комбінації метформін + тіотриазолін. Цей варіант фармакотерапії сприяв достовірному (p<0,05) зниженню офісного САТ (на 21,8±0,9%) і офісного ДАТ (на 19,4±1,5%); забезпечував досягнення нормотонічних показників офісного САТ і офісного ДАТ після 2 тиж лікування.
Зазначимо, що базисна антигіпертензивна фармакотерапія не сприяла достовірним змінам показників обміну вуглеводів, тоді як додавання метаболітотропних препаратів (2-га; 3-тя та 4-та групи) поліпшувало ці показники. Однак найбільш суттєві результати за 16 тиж продемонструвало лікування, що включало у складі базисної терапії комбінацію метформін + тіотриазолін. Цей варіант фармакотерапії сприяв подоланню ІР, що проявлялася статистично значущим (p<0,05) зниженням показників обміну вуглеводів: індексу HOMA-IR на 24,5±5,4% із досягненням значення <3,0. Знижувалися (p<0,05) також показники глікемії натще на 6,5±0,4%, глікемії через 2 год після «стандартного сніданку» — на 7,0±0,4%, рівень інсуліну в плазмі крові — на 26,1±4,0%.
Застосування різних варіантів фармакотерапії протягом 16 тиж поліпшувало показники обміну ліпідів. Найбільш значущі зміни з боку показників обміну ліпідів спостерігали у хворих 4-ї та 5-ї груп, які додатково застосовували метформін і метформін + тіотриазолін. Також у хворих цих груп рівень загального ХС протягом усього періоду лікування знижувався суттєвіше, ніж у хворих 2-ї групи. Показник загального ХС у хворих 3-ї групи досяг такого ж показника, як і у хворих 1-ї групи, в яких зміни з боку обміну ліпідів були найменшими. Водночас зазначимо, що в жодній групі не досягнутий рекомендований цільовий показник загального ХС (<4,5 ммоль/л).
Що стосується змін показників рівнів ТГ, то саме у хворих 3-; 4- та 5-ї груп досягнуті цільові значення цього показника (<1,81 ммоль/л). Усі зміни рівнів ТГ у групах (методи множинних порівнянь — критерій Шеффе у разі нормального закону розподілу, критерій Данна у разі відмінності закону розподілу від нормального), а також відмінності були статистично значущі (p<0,05) порівняно з показниками до лікування (методи порівнянь пов’язаних вибірок — критерій Стьюдента у разі нормального закону розподілу, критерій Вілкоксона у разі відмінності закону розподілу від нормального).
Все ж відзначимо, що в жодній групі хворих наприкінці 16 тиж лікування показник ЛПНЩ не досяг цільового (<2,5 ммоль/л). Лише у хворих 3-ї та 4-ї груп ІА, досягнутий після 16 тиж лікування, становив 3,6±0,1 та наблизився до показника нормального значення (3,5), а у 5-й групі досяг показника 3,5.
Найбільш вагомими були зміни з боку обміну ліпідів при застосуванні у складі базисної фармакотерапії метформіну + тіотриазоліну (p<0,05): зниження рівня загального ХС на 18,2±2,3%; ТГ — на 55,2±6,7%; ЛПНЩ — на 14,8±2,1%; ЛПДНЩ — на 55,2±4,5%; ІА — на 46,2±3,2%; підвищення ЛПВЩ — на 34,1±2,8%.
Результати аналізу динаміки стану САС і РАС свідчать, що застосування різних варіантів фармакотерапії знижує надмірну активацію цих нейрогуморальних систем, визначену до початку дослідження. За 16 тиж лікування рівень альдостерону в плазмі крові у хворих 1-ї групи знизився у середньому на 32,9±4,9%; 2-ї — на 32,8±4,8%; 4-ї — на 35,9±5,1% (p<0,05), а найбільше — у 3-й і 5-й групах: на 41,7±2,0 і 46,9±1,5% (p<0,01) відповідно.
Після 16 тиж застосування різних варіантів лікування середнє зниження рівня активності реніну плазми крові відносно початкового рівня у хворих 1-ї групи становило 21,5±3,9%; 2-ї — 25,4±3,6%. Значно вагомішими показники були у решти груп (p<0,01): у 3-й — 41,6±5,9%, у 4-й — 37,5±5,4%, у 5-й — 48,5±6,6%.
Під впливом проведених фармакотерапевтичних заходів рівень добової екскреції норадреналіну з сечею у хворих 3-; 4- та 5-ї груп досяг норми (47,3–591,0 нмоль/добу), починаючи з 8-го тижня лікування, при цьому починаючи з 12-го тижня він був у середньому нижчий, ніж у пацієнтів 1-ї групи (p<0,05). У хворих 2-ї групи показника норми досягнуто на 12-му тижні лікування, а у 1-й групі — на 16-му тижні. Після 16 тиж середнє зниження рівня добової екскреції норадреналіну з сечею у хворих 1-ї групи становило 13,4±1,6%; 2-ї — 13,3±1,8%, найбільше ж — у 3-й групі — 20,7±2,2%, у 4-й групі — 18,8±1,9%, у 5-й групі — 22,2±2,7% (p<0,01).
Застосування методу побудови нейронних мереж Кохонена дозволило оцінити ефективність базисної фармакотерапії і різних варіантів комбінацій метаболітотропних лікарських засобів у пацієнтів із ГХ, асоційованою з ІР, у 18-вимірному просторі ознак:
- САТ (X1);
- ДАТ (X2);
- середній АТ (X3);
- частота серцевих скорочень (X4);
- хвилинний об’єм кровообігу (X5);
- глікемія натще (X6);
- глікемія через 2 год після прийому «стандартного сніданку» (X7);
- рівень інсуліну в плазмі крові (X8);
- індекс HOMA-IR (X9);
- рівень загального ХС (X10);
- рівень ТГ (X11);
- рівень ЛПВЩ (X12);
- рівень ЛПНЩ (X13);
- рівень ЛПДНЩ (X14);
- ІА (X15);
- рівень альдостерону в плазмі крові (X16);
- рівень активності реніну плазми крові (X17);
- рівень добової екскреції норадреналіну з сечею (X18).
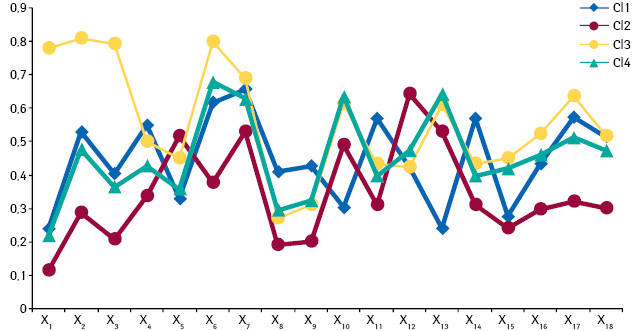
Аналіз отриманих результатів свідчить про те, що оптимальна кількість кластерів розбиття становила 4. На рисунку наведено положення центрів 4 виділених кластерів у 18-вимірному просторі ознак. Виходячи з аналізу положень центрів кластерів, можна вважати, що спостереження, віднесені до Cl3, характеризуються «незадовільним» станом за сукупністю 18 показників. Так, для них характерні найвищі значення X1–3; X6–7 та X16–17 (див. рисунок). На противагу цьому кластеру до Cl2 належать спостереження з найбільш низькими значеннями показників X1–9; X11; X14–18 і найбільш високими значеннями показників X5 і X12, що дозволяє говорити про спостереження, віднесені до цього кластера, як про такі, що відповідають «задовільному» стану. У цьому разі Cl1 і Cl4 відповідають деякому «проміжному» стану пацієнта.
При проведенні аналізу кожного спостереження встановлено, що включення в базисну фармакотерапію метформіну + тіотриазоліну (5-та група) забезпечує максимальну ефективність лікування пацієнтів із ГХ ІІ стадії, асоційованою з ІР, за сукупністю впливу на показники АТ, обміну вуглеводів та ліпідів, а також стан САС і РАС з 8-го тижня його проведення, при цьому на 16-му тижні ефективність лікування у 5-й групі вища, ніж у 1-й і 3-й (p=0,04).
Для аналізу ефективності терапії у пацієнтів із ГХ ІІ стадії, асоційованою з ІР, використано метод побудови багатофакторних математичних моделей класифікації. При виборі для оцінки ефективності терапії показника глюкози натще на 12-му тижні лікування встановлено (показник відношення правдоподібності моделі LR+ 7,1; LR– 0,14), що на прогноз позитивного результату статистично значущо (p=0,01) впливає варіант лікування. Найбільш ефективним є застосування базисної фармакотерапії з метформіном + тіотриазоліном, менш ефективним — базисної фармакотерапії з розиглітазоном + тіотриазоліном, найменш ефективною є базисна фармакотерапія (ВШ 0,04; 95% ДІ 0,01–0,50).
Для оцінки ефективності лікування нами вибрано рівень АТ дослiджуваних після 8 тиж терапії. Також встановлено (показник відношення правдоподібності моделі LR+ 3,6; LR– 0,28), що застосування 5-ї схеми лікування знижує ризик неефективності терапії (ВШ 0,19; 95% ДІ 0,04–0,80). При виборi основним критерiєм оцінки ефективності терапії показника IА на 16-му тижні лікування виявлено (показник відношення правдоподібності моделі LR+ 3,9; LR– 0,26), що найменш ефективним є 1-й варіант терапії, наступним за неефективністю — 3-й варіант, а застосування 5-го варіанту знижує вірогідність недосягнення ефекту (ВШ 0,08; 95% ДІ 0,05–0,26).
Коли для оцінки ефективності терапії вибрано показник ТГ, на 16-му тижні лікування виявлено, що при застосуванні базисної антигіпертензивної фармакотерапії або фармакотерапії, яка додатково включала розиглітазон + тіотриазолін, прогноз є позитивним лише за початкового критичного рівня ТГ ≤3,6 ммоль/л. При додаванні до базисної терапії метформіну + тіотриазоліну поріг, при якому в рамках математичної моделі прогнозується позитивний ефект, зсувається до критичного значення ≤4,75 ммоль/л.
Висновки
Клінічно показано, а методом аналізу багатофакторних моделей встановлено, що включення в базисну фармакотерапію (периндоприл + кандесартан) метформіну + тіотриазоліну забезпечує максимальну ефективність лікування пацієнтів із ГХ, асоційованою з ІР, за сумарним впливом на показники АТ, обміну вуглеводів та ліпідів, а також на стан САС та РАС з 8-го тижня лікування, при цьому наприкінці 16-го тижня ефективність лікування у 5-й групі вища, ніж у 1-й та 3-й (p=0,04).
Встановлено, що застосування базисної фармакотерапії з додаванням у схему метформіну + тіотриазоліну порівняно із базисною фармакотерапією знижує ризик неефективності терапії:
- за показником глюкози натще (ВШ 0,04; 95% ДІ 0,01–0,50; p=0,01);
- за рівнем АТ (ВШ 0,19; 95% ДІ 0,04–0,80; p=0,02);
- за показником ІА (ВШ 0,08; 95% ДІ 0,05–0,26; p<0,001) — при проведенні стандартизації стану хворих за іншими факторами ризику.
Список використаної літератури
- Ахметзянова Э.Х., Аллабердина Э.Х. (2006) Распространенность артериальной гипертензии у больных сахарным диабетом 2 типа. Рос. кардиол. журн., 1: 25–28.
- Бабак О.Я., Ярмыш Н. В., Кравченко Н.А. (2010) Перспективы и безопасность применения агонистов и селективных модуляторов активности PPARs в коррекции метаболических нарушений, связанных с инсулинорезистентностью. Укр. терапевт. журн., 3: 7–14.
- Волков В.И., Серик С.А. (2010) Сахарный диабет и сердечная недостаточность. Укр. терапевт. журн., 1: 27–34.
- Волошин Н.А., Визир В.А., Волошина И.Н. (2008) Тиотриазолин, тиоцетам, тиодарон в практике врача. ЗГМУ, Запорожье, 224 с.
- Горбась І.М. (2007) Контроль артеріальної гіпертензії серед населення: стан проблеми за даними епідеміологічних досліджень. Укр. кардіол. журн., 2: 21–25.
- Григорян О.Р. (2006) Терапия метаболического синдрома: коррекция углеводного обмена и артериальной гипертензии. Справоч. поликлин. врача, 1: 61–68.
- Дражнин Б.Б. (2009) Атеросклероз при диабете и инсулинорезистентности. Ліки України, 5: 42–45.
- Ермолаева А.С., Дербенцева Е.А., Дралова О.В. и др. (2001) Гипотензивная и нефропротективная эффективность, переносимость и безопасность комбинированной терапии, включающей валсартан или эналаприл, у пациентов с артериальной гипертонией и ожирением. Лекарственные средства: Прикладная фармакология и персонализированная фармакотерапия, 1: 32–36.
- Задионченко B.C., Адашева Т.В., Демичева О.Ю. и др. (2005) Метаболический синдром: лечение ожирения и нарушений углеводного обмена. Справоч. поликлин. врача, 5: 59–66.
- Звенигородская Л.А. (2007) Метаболический синдром: основы патогенеза, исследования в будущем. Экспериментальная и клиническая гастроэнтерология. Эксперимент. и клин. гастроэнтерология, 1: 5–7.
- Зилов А.И. (2004) Способность метформина защищать сосуды: миф или реальность? Врач, 9: 43–45.
- Изможерова Н.В., Попов А.А., Тагильцев Н.В. и др. (2006) Гиперинсулинемия и инсулинорезистентность у женщин с метаболическим синдромом в климактерическом периоде. Клин. медиц., 5: 65–68.
- Казаков В.Н., Лях Ю.Е., Кутько И.И. и др. (2007) Теоретические и практические аспекты автоматизированной информационной системы «Депрессии». ДонГМУ, Донецк, 160 с.
- Лях Ю.Е., Гурьянов В.Г. (2012) Математическое моделирование при решении задач классификации в биомедицине. Укр. журн. телемедицини та мед. телематики, 10(2): 69–76.
- Нальотова О.М. (2011) Стан нейрогуморальних систем у хворих на гіпертонічну хворобу, асоційовану з інсулінорезистентністю, при включенні до стандартної фармакотерапії метформіну і тіотриазоліну. Клін. фармац., 15(3): 4–9.
- Appel L.J., Brands M.W., Daniels S.R. et al.; American Heart Association (2006) Dietary approaches to prevent and treat hypertension: a scientific statement from the American Heart Association.Hypertension, 47(2): 296–308.
- Fabris B., Bortoletto M., Candido R. et al. (2005) Genetic polymorphisms of the renin-angiotensin-aldosterone system and renal insufficiency in essential hypertension. J. Hypertens., 23(2): 309–316.
- Gundewar S., Calvert J.W., Toedt-Pingel I. et al. (2009) Activation of AMP-activated protein kinase by metformin improves left ventricular function and survival in heart failure. Circ. Res., 104(3): 403–411.
- Lau C.H., Muniandy S. (2011) Novel adiponectin-resistin (AR) and insulin resistance (IRAR) indexes are useful integrated diagnostic biomarkers for insulin resistance, type 2 diabetes and metabolic syndrome: a case control study. Cardiovasc. Diabetol., 10(1): 8.
- Lee D.S., Ghosh N., Floras J.S. et al. (2009) Association of blood pressure at hospital discharge with mortality in patients diagnosed with heart failure. Circ. Heart Fail., 2(6): 616–623.
- Ratner R., Goldberg R., Haffner S. et al. (2005) Impact of intensive lifestyle and metformin therapy on cardiovascular disease risk factors in the diabetes prevention program. Diabetes Care, 28(4): 888–894.
- Schianca G.P., Castello L., Rapetti R. et al., (2006) Insulin sensitivity: gender-related differences in subjects with normal glucose tolerance. Nutr. Metab. Cardiovasc., 16(5): 339–344.
вариантов фармакотерапии у пациентов с гипертонической болезнью, ассоциированной с инсулинорезистентностью
Резюме. Антигипертензивная фармакотерапия (периндоприл и кандесартан) у пациентов с гипертонической болезнью ІІ стадии, ассоциированной с инсулинорезистентностью, способствовала снижению систолического артериального давления на 19,7±0,8%, диастолического артериального давления — на 18,5±1,2% (p<0,05); обеспечивала достижение нормотонических показателей после 4 нед лечения. Включение метформина и тиотриазолина в базисную антигипертензивную фармакотерапию у этих больных способствовало снижению систолического артериального давления на 21,8±0,9%, диастолического артериального давления на 19,4±1,5% (p<0,05); обеспечивало достижение нормотонических показателей после 2 нед лечения. Методом анализа многофакторных моделей установлено, что добавление к базисной антигипертензивной фармакотерапии (периндоприл и кандесартан) метформина и тиотриазолина обеспечивает максимальную эффективность лечения пациентов с гипертонической болезнью ІІ стадии, ассоциированной с инсулинорезистентностью, по совокупности влияния на показатели артериального давления, обмена углеводов и липидов, а также на состояние симпатоадреналовой и ренин-ангиотензиновой систем.
Ключевые слова: артериальная гипертензия, инсулинорезистентность, стандартная фармакотерапия, метформин, тиотриазолин.
Summary. Antihypertensive drug therapy (perindopril and candesartan) in patients with essential hypertensionstage II, associated with insulin resistance, contributed to decrease in systolic blood pressure at 19.7±0.8% and diastolic blood pressure at 18.5±1.2% (p<0.05), contributed to the achievement of normotensive indicators after 4 weeks of therapy. The inclusion of metformin and thiotriazolin in basic antihypertensive drug therapy in these patients contributed to the reduction in systolic blood pressure at 21.8±0.9% and diastolic blood pressure at 19.4±1.5% (p<0.05) contributed to the achievement of normotensive indicators after 2 weeks of therapy. The multi-factor models analysis found that the addition of metformin and thiotriazoline to the basic antihypertensive drug therapy (perindopril and candesartan) provides maximum effectiveness of treatment in patients with essential hypertension stage II, associated with insulin resistance, on blood pressure, metabolism of carbohydrates and lipids, and also on the sympathoadrenal and renin-angiotensin systems state.
Key words: arterial hypertension, insulin resistance, basic pharmacotherapy, metformin, thiotriazolin.
Адреса для листування:
Нальотова Олена Миколаївна
83003, Донецьк, просп. Ілліча, 16
Донецький національний медичний
університет ім. Максима Горького,
кафедра загальної практики —
сімейної медицини
E-mail: [email protected]





