З часів стародавніх Греції та Єгипту до середини ХХ ст. людство намагалося знайти способи лікування туберкульозу, про що свідчить довгий перелік різних методів — кровопускання, кліматотерапія, ліжковий режим, вживання жирів, перерізування діафрагмального нерва, пневмоторакс, пневмоперитонеум, олеоторакс, торакопластика. Однак тільки з появою стрептоміцину в 1943 р. туберкульоз перестав бути фатальною хворобою. Одночасно в Європі синтезована пара-аміносаліцилова кислота (PAS), а у 1952 р. відкрито найефективніший протитуберкульозний препарат — ізоніазид (Iseman M.D., 2002).
Хаотичне, безсистемне, різне за тривалістю застосування цих ліків дуже швидко призвело до виникнення нової суттєвої проблеми — медикаментозної резистентності збудника туберкульозу та зниження їх ефективності (Dye C. et al., 2002).
Результати мікробіологічних досліджень того часу встановили, що мікобактерія туберкульозу (МБТ; Micobacterium tuberculosis) належить до облігатних аеробів з повільним розмноженням (кожні 20–30 год) і неминучим виникненням у процесі розмноження мутантів, резистентних до антибактеріальних препаратів. Ці відомості, а також дані численних клінічних досліджень ефективності застосування стрептоміцину, PAS та ізоніазиду ізольовано і в комбінаціях стали підставою для розробки основних принципів лікування пацієнтів з туберкульозом, які залишились актуальними до сьогодні (Хоменко А.Г., 1980; World Health Organization, 1997):
1. Застосування стандартних комбінацій антибактеріальних препаратів (для попередження селекції резистентних мутантів та розвитку медикаментозної резистентності МБТ).
2. Призначення хіміопрепаратів у добових дозах за один прийом для створення максимальної бактеріостатичної концентрації у крові.
3. Основний курс хіміотерапії туберкульозу повинен тривати до повного припинення бактеріовиділення, зникнення запальних явищ в легенях.
Ефективна тривалість лікування у разі застосування режиму ізоніазид+стрептоміцин+PAS за даними численних клінічних досліджень становила 12 міс. Був розроблений стандартний режим хіміотерапії 12HSPAS (ізоніазид+стрептоміцин+PAS щоденно протягом 12 міс), який дозволив суттєво поліпшити епідеміологічну ситуацію щодо туберкульозу — захворюваність в різних країнах світу почала знижатися щорічно на 5–7%, ефективність лікування досягла 40–70% за показником припинення бактеріовиділення.
Розроблено нові протитуберкульозні препарати — тіоацетазон, піразинамід, циклосерин, але вони мали низькі протитуберкульозні властивості, а етамбутол і етіонамід — помірні, тому істотно не вплинули на результати лікування хворих на туберкульоз. Проте завдяки цим препаратам були розроблені нові стандартні режими хіміотерапії — 6HSE6HE (ізоніазид+ стрептоміцин+етамбутол щоденно протягом 6 міс, а потім ізоніазид+етамбутол щоденно ще 6 міс), які відрізнялись кращою переносимістю, ніж у разі застосування PAS. У 60–70-ті роки ХХ ст. у світі відзначали стабільне зниження (на 5% щорічно) захворюваності на туберкульоз, смертності і майже незмінні результати хіміотерапії — 50–70% (Хоменко А.Г., 1980).
Ситуація значно змінилася в середині 70-х та на початку 80-х років ХХ ст., коли було відкрито протитуберкульозні властивості рифампіцину, який за активністю не відрізнявся від ізоніазиду. Отримана нова інформація про мікобактеріальну популяцію і механізм дії протитуберкульозних препаратів. Ці відомості стали новим концептуальним етапом розвитку хіміотерапії туберкульозу (Mitchison D.A., 1985; Snider D.E. et al., 1985).
Популяція МБТ складається з типових бактерій, що швидко і повільно розмножуються, і персистуючих форм. У хворих із вперше діагностованим туберкульозом із звичайним перебігом до початку лікування популяція МБТ складається з 80% бактерій, що швидко ростуть, 15% — що ростуть повільно, 5% — що персистують. Під дією протитуберкульозних препаратів співвідношення у популяції МБТ швидко (з 5–10-го дня) змінюється у бік збільшення персистуючих форм. У разі монотерапії на 7–10-й день лікування у бактеріальній популяції з’являються резистентні й залежні від антимікобактеріальних препаратів МБТ. Форми МБТ, що змінилися під дією лікування, не втрачають своєї патогенності й легко реверсують у початкові форми (крім резистентних) після припинення дії несприятливого чинника. Встановлено, що на МБТ, які активно розмножуються, бактерицидно впливають ізоніазид і рифампіцин, бактеріостатично — стрептоміцин та етамбутол. Одночасно відкриті унікальні властивості піразинаміду — бактерицидний вплив на персистуючі внутрішньоклітинно розташовані МБТ (до того часу вважали, що піразинамід бактеріостатично діє проти зовнішньоклітинно розташованих МБТ в казеозних масах) (Grosset J., 1985; Mitchison D.A., 1985; Sbarbaro J.A. et al., 1992).
Усі ці відомості стали підставою для розробки нових, дуже важливих принципів хіміотерапії туберкульозу:
1. Двоетапність лікування туберкульозу: перша інтенсивна щоденна фаза (бактерицидна дія протитуберкульозних препаратів проти МБТ, що активно, повільно розмножуються та персистують), друга — підтримувальна інтермітуюча або щоденна.
2. Тривалість основного курсу скорочена до 6–8 міс завдяки бактерицидному впливу ізоніазиду, рифампіцину, піразинаміду на всі форми МБТ, що активно розмножуються та персистують.
Численними дослідженнями ефективності короткострокових курсів хіміотерапії доведена її оптимальна тривалість — 5–6 міс у разі МБТ-негативних форм і 7–8 міс — у разі МБТ-позитивних форм (Espinal M.A. et al., 2000).
З’явилися нові стандартні схеми лікування туберкульозу:
• 2HRS4H3R3 (ізоніазид+рифампіцин+стрептоміцин щоденно 2 міс, далі ізоніазид+рифампіцин 3 рази на тиждень 4 міс) — для МБТ-негативних вперше діагностованих форм;
• 2HRSZ6H3R3Z3 (ізоніазид+рифампіцин+
стрептоміцин+піразинамід щоденно 2 міс, далі ізоніазид+рифампіцин+піразинамід 3 рази на тиждень 6 міс) — для МБТ-позитивних вперше діагностованих форм;
• 2HRSEZ1HREZ5HRZ (ізоніазид+рифампіцин+стрептоміцин+етамбутол + піразинамід щоденно 2 міс, далі ізоніазид+рифампіцин+етамбутол+піразинамід щоденно 1 міс і далі ізоніазид+ рифампіцин+піразинамід 3 рази на тиждень 5 міс) — для рецидивів туберкульозу (World Health Organization, 1997).
Ці режими хіміотерапії дозволяють досягти 95–100% ефективності у разі застосування у хворих із вперше діагностованим туберкульозом серед вибіркових контингентів пацієнтів (з високим рівнем сприяння лікуванню, без ускладнених і задавнених форм туберкульозу) і у 60–85% — у загальній популяції, яка включає тяжкі або хіміорезистентні форми туберкульозу (World Health Organization, 1997).
Але наприкінці 80-х і початку 90-х років ХХ століття епідеміологічна ситуація щодо туберкульозу раптово погіршилась. Захворюваність в усіх країнах світу підвищилась на 20–100%, зросла смертність, погіршились показники ефективності лікування, значно зросла медикаментозна резистентність МБТ до протитуберкульозних препаратів (Riley L.W., 1993; Iseman M.D., 2002).
У 1992 р. більшість країн світу почали вживати заходів з приводу загрози світової епідемії туберкульозу після 20 років ігнорування цієї проблеми. Зростання захворюваності на туберкульоз і спалах мультирезистентного туберкульозу у великих містах (Нью-Йорк, 1993) стали рушійною силою в об’єднанні зусиль світової громадськості для подолання цієї загрози (Sbarbaro J.A., 1995; Raviglione M.C., 2003).
Результати епідеміологічних досліджень свідчать, що 95% усіх випадків туберкульозу припадало на країни, що розвиваються. З початку 90-х років ХХ ст. у країнах Африки і колишнього Радянського Союзу захворюваність на туберкульоз зростала відповідно на 10 і 7% на рік (Sbarbaro J.A., 1995).
Впроваджені з 70-х років XX століття багатокомпонентні режими хіміотерапії повинні були попереджати виникнення медикаментозної резистентності, але вони не використовувалися в повному обсязі, що було зумовлено рядом причин. Найбільш поширеною причиною була відсутність державної фінансової та законодавчої підтримки, національних стратегій з лікування туберкульозу, недостатнє сприяння лікуванню, епідемія ВІЛ-інфекції в Африці, погіршення соціально-економічних умов у країнах Східної Європи. У 1992 р. лише в 15 країнах світу були національні програми боротьби з туберкульозом. З урахуванням негативного досвіду впровадження в широку практику найефективнішого протитуберкульозного препарату рифампіцину (мультирезистентність з’явилась і зросла тільки в країнах, де його широко застосовували) наукові та фінансові зусилля світової громадськості для подолання загрозливої ситуації щодо туберкульозу були спрямовані не на розробку нових ліків, а на заходи, спрямовані на розрив ланцюга передачі інфекції — виявлення заразних форм захворювання та їх ефективне лікування шляхом забезпечення регулярного прийому протитуберкульозних препаратів (Raviglione M.C., 2003).
Зважаючи на це, Всесвітня організація охорони здоров’я (ВООЗ) у 1993 р. оголосила глобальну небезпеку з туберкульозу. За ініціативою ВООЗ у 1993 р. була розроблена стратегія контролю туберкульозу, яка гарантує найкращий спосіб застосування протитуберкульозних препаратів, що існують — короткострокове лікування під прямим наглядом — DOTS (Directly Observed Treatment Short-course, що означає «суворо контрольований короткий курс антимікобактеріальної терапії») (Iseman M.D., 2002; Raviglione M.C., 2003; World Health Organization, 2003).
Стратегія DOTS складається з 5 компонентів:
1. Державна підтримка контролю і нагляду за туберкульозом (уряд країни має підтримувати стратегію DOTS та фінансувати її, залучаючи неурядові організації. Для цього необхідна програма уряду щодо впровадження DOTS та навчання медичних працівників з питань реалізації стратегії).
2. Виявлення випадків захворювання на туберкульоз за зверненням пацієнта за допомоогою методу мікроскопії мазка.
3. Лікування хворих на туберкульоз (безпосереднє спостереження за проведенням стандартизованого короткого курсу лікування).
4. Регулярне безперервне постачання протитуберкульозних препаратів гарантованої якості через ефективну систему їх закупівлі.
5. Моніторинг та оцінка результатів лікування (стандартна система реєстрації та звітності, що базується на квартальному когортному аналізі).
П’ять компонентів DOTS-стратегії спрямовані на досягнення такої мети: виявлення 70% бацилярних форм туберкульозу (серед усіх форм туберкульозу) і досягнення припинення бактеріовиділення у 85% хворих, що пройшли повний курс хіміотерапії (World Health Organization, 2003). Ці показники є загальними для інфекційних хвороб. Згідно з законами виникнення епідемії інфекційних захворювань, якщо виявляти не менше 70% найнебезпечніших хворих, які виділяють збудник хвороби в навколишнє середовище, серед усіх, хто захворів, виліковувати не менше 85%, то ланцюг передачі інфекції буде перервано, що призведе до зниження захворюваності (World Health Organization, 2003).
DOTS-стратегія охоплює всі напрямки боротьби з туберкульозом і в цілому є досконалою. Недоліки починають проявлятися тільки при впровадженні фондів, передбачених для реалізації кожного з компонентів цієї стратегії, що прямо залежать від фінансових можливостей країни.
Оскільки DOTS-стратегія була запропонована для найбідніших країн, у яких взагалі була відсутня протитуберкульозна служба, а фінансування в галузі медицини вкрай недостатнє, то були розроблені найбільш економічні заходи щодо кожного її компонента, які дозволяють зупинити епідемію туберкульозу та контролювати рівень захворюваності в країні.
Наприклад, компонент, який стосується виявлення та діагностики захворювання. Основний метод виявлення і діагностики туберкульозу — мікроскопія мазка мокротиння у хворих із симптомами респіраторних захворювань як найдешевший і найпростіший метод, який дозволяє виявляти найнебезпечніші джерела інфекції. Однак мікроскопія мазка — це малочутливий метод (щоб виявити збудник туберкульозу МБТ методом мікроскопії, його кількість в 1 мл досліджуваного матеріалу повинна бути дуже великою — 105 мікроорганізмів) і технічно громіздкий. Більше того, цей метод дозволяє виявляти запущені випадки хвороби і мало придатний для діагностики туберкульозу у ВІЛ-інфікованих і дітей, оскільки вони рідко хворіють на легеневі форми туберкульозу із бактеріовиділенням.
Згідно з DOTS-стратегією цей компонент не передбачає рентгенівського дослідження, оскільки це малочутливий і дорогий метод і дозволяє виявити 0,3–0,5 випадка туберкульозу на 1000 осіб при масовому обстеженні. Однак його чутливість у 10 разів підвищується при обстеженні окремих контингентів населення — осіб, які мали безпосередній контакт із хворим на туберкульоз, бездомних, біженців, ВІЛ-інфікованих, хворих із набутим імунодефіцитом внаслідок тяжких соматичних захворювань тощо. Перевагою рентгенівського обстеження легень є те, що воно дозволяє виключити туберкульоз у разі відсутності змін у легенях або припустити його наявність при невеликих змінах у легенях у осіб без респіраторних симптомів (на ранніх стадіях туберкульозного процесу, коли бактеріовиділення ще відсутнє).
Економічний варіант виявлення і діагностики туберкульозу згідно з DOTS-стратегією не передбачає посів мокротиння, що потребує додаткових фінансових витрат. Це негативно впливає на якість та ефективність діагностики і лікування туберкульозу, тому що цей метод у 100 разів чутливіший за метод мікроскопії, дозволяє ідентифікувати збудника захворювання і визначити його чутливість до антибактеріальних препаратів.
Компонент DOTS-стратегії, який стосується лікування, також передбачає найбільш економічні режими терапії, недостатньо ефективні для лікування при поширених формах туберкульозу. Проте цей компонент досить органічно поєднаний з діагностикою туберкульозу та моніторингом результатів лікування, які не передбачають рентгенівського дослідження та урахування ефективності лікування за показником загоєння каверн. Через економію коштів не передбачені контрольні рентгенівські дослідження, що негативно вплине на результати лікування, оскільки фахівці не матимуть інформації про наявність каверн у легенях як на початку, так і в кінці лікування. На початку терапії лікар не може передбачити ефективність економічного режиму хіміотерапії, тому що не має уявлення про поширеність туберкульозного процесу. Корекція лікування буде проводитися тільки через 3–4 міс за умови відсутності ефекту за даними мікроскопії мазка мокротиння. У хворих із незагоєними кавернами, які успішно пройшли основний курс хіміотерапії, загострення туберкульозу відбувається в 4,5 разу частіше, ніж у пацієнтів із загоєними кавернами.
За даними Інституту фтизіатрії і пульмонології ім. Ф.Г. Яновського АМН України, отриманих у процесі дослідження ефективності DOTS-режимів, у 80,3% пацієнтів із вперше діагностованим туберкульозом із бактеріовиділенням не змогли застосувати економічний режим DOTS, який передбачав призначення 4 препаратів протягом 2–3 міс з подальшим переходом на 2–3 препарати ще протягом 3–4 міс (Петренко В.М., Литвиненко Н.А., 2005). Причинами зміни режиму хіміотерапії на більш інтенсивний було:
• продовження бактеріовиділення більше ніж 3 міс або відновлення бактеріовиділення після переходу на 3- або 2-компонентний режим хіміотерапії;
• визначення первинної резистентності до протитуберкульозних препаратів першого ряду;
• тривале незагоювання каверн;
• погана переносимість протитуберкульозних препаратів першого ряду.
Однак така низька ефективність економічного DOTS-режиму не характеризує ситуацію в Україні, оскільки в Інституті фтизіатрії і пульмонології лікують пацієнтів з тяжкими поширеними формами туберкульозу, яким необхідна 5-компонентна терапія з самого початку.
В загальній популяції хворих на туберкульоз буде більше пацієнтів з обмеженими формами захворювання, у яких економічний DOTS-режим буде високоефективним.
Економічний варіант DOTS-стратегії не передбачає стаціонарного лікування хворих на туберкульоз або обмежує термін перебування в стаціонарі інтенсивною фазою. Результати досліджень в Інституті фтизіатрії і пульмонології, свідчать, що тривалість стаціонарного етапу лікування впливає як на безпосередні, так і на віддалені результати лікування хворих на туберкульоз. Серед хворих, які довше перебували у стаціонарі, більше осіб, які вилікувались від туберкульозу як у безпосередній, так і у віддалений період. Так, середня тривалість стаціонарного етапу лікування у пацієнтів, які вилікувались від туберкульозу, становила 4,2 міс, а у хворих, у яких лікування виявилося неефективним, — 2,1 міс (Черенько С.О. та співавт., 2004).
Звичайно, такі результати значною мірою пов’язані з тим, що на сьогодні в Україні не створені умови для контрольованого лікування в амбулаторних умовах. Однак, зважаючи на соціальну структуру хворих на туберкульоз в Україні (у 2004 р. 42,9% хворих на туберкульоз становили непрацюючі особи працездатного віку, 13% —пенсіонери, 2,4% — бомжі), лікування в умовах стаціонару виконує не тільки медичні, а й соціальні функції, оскільки хворих забезпечують житлом та харчуванням (Порівняльні дані про розповсюдженість туберкульозу та ефективність діяльності протитуберкульозних закладів України за 1994 та 2004 р., 2004). Крім того, серед хворих на туберкульоз багато осіб, які зловживають алкоголем. Перебування в стаціонарі під контролем медичних працівників перешкоджає побутовому пияцтву і дає змогу вилікувати туберкульоз у такого складного щодо комплаєнтності контингенту. У Росії, де DOTS-стратегію впроваджують у 5 областях, понад 40% ліжко-місць в протитуберкульозних закладах виконують соціальні функцію (World Health Organization, 2002).
DOTS-стратегія не передбачає профілактики туберкульозу (первинної та повторної вакцинації) та лікування осіб з латентною туберкульозною інфекцією в групах ризику (які мають контакт з бактеріовиділювачами та діти, інфіковані МБТ). Ці заходи в країнах з високою захворюваністю на туберкульоз, до яких належить й Україна, є дуже важливими.
В Україні проводиться первинна і вторинна профілактика туберкульозу, що дає високі позитивні результати. Так, захворюваність на туберкульоз серед дітей невисока (не перевищує 10 на 100 тис. дитячого населення протягом багатьох років, в 2004 р. становила 9,3), фіксують лише поодинокі випадки смертності (протягом останніх 5 років — 2–11 випадків в абсолютних числах, в 2004 р. — 4).
Ігнорування проблеми туберкульозу у дітей на світовому рівні було звичайним явищем. Оскільки кількість бацилярних форм туберкульозу була невеликою, показники захворюваності приєднували до загальних. У більшості країн не вели статистики щодо епідеміологічних показників туберкульозу у дітей. Це відбувалося насамперед тому, що випадки захворювання на туберкульоз серед дітей, які можна діагностувати мікроскопічно, виникають дуже рідко, що значно ускладнює підтвердження діагнозу. Крім того, діти не були суб’єктами у програмах контролю над туберкульозом, тому що не становили джерела інфекції для оточуючих. Фахівці також довіряли вакцині БЦЖ, яка в більшості випадків давала змогу запобігти виникненню тяжких форм туберкульозу (Starke J.R., 2002). Важливою причиною було також і те, що педіатри не приділяли уваги туберкульозу навіть у регіонах з високою захворюваністю. Їх ніколи не залучали до складання програм контролю над туберкульозом. Наукові розробки з цієї проблеми занепали через відсутність до них інтересу дослідників і спонсорів. Крім того, довго існувала догма, що єдиний спосіб попередження туберкульозу у дітей — це лікування й попередження туберкульозу у дорослих.
До появи DOTS-стратегії було важко виділити кошти на вирішення проблеми туберкульозу у дітей. Нові підходи до лікування туберкульозу надають значно більші можливості допомогти дітям. DOTS — це не тільки лікування під безпосереднім наглядом, нова стратегія, спрямована на допомогу й підтримку хворого на туберкульоз. Профілактика туберкульозу у дітей повинна набути пріоритетного значення в DOTS-стратегії (Starke J.R., 2002).
В Україні завдяки розвиненій протитуберкульозній службі відзначають велику різницю між захворюваністю на туберкульоз у дорослих та дітей та зниженням захворюваності серед дітей (рисунок). Захворюваність серед дітей знизилась із 240 на 100 тис. дитячого населення у 1955 р. до 4,6 у 1989–1991 рр. Проте вона почала повільно підвищуватись і досягла у 2004 р. 9,3. Захворюваність на туберкульоз серед дорослих також знизилась із 240 на 100 тис. населення у 1995 р. до 31,8 у 1988 р., а згодом почала швидко підвищуватись і у 2004 р. досягла 80,9. Однак досить велику різницю між показниками захворюваності у дорослих і дітей виявляли вже з середини 60-х років ХХ століття, коли почали широко використовувати вакцину БЦЖ в ін’єкційній формі (до того застосовували перорально), створена мережа дитячих протитуберкульозних санаторіїв, в яких проводили лікування як активних форм туберкульозу, так і латентної інфекції. На даний час вдається утримувати значну різницю між показниками захворюваності серед дорослих та дітей (яка підвищується з середини 90-х років ХХ століття) тільки завдяки налагодженій системі первинної та вторинної профілактики туберкульозної інфекції.
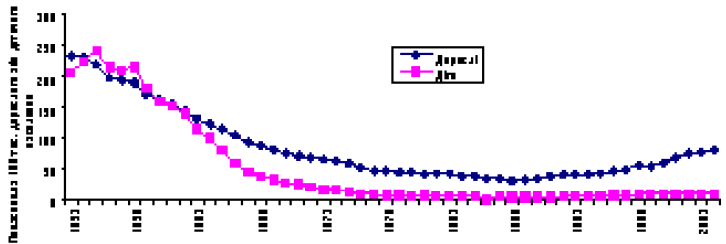
Рисунок. Динаміка захворюваності на туберкульоз дорослого та дитячого населення України
Протягом 20 років ВООЗ рекомендувала проводити хіміопрофілактику ізоніазидом дітям віком до 5 років, які контактують із бацилярними хворими. Проте таких заходів рідко вживали в країнах, що розвивались, де вони могли дати значний результат. Такий підхід можна застосовувати навіть за умови відсутності діагностичних тестів у регіоні. Тобто дітям, які контактують із хворими і мають симптоми туберкульозу, необхідно призначати обстеження на більш високому рівні. Дітям без симптомів туберкульозу можна застосовувати хіміопрофілактику ізоніазидом. Цей розділ контролю над туберкульозом є основою для плідних наукових досліджень і розробок (Starke J.R., 2002).
Отже, від обсягу фінансових витрат на медицину залежить обсяг впровадження компонентів DOTS-стратегії, які стосуються насамперед виявлення, діагностики, лікування, профілактики та моніторингу. Адаптація національних програм до DOTS-стратегії полягає в урахуванні фінансових можливостей країни, національних та соціальних особливостей країни та об’єктивних медичних факторів. Останні стосуються мікробіологічних ознак збудника туберкульозу, які визначають його вірулентність, патогенність та чутливість до протитуберкульозних препаратів (в різних країнах поширені різні штами МБТ). Ці характеристики МБТ прямо впливають на перебіг туберкульозу, визначаючи його тяжкість, поширеність, схильність до прогресування і таким чином впливають на ефективність лікування.
З 1994 р. DOTS-стратегію почали впроваджувати в багатьох країнах світу і в 2000 р. її прийняли у 148 країнах (у тому числі у 22 країнах з найвищою захворюваністю на туберкульоз), у яких зареєстровано 80% усіх випадків туберкульозу. Це сприяло значному прогресу в лікуванні туберкульозу, але значно меншому у виявленні бацилярних форм туберкульозу. Успішне лікування в країнах, що запровадили стратегію DOTS, стабільно високе (виліковують понад 80% пацієнтів), тоді як у країнах, де DOTS не впроваджена, — 50% хворих (World Health Organization, 2000).
З 1995 по 2000 р. виявлення бацилярних форм туберкульозу збільшилось з 11 до 27%. Мети DOTS-стратегії (виліковування 85% бактеріовиділювачів) вже досягнуто в Перу, де захворюваність на туберкульоз знижується на 6,5% на рік. В 2005 р. зниження захворюваності очікується у В’єтнамі, який належить до 22 країн із найвищим рівнем захворюваності. Значних успіхів у лікуванні туберкульозу завдяки DOTS-стратегії досягли Індія і Китай, де виліковують понад 90% бактеріовиділювачів (World Health Organization, 2000; Raviglione M.C., 2003).
На жаль, в інших країнах світу з найвищою захворюваністю на туберкульоз успіхів у контролі над туберкульозом досягають повільніше. Основними причинами цього є відсутність державної підтримки, недостатність фінансових і людських ресурсів, недостатня кількість протитуберкульозних препаратів, значні організаційні недоліки, епідемія ВІЛ-інфекції та підвищення мультирезистентності збудника туберкульозу, а також об’єктивні причини, пов’язані з виявленням, діагностикою і лікуванням туберкульозу.
Оскільки всі 5 компонентів DOTS-стратегії є об’єктивними складовими програми контролю інфекційного захворювання, вони не є чимось новим для української протитуберкульозної служби, яку почали створювати ще в післявоєнні роки й остаточно сформували в 60-х роках ХХ сторіччя, з появою протитуберкульозних препаратів. Схожі принципи були закладені в нормативних документах туберкульозної служби за часів СРСР, що сприяло значним успіхам у боротьбі з туберкульозом. Захворюваність на туберкульоз знизилась зі 155 випадків на 100 тис. населення в 1961 р. до 32 випадків на 100 тис. населення в 1991 р. (Фещенко Ю.І., Мельник В.М., 1997; Порівняльні дані про розповсюдженість туберкульозу та ефективність діяльності протитуберкульозних закладів України за 1994 та 2004 р., 2004).
Після здобуття незалежності Україна потрапила в економічну кризу, яка призвела до збідніння населення, порушення сфери виробництва, погіршення функціонування організацій охорони здоров’я і значного підвищення захворюваності на туберкульоз. З 1991 по 2004 р. захворюваність на туберкульоз в Україні підвищилась з 32 до 80,9 на 100 тис. населення (Порівняльні дані про розповсюдженість туберкульозу та ефективність діяльності протитуберкульозних закладів України за 1994 та 2004 р., 2004).
Крім соціальних факторів, причиною зростання захворюваності на туберкульоз і зниження ефективності його лікування було також те, що не реалізувалися 3 з 5 компонентів стратегії: державна підтримка контролю і нагляду за туберкульозом (призвело до відсутності фінансування на придбання протитуберкульозних препаратів, планомірну роботу протитуберкульозних закладів); виявлення і діагностика випадків захворювання на туберкульоз (внаслідок відсутності фінансування цих заходів), лікування пацієнтів з туберкульозом (Україна була забезпечена протитуберкульозними препаратами менше ніж на 30%).
З 1990 р. в Україні широко застосовували короткострокові режими хіміотерапії; у 1996 р. вимога щодо їх застосування затверджена наказом МОЗ України № 233, яким передбачені також міжнародна форма оцінки результатів лікування та когортний аналіз. Але ці заходи не мали фінансового забезпечення.
Для виходу з цієї ситуації була розроблена і затверджена Указом Президента України від 20 серпня 2001 р. Національна Програма боротьби із захворюванням на туберкульоз на 2002–2005 роки», у якій одним із державних завдань була реорганізація туберкульозної служби. В цілому програма була побудована на принципах DOTS-стратегії, але її виконання ускладнювалося також відсутністю достатнього фінансового забезпечення, а моніторинг її виконання не передбачений.
Все ж заходи боротьби з туберкульозом, які проводились в межах національної програми у 2002–2005 рр., та забезпечення усіх хворих на туберкульоз протитуберкульозними препаратами першого ряду в повному обсязі зумовили значні позитивні зрушення. Ефективність лікування туберкульозу в Україні є досить високою. Однак ефективність лікування туберкульозу оцінюють не тільки за показником припинення бактеріовиділення, як передбачено DOTS-стратегією, але й за показником загоєння каверн, яке відбувається через 4–5 міс хіміотерапії. Пацієнт з туберкульозом вважається вилікуваним, якщо в нього припиняється бактеріовиділення та загоюються каверни. Тому в Україні застосовують більш інтенсивні режими хіміотерапії, щоб досягти вилікування (як правило, інтенсивну фазу з 4-компонентним режимом подовжують на 1–2 міс, і в підтримувальну фазу рідко застосовують 2 препарати). У 2004 р. показник припинення бактеріовиділення в цілому в Україні досяг 89,5% (перевищує встановлений критерій ВООЗ), а загоєння каверн — 77,9% (Порівняльні дані про розповсюдженість туберкульозу та ефективність діяльності протитуберкульозних закладів України за 1994 та 2004 р., 2004).
Аналіз епідеміологічної ситуації у світі дозволяє очікувати прогрес щодо виявлення бацилярних форм туберкульозу в найближчі 2 роки, очікується, що у 2005 р. цей показник становитиме 40%. Однак експерти ВООЗ вважають, що лише географічне поширення DOTS-стратегії ніколи не забезпечить 70% виявлення бацилярних форм. Необхідно постійно удосконалювати методи виявлення туберкульозу в тих країнах, де вже впроваджена DOTS, шляхом застосування нових технологій діагностики й застосування нових інструментів у лікуванні туберкульозу (Dye C. et al., 2003).
У цілому можливості виявлення й діагностики туберкульозу відстають від можливостей його лікування. У результаті цього лікування туберкульозу в більшості країн починають зі значною затримкою й багато джерел інфекції залишаються невиявленими. Туберкульоз виявляють у хворих з наявністю симптомів, які проявилися понад місяць, що призводить до зараження здорових осіб і поширення інфекції (Perkins M.D., 2002). Існують дві причини такого становища.
Одна з них — це застосування мікроскопії мазка мокротиння як основного діагностичного інструменту виявлення туберкульозу. Мікроскопія мазка — це малочутливий і технічно громіздкий метод, який дозволяє виявляти запущені форми хвороби, потребує кількох візитів у клініку найнебезпечніших виділювачів інфекції.
Отже, для виявлення туберкульозу необхідний більш чутливий і простий тест. Для його розробки організована програма Tuberculosis Diagnostics Initiative (http://www.who.int/tdr/diseases/tb/tbdi.htm) за підтримки Світового Банку та Special Programme for Research and Training in Tropical Diseases ВООЗ.
Друга причина відставання діагностики туберкульозу — це те, що якісному лікуванню приділяють значно більше уваги, ніж якісній діагностиці. З одного боку, це зумовлено тим, що є термінова необхідність підвищувати ефективність лікування, а з іншого — тим, що думка медичної спільноти значною мірою формується клініцистами, які приділяють медикаментозному лікуванню значно більше уваги в питанні контролю над туберкульозом.
На жаль, у багатьох країнах діагностична туберкульозна служба знаходиться в незадовільному стані. За даними перевірки стану мікробіологічних лабораторій, лабораторії перевантажені, у них не дотримуються необхідні технології, що зумовлено недостатнім навчанням співробітників, а також використанням нестандартних реактивів і застарілого чи зіпсованого оснащення. Поганий стан лабораторій призводить до відхилень від стандартних методик і допущення помилок у лабораторних циклах (Perkins M.D., 2002).
Для подолання цих проблем необхідно розробити простий, швидкий і надійний тест, який зміг би замінити мікроскопію мазка у мережі туберкульозних лабораторій. Однак спроби покращити виявлення туберкульозу шляхом впровадження нових технологій у лабораторії, які погано функціонують, не призведуть до успіху, а навпаки — до додаткових медичних помилок і дискредитації дійсно хороших тестів.
Інтеграція нових діагностичних тестів у рутинну медичну практику потребує значних витрат коштів. Тому до впровадження нових діагностичних тестів важливо визначити, якою мірою дотримується стратегія контролю туберкульозу й у якій мірі стандартизовані рутинні лабораторні методи виявлення туберкульозу. Насамперед, таку роботу необхідно провести в країнах із високою захворюваністю на туберкульоз. Усі її етапи вже визначені й будуть здійснюватись за підтримки Tuberculosis Diagnostics Initiative (Dye C. et al., 2003).
Перший крок — це надання мікробіологічним лабораторіям необхідної фінансової, технічної та освітньої допомоги і забезпечення постійного контролю якості рутинної діагностики туберкульозу.
Другий крок — це створення нових лабораторій у країнах із високою захворюваністю на туберкульоз за стандартними методиками рутинної діагностики туберкульозу.
Третій крок — це розробка й визначення вартості/ефективності нових діагностичних тестів, які б змогли замінити рутинну діагностику в умовах лабораторій, які працюють за стандартними технологіями у співпраці із клініцистами (Dye C. et al., 2003).
Успіх сучасної стратегії контролю над туберкульозом цілком залежить від виявлення туберкульозу на ранніх стадіях. Щоб досягти поставленої мети у виявленні туберкульозу, фінансування лабораторій і швидка розробка нових діагностичних тестів повинні стати пріоритетними завданнями.
Для подолання епідемії туберкульозу пріоритетним завданням в країнах з високою захворюваністю на туберкульоз, до яких належить і Україна, необхідно постійно удосконалювати національні програми боротьби з туберкульозом, які повинні обов’язково базуватися на компонентах DOTS-стратегії з урахуванням уже досягнутих результатів. В Україні, де досягнута мета DOTS-стратегії щодо ефективності лікування туберкульозу, в наступні роки зусилля уряду, науковців, медичних працівників, політичних та громадських організацій повинні бути спрямовані на своєчасну та якісну діагностику туберкульозу та соціальні заходи для підвищення рівня життя та пропагування у населення здорового способу життя.
Крім того, в Україні, де зростає поширеність ВІЛ-інфекції, пріоритетом національної програми боротьби з туберкульозом має бути організація тісної співпраці між системою контролю туберкульозу та ВІЛ/СНІДу на національному, обласному та районному комунально-громадському рівні в галузі освіти, просвіти та підтримки.
Такий розвиток та удосконалення національної програми можливий за умови забезпечення усім хворим на туберкульоз доступу до ефективної допомоги. Для цього в країні має постійно працювати стратегія, заснована на політичній волі країни, яка спрямована на забезпечення достатніх кадрових ресурсів, безперервного тривалого фінансового забезпечення для зупинення епідемії туберкульозу. Має виконуватись програма лікування туберкульозу та його розширена профілактика на основі DOTS-стратегії в усіх службах громадської охорони здоров’я відповідно до прийнятих на щорічній основі стандартів. Слід створити систему моніторингу та оцінки виконання національної програми для боротьби з туберкульозом та профілактики виникнення штамів, резистентних до медикаментозної терапії, та ефективного ведення хворих на мультирезистентний туберкульоз. Необхідно постійно розвивати партнерські зв’язки усіх заінтересованих сторін, включаючи уряд та неурядові організації, приватні компанії, промислові підприємства, установи соціального страхування. Необхідно постійно підвищувати свідомість і мобілізувати громадськість з метою провадження діяльності щодо профілактики та лікування туберкульозу (Всемирная организация здравоохранения, 2002).
Координація ефективних дій щодо боротьби з туберкульозом повинна проводитись за постійної міжнародної співпраці з метою створення єдиного руху проти туберкульозу та за покращання здоров’я усіх членів суспільства. Боротьба з туберкульозом — глобальна проблема, що потребує глобальних дій. Епідемія туберкульозу поширюватиметься все більше, якщо не об’єднати усі ресурси всередині кожної країни та в усьому світі (World Health Organization, 2000).
Завдяки сприянню боротьбі з туберкульозом на міжнародному рівні для виконання рекомендацій глобальної стратегії DOTS розроблено план її поширення в Європі (Всемирная организация здравоохранения, 2002). Європейські держави підтримали цей план на 52-й сесії Європейського регіонального комітету ВООЗ у вересні 2002 р. Європейський план — своєрідний зразок і керівництво для мобілізації та координації людських і фінансових ресурсів, необхідних для встановлення належного контролю над туберкульозом і боротьби з ним у регіоні як складової глобальних цілей ВООЗ щодо боротьби з туберкульозом.
ЛІТЕРАТУРА
- Всемирная организация здравоохранения (2002) План расширения программы DOTS для борьбы с туберкулезом в Европейском регионе ВОЗ 2002–2006 гг. Европейское региональное бюро ВОЗ, Копенгаген, 50 c. (http://www.euro.who.int/document/E77477R.pdf).
- Петренко В.М., Литвиненко Н.А. (2005) Эффективность применения в клинике краткосрочного контролируемого лечения (DOTS) больных с впервые выявленным деструктивным туберкулезом легких. Пробл. туберкулеза, 3: 16–20.
- Порівняльні дані про розповсюдженість туберкульозу та ефективність діяльності протитуберкульозних закладів України за 1994 та 2004 р. (2004) Інститут фтизіатрії і пульмонології ім. Ф.Г. Яновського АМН України, Київ, 60 с.
- Фещенко Ю.І., Мельник В.М. (1997) Епідеміологічна ситуація з туберкульозу в Україні та діяльність протитуберкульозної служби. Укр. пульмонол. журн., 3: 5–9.
- Хоменко А.Г. (ред.) (1980) Химиотерапия туберкулеза легких. Медицина, Москва, 320 с.
- Черенько С.О., Бегоулев О.Є., Погрєбна М.В. (2004) Безпосередні і віддалені результати лікування хворих на туберкульоз легень, які лікувались у стаціонарі протитуберкульозного диспансеру протягом одного року. Укр. пульмонол. журн., 2: 55–60.
- Dye C., Espinal M.A., Watt C.J., Mbiaga C., Williams B.G. (2002) Worldwide incidence of multidrug-resistant tuberculosis. J. Infect. Dis., 185(8): 1197–1202.
- Dye C., Watt C.J., Bleed D.M., Williams B.G. (2003) What is the limit to case detection under the DOTS strategy for tuberculosis control? Tuberculosis (Edinb.), 83(1–3): 35–43.
- Espinal M.A., Kim S.J., Suarez P.G., Kam K.M., Khomenko A.G., Migliori G.B., Baez J., Kochi A., Dye C., Raviglione M.C. (2000) Standard short-course chemotherapy for drug-resistant tuberculosis: treatment outcomes in 6 countries. JAMA, 283(19): 2537–2545.
- Grosset J. (1985) Bacteriological bases of short-course chemotherapy. Rev. Ig. Bacteriol. Virusol. Parazitol. Epidemiol. Pneumoftiziol. Pneumoftiziol., 34(2): 103–107.
- Iseman M.D. (2002) Tuberculosis therapy: past, present and future. Eur. Respir. J. Suppl., 36: 87s–94s.
- Mitchison D.A. (1985) Mechanism of drug action in short-course of chemotherapy. Bull. Int. Union Tuberc. Lung Dis., 65: 30–37.
- Perkins M.D. (2002) Progress and pitfalls in TB diagnostics development. In: Abstract book of the 4th World Congress on Tuberculosis, June 3–5, 2002, Washington, DC, USA, pp. 24–25.
- Raviglione M.C. (2003) The TB epidemic from 1992 to 2002. Tuberculosis (Edinb.), 83(1–3): 4–14.
- Riley L.W. (1993) Drug resistant tuberculosis. Clin. Infect. Dis., 17(Suppl. 2): S442–446.
- Sbarbaro J.A. (1995) Tuberculosis in the 1990s. Epidemiology and therapeutic challenge. Chest, 108(2 Suppl.): 58S–62S.
- Sbarbaro J.A., Iseman M.D., Crowle A.J. (1992) The combined effect of rifampin and pyrazinamide within the human macrophages. Am. Rev. Respir. Dis., 146 (6): 1448–1451.
- Snider D.E. Jr, Cohn D.L., Davidson P.T., Hershfield E.S., Smith M.H., Sutton F.D. Jr (1985) Standard therapy for tuberculosis 1985. Chest, 87(Suppl. 2): 117S–124S.
- Starke J.R. (2002) Childhood tuberculosis: ending the neglect. Int. J. Tuberc. Lung Dis., 6(5): 373–374.
- World Health Organization (1997) Treatment of tuberculosis: guidelines for national programmes. WHO, Geneva, 220 p.
- World Health Organization (2000) Global tuberculosis control. WHO report 2000. WHO, Geneva, 33 p.
- World Health Organization (2002) WHO project «Cost-effective TB control in the Russian Federation». Report of the second project workshop, St Petersburg, Russia, 18–20 June, 2002. WHO, Geneva, 108 p.
- World Health Organization (2003) Treatment of tuberculosis: guidelines for national programmes (Third edition). WHO, Geneva, 108 p (http://www.who.int/tb/publications/cds_tb_2003_313/en/).
Резюме. Освещены основные исторические этапы борьбы человечества с туберкулезом и достижения на этом пути. В свете разработанной по инициативе Всемирной организации здравоохранения глобальной стратегии контроля над туберкулезом (DOTS) обсуждаются актуальные проблемы преодоления заболевания в мире в целом и в Украине в частности.
Ключевые слова: туберкулез, диагностика, профилактика, лечение, химиотерапия, мультирезистентность, стратегия DOTS
Summary. Basic historical stages of mankind struggle against tuberculosis and achievements on this way are reflected. An actual problems on the overcoming the disease throughout the world in general and in Ukraine particularly are discussed in the light of the World Health Organization global tuberculosis control strategy (DOTS).
Key words: tuberculosis, diagnostics, prophylaxis, treatment, chemotherapy, multiresistance, DOTS strategy





