ВСТУП
Сучасний рівень знань дозволяє говорити про залучення системної імунозапальної активації до патогенезу низки серцево-судинних захворювань, які традиційно не пов’язані з запаленням (Mehra V.C. et al., 2005; Vasan R.S., 2006). За останні роки значну увагу науковців прикуто до з’ясування патофізіологічної ролі цитокінів у цих процесах. При цьому об’єктом дослідження в основному є експериментальна та клінічна хронічна серцева недостатність (ХСН) різної етіології (Feldman A.M. et al., 2000; Conraads V.M. et al., 2002). Існуючий інтерес до розуміння ролі цитокінів обумовлений спостереженнями про те, що більшість аспектів ХСН можна пояснити відомими біологічними ефектами цих молекул, що навіть привело до появи так званої цитокінової гіпотези ХСН (Blankenberg S., Yusuf S., 2006). Прозапальні цитокіни здатні модулювати кардіоваскулярну функцію через низку механізмів, результатом яких є гіпертрофія, дилатація лівого шлуночка серця, дисфункція міокарда, набряк легень, ендотеліальна дисфункція та кардіоміопатія (Mann D.L., 2001; Tabet J.Y. et al., 2002). Тому гіперпродукція цитокінів, на кшталт продукції нейрогормонів, є одним із ймовірних біохімічних механізмів, відповідальних за розвиток симптомів у пацієнтів із ХСН (Niebauer J., 2000; Mann D.L., 2002). В той же час є незначна кількість повідомлень щодо вивчення регуляції продукції цитокінів у пацієнтів з артеріальною гіпертензією (АГ). Тому метою нашого клінічного дослідження було вивчення плазматичного вмісту прозапального цитокіну — фактора некрозу пухлини альфа (ФНП-α) та його розчинного рецептора 1-го типу (рФНП-Р1) у пацієнтів з АГ.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Обстежено 78 пацієнтів з АГ, яким було проведено загальноклінічне та лабораторно-інструментальне обстеження. До групи контролю увійшли 22 практично здорові особи. «Офісний» артеріальний тиск (АТ) вимірювали в ранкові години в положенні пацієнта сидячи у стані спокою тричі з інтервалом 2 хв. Аналізували середнє арифметичне значення систолічного (САТ) та діастолічного АТ (ДАТ). Частоту серцевих скорочень (ЧСС) визначали одразу після другого вимірювання АТ. Верифікацію діагнозу, визначення стадії та ступеня АГ проведено згідно з критеріями, рекомендованими Українським товариством кардіологів (2004) та Європейським товариством з артеріальної гіпертензії/Європейським кардіологічним товариством (European Society of Hypertension/European Society of Cardiology Guidelines Committee, 2003). Визначення рівня ФНП-α та рФНП-Р1 у плазмі крові пацієнтів проводилося імуноферментним методом (ELISA/enzyme-linked immunosorbent assay) за допомогою наборів реагентів ProCon TNF-α («Протеиновый контур», Санкт-Петербург, Росія), sTNF-RI EASIA (BioSource Europe S.A., Belgium).
До дослідження не включали пацієнтів із вторинною АГ, супутньою онкопатологією, гострими та хронічними запальними захворюваннями та цукровим діабетом.
Статистичну обробку отриманих даних проведено стандартними методами варіаційної статистики з використанням пакету статистичних програм Statistica 6.0. Результати наведено як (M±m), де М — середнє значення показника, m — стандартна похибка. Достовірність розбіжностей між досліджуваними показниками визначалася за допомогою двовибіркового критерію Стьюдента. Для дослідження взаємозв’язку між показниками проведено кореляційний аналіз із розрахунком парних коефіцієнтів кореляцій Пірсона (r) та Спірмена (rs).
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Активність прозапальних цитокінів модулюється низкою факторів, серед яких розглядається значення такого фактора, як підвищення рівня АТ. Результати попередніх експериментальних та деяких клінічних досліджень свідчать про можливість підвищення продукції цитокінів під впливом біомеханічного стресу, який обумовлено високим АТ (Chae C.U. et al., 2001; Bautista L.E. et al., 2005; Mahmud A., Feely J., 2005). Підтвердженням цьому є результати, які отримано в нашому клінічному дослідженні пацієнтів із АГ (табл. 1).
| Показники | Контрольна група | Пацієнти із АГ |
|---|---|---|
| Вік (роки) | 46,50±1,01 | 54,51±1,07 |
| Тривалість АГ (роки) | – | 9,64±0,93 |
| ЧСС (уд./хв) | 72,36±0,54 | 80,32±1,26 |
| САТ (мм рт. ст.) | 121,09±0,37 | 175,65±2,59 |
| ДАТ (мм рт. ст.) | 80,82±0,36 | 105,87±1,35 |
| ФНП-α (пкг/мл) | 13,23±3,40 | 124,99±13,26 |
| рФНП-Р1 (нг/мл) | 1,20±0,60 | 2,12±0,08 |
| ФНП/рФНП-Р1 | 11,03±2,84 | 59,64±6,44 |
Як видно з представленої таблиці, пацієнти із АГ та здорові особи контрольної групи суттєво не відрізнялися за віком. Середні значення показників периферичної гемодинаміки пацієнтів достовірно перевищували показники контрольної групи (p<0,05 в усіх випадках).
Нами виявлено значне підвищення плазматичного рівня ФНП-α у гіпертензивних пацієнтів в порівнянні з практично здоровими особами (p=0,001). При високій концентрації продукція ФНП-α перевищує кількість ФНП-Р на поверхні клітин. Цей надлишок й циркулює в кровообігу, як показано в нашому дослідженні.
Вміст рФНП-Р1 в плазмі крові пацієнтів характеризувався достовірно вищим середнім значенням у порівнянні з контролем (p=0,032). Величина співвідношення ФНП/рФНП-Р1 була також більшою, що свідчить про високий ступінь запальної активності при АГ.
У зв’язку з тим, що існують експериментальні дані щодо взаємозв’язку між продукцією цитокінів та віком піддослідних тварин, нами проаналізовано рівень ФНП-α та його розчинного рецептора у пацієнтів з АГ різних вікових категорій (табл. 2). Хворих було поділено на квартилі: 1-й квартиль — пацієнти віком 25–49 років (n=20); 2-й квартиль — 50–54 роки (n=19); 3-й квартиль — 55–61 рік (n=20); 4-й квартиль — 62–71 рік (n=19).
| Показники | Квартилі (за віком, роки) | |||
|---|---|---|---|---|
| 25–49 | 50–54 | 55–61 | 62–71 | |
| Середній вік (роки) | 42,25±1,54 | 52,21±0,38 | 58,25±0,43 | 65,79±0,53 |
| Тривалість АГ (роки) | 6,20±1,51 | 9,74±1,91 | 9,40±1,61 | 13,43±2,14 |
| ЧСС (уд./хв) | 74,36±1,33 | 79,25±2,42 | 79,40±2,18 | 79,74±2,07 |
| САТ (мм рт. ст.) | 174,88±4,27 | 173,34±5,55 | 174,81±6,43 | 179,57±4,67 |
| ДАТ (мм рт. ст.) | 107,45±2,00 | 106,09±2,97 | 107,67±3,51 | 109,11±1,95 |
| ФНП-α (пкг/мл) | 113,11±28,88 | 133,23±25,05 | 123,38±24,37 | 130,95±29,31 |
| рФНП-Р1 (нг/мл) | 2,14±0,15 | 2,06±0,15 | 2,00±0,08 | 2,29±0,26 |
| ФНП/рФНП-Р1 | 53,69±13,99 | 64,67±10,78 | 63,15±12,85 | 63,08±14,41 |
Тривалість АГ була мінімальною у пацієнтів 1-го квартиля (p<0,05 в порівнянні з усіма іншими квартилями), практично не відрізнялася поміж собою у 2-му та 3-му квартилі (p=0,89) та характеризувалася максимальним середнім значенням у пацієнтів 4-го квартиля (p<0,05 в усіх випадках).
Величина ЧСС була найменшою також у пацієнтів 1-го квартиля, при приблизно однакових значеннях у пацієнтів старших вікових категорій (р>0,05 в усіх випадках). Суттєвих та достовірних розбіжностей рівня САТ та ДАТ у перших трьох квартилях не відзначено (р>0,05 в усіх випадках). В той час як у пацієнтів 4-го квартиля середній рівень АТ був незначно вищим.
Результати аналізу плазматичного вмісту ФНП-α свідчать про чітку тенденцію до його підвищення у 1-му (р=0,0009) та 2-му квартилі (р=0,00001) в порівнянні із здоровими особами (рис. 1). У пацієнтів 3-го квартиля відзначали зниження рівня цитокіну в порівнянні з попередніми квартилями (p>0,05 в обох випадках), який, однак, залишався вищим за рівень практично здорових осіб (р=0,00003). В подальшому у найстарших пацієнтів виявлено незначне підвищення ФНП-α (p>0,05 між групами пацієнтів із АГ; р=0,0001 порівняно із контрольною групою).

Слід зазначити, що при вивченні цитокінів необхідно брати до уваги той факт, що їх біоактивність залежить від концентрації самого цитокіна, концентрації відповідних рецепторів на поверхні клітин-мішеней, а також від наявності циркулюючих антагоністів (Conraads V.M. et al., 2002). У випадку з ФНП-α такими антагоністами є розчинні форми ФНП-Р, які утворюються шляхом відокремлення екстрацелюлярної частини активного рецептора від клітинної мембрани під впливом матриксної металопротеїнази — матрилізину (Nowak J. et al., 2002; Kassiri Z. et al., 2005). Існує два типи ФНП-α-активних рецепторів і відповідно розчинних форм рецепторів: рФНП-Р1 (рФНП-Р1) та рФНП-Р 2-го типу (рФНП-Р2). Оскільки основна активність ФНП-α реалізується за рахунок зв’язування з ФНП-Р1, нами обрано саме цей тип рецептора.
Ми дослідили динаміку змін рівня рФНП-Р1 залежно від віку пацієнтів із АГ, яка була схожа на динаміку ФНП-α (рис. 2).
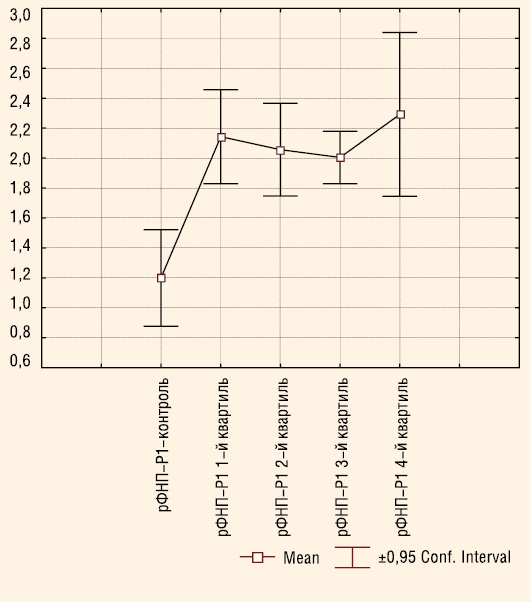
Плазматичний вміст рФНП-Р1 пацієнтів достовірно перевищував аналогічний показник здорових осіб (p<0,05 в усіх випадках). У наймолодших пацієнтів 1-го квартиля відзначено підвищення рФНП-Р1 з подальшим незначним зниженням у 2-му та 3-му квартилі та підвищенням у найстарших пацієнтів 4-го квартиля. Розбіжності у всіх випадках виявилися недостовірними (p>0,05).
Утворення розчинних форм ФНП-Р при високій концентрації ФНП-α розглядається, з одного боку, як механізм самозахисту. По-перше, зменшується кількість активних рецепторів на поверхні клітин. По-друге, рФНП-Р1 шляхом зв’язування з ФНП-α здатен швидко нейтралізувати цитотоксичну активність даного цитокіна (Conraads V.M. et al., 2002; Nowak J. et al., 2002). Підвищення плазматичного вмісту рФНП-Р1 у пацієнтів молодшого 1-го квартиля на початкових стадіях АГ може бути розцінено як адаптивна відповідь на підвищення активності ФНП-α. У подальшому у хворих 2-го квартиля відзначали імунозапальну гіперактивацію, на що вказувало зниження рівня рФНП-Р1 на фоні зростаючого ФНП-α та співвідношення ФНП-α/рФНП-Р1. Тобто продукція цитокіна перевищувала кількість його розчинних рецепторів, і такої концентрації рФНП-Р1 було недостатньо для інактивації ФНП-α. У пацієнтів 3-го квартиля з’ясовано зниження плазматичного вмісту ФНП-α, що вірогідно пояснюється або зв’язуванням частини цитокіна із своїми розчинними рецепторами, або дисрегуляцією його продукції. Зниження продукції може бути обумовлено фізіологічною втратою клітин-продуцентів ФНП-α з віком та/або патологічною втратою в результаті фіброзу, некрозу, апоптозу. Однак незважаючи на зменшення ФНП-α, рівень цитокінової активації продовжував бути високим, на що вказувала величина співвідношення ФНП-α/рФНП-Р1, яка суттєво не змінилася у порівнянні з 2-м квартилем.
Як вже згадувалося, високий плазматичний вміст РФНП-Р1 може в деяких випадках ефективно дезактивувати цитокін, що має сприятливе значення у контексті прогресування кардіальної патології. З іншого боку, комплекс «ФНП-α-ліганд — ФНП-α-рецептор» може відігравати роль резервуару повільного викиду біологічно активного ФНП-α у кровообіг, чим ймовірно і пояснюється підвищення плазматичного вмісту цитокіну та рФНП-Р1 у пацієнтів найстаршої вікової категорії при максимальному терміні перебігу АГ.
Поведений кореляційний аналіз виявив у 1-му квартилі наявність позитивного взаємозв’язку між віком пацієнтів та ЧСС (r=0,45; р=0,047); між тривалістю АГ та САТ (r=0,52; р=0,018); ДАТ (r=0,49; р=0,028). У пацієнтів 2-го квартиля відзначено позитивний зв’язок між тривалістю АГ та САТ (r=0,68; р=0,002); ДАТ (r=0,52; р=0,021); рФНП-Р1 (rs=0,48; р=0,038). Рівень САТ корелював з рФНП-Р1 (rs=0,51; р=0,026); ДАТ з ФНП-α (rs=0,47; р=0,044), рФНП-Р1 (rs=0,58; р=0,01). Встановлено взаємозв’язок між віком пацієнтів та САТ (r=0,45; р=0,045); між ЧСС та ФНП-α (rs=0,52; р=0,018) ФНП-α/рФНП-Р1 (r=0,46; р=0,042) у 3-му квартилі. У пацієнтів 4-го квартилю не виявлено достовірних кореляційних взаємозв’язків між показниками, які аналізувалися.
ВИСНОВКИ
Виявлене в нашому клінічному дослідженні підвищення циркулюючого рівня прозапального цитокіна ФНП-α та співвідношення ФНП/рФНП-Р1 свідчить про підвищення імунозапальної активності у пацієнтів з АГ. Продукція та біотоксичність ФНП-α може модулюватися не стільки віком пацієнтів, скільки наявністю, тривалістю, рівнем підвищення АТ та концентрацією його ендогенного інгібітора — рФНП-Р1 в комплексі. Уточнення механізмів імунозапальної відповіді при АГ відкриває нові перспективи терапевтичної стратегії, такої як застосування препаратів з антицитокіновим ефектом.
ЛІТЕРАТУРА
- Bautista L.E., Vera L.M., Arenas I.A., Gamarra G. (2005) Independent association between inflammatory markers (C-reactive protein, interleukin-6, and TNF-alpha) and essential hypertension. J. Hum. Hypertens., 19(2): 149–154.
- Blankenberg S., Yusuf S. (2006) The inflammatory hypothesis: any progress in risk stratification and therapeutic targets? Circulation, 114(15): 1557–1560.
- Chae C.U., Lee R.T., Rifai N., Ridker P.M. (2001) Blood pressure and inflammation in apparently healthy men. Hypertension, 38(3): 399–403.
- Conraads V.M., Bosmans J.M., Vrints C.J. (2002) Chronic heart failure: an example of a systemic chronic inflammatory disease resulting in cachexia. Int. J. Cardiol., 85(1): 33–49.
- European Society of Hypertension — European Society of Cardiology Guidelines Committee (2003) 2003 European Society of Hypertension-European Society of Cardiology guidelines for the management of arterial hypertension. J. Hypertens., 21(6): 1011–1053.
- Feldman A.M., Combes A., Wagner D., Kadakomi T., Kubota T., Li Y.Y., McTiernan C. (2000) The role of tumor necrosis factor in the pathophysiology of heart failure. J. Am. Coll. Cardiol., 35(3): 537–544.
- Kassiri Z., Oudit G.Y., Sanchez O., Dawood F., Mohammed F.F., Nuttall R.K., Edwards D.R., Liu P.P., Backx P.H., Khokha R. (2005) Combination of tumor necrosis factor-alpha ablation and matrix metalloproteinase inhibition prevents heart failure after pressure overload in tissue inhibitor of metalloproteinase-3 knock-out mice. Circ. Res., 97(4): 380–390.
- Mahmud A., Feely J. (2005) Arterial stiffness is related to systemic inflammation in essential hypertension. Hypertension, 46(5): 1118–1122.
- Mann D.L. (2001) Recent insights into the role of tumor necrosis factor in the failing heart. Heart Fail. Rev., 6(2): 71–80.
- Mann D.L. (2002) Inflammatory mediators and the failing heart: past, present, and the foreseeable future. Circ. Res., 91(11): 988–998.
- Mehra V.C., Ramgolam V.S., Bender J.R. (2005) Cytokines and cardiovascular disease. J. Leukoc. Biol., 78(4): 805–818.
- Niebauer J. (2000) Inflammatory mediators in heart failure. Int. J. Cardiol., 72(3): 209–213.
- Nowak J., Rozentryt P., Szewczyk M., Gierlotka M., Duszanska A., Szygula B., Wojnicz R., Hawranek M., Polonski L., Zembala M. (2002) Tumor necrosis factor receptors sTNF-RI and sTNF-RII in advanced chronic heart failure. Pol. Arch. Med. Wewn., 107(3): 223–229.
- Tabet J.Y., Lopes M.E., Champagne S., Su J.B., Merlet P., Hittinger L. (2002) Inflammation, cytokines and anti-inflammatory therapies in heart failure. Arch. Mal. Coeur Vaiss., 95(3): 204–212.
- Vasan R.S. (2006) Biomarkers of cardiovascular disease: molecular basis and practical considerations. Circulation, 113(19): 2335–2362.
МОДУЛЯЦИЯ АКТИВНОСТИ ФАКТОРА НЕКРОЗА ОПУХОЛИ АЛЬФА ЕГО РАСТВОРИМЫМ РЕЦЕПТОРОМ В ЗАВИСИМОСТИ ОТ ВОЗРАСТА ПАЦИЕНТОВ С АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ
Резюме. Провоспалительный цитокин — фактор некроза опухоли альфа (ФНО-a) — является медиатором кардиальной патологии. Растворимый рецептор ФНО-a 1-го типа (рФНО-Р1) — естественный антагонист ФНО-a, который способен угнетать его цитотоксическую активность. Целью нашего исследования было изучение плазматического уровня ФНО-a и рФНО-Р1 в зависимости от возраста пациентов с артериальной гипертензией (АГ). Обследовано 78 пациентов с АГ и 22 практически здоровых лица контрольной группы. Уровень цитокинов измеряли иммуноферментным методом. Установлено повышение содержания ФНО-a (124,99±13,26 пкг/мл) и рФНО-Р1 (2,12±0,08 нг/мл) у гипертензивных пациентов по сравнению с нормотензивными (13,23±3,40 пкг/мл; p=0,001 и 1,20±0,60 нг/мл; p=0,032 соответственно). Исследование показало изменение активности ФНО-a и рФНО-Р1 в зависимости от возраста пациентов, наличия, длительности и степени АГ. Полученные результаты свидетельствуют о вовлечении системного иммуновоспалительного ответа в патогенез АГ. Циркулирующий рФНО-Р1 может играть важную роль в качестве эндогенного модулятора активности ФНО-a при АГ.
Ключевые слова: артериальная гипертензия, цитокины, фактор некроза опухоли альфа, растворимый рецептор фактора некроза опухоли альфа 1-го типа
MODULATION OF TUMOR NECROSIS FACTOR ALPHA ACTIVITY BY ITS SOLUBLE RECEPTOR DEPENDING ON AGE OF THE PATIENTS WITH ARTERIAL HYPERTENSION
Summary. Proinflammatory cytokine — tumor necrosis factor-alpha (TNF-a) is a mediator of cardiac pathology. Soluble TNF-a receptor type 1 (sTNF-R1) is natural TNF-a antagonist that might inhibit its cytotoxic activity. The aim of the study was to investigate plasma TNF-a and sTNF-R1 levels depend on age of patients with arterial hypertension (AH). 78 hypertensive patients and 22 healthy controls were examined. Cytokines levels were measured by enzyme-linked immunosorbent assay (ELISA). Elevated concentrations of TNF-a (124.99±13.26 pg/ml) and sTNF-R1 (2.12±0.08 ng/ml) in hypertensive patients as compared with normotensive subjects (13.23±3.40 pg/ml; p=0.001 and 1.20±0.60 ng/ml; p=0.032 respectively) were revealed. The study showed changes of TNF-a and sTNF-R1 activity depending on age of the patients, presence, duration and degree of AH. Obtained data suggest involving of systemic immunoinflammatory response in pathogenesis of AH. Circulating sTNF-R1 could play an important role as endogenous modulator of TNF-a activity in AH.
Key words: arterial hypertension, cytokines, tumor necrosis factor-alpha, soluble tumor necrosis factor-alpha receptor type 1
Адреса для листування:
Ащеулова Тетяна Вадимівна
61022, Харків, просп. Леніна, 4
Харківський державний медичний університет,
кафедра пропедевтики внутрішньої медицини № 1
E-mail: [email protected]





