Вступ
Розсіяний склероз (РС) — імуноопосередковане нейродегенеративне захворювання центральної нервової системи (ЦНС), що характеризується демієлінізацією, втратою олігодендроглії та аксональною патологією [1, 2].
Демієлінізація порушує передачу сигналів у ЦНС, викликаючи поступове накопичення фізичної та когнітивної інвалідності [3, 4]. Встановлено, що тривала демієлінізація призводить до прогресуючої дегенерації аксонів. Таким чином, ремієлінізація, утворення нового мієліну, є важливим процесом для підтримки структурної цілісності аксонів, а також для відновлення та підтримки неврологічної функції при РС (рис. 1) [5, 6].

Ремієлінізація може відбуватися спонтанно, безпосередньо в демієлінізуючих бляшках, проте ця здатність знижується з тривалістю перебігу РС, особливо при прогресуючому перебігу [6, 8]. Хоча основні механізми не до кінця вивчені, вважається, що ремієлінізація є неповною при прогресуючому РС через множину факторів, включаючи виснаження клітин-попередників олігодендроцитів, їх знижену здатність до диференціювання в зрілі мієлінізуючі олігодендроцити і наявність інгібуючих факторів у мікрооточенні вогнищ РС [9, 10].
Сучасна патогенетична терапія при РС насамперед включає імуномодулюючі лікарські засоби, спрямовані на зменшення вираженості нейрозапалення та запобігання рецидивам — хворобомодифікуюче лікування [11]. Однак це лікування залишається менш ефективним щодо запобігання прогресуванню нейродегенерації та зниження інвалідизації пацієнтів із РС [12].
Наголошуючи на потребі в регенеративній терапії РС, розробка стратегій, спрямованих на запобігання пошкодженню олігодендроцитів та безпосередньо мієліну, а також посилення ремієлінізації та цілісності аксонів, в останні роки викликала дедалі більшу увагу дослідників та клініцистів (рис. 2) [13].

Ліки, доступні в даний час для лікування РС, в основному ґрунтуються на різних механізмах модуляції периферичної імунної системи (ліворуч на рис. 2) для уповільнення прогресування захворювання. У даний час досліджується кілька потенційних ліків, які спрямовані на запалення ЦНС та різні аспекти та стадії ремієлінізації (праворуч на рис. 2).
Ремієлінізація є варіантом «омолодження» ЦНС після викликаного імунною системою пошкодження мієліну та олігодендроцитів. Отже, стимуляція ремієлінізації забезпечує додаткову лінію захисту від пошкодження аксонів, яке слідує за втратою мієліну.
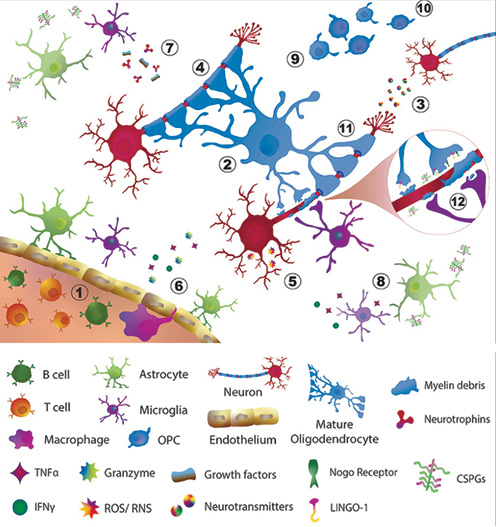
Стратегії ремієлінізації включають, серед іншого, посилення трофічної підтримки олігодендроцитів та аксонів, стимуляцію олігодендрогенезу, нейтралізацію інгібіторів диференціювання та ремієлінізації олігодендроцитів, а також забезпечення цілісності та регенерації аксонів (рис. 3) [13].
Роль мієліну
Мієлінізація пропонує кращий спосіб зростання швидкості провідності нервових волокон, ніж просте збільшення розміру аксона. Мієлін підвищує поперечний ізолюючий опір мембрани аксона, у той час як потенціалзалежні натрієві та калієві канали практично обмежені короткими немієлінізованими перехопленнями Ранв’є. Таким чином, потенціал дії поширюється за допомогою порівняно швидкого та енергоефективного процесу стрибкоподібної провідності [15]. З цього випливає, що втрата мієліну призводить до більш повільної передачі потенціалу дії і, отже, збільшення латентного періоду, але також може призвести до блокади провідності [16]. Таким чином, ремієлінізація є способом відновлення стрибкоподібної провідності та клінічної функції після демієлінізації [17].
Крім того, олігодендроцити безпосередньо підтримують нейрон, наприклад, забезпечуючи лактатом для метаболізму та утворення аденозинтрифосфату (АТФ) [18, 19]. Дослідження патологічного процесу на експериментальній моделі також припускають, що вираженість дегенерації аксонів зменшується в ремієлінізованих ділянках [20, 21]. Отже, у сукупності ремієлінізуюча терапія необхідна для відновлення функції та запобігання нейродегенерації.
На сьогодні більш очевидним є те, що регуляція синтезу мієліну є динамічним процесом. У цьому процесі беруть участь як новоутворені олігодендроцити, так і олігодендроцити, які існували раніше, що ремоделюють мієлін, часто у відповідь на активність процесу. Ці явища покращують пластичність [22]. Питання, чи можна відновити залежну від активності РС ремієлінізацію за допомогою запропонованих методів лікування, залишається без відповіді.
Біологія ремієлінізації
Демієлінізація (індукована експериментально або захворюванням) може супроводжуватися регенеративною відповіддю, що призводить до утворення нових мієлінових оболонок навколо оголених аксонів новоутвореними олігодендроцитами [23, 24]. Гістопатологічні оцінки показали, що це може часто відмічатися в окремих пацієнтів із РС [25], але не є характерним для переважної їх більшості [26]. Висока міжіндивідуальна варіабельність здатності до ремієлінізації підтверджується візуалізацією мієліну з використанням позитронно-емісійної томографії в динаміці. Ці дані поєднуються з доказами того, що у пацієнтів із більш високою ремієлінізацією виявляють нижчий рівень непрацездатності, саме це підкреслює терапевтичні перспективи ремієлінізуючого лікування [27, 28]. Визначення лікарських мішеней для активації процесу ремієлінізації дозволить значно підвищити ефективність лікування РС.
Механізми ремієлінізації
Зрілі олігодендроцити, що існували до демієлінізації, здатні збільшувати кількість міжвузлів, які вони генерують, і, отже, сприяють відновленню після демієлінізації [29], хоча вони не додаються до пулу мієлінутворювальних олігодендроцитів (нових), які необхідні для ремієлінізації у тварин [30]. Таким чином, ремієлінізація значною мірою залежить від клітин-попередників дорослих олігодендроцитів (aOPCs), отриманих з неонатальних клітин-попередників олігодендроцитів (nOPCs) [31], які, як показано у генетичних дослідженнях, є клітинами, відповідальними за генерацію більшості в дорослій нервовій системі [32]. Ці клітини підтримуються в достатній кількості переважно за рахунок власного самооновлення, а не заміщення з ніш нейральних стовбурових клітин ЦНС [33].
Після пошкодження мієлінових ділянок клітини-попередники дорослих олігодендроцитів повинні наслідувати процес активації, міграції, проліферації та диференціювання, перш ніж завершитися утворенням нових мієлінових оболонок [32]. Кінцевим продуктом є ущільнений шар мієліну, який тонший і коротший, ніж той, що утворюється під час мієлінізації у процесі розвитку [34]. Цей факт часто використовується для гістологічної ідентифікації ремієлінізації в ході вивчення процесу на експериментальних моделях на тваринах. Механічно ремієлінізація може бути невдалою через дефект у будь-якому місці цієї послідовності; нестача прорегенеративних факторів або надлишок інгібуючих факторів, як це видно при ураженнях при РС, у поєднанні з внутрішнім складом aOPCs може обмежувати здатність до ремієлінізації [23].
Враховуючи, що велика кількість клітин-попередників дорослих олігодендроцитів виявляється при хронічних вогнищах демієлінізації при РС [35], часто виникають думки, що ремієлінізація зазнає невдачі, оскільки aOPCs стають нерухомими та нездатними до диференціювання.
Однак слід визнати, що диференціювання не завжди може бути стадією, що обмежує швидкість ремієлінізації у пацієнтів. Раніше встановлено, що aOPCs дійсно мігрують до місць пошкодження і рівномірно розподіляються, щоб сприяти ремієлінізації [36], хоча вони, ймовірно, роблять це на короткі відстані [37]. Крім цього, згідно з останніми дослідженнями виявлено зміни в профілях експресії генів олігодендроцитів між ділянками білої речовини головного мозку, що нормально виглядають при РС, і здоровим контролем, маючи на увазі, що патологія, яка виявляється в ураженнях, може не відображати глобальні клітинні зміни, які відбуваються при РС.
Такі результати можуть знайти пояснення у відмінностях між даними пацієнтів та даними з експериментальних моделей на щурах та мишах, що використовують для вивчення захворювання. Зважаючи на дані про те, що у деяких пацієнтів із РС ремієлінізація відбувається краще, ніж у інших, здається очевидним, що стратегія лікування, яка тільки посилює диференціювання, не обов’язково може бути достатньою для вирішення проблеми ремієлінізації у популяції гетерогенних пацієнтів із РС [27].
Крім того, нещодавно описано А1-реактивні астроцити, які зумовлюють загибель олігодендроцитів [39].
Паралельно до вищеописаних процесів демонстрація того, що синтез білка в OPCs модулюється потенціалами дії аксонів [38], свідчить про симбіоз між нейроном і клітинами, відповідальними за його мієлінізацію. У периферичній нервовій системі існує необхідний взаємозв’язок між аксоном і шванівською клітиною, що ілюструється залежністю від фактора росту нейронів — нейрорегуліну 1, який керує мієлінізацією периферичних нервів [40, 41]. У ЦНС клітини-попередники олігодендроцитів здатні диференціюватися навіть за відсутності аксонів [42] і у культурі здатні мієлінізувати інертні аксоноподібні субстрати [43]. Проте у той час як олігодендроцити мають здатність за замовчуванням диференціюватися і мієлінізувати аксони, цей процес модулюється діаметром та активністю аксонів, що вказує на необхідність взаємодії з інтактними аксонами in vivo [44, 45].
Аналізуючи наведені дані, стає зрозуміло, що для полегшення ремієлінізації потрібні комбінації лікарських засобів, які діють на різні процеси з максимальною ефективністю (за умови достатньо збереженого демієлінізованого аксона).
Причини невдач ремієлінізації
Щоб зрозуміти, чому ремієлінізація не вдається при РС, необхідно розглянути два важливі супутні процеси, а саме вік та імунну систему.
У той час як імунна система часто розглядається як така, що зумовлює згубну дію при РС, показано, що вроджена імунна система відіграє важливу роль у біології ремієлінізації [45]. Мієлінові залишки містять інгібітори диференціювання aOPC, тому їх очищення шляхом фагоцитозу є важливим етапом регенерації мієлінової оболонки [46]. Так само інфільтруючі макрофаги та активована мікроглія секретують безліч нейротрофічних факторів, які чинять прямий вплив на aOPCs [47]. Справді, для забезпечення надійної ремієлінізації in vitro потрібна поляризація відповіді макрофагів на імунорегуляторний фенотип М2 [48]. Незрозуміло, як ці результати пов’язані з поведінкою макрофагів і мікроглії, що походять з моноцитів, in vivo, але вони підкреслюють, як поліпшення нашого розуміння субпопуляцій макрофагів/мікроглії та лімфоцитів у головному мозку необхідне для розробки методів лікування, які запобігають демієлінізації, водночас стимулюючи ремієлінізацію.
Потенціал ендогенної ремієлінізації залежить як від віку, так і від тривалості захворювання: ремієлінізація найбільш виражена в осіб віком до 55 років та протягом перших 10 років від початку захворювання [49]. Ще потрібно з’ясувати відносний внесок віку залежно від тривалості демієлінізації та недостатності ремієлінізації, але клінічні дані свідчать про те, що вік особливо важливий, оскільки пацієнти досягають інвалідності в однаковому віці, незалежно від того, чи мають вони рецидивні або прогресуючі симптоми на початку [50]. Таким чином, ремієлінізація, як і інші регенеративні процеси в організмі людини [51], стає з часом менш ефективною [52], тому розуміння вікової недостатності ремієлінізації має важливе значення для розробки лікування.
Детальне розуміння внутрішніх вікових змін в aOPCs викладено в одному з досліджень [53], де продемонстровано, що старіючі aOPC стають менш чутливими до факторів, що викликають диференціювання, що зумовлює зниження здатності до ремієлінізації, яке відмічають у багатьох хронічних неремієлінізуючих ураженнях РС [54]. Більше того, секвенування РНК від молодих і старих aOPC виявило значний внесок шляху mTOR (механічна мішень рапаміцинкінази). Встановлено, що маніпулювання цим шляхом у старих щурів з обмеженням калорійності (три непослідовні дні голодування на тиждень протягом 6 міс) або за допомогою AMPK-агоніста метформіну (>3 міс) повертає назад знижену здатність диференціювання aOPCs та відновлює їх здатність до ремієлінізації. У результаті вплив на внутрішні зміни в цих стовбурових клітинах стає перспективною стратегією лікування.
Нарешті, існують також анатомічні відмінності в ступені ремієлінізації в межах різних локалізацій уражень в однієї людини. Наприклад, перивентрикулярні вогнища менш схильні до ремієлінізації, ніж підкіркові [26]. Це може відображати гетерогенність OPC, що лежить в основі процесу, або відмінності в їх диференціюванні залежно від локалізації [55], для прикладу — в корі менше інгібіторів ремієлінізації. Це також може бути пов’язане з важливістю нейронної активності для ремієлінізації. Регіонарні варіації ремієлінізації дають можливість дослідити бар’єри для посилення ремієлінізації, а також піднімають питання про те, які ураження слід вивчати в клінічних дослідженнях [56].
Висновок
У цій статті ми акцентували увагу на деяких теоретичних питаннях можливостей та механізмів ремієлінізації, які дають надію на розроблення нових засобів лікування пацієнтів із РС, проте потребують системного та глибокого подальшого вивчення.
Для правильного розуміння напряму розвитку фармакотерапії РС необхідно зосередитися на поглибленні знань щодо тонкощів механізмів не лише демієлінізації при РС, але й механізмів та шляхів ремієлінізації як одного з найбільш перспективних підходів у розробці нових засобів лікування РС.
Список використаної літератури
- 1. Нефьодов О.О., Кальбус О.І. (2022) Механізми виникнення та хронізації нейропатичного болю при розсіяному склерозі в клінічних та експериментальних умовах. Укр. мед. часопис, 1–2(147–148): 7–11.
- 2. Trapp B.D., Nave K.A. (2008) Multiple sclerosis: An immune or neurodegenerative disorder? Annu Rev. Neurosci., 31: 247–269.
- 3. Baird J.F., Cederberg K.L.J., Sikes E.M. et al. (2019) Physical activity and walking performance across the lifespan among adults with multiple sclerosis. Mult. Scler. Relat. Disord., 35: 36–41.
- 4. Benedict R.H.B., Amato M.P., DeLuca J. et al. (2020) Cognitive impairment in multiple sclerosis: Clinical management, MRI, and therapeutic avenues. Lancet Neurol., 19(10): 860–871.
- 5. Lubetzki C., Zalc B., Williams A. et al. (2020) Remyelination in multiple sclerosis: From basic science to clinical translation. Lancet Neurol., 19(8): 678–688.
- 6. Plemel J.R., Liu W.Q., Yong V.W. (2017) Remyelination therapies: A new direction and challenge in multiple sclerosis. Nat. Rev. Drug Discov., 16(9): 617–634.
- 7. Melchor G.S., Khan T., Reger J.F., Huang J.K. (2019) Remyelination Pharmacotherapy Investigations Highlight Diverse Mechanisms Underlying Multiple Sclerosis Progression. ACS Pharmacol. Transl. Sci., 2(6): 372–386. doi: 10.1021/acsptsci.9b00068
- 8. Kremer D., Gottle P., Flores-Rivera J. et al. (2019;) Remyelination in multiple sclerosis: From concept to clinical trials. Curr. Opin. Neurol., 32(3): 378–384.
- 9. Cui Q.L., Kuhlmann T., Miron V.E. et al. (2013) Oligodendrocyte progenitor cell susceptibility to injury in multiple sclerosis. Am. J. Pathol., 183(2): 516–525.
- 10. Pu A., Stephenson E.L., Yong V.W. (2018) The extracellular matrix: Focus on oligodendrocyte biology and targeting CSPGs for remyelination therapies. Glia, 66(9): 1809–1825.
- 11. Thompson A.J. (2018) Commentary on the ECTRIMS-EAN guideline for pharmacological treatment of multiple sclerosis. Ther. Adv. Neurol. Disord., 11: 1–2.
- 12. Ineichen B.V., Plattner P.S., Good N. et al. (2017) Nogo-A antibodies for progressive multiple sclerosis. CNS Drugs, 31(3): 187–198.
- 13. Kremer D., Gottle P., Hartung H.P. et al. (2016) Pushing Forward: Remyelination as the New Frontier in CNS Diseases. Trends Neurosci., 39(4): 246–263.
- 14. Allanach J.R., Farrell J.W., Mésidor M. et al. (2021) Current status of neuroprotective and neuroregenerative strategies in multiple sclerosis: A systematic review (https://journals.sagepub.com/doi/full/10.1177/13524585211008760).
- 15. Smith K., McDonald W., Blakemore W. (1979) Restoration of secure conduction by central demyelination. Trans. Am. Neurol. Assoc., 104: 25–29.
- 16. Smith K.J., McDonald W.I. (1999) The pathophysiology of multiple sclerosis the mechanisms underlying the production of symptoms and the natural history of the disease. Philos Trans R. Soc. Lond. B. Biol. Sci., 354(1390): 1649–1673.
- 17. Duncan I.D., Brower A., Kondo Y. et al. (2009) Extensive remyelination of the CNS leads to functional recovery. Proc. Natl. Acad. Sci. USA, 106(16): 6832–6836.
- 18. Fünfschilling U., Supplie L.M., Mahad D. et al. (2012) Glycolytic oligodendrocytes maintain myelin and long-term axonal integrity. Nature, 485(7399): 517–521.
- 19. Morrison B.M., Lee Y., Rothstein J.D. (2013) Oligodendroglia: metabolic supporters of axons. Trends Cell Biol., 23(12): 644–651.
- 20. Irvine K.A., Blakemore W.F. (2008) Remyelination protects axons from demyelination-associated axon degeneration. Brain, 131(6): 1464–1477.
- 21. Mei F., Lehmann-Horn K., Shen Y.-A.A. et al. (2016) Accelerated remyelination during inflammatory demyelination prevents axonal loss and improves functional recovery. eLife. ;5:e18246.
- 22. Sampaio-Baptista C., Johansen-Berg H. (2017) White matter plasticity in the adult brain. Neuron, 96(6): 1239–1251.
- 23. Franklin R.J.M., French-Constant C. (2017) Regenerating CNS myelin — from mechanisms to experimental medicines. Nat. Rev. Neurosci., 18: 753.
- 24. Franklin R.J.M., French-Constant C., Edgar J.M., Smith K.J. (2012) Neuroprotection and repair in multiple sclerosis. Nat. Rev. Neurol., 8: 624.
- 25. Patani R., Balaratnam M., Vora A., Reynolds R. (2007) Remyelination can be extensive in multiple sclerosis despite a long disease course. Neuropathol. Appl. Neurobiol., 33(3): 277–287.
- 26. Patrikios P., Stadelmann C., Kutzelnigg A. et al. (2006) Remyelination is extensive in a subset of multiple sclerosis patients. Brain, 129(12): 3165–3172.
- 27. Bodini B., Veronese M., García-Lorenzo D. et al. (2016) Dynamic imaging of individual remyelination profiles in multiple sclerosis. Ann. Neurol., 79(5): 726–738.
- 28. Bramow S., Frischer J.M., Lassmann H. et al. (2010) Demyelination versus remyelination in progressive multiple sclerosis. Brain, 133(10): 2983–2998.
- 29. Jeffries M.A., Urbanek K., Torres L. et al. (2016) ERK1/2 Activation in preexisting oligodendrocytes of adult mice drives new myelin synthesis and enhanced CNS function. J. Neurosci., 36(35): 9186–9200.
- 30. Crawford A.H., Tripathi R.B., Foerster S. et al. (2016) Pre-Existing mature oligodendrocytes do not contribute to remyelination following toxin-induced spinal cord demyelination. Am. J. Pathol., 186(3): 511–516.
- 31. French-Constant C., Raff M.C. (1986) Proliferating bipotential glial progenitor cells in adult rat optic nerve. Nature, 319: 499.
- 32. Zawadzka M., Rivers L.E., Fancy S.P.J. et al. (2010) CNS-resident glial progenitor/stem cells produce Schwann cells as well as oligodendrocytes during repair of CNS demyelination. Cell Stem. Cell, 6(6): 578–590.
- 33. Psachoulia K., Jamen F., Young K.M., Richardson W.D. (2009) Cell cycle dynamics of NG2 cells in the postnatal and ageing brain. Neuron Glia Biol., 5(3–4): 57–67.
- 34. Blakemore W.F. (1974) Pattern of remyelination in the CNS. Nature, 249(5457): 577–578.
- 35. Wolswijk G. (1998) Chronic stage multiple sclerosis lesions contain a relatively quiescent population of oligodendrocyte precursor cells. J. Neurosci., 18(2): 601.
- 36. Hughes E.G., Kang S.H., Fukaya M., Bergles D.E. (2013) Oligodendrocyte progenitors balance growth with self-repulsion to achieve homeostasis in the adult brain. Nat. Neurosci., 16(6): 668–676.
- 37. Franklin R.J.M., Gilson J.M., Blakemore W.F. (1997) Local recruitment of remyelinating cells in the repair of demyelination in the central nervous system. J. Neurosci. Res., 50(2): 337–344.
- 38. Hammond T.R., Gadea A., Dupree J. et al. (2014) Astrocyte-derived endothelin-1 inhibits remyelination through notch activation. Neuron, 81(3): 588–602.
- 39. Liddelow S.A., Guttenplan K.A., Clarke L.E. et al. (2017) Neurotoxic reactive astrocytes are induced by activated microglia. Nature, 18(541): 481.
- 40. Wake H., Lee P.R., Fields R.D. (2011) Control of local protein synthesis and initial events in myelination by action potentials. Science, 333(6049): 1647.
- 41. Birchmeier C., Nave K. (2008) Neuregulin-1, a key axonal signal that drives Schwann cell growth and differentiation. Glia, 56(14): 1491–1497.
- 42. Almeida R., Lyons D. (2016) Oligodendrocyte development in the absence of their target axons in vivo. PLoS ONE, 11(10): e0164432.
- 43. Mei F., Fancy S.P.J., Shen Y.-A.A. et al. (2014) Micropillar arrays as a high-throughput screening platform for therapeutics in multiple sclerosis. Nat. Med., 20(8): 954–960.
- 44. Klingseisen A., Lyons D.A. (2017) Axonal regulation of central nervous system myelination: structure and function. Neuroscientist., 24(1): 7–21.
- 45. Rawji K.S., Yong V.W. (2013) The benefits and detriments of macrophages/microglia in models of multiple sclerosis. Clin. Dev. Immunol., 2013: 948976.
- 46. Döring A., Sloka S., Lau L. et al. (2015) Stimulation of monocytes, macrophages, and microglia by amphotericin B and macrophage colony-stimulating factor promotes remyelination. J. Neurosci., 35(3): 1136.
- 47. Yong V.W., Rivest S. (2009) Taking advantage of the systemic immune system to cure brain diseases. Neuron, 64(1): 55–60.
- 48. Miron V.E., Boyd A., Zhao J.-W. et al. (2013) M2 microglia and macrophages drive oligodendrocyte differentiation during CNS remyelination. Nat. Neurosci., 16(9): 1211–1218.
- 49. Frischer J.M., Weigand S.D., Guo Y. et al. (2015) Clinical and pathological insights into the dynamic nature of the white matter multiple sclerosis plaque. Ann. Neurol., 78(5): 710–721.
- 50. Goldschmidt T., Antel J., König F.B. et al. (2009) Remyelination capacity of the MS brain decreases with disease chronicity. Neurology, 72(22): 1914.
- 51. Oh J., Lee Y.D., Wagers A.J. (2014) Stem cell aging: mechanisms, regulators and therapeutic opportunities. Nat. Med., 20(8): 870–880.
- 52. van Wijngaarden P., Franklin R.J.M. (2013) Ageing stem and progenitor cells: implications for rejuvenation of the central nervous system. Development, 140(12): 2562.
- 53. Neumann B., Baror R., van Wijngaarden P., Franklin R.J. (2017) Remyelination of regenerating axons. Acta Ophthalmola, 95(S259). 10.1111/j.1755-3768.2017.03525.
- 54. Kitada M., Rowitch D.H. (2006) Transcription factor co-expression patterns indicate heterogeneity of oligodendroglial subpopulations in adult spinal cord. Glia, 54(1): 35–46.
- 55. Kuhlmann T., Miron V., Cuo Q. et al. (2008) Differentiation block of oligodendroglial progenitor cells as a cause for remyelination failure in chronic multiple sclerosis. Brain, 131(7): 1749–1758.
- 56. Chang A., Staugaitis S.M., Dutta R. et al. (2012) Cortical remyelination: a new target for repair therapies in multiple sclerosis. Ann. Neurol., 72(6): 918–926.
Відомості про авторів:
Нефьодов Олександр Олександрович — доктор медичних наук, професор, ТДВ «ІНТЕРХІМ», начальник клінічного відділу, Одеса, Україна. scholar.google.com.ua/citations?user=kL0bHKcAAAAJ&hl=uk; orcid.org/0000-0002-5796-1852 Кальбус Олександр Іванович — доктор медичних наук, доцент, Дніпровський державний медичний університет, завідувач кафедри неврології, Дніпро, Україна. scholar.google.com.ua/citations?user=xosmlBIAAAAJ&hl=uk&oi=sra; orcid.org/0000-0003-0796-4825 Ларіонов Віталій Борисович — доктор біологічних наук, старший науковий дослідник, Фізико-хімічний інститут ім. О.В. Богатського НАН України, завідувач лабораторії фізико-хімічної фармакології відділу медичної хімії, Одеса, Україна. scholar.google.com.ua/citations?hl=uk&user=mSh_xSYAAAAJ; orcid.org/0000-0003-2678-4264 Адреса для кореспонденції:
Кальбус Олександр Іванович 49044, Дніпро, вул. В. Вернадского, 9 E-mail: [email protected] |
Information about the authors:
Nefedov Oleksandr O. — Doctor of Medical Sciences, Professor, «INTERCHIM» ALC, Head of the Clinical Department, Odessa, Ukraine. scholar.google.com.ua/citations?user=kL0bHKcAAAAJ&hl=uk; orcid.org/0000-0002-5796-1852 Kalbus Oleksandr I. — Doctor of Medical Sciences, Associate Professor, Dnipro State Medical University, Head of the Department of Neurology, Dnipro, Ukraine. scholar.google.com.ua/citations?user=xosmlBIAAAAJ&hl=uk&oi=sra; orcid.org/0000-0003-0796-4825 Larionov Vitaliy B. — Doctor of Biological Sciences, Senior Researcher, O.V. Bogatsky Physico-chemical institute of NAS of Ukraine, Head of the Laboratory of Physical and Chemical Pharmacology, Department of Medical Chemistry, Odessa, Ukraine. scholar.google.com.ua/citations?hl=uk&user=mSh_xSYAAAAJ; orcid.org/0000-0003-2678-4264 Address for correspondence:
Oleksandr Kalbus 49044, Dnipro, V. Vernadsky str., 9 E-mail: [email protected] |
Надійшла до редакції/Received: 29.04.2022
Прийнято до друку/Accepted: 17.05.2022





