ВСТУП
Акумуляція ліпідів у паренхімі печінки є поширеною аномалією. Серед загальної популяції стеатоз печінки (СП) діагностують у 15% випадків. Але СП значно частіший у тих, які зловживають алкоголем (45%), мають гіпертригліцеридемію (50%), ожиріння (75%), а також при поєднанні ожиріння зі щоденним вживанням алкоголю (95%) (Nomura H. et al., 1988; Angulo P., 2002; Shen L. et al., 2003; Hamer O.W., 2006).
СП може бути алкоголь-, вірус- чи токсиніндукованим (Lonardo A. et al., 2005), розвиватися в пацієнтів з надмірною масою тіла, цукровим діабетом 2-го типу, генетично детермінованою гіпобеталіпопротеїнемією (Schonfeld G. et al., 2003; Tanoli T. et al., 2004; Whitfield A.J. et al., 2005), при порушеннях живлення, асоціюватися із застосуванням багатьох медичних засобів: глюкокортикоїдів, антагоністів кальцієвих каналів, аміодарону, цитостатиків, нестероїдних протизапальних і психотропних препаратів (Yu A.S., Keeffe E.B., 2002). Метаболічний чи спричинений зловживанням алкоголем СП прогресує до стеатогепатиту, фіброзу і цирозу (Abrams G.A. et al., 2004; Lefkowitch J.H., 2005), вірусіндукований СП поєднується з гепатитом і спричиняє розвиток та прогресування фіброзу печінки (Angulo P., 2002).
Діагностика жирової інфільтрації печінки має значення в кожному з вищеописаних випадків, оскільки при СП ушкоджуються гепатоцити 3-ї зони печінкової часточки, що відповідає за детоксикацію найрізноманітніших речовин, які поступають через ворітну вену. У цій зоні відбувається метаболізм великої частини лікарських засобів (Шерлок Ш., Дули Дж., 1999).
Досі біопсію печінки вважають точним, чутливим і специфічним методом діагностики СП, хоча її застосування не завжди безпечне для здоров’я пацієнта, має певні технічні обмеження.
Ще з 80-х років ХХ ст. для діагностики СП використовували метод ультрасонографії як неінвазивний, а також високочутливий і достатньо специфічний при нагромадженні жиру в гепатоцитах (Saverymuttu S.H. et al., 1986). Ультрасонографічний метод рекомендують для скринінгу СП при епідеміологічних дослідженнях, для моніторингу перебігу хвороби печінки, для контролю за ефективністю лікування пацієнтів з хронічними вірусними гепатитами (ХВГ). Комп’ютерну (КТ) та магнітно-резонансну томографію (МРТ) рекомендують проводити для верифікації діагнозу при виявленні в печінці вогнищевих нагромаджень ліпідів.
Мета дослідження — на основі даних літератури і власних спостережень розробити алгоритм ультразвукового дослідження печінки для діагностики дифузного СП (ДСП) й вивчити ступені стеатозу у осіб з алкогольною хворобою печінки (АХП) та ХВГ.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Відбір пацієнтів для виявлення діагностичних ознак дифузної інфільтрації ліпідами паренхіми печінки проводили серед хворих на хронічний гепатит (ХГ) у терапевтичній клініці клінічної бази кафедри факультетської терапії впродовж 2004–2006 рр. Наявність у медичній документації хоча б одного запису про гіперехогенність печінки під час ультрасонографії була приводом для включення хворого на гепатит для подальшого обстеження. Діагноз верифікувався стандартними клінічними методиками, що включали дані анамнезу (зловживання алкоголем, визначення групи ризику щодо інфікування вірусами гепатитів В і С, уживання гепатотоксичних медичних засобів тощо), ультрасонографію та сонографію за Допплером органів черевної порожнини, тести на функціональний стан печінки, синдром цитолізу, визначення глюкози крові, маркерів вірусних гепатитів B і C. Основними критеріями включення в групи для аналізу були ультрасонографічний діагноз СП, відсутність клінічних ознак портальної гіпертензії та функціональної недостатності печінки середнього чи тяжкого ступеня.
Діагностика гіперехогенності печінки як основної сонографічної ознаки жирової інфільтрації її паренхіми базувалася на порівнянні ехогенності печінки, коркового шару правої нирки, селезінки та коркового шару лівої нирки (Tchelepi H. et al., 2002). Ехогенність паренхіми здорової печінки та коркового шару правої нирки однакові. Якщо різниця між ними є більша від різниці між ехогенністю селезінки і коркового шару лівої нирки, таку печінку розглядають як гіперехогенну (Tchelepi H. et al., 2002). Особливо важливе значення має таке порівняння у разі СП І ступеня. Одночасно оцінювали стан структури печінки, ступінь візуалізації стінок розгалужень ворітної та печінкової вен, стінки жовчного міхура, капсули печінки та діафрагми (Saverymuttu S.H. et al., 1986; Osawa H., Mori Y., 1996; Kim H.C. et al., 2005), на яких базувалася класифікація ДСП за ступенем ліпідної інфільтрації гепатоцитів (Saverymuttu S.H. et al., 1986; Lupsor M., Badea R., 2005; Hamer O.W. et al., 2006).
Ультрасонографічні ознаки різних ступенів жирової інфільтрації печінки наведено H.C. Kim та співавторами (2005):
- м’який СП — незначне збільшення ехогенності печінки, незначна різниця між ехогенністю останньої та нирки, відносне збереження ехолінії стінки портальної вени;
- помірний СП — втрата ехолінії стінок портальної вени та її периферичних гілок, що проявляється невиразною структурою печінки;
- тяжкий СП — більш виражена редукція проникнення ехосигналу, більше зниження ехогенності стінок портальної вени, включаючи основну гілку, та велика різниця в ехогенності печінки і правої нирки (прим. ред.: приклади ультрасонограм див. Kim H.C. et al., 2005).
Враховуючи мету дослідження, ми не включали в аналіз хворих із сонографічними ознаками фіброзу печінки, якими вважали підвищення ехогенності останньої з одночасним зниженням проникності ультразвуку через неї на фоні СП ІІІ ступеня (Lupsor M., Badea R., 2005).
Специфічність і чутливість ультрасонографії в діагностиці ДСП становить 84 і 94% відповідно (Saverymuttu S.H. et al., 1986). Між СП, діагностованим гістологічно і сонографічно, існує істотний прямий кореляційний зв’язок Спірмена (Hepburn M.J. et al., 2005).
Клінічне обстеження проведене у 127 чоловіків віком 41–61 років. В основі розподілу обстежених на групи був етіологічний діагноз. 1-ша група включала 38 хворих на вірусний гепатит С, 2-га — 28 пацієнтів з вірусним гепатитом В, які заперечували зловживання алкоголем. На зловживання алкоголем вказав 61 хворий, з них АХП діагностована в 27 осіб (3-тя група); серед решти 34 пацієнтів (4-та група) зловживання алкоголем поєднувалося у 22 осіб з вірусним гепатитом С і у 12 — з вірусним гепатитом В. У 108 пацієнтів діагностовано ДСП і визначено його ступені. Вогнищевий СП (ВСП) виявлено у 2 пацієнтів, які зловживали алкоголем. Протокол сонографічної діагностики наведено нижче.
ПРОТОКОЛ УЗД-ДІАГНОСТИКИ ДСП
|
Показник |
Норма |
Ступінь СП |
||
|
І |
ІІ |
ІІІ |
||
|
Ехогенність паренхіми печінки і коркового шару правої нирки |
Однакова |
+ |
++ |
+++ |
|
Візуалізація структури печінки |
||||
|
стінок розгалужень вен |
Добра |
Добра |
Гірша |
Невидима |
|
стінки жовчного міхура |
Добра |
Добра |
Гірша |
Невидима |
|
жовчних проток |
Добра |
Добра |
Гірша |
Невидима |
|
капсули печінки |
Добра |
Добра |
Гірша |
Невидима |
|
діафрагми |
Добра |
Добра |
Гірша |
Невидима |
|
Sparing-зони (гіпоехогенні, вільні від інфільтрації ліпідами ділянки) |
||||
|
вказати сегмент, форму, розміри |
||||
|
Ознаки портальної гіпертензії |
||||
|
ширина ворітної вени |
||||
|
ширина селезінкової вени |
||||
|
розширення печінкових вен (+,−) |
||||
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
За поширеністю (площею) та формою інфільтрації розрізняють декілька видів СП, що виявляються під час ультрасонографії. СП може бути дифузним однорідним і неоднорідним, вогнищевим, багатовогнищевим, підкапсулярним, перипортальним, перивенулярним, навколо вогнища ураження печінки та всередині нього.
ДСП. В основі діагнозу ДСП, що виявляється при інфільтрації ліпідами >20% гепатоцитів, є гіперехогенність паренхіми печінки та різний ступінь візуалізації її структури (Brooks М., 1998; Palmentieri B. et al., 2006).
Ультрасонографічно однорідність чи неоднорідність ДСП визначається наявністю чи відсутністю додаткових вогнищ, наявністю гіпоехогенних ділянок на фоні дифузної гіперехогенності печінки. Кольорове дослідження за Допплером дає інформацію про швидкість кровотоку у венах печінки та про порушення внутрішньопечінкового венозного й артеріального кровотоку внаслідок масивних депозитів ліпідів у гепатоцитах (Oguzkurt L. et al., 2005). Частота виявлення окремих симптомів СП в нашому дослідженні наведена в табл. 1.
Таблиця 1
Частота сонографічних ознак ДСП
у 108 хворих на ХГ
|
Симптом |
n/% |
|
Гіперехогенна печінка |
108/100 |
|
Добра візуалізація – структури печінки – стінок судин – стінки жовчного міхура – капсули печінки – діафрагми |
26/24 26/24 26/24 26/24 26/24 |
|
Структура печінки розрізняється погано |
52/48 |
|
Капсула печінки та діафрагма не розрізняються |
52/48 |
|
Структура печінки розрізняється, але не чітко |
30/28 |
|
Гіпоехогенні зони – у 5-му сегменті – у 3-му сегменті – у 2-му сегменті |
9/8 1/0,9 1/0,9 |
Усі описані у літературі ознаки ДСП достатньо чітко виявляються або не виявляються в процесі її ультрасонографічного дослідження і дають можливість чітко визначити ступені жирової інфільтрації печінки (табл. 2).
Таблиця 2
Критерії ультрасонографічної діагностики
трьох ступенів СП
|
Сонографічний показник |
Ступінь СП |
||
|
І |
ІІ |
ІІІ |
|
|
Гіперехогенність печінки |
|
|
|
|
Візуалізація структури печінки |
■ |
■ |
■ |
|
Візуалізація основних судин та їх розгалужень |
■ |
■ |
■ |
|
Візуалізація стінок жовчного міхура |
■ |
■ |
■ |
|
Візуалізація капсули і діафрагми |
■ |
■ |
■ |
■ візуалізуються добре; ■ візуалізуються гірше; ■ не візуалізуються.
Серед 108 хворих найчастіше (48%) виявляли ІІІ, у 28% — ІІ, у 24% — І ступінь СП. У хворих на вірусний гепатит С істотно частіше діагностували І, ніж ІІІ ступінь жирової інфільтрації. А у пацієнтів з вірусним гепатитом В відзначали тенденцію до зростання частоти ІІІ та істотно меншої частоти І ступенів ліпідної інфільтрації гепатоцитів. У хворих на АХП, як і в пацієнтів з ХВГ, які зловживали алкоголем, переважав тяжчий за ступенем стеатоз (63 і 56% відповідно) (табл. 3, рис. 1).
Таблиця 3
Частота трьох ступенів СП за даними сонографії в аналізованих групах пацієнтів
|
Група |
Кількість пацієнтів з різним ступенем СП, n/М±m, % |
Всього |
||
|
І |
ІІ |
ІІІ |
||
|
1 |
17/61±9 |
4/14±7* |
7/25±8*, ** |
28/100 |
|
2 |
5/24±10# |
6/29±9 |
10/47±10 |
21/100 |
|
3 |
− |
10/37±9 |
17/63±9# |
27/100 |
|
4 |
4/13±6# |
10/31±6 |
18/56±8**, # |
32/100 |
|
Всього |
26/24±4 |
30/28±4 |
52/48±5 |
108/100 |
*Відмінність статистично значуща порівняно з І ступенем СП (p<0,05); **відмінність статистично значуща порівняно з ІІ ступенем СП (p<0,05);
#відмінність статистично значуща порівняно з відповідним показником 1-ї групи (p<0,05).
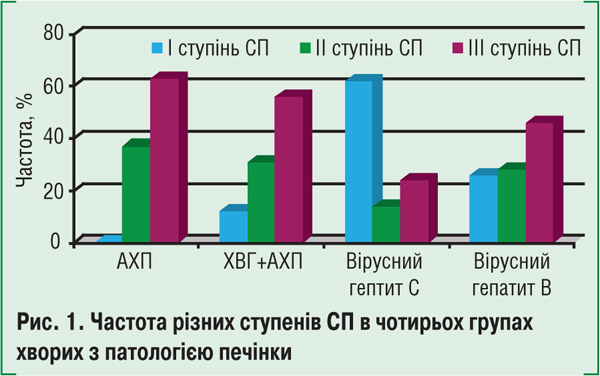
ІІ і ІІІ ступінь СП сонографічно відповідають більшій кількості тригліцеридів (ТГ) у гепатоцитах і більшій кількості інфільтрованих ліпідами клітин печінки (Kim H.C. et al., 2005; Vuppalanchi R. et al., 2007). Вищий ступінь СП гістологічно відповідає більш тривалому процесу в ній, у таких випадках при АХП чи неалкогольних гепатитах є ознаки стеатогепатиту та фіброзу печінки (Brunt E.M. et al., 1999). Однак гепатит не має характерних ознак на сонограмі. Як видно з рис. 2, в аналізованій вибірці за тяжкістю хвороби на 1-му місці були пацієнти з АХП, на 2-му — з ХВГ, які зловживали алкоголем, на 3-му — з вірусним гепатитом В.
У разі ДСП на гіперехогенній печінці можна виявити гіпоехогенні зони (в англомовній літературі їх називають «focal sparing» (Hamer O.W. et al., 2006). Надалі ми називатимемо їх sparing зони.
Гіпоехогенні зони на фоні дифузного стеатозу. Sparing зони як одну з характерних ознак ДСП не можна назвати істинно гіпоехогенними. Насправді ці вогнища відповідають ехогенності нормальної паренхіми печінки, але на фоні жирової інфільтрації виглядають як менш ехогенні (Chong V.F., Fan Y.F., 1994; Zezos P. et al., 2006).
Ділянки печінки, неінфільтровані ліпідами, часто овальні, еліпсоподібні, іноді круглі, що мають більш-менш типову локалізацію: навколо жовчного міхура, а за його відсутності в ямці жовчного міхура — сегменти печінки IV і V; в медіальних сегментах лівої частки (сегменти III і II) чи під капсулою печінки (Arita T. еt al., 1996; Kyogoku S. et al., 2004), у сегментах VI і VIII (Tom W.W. et al., 2004). Найчастіше при ДСП виявляють sparing зони в сегментах печінки IV і V (Aubin B. et al., 1995).
За нашими даними гіпоехогенні зони виявлені в 11 (10%) пацієнтів, у 4 — із ДСП ІІІ, у 7 — ІІ ступеня. Ці ділянки були овальної, не зовсім правильної форми, з нечітко окресленими межами. 9 з них розміщувалися в сегменті V, по 1 — в сегментах ІІ і ІІІ. Усі гіпоехогенні зони на КТ виглядали як не дуже чітко окреслені гіперденсивні ділянки.
При відсутності іншої, крім СП, патології sparing зони пов’язують з аномаліями судин, що відповідають тим типовим сегментам, у яких ці зони найчастіше виявляють. Вважають, що такі sparing зони виникають у тих ділянках, які мають з різних причин сповільнений кровотік у розгалуженнях ворітної вени (Arai K. еt al., 1988; Martí-Bonmatí L. еt al., 2005). Парадоксально, але гепатоцити, інфільтровані ліпідами, у цих випадках вважають метаболічно повноцінними, в той час як гепатоцити sparing зон, незважаючи на гістологічно збережену форму, розглядають як такі, що мають дефекти у внутрішньоклітинному обміні (Grossholz M. et al., 1998).
Sparing зони виявляють навколо гемангіом, метастазів і гепатоцелюлярної карциноми (Itai Y., 2000). У хворих з онкопатологією на фоні ДСП відзначають різні за величиною і формами ділянки з неінфільтрованими ліпідами гепатоцитами: периферичні, сегментарні, лобарні. Такі ділянки діагностовано у 51% метастазів, 18,5% — гемангіом і 2% — гепатоцелюлярних карцином (Martí-Bonmatí L. et al., 2005). M. Karcaaltincaba, O. Akhan (2007) описали sparing зону навколо фокальної нодулярної гіперплазії печінки. Лобарну гіпоехогенну зону виявляють при холангіокарциномі у воротах печінки (пухлина Клацкіна) (Grossholz M. et al., 1998). У цих випадках sparing зони пояснюються тромбозами у відповідних венах або порушенням кровотоку в судинах пухлинними масами (Grossholz M. et al., 1998).
Методами, що дозволяють визначити природу sparing зон, є сонографія за Допплером (швидкість кровотоку у венах чи артеріях печінки, їх стенозування чи тромбози), КТ та МРТ з контрастуванням (додаткова васкуляризація у пухлинах) та прицільна біопсія з дослідженням біоптату печінки (Chung J.J. et al., 2003; Görg C., Bert T., 2005; Park S.H. et al., 2006).
Як видно із вищезазначеного, виявлення зони, вільної від ліпідів, на фоні СП в усіх випадках потребує прицільної уваги для виключення патології печінки, що може розвиватися в пацієнта із СП.
Хвороби і синдроми, ознаками яких є гіпоехогенні утворення на фоні гіперехогенної печінки (Grossholz M. et al., 1998; Görg C., Bert T., 2005; Hamer O.W. et al., 2006):
- дифузний стеатоз із sparing зонами різної етіології, в тому числі індукований цитостатиками в онкохворих;
- фокальна нодулярна гіперплазія печінки;
- регенераторні вузли в печінці;
- інфаркти печінки;
- гіпоехогенні метастази у хворих зі злоякісними новоутвореннями; гіпоехогенна нодулярна лімфома.
Але слід враховувати, що далеко не завжди у хворих з онкопатологією кожна sparing зона є метастазом (Kato M. et al., 1997).
«Найбезпечнішими» є поодинокі ділянки печінки, вільні від ліпідів, якщо вони розміщені навколо жовчного міхура (сегмент IV, V).
Гіперехогенні вогнища: проблеми діагностики. ВСП виявляють значно рідше, ніж ДСП. Першою і важливою його ознакою є гіперехогенне чи гіперехогенні вогнища на ультрасонограмі, що виглядають як гіподенсивні на КТ. ВСП найчастіше виявляють випадково під час ультрасонографії печінки у хворих на цукровий діабет 2- го типу, ожиріння, в осіб, які зловживають алкоголем. Звичайно, такі ділянки мають різну величину, неправильну форму та нечіткі контури. У зоні ліпідної інфільтрації можна побачити незмінені судини, що свідчить про збережену структуру печінки.
Але гіперехогенні вогнища на фоні нормоехогенної печінки можуть бути ознакою багатьох хвороб: аденома печінки, добре диференційована гепатокарцинома та інші, що мають здатність нагромаджувати ліпіди (Siegelman E.S., Rosen M.A., 2001) і для диференційної діагностики потребують додаткових, в тому числі інвазивних, методів.
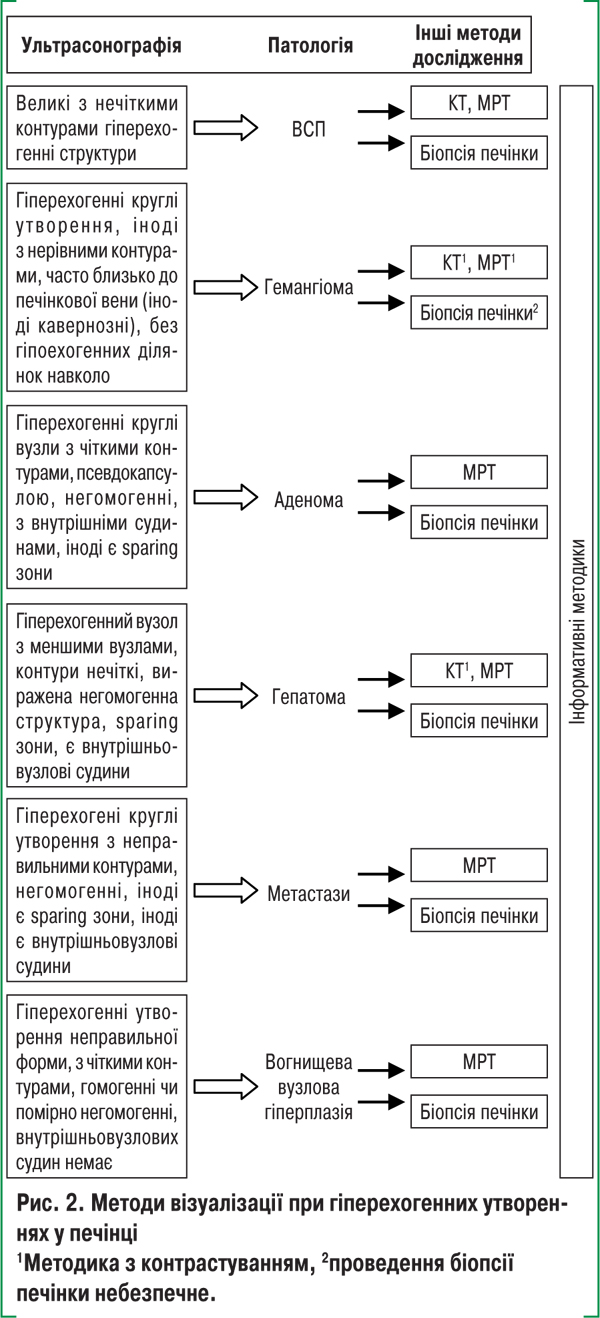
За даними ряду авторів (Mortelé K.J., 2000; Sohn J. et al., 2000; Prasad S.R. et al., 2005; Görg C., Bert T., 2005; Hamer O.W. et al., 2006; Karcaaltincaba M., Akhan O., 2007) диференційний діагноз гіперехогенних вогнищ у печінці проводять між численною групою хвороб: фокальний СП; гемангіома печінки; аденома печінки; ліпома печінки; метастатичні пухлини печінки; гепатоцелюлярна карцинома; метастази інсуліноми в печінку; вогнищева вузлова гіперплазія печінки (рідко); гамартома (комплекс Мейенбурга).
У нашому спостережені було 2 випадки ВСП. Обидва пацієнти зловживали алкоголем. У першому випадку в чоловіка віком 52 років на фоні нормоехогенної з непорушеною структурою печінки було 4 вузли розмірами 3–5 см з нечіткими контурами. На КТ усі вогнища були гіподенсивними. Жодної ознаки пухлини в печінці не виявлено. При повному клінічному обстеженні інших органів дані щодо онкопатології відсутні. У другого пацієнта віком 41 рік гіперехогенний вузол розміщувався в правій частці розміром 4х6 см зі збереженою структурою печінки, гіподенсивний на КТ. З боку легень, шлунка, прямої кишки й підшлункової залози додатковими методами патології не виявлено. Величина альфа- фетопротеїну в пацієнта визначалася в межах норми. Від біопсії вузла пацієнт відмовився. Повторний ультрасонографічний огляд через рік не виявив додаткових утворень та підтвердив наявність вищеописаного вузла. Стан здоров’я пацієнта добрий.
Окремі форми жирової інфільтрації печінки, зокрема субкапсулярний СП, характерний для інсулінзалежного цукрового діабету, ускладненого нирковою недостатністю (Kallio T. et al., 2001; Khalili K. et al., 2003). Перипортальна і перивенулярна форми стеатозу відзначають у пацієнтів, які зловживають алкоголем (Hamer O.W. et al., 2006). На КТ така ділянка гіподенсивна й видима навколо чи вздовж вен. Наявність жиру підтверджує МРТ. Прицільна біопсія дозволяє діагностувати в гепатоцитах вогнища макровезикулярного стеатозу.
Гемангіоми на фоні нормоехогенної печінки. Доброякісні судинні утворення в печінці виявляють у 7% автопсій , що за життя переважно безсимптомні. На ультрасонограмі гемангіома візуалізується як гіперехогенне утворення з неправильними, але чіткими контурами. Серед додаткових методів візуалізації використовують КТ і МРТ з контрастуванням. Важливою ознакою гемангіоми є нерівномірне нагромадження контрасту по периферії (Mirowitz S.A. et al., 1990). Високоспецифічною для гемангіоми при диференційній діагностиці з пухлиною є сцинтіграфія печінки еритроцитами, міченими 99mTc.
Аденома на фоні нормоехогенної печінки. Аденома печінки — доброякісна пухлина, походження якої пов’язують із застосуванням контрацептивів жінками та андрогенів чи стероїдних препаратів чоловіками (Шерлок Ш., Дули Дж., 1999). Гістологічна неоднорідність аденоми зумовлює її неоднорідність на ультрасонографії, КТ і МРТ. Вона добре окреслена, розміром від 1 до 19 см у вигляді одного чи кількох вузлів. Гіперехогенний її варіант на ультрасонограмі є гіподенсивним на КТ. Методикою вибору при підозрі на аденому є МРТ.
Гіперехогенні вогнища злоякісних пухлин і метастазів злоякісних пухлин у печінці. Серед різних за ехогенністю пухлин печінки звернемо увагу на гіперехогенні вогнища гепатоцелюлярної карциноми, що здатна акумулювати ліпіди (Prasad S.R. et al., 2005). Гіперехогенне вогнище пухлини може бути оточене гіпоехогенним обідком. Вузол пухлини може бути один на фоні незміненої печінки, його розмір перевищує 5 см, внутрішня структура неоднорідна.
Серед метастатичних пухлин печінки більша частина гіперехогенних. Останні характерні для раку шлунково-кишкового тракту, особливо товстої кишки, легень, підшлункової залози, нирки (Hoshiba K. et al., 1997; Fregeville A. et al., 2005). На ультрасонограмі виявляється поліморфна картина вузлів різної величини й ехогенності. Для додаткової візуалізації та діагностики переваги має МРТ.
Вогнищева вузлова гіперплазія. Найчастіше виявляють у жінок репродуктивного віку. Периферичні гіперехогенні вогнища можуть бути характерні для окремих випадків вогнищевої вузлової гіперплазії в печінці. Розміщуються гомогенні вузли субкапсулярно, діаметр їх від 1 до 10 см. У біоптаті вузла можна виявити всі клітинні елементи нормальної печінки, однак часточкова архітектура порушена. Підтвердити діагноз можна за допомогою радіонуклідного сканування, оскільки 70% усіх клітин становлять клітини Купфера. Якщо діагноз не підтвердився радіонуклідним скануванням, слід використати інші методи зображення й/або біопсію (Brooks М., 1998). Проведення КТ у разі вогнищевої вузлової гіперплазії менш інформативне, ніж МРТ.
Вибір додаткових методів візуалізації для диференційної діагностики гіперехогенного вузла наведено на рис. 2.
Висновки
Запропоновано діагностичний алгоритм ультрасонографічного обстеження пацієнта для діагностики ДСП та його ступенів і методів додаткової візуалізації для диференційного діагнозу.
Гіпоехогенні вогнища в пацієнтів із ДСП характерні для останнього, однак для виключення іншої патології (особливо злоякісних новотворень) ультрасонографію необхідно доповнити додатковими методами візуалізації.
Ультрасонографічний метод діагностики СП — чутливий і специфічний.
ЛІТЕРАТУРА
- 1. Шерлок Ш., Дули Дж. (1999) Заболевания печени и желчных путей (Пер. с англ.). Гэотар Медицина, Москва, 858 с.
- 2. Abrams G.A., Kunde S.S., Lazenby A.J., Clements R.H. (2004) Portal fibrosis andhepatic steatosis in morbidlyobese subjects: A spectrum of nonalcoholic fattyliver disease. Hepatology, 40(2): 475–483.
- 3. Angulo P. (2002) Nonalcoholic fattyliver disease. N. Engl. J. Med., 346(16): 1221–1231.
- 4. Arai K., Matsui O., Takashima T. et al. (1988) Focal sparedareas in fattyliver causedbyregional decreasedportal flow. A.J.R. Am. J. Roentgenol., 151(2): 300–302.
- 5. Arita T., Matsunaga N., Honma Y. et al. (1996) Focallysparedarea of fattyliver causedbyarterioportal shunt. J. Comput. Assist. Tomogr, 20(3): 360–362.
- 6. Aubin B., Denys A., Lafortune M. et al. (1995) Focal sparing of liver parenchyma in steatosis: role of the gallbladder andits vessels. J. Ultrasound. Med., 14(2): 77–80.
- 7. Brooks M. (1998) Печінка. В кн.: Б. Гольдберг, Г. Петтерсон (ред.). Ультрасонографія. Медицина світу, Львів, с. 55–81.
- 8. Brunt E.M., Janney C.G., Di Bisceglie A.M. et al. (1999) Nonalcoholic steatohepatitis: a proposal for grading andstaging the histological lesions. Am. J. Gastroenterol., 94(9): 2467–2474.
- 9. Chong V.F., Fan Y.F. (1994) Ultrasonographic hepatic pseudolesions: normal parenchyma mimicking mass lesions in fattyliver. Clin. Radiol, 49(5): 326–329.
- 10. Chung J.J., Kim M.J., Kim J.H. et al. (2003) Fat sparing of surrounding liver from metastasis in patients with fattyliver: MR imaging with histopathologic correlation. A.J.R. Am. J. Roentgenol., 180(5): 1347–1350.
- 11. Fregeville A., Couvelard A., Paradis V. et al. (2005) Metastatic insulinoma andglucagonoma from the pancreas responsible for specific peritumoral patterns of hepatic steatosis secondaryto local effects of insulin andglucagon on hepatocytes. Gastroenterology, 129(4): 1150, 1365.
- 12. Görg C., Bert T. (2005) Pictorial review: sonographic patterns of diffuse andfocal fattyinfiltration of the liver: differential diagnosis to metastatic liver disease. Onkologie, 28(12): 659–664.
- 13. Grossholz M., Terrier F., Rubbia L. et al. (1998) Focal sparing in the fattyliver as a sign of an adjacent space occupying-lesion. A.J.R. Am. J. Roentgenol., 171(5): 1391–1395.
- 14. Hamer O.W., Aguirre D.A., Casola G. et al. (2006) Fattyliver: imaging patterns andpitfalls. Radiographics, 26(6): 1637–1653.
- 15. Hepburn M.J., Vos J.A., Fillman E.P., Lawitz E.J. (2005) The accuracyof the report of hepatic steatosis on ultrasonographyin patients infectedwith hepatitis C in a clinical setting: a retrospective observational study. B.M.C. Gastroenterol., 5: 14.
- 16. Hoshiba K., Demachi H., Miyata S. et al. (1997) Fattyinfiltration of the liver distal to a metastatic liver tumor. Abdom. Imaging, 22(5): 496–498.
- 17. Itai Y. (2000) Peritumoral sparing of fattyliver: another important instance of focal sparing causedbya hepatic tumor. A.J.R. Am. J. Roentgenol., 174(3): 868−870.
- 18. Kallio T., Nevalainen P.I., Lahtela J.T. et al. (2001) Hepatic subcapsular steatosis in diabetic CAPD patients treatedwith intraperitoneal insulin. Description of a typical pattern. Acta. Radiol., 42(3): 323–325.
- 19. Karcaaltincaba M., Akhan O. (2007) Imaging of hepatic steatosis andfattysparing. Eur. J. Radiol, 61(1): 33–43.
- 20. Kato M., Saji S., Kanematsu M. et al. (1997) A case of liver metastasis from colon cancer masquerading as focal sparing in a fattyliver. Jpn J. Clin. Oncol., 27(3): 189–192.
- 21. Khalili K., Lan F.P., Hanbidge A.E. et al. (2003) Hepatic subcapsular steatosis in response to intraperitoneal insulin delivery: CT findings andprevalence. A.J.R. Am. J. Roentgenol., 180(6): 1601–1604.
- 22. Kim H.C., Choi S.H., Shin H.W. et al. (2005) Severityof ultrasonographic liver steatosis andmetabolic syndrome in Korean men andwomen. WorldJ. Gastroenterol., 11(34): 5314–5321 (http://www.wjgnet.com/1007-9327/11/5314.pdf).
- 23. Kyogoku S., Shiraishi A., Ozaki Y., Kurosaki Y. (2004) Focal sparing of segment 2 in fattyliver: US appearance. Radiat. Med., 22(5): 342−345.
- 24. Lefkowitch J.H. (2005) Morphologyof alcoholic liver disease. Clin. Liver Dis., 9(1): 37–53.
- 25. Lonardo A., Lombardini S., Ricchi M. et al. (2005) Review article: hepatic steatosis andinsulin resistance. Aliment. Pharmacol. Ther., 22: 64–70.
- 26. Lupsor M., Badea R. (2005) Imaging diagnosis andquantification of hepatic steatosis: is it an acceptedalternative to needle biopsy? Rom. J. Gastroenterol., 14(4): 419–425.
- 27. Martí-Bonmatí L., Peñaloza F., Villarreal E., Martinez M.J. (2005) Nonspecificityof the fat-sparing ring surrounding focal liver lesion at MR imaging. Acad. Radiol., 12(12): 1551–1556.
- 28. Mirowitz S.A., Lee J.K., Heiken J.P. (1990) Cavernous hemangioma of the liver: assessment of MR tissue specificitywith a simplifiedT2 index. J. Comput. Assist. Tomogr., 14(2): 223–228.
- 29. Mortelé K.J., Stubbe J., Praet M. et al. (2000) Intratumoral steatosis in focal nodular hyperplasia coinciding with diffuse hepatic steatosis: CT andMRI findings with histologic correlation. Abdom. Imaging, 25(2): 179–181.
- 30. Nomura H., Kashiwagi S., Hayashi J. et al. (1988) Prevalence of fattyliver in a general population of Okinawa, Japan. Jpn J. Med., 27(2): 142–149.
- 31. Oguzkurt L., Yildirim T., Torun D. et al. (2005) Hepatic vein Doppler waveform in patients with diffuse fattyinfiltration of the liver. Eur. J. Radiol., 54(20): 253–257.
- 32. Osawa H., Mori Y. (1996) Sonographic diagnosis of fattyliver using a histogram technique that compares liver andrenal cortical echo amplitudes. J. Clin. Ultrasound., 24(1): 25–29.
- 33. Palmentieri B., de Sio I., La Mura V. et al. (2006) The role of bright liver echo pattern on ultrasoundB-mode examination in the diagnosis of liver steatosis. Dig. Liver Dis., 38(7): 485–489.
- 34. Park S.H., Kim P.N., Kim K.W. et al. (2006) Macrovesicular hepatic steatosis in living liver donors: use of CT for quantitative andqualitative assessment. Radiology., 239(1): 105–112.
- 35. Prasad S.R., Wang H., Rosas H. et al. (2005) Fat-containing lesions of the liver: radiologic-pathologic correlation. Radiographics, 25(2): 321–331.
- 36. Saverymuttu S.H., Joseph A.E., Maxwell J.D. (1986) Ultrasoundscanning in the detection of hepatic fibrosis andsteatosis. Br. Med. J. (Clin. Res. Ed.), 292(6512): 13–15.
- 37. Schonfeld G., Patterson B.W., Yablonskiy D.A. et al. (2003) Fattyliver in familial hypobetalipoproteinemia: triglyceride assemblyinto VLDL particles is affectedbythe extent of hepatic steatosis. J. Lipid. Res., 44(3): 470–478.
- 38. Shen L., Fan J.G., Shao Y. et al. (2003) Prevalence of nonalcoholic fattyliver among administrative officers in Shanghai: an epidemiological survey. WorldJ. Gastroenterol., 9(5): 1106–1110.
- 39. Siegelman E.S., Rosen M.A. (2001) Imaging of hepatic steatosis. Semin. Liver. Dis., 21(1): 71–80.
- 40. Sohn J., Siegelman E., Osiason A. (2001) Unusual patterns of hepatic steatosis causedbythe local effect of insulin revealedon chemical shift MR imaging. A.J.R. Am. J. Roentgenol., 176(2): 471–474.
- 41. Tanoli T., Yue P., Yablonskiy D., Schonfeld G. (2004) Fattyliver in familial hypobetalipoproteinemia: roles of the APOB defects, intra-abdominal adipose tissue, andinsulin sensitivity. J. LipidRes., 45(5): 941–947.
- 42. Tchelepi H., Ralls P.W., Radin R., Grant E. (2002) Sonographyof diffuse liver disease. J. Ultrasound. Med., 21(9): 1023–1032.
- 43. Tom W.W., Yeh B.M., Cheng J.C. et al. (2004) Hepatic pseudotumor due to nodular fattysparing: the diagnostic role of opposed-phase MRI. A.J.R. Am. J. Roentgenol., 183(3): 721–724.
- 44. Vuppalanchi R., Cummings O.W., Saxena R. et al. (2007) Relationshipamong histologic, radiologic, andbiochemical assessments of hepatic steatosis: a studyof human liver samples. J. Clin. Gastroenterol., 41(2): 206–210.
- 45. Whitfield A.J., Barrett P.H., Robertson K. et al. (2005) Liver dysfunction andsteatosis in familial hypobetalipoproteinemia. Clin. Chem., 51(1): 266–269.
- 46. Yu A.S., Keeffe E.B. (2002) Nonalcoholic fattyliver disease. Rev. Gastroenterol. Disord., 2(1): 11–19.
- 47. Zezos P., Tatsi P., Nakos A. et al. (2006) Focal fattyliver sparing lesion presenting as a «pseudotumour»: case report. Acta Gastroenterol. Belg., 69(3): 323–326.
Резюме. Цель работы — на основании собственных наблюдений и данных литературы разработать алгоритм
ультразвукового исследования печени для диагностики ее стеатоза, изучить степени стеатоза
у пациентов с алкогольной болезнью печени и хроническими
вирусными гепатитами (ХВГ). Клиническое обследование проведено у 127 мужчин. Гиперэхогенная печень диагностирована у 108 больных. У 48% пациентов плохо различалась капсула печени и диафрагма. Гипоэхогенные зоны выявлены у 10% пациентов. Среди 108 пациентов чаще всего (48%) отмечали ІІІ, у 28% — ІІ и у 24% — І степень стеатоза печени. У больных вирусным гепатитом С значительно чаще диагностировали І степень, а у больных
вирусным гепатитом В — ІІІ степень стеатоза. ІІ и ІІІ степень стеатоза превалировали у пациентов с ХВГ, злоупотребляющих алкоголем. Предложен диагностический алгоритм ультрасонографичного обследования пациента для диагностики диффузного стеатоза печени и его степени. Гипоехогенные очаги у пациентов с диффузным стеатозом печени характерны
для стеатоза, однако для исключения другой патологии, особенно злокачественных новообразований, кроме ультрасонографии, требуются дополнительные
методы визуализации.
Ключевые слова: стеатоз печени, варианты стеатоза,
ультрасонография
Summary. The purpose of the study: on the basis of own observations and literary data to develop the algorithm of the ultrasonic study for diagnostics of the liver steatosis,
to study the steatosis degrees in patients with alcoholic
liver disease (АLD) and chronic viral hepatitіs (CVH). Clinical examination of 127 men was conducted. Hyperechogenic liver was diagnosed in 108 patients. The liver capsule and the diaphragm were badly visualized in 48% of patients. Hypoechogenic zones were found out in 10% of patients. Among 108 patients, the liver steatosis
of the third degree was revealed more often — in 48%, followed by the second (28%) and the first (24%) degrees. The second and the third degree of the liver steatosis prevailed in alcohol abused patients with CVH. The diagnostic
algorithm of ultrasonographic study for diagnostics
of the diffuse liver steatosis and its degree is offered. The hypoechogenic foci are characteristic for patients with diffuse liver steatosis, however to exclude other pathology, especially malignant tumors, ultrasonography should be supplemented with additional methods of visualization.
Key words: liver steatosis, variants of steatosis, ultrasonography
Адреса для листування:
Панчишин Юлія Мирославівна
79044, Львів, вул. Жуковського 10, кв. 29
e-mail: [email protected]





