Виды внутригрудных анастомозов трансплантата и пищевода
|
Вариант анастомоза |
Количество больных |
|
Конец толстой кишки в конец пищевода |
2 |
|
Конец желудка в конец пищевода |
2 |
|
Бок толстой кишки в бок пищевода |
4 |
|
Конец пищевода в бок желудка |
6 |
|
Конец толстой кишки в бок пищевода |
8 |
|
Всего |
22 |
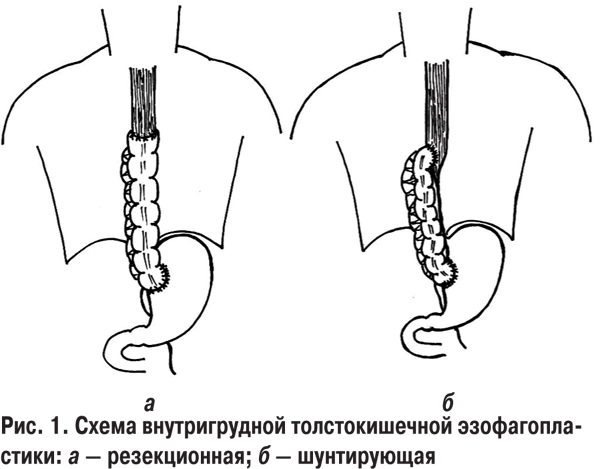
При шунтирующих пластиках мы отдаем, как и на шее, предпочтение анастомозу «конец толстой кишки в бок пищевода» (см. табл. 2). На наш взгляд, он более физиологичен, а просвета толстой кишки достаточно для широкого соустья.
При резекционных операциях примерно поровну использовали анастомозы «конец в конец» и «конец в бок».
При формировании соустий «конец в конец» важно пересечь пищевод в зоне неизмененной стенки и подтвердить это экспресс-исследованием, иначе значительно повышается угроза стенозирования анастомоза.
При создании анастомоза по типу «конец в бок» и «бок в бок» для того, чтобы избежать образования «слепого мешка» собственного пищевода, трансплантат соединяют с пищеводом как можно ближе к стриктуре, но не захватывая в анастомоз рубцово-измененную стенку.
Основные моменты внутрибрюшного этапа этих операций схожи с этапами субтотальной и тотальной эзофагопластик. Учитывая предварительную подготовку сосудов будущего толстокишечного трансплантата, мы всегда использовали изоперистальтический вариант расположения участка левой половины толстой кишки с питающей ножкой a. colica sinistra. Проблемного кровоснабжения трансплантата не было ни в одном случае. После выкраивания трансплантата и создания межкишечного соустья мы мобилизовывали левую долю печени рассечением треугольной связки и отводили ее вправо печеночным зеркалом. После мобилизации и взятия на турникет абдоминального отдела пищевода рассекали правую медиальную ножку диафрагмы и, раздвигая пальцами ткани, создавали канал в заднем средостении правее пищевода, стараясь не повредить медиастинальную плевру, чтобы не вызвать пневмоторакс справа. Лучше вскрывать средостенную плевру после торакотомии. Проведенный позади желудка трансплантат укладывали в этот канал. Создавали губовидный толстокишечно-желудочный анастомоз, проводили через гастростому зонд в тощую кишку и завершали брюшной этап эзофагопластики дренированием. Далее выполняли боковую торакотомию по V межреберью. Следует отметить, что при рубцовых стенозах пищевода, начинающихся выше уровня ThVII, мы использовали толстокишечный трансплантат, а с уровня ThVII и ниже — желудочный. Поэтому проблем с достаточной длиной желудочного трансплантата даже при наличии гастростомы и необходимости проксимальной резекции (в случаях стенозов после предшествующих операций) желудка у нас не возникало.
После торакотомии выполняли медиастинотомию и выводили кишечный трансплантат в правую плевральную полость. Контурируя уровень облитерации пищевода с помощью толстого желудочного зонда, определяли уровень формирования кишечно-пищеводного анастомоза по типу «конец в бок» (8), «бок в бок» (4) или «конец в конец» (2), который применили в случаях протяженных стенозов с облитерацией на 1–2 грудных позвонка ниже начала стеноза. Это позволило избежать формирования «слепого мешка» собственного пищевода. Кишечно-пищеводный анастомоз в груди создавали двухрядным, узловым, атравматическим швом (викрил 3/0). Несколькими дополнительными разгрузочными швами крепили анастомоз к медиастинальной плевре.
В случаях резекции пищевода с гастроэзофагопластикой (8), учитывая уровень рубцовых изменений пищевода с ThVII и ниже, у 5 больных в качестве доступа использована лапароторакотомия слева по VII межреберью. В 3 наблюдениях применили лапаротомию и торакотомию по V межреберью справа. В связи с формированием соустья пищевода и желудка ниже уровня бифуркации трахеи длина трансплантата всегда была достаточной и для надежности кровоснабжения мы всегда выполняли резекцию кардии и дна желудка по А.А. Шалимову. Питающими сосудами были a. gastrica et a. gastroepiploica dextra. Мобилизацию желудка всегда дополняли пилоропластикой, что являлось надежной профилактикой застоя в желудке. Мобилизацию пищевода проводили в зоне его резекции и наложения анастомоза. При пластике пищевода желудком у 2 пациентов создан анастомоз «конец пищевода в конец желудка» и у 6 — «конец пищевода в бок желудка (рис. 2).
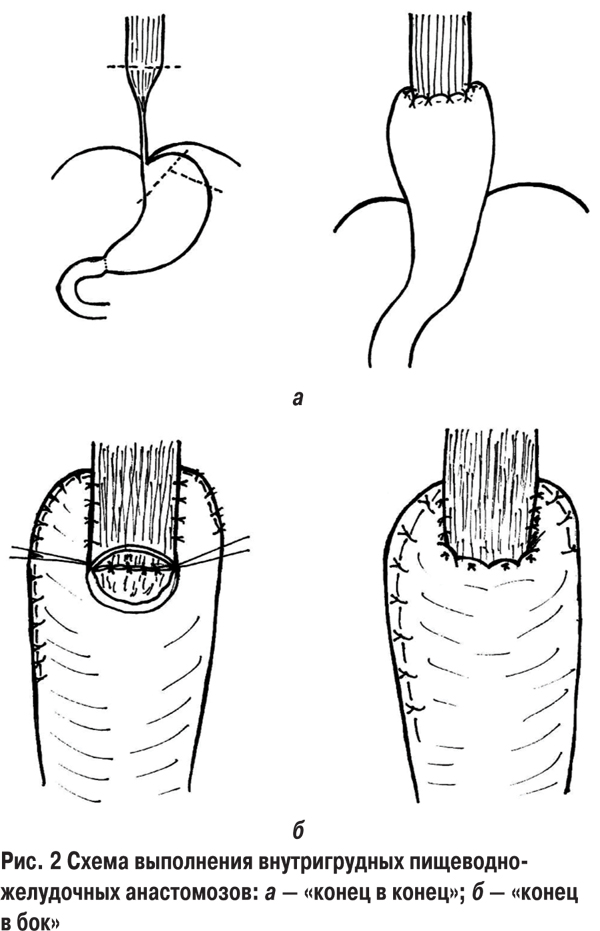
Внутригрудной анастомоз пищевода с желудком также формировали двумя рядами узловых швов (викрил 3/0) на толстом желудочном зонде. Для второго ряда можно использовать П-образные швы, они менее подвержены прорезыванию и облегчают инвагинацию пищевода в желудочный трансплантат. Для разгрузки анастомоза накладывали редкие швы между медиастинальной плеврой и желудком. Для декомпрессии желудка вводили тонкий назогастральный зонд, который используется и для питания со 2–3-х суток после операции до момента начала кормления через рот. Анастомоз «конец пищевода в бок желудка» более надежен, так как пищевод укладывается на желудочный трансплантат и фиксируется к нему, что является хорошей профилактикой натяжения анастомоза и надежным прикрытием ½ окружности анастомоза, а также такой вариант анастомоза по типу «чернильницы- непроливайки» обладает лучшим антирефлюксным механизмом. Внутригрудной этап завершали дренированием плевральной полости с подведением дренажа к линии анастомоза и удалением его в послеоперационный период только после проверки состоятельности анастомоза и начала кормления через рот.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
У 11 пациентов развились различные послеоперационные осложнения (табл. 3).
Таблица 3
Ранние послеоперационные осложнения после внутригрудной эзофагопластики
|
Характер осложнения |
Количество |
|
Гидроторакс |
8 |
|
Гидропневмоторакс |
1 |
|
Гиповентиляция легкого |
2 |
|
Ателектаз доли легкого |
2 |
|
Абсцесс легкого |
1 |
|
Эмпиема плевры |
1 |
|
Несостоятельность анастомоза |
2 |
|
Длительное нарушение эвакуации из желудка |
1 |
|
Всего |
18 |
Анализ зависимости осложнений от вида пластики показал, что чаще они возникали после гастроэзофагопластики (у 75% пациентов) в сравнении с внутригрудной колоэзофагопластикой (35,7%) (р≤0,05).
Наиболее грозным осложнением при внутригрудной пластике пищевода считается несостоятельность анастомоза, отмеченная нами у 2 (9%) пациентов после операции Гарлока. В 1 случае недостаточность соустья была диагностирована на 6-е сутки после операции, в другом — на 13-е. Диагностика этого осложнения основана на наблюдении за плевральным дренажом, который мы подводим к анастомозу и не удаляем до начала кормления через рот. При появлении субфебрильной температуры и мутного экссудата по дренажу необходимо сразу уточнить состояние анастомоза и плевральных полостей.
Для этого даем выпить больному окрашенный (метиленовым синим или бриллиантовым зеленым) физиологический раствор, который при несостоятельности появляется в плевральном дренаже. Вторым шагом выполняем эзофагографию с водорастворимым контрастом в положении Тренделенбурга и рентгеноскопию плевральных полостей. В обоих случаях выявляли затек контраста в левую плевральную полость, у 1 пациента при этом создавалось депо рентгенконтраста в плевре, что послужило показанием для дополнительного дренирования. У другого больного дренаж обеспечивал хороший отток из зоны несостоятельности, но у него сформировался абсцесс левого легкого, который хорошо дренировался через бронх. Оба пациента излечены консервативно. У первого несостоятельность устранена в течение 17 сут, а у второго для ликвидации абсцесса легкого и дефекта анастомоза потребовалось 30 сут. Контрольная эзофагография показала у них удовлетворительную проходимость анастомозов и отсутствие затеков контраста за пределы соустий. Отметим, что в отдаленный период у этих пациентов развился стеноз пищеводно-желудочных анастомозов для устранения которого потребовалось бужирование.
Если из 8 пищеводно-желудочных соустий у 2 (25%) развилась несостоятельность, то после 14 внутригрудных толстокишечных эзофагопластик нами не выявлено ни одного такого осложнения.
Использование подготовленного толстокишечного трансплантата в сочетании с исключением гастростаза, который всегда в какой-то степени возникает после перемещения желудка в плевральную полость (при гастроэзофагопластике), травмы блуждающих нервов, а также лучшим сопоставлением стенок анастомозируемых сегментов пищевода и толстой кишки, показало преимущество (р<0,05) внутригрудной толстокишечной эзофагопластики перед пластикой желудком в плане развития несостоятельности соустья пищевода с трансплантатом.
В отличие от такого специфического осложнения, как несостоятельность анастомоза, плевролегочные осложнения были присущи обоим вариантам сегментарной внутригрудной эзофагопластики. И обусловлены были, на наш взгляд, прежде всего не видом пластики пищевода, а самим чресплевральным вмешательством, сочетающимся с травмой правого или левого купола диафрагмы. Эти обстоятельства обусловливали ухудшение вентиляции легкого на стороне операции. Так, гиповентиляция левого легкого выявлена после операции Гарлока у 1 пациента, а правого легкого также у 1 пациента — после внутригрудной шунтирующей толстокишечной эзофагопластики. Ателектаз средней (1) и нижней (1) доли правого легкого отмечали после толстокишечной эзофагопластики.
Такое осложнение, как гидроторакс, было одинаково часто после желудочной (4) и толстокишечной (4) эзофагопластик.
Эмпиему плевры справа отмечали у 1 пациента после внутригрудной резекционной толстокишечной пластики пищевода. Излечена была дренированием «от дна» с последующей ежедневной санацией.
Таким образом, у 22 пациентов развилось 15 (68,2%) плевролегочных осложнений. Только в 2 случаях (абсцесс легкого, эмпиема плевры) осложнения носили стойкий характер и требовали длительного лечения. Остальные патологические состояния легких (гиповентиляция, ателектаз) и плевры (гидроторакс, гидропневмоторакс) устранялись в короткий срок благодаря следующим отработанным диагностическим и лечебным мероприятиям:
1) рентгеновское исследование органов грудной клетки на 2-й день после операции;
2) санационная фибробронхоскопия на 2-й день после операции;
3) пункция или дренирование при выявлении плевральных осложнений;
4) рентгеновский контроль после устранения осложнения;
5) активизация больных в ранний срок после операции.
Летальных исходов в этой группе больных не было.
ВЫВОДЫ
Таким образом, дифференцированный подход в выборе трансплантата при различных по протяженности внутригрудных сегментарных эзофагопластиках, подготовка толстокишечного трансплантата, использование по показаниям резекционного и шунтирующего вариантов пластики пищевода позволяют сохранить значительный сегмент неизмененного собственного пищевода и получить хорошие функциональные результаты в отдаленный период.
ЛИТЕРАТУРА
- Петровский Б.В. (1947) Внутриплевральная резекция пищевода, кардии и тотальная гастрэктомия с одновременным эзофагогастро- и эзофагоеюноанастомозом при раке. Хирургия, 9: 79–94.
- Петровский Б.В., Ванцян Э.Н., Тощаков Р.А. (1967) Пластика пищевода при рубцовой стриктуре коротким кишечным трансплантатом. Хирургия, 1: 154–157.
- Саенко В.Ф., Андреещев С.А., Кондратенко П.Н., Мясоедов С.Д. (2002) Восстановительные операции по поводу рубцовой послеожоговой стриктуры пищевода. Клін. хірургія, 5–6: 4.
- Черноусов А.Ф., Андрианов В.А., Домрачеев С.А., Богопольский П.М. (1998) Опыт 1100 пластик пищевода. Хирургия, 6: 21–25.
- Черноусов А.Ф., Богопольский П.М., Курбанов Ф.С. (2000) Хирургия пищевода. Медицина, Москва, 350 с.
- Шалимов А.А., Гоер Я.В., Шалимов С.А. (1979) Внутригрудная пластика пищевода. Клин. хирургия, 10: 44–45.
- Garlock J.H. (1944) The re-establishment of esophago-gastric continuity following resection of esophagus for carcinoma of the middle third. Surg. Gynecol. Obstet., 78(1): 23–28.
- Garlock J.H. (1947) Technical problems in the surgical treatment of carcinoma of the esophagus and upper stomach. J. Thorac. Surg., 16: 215.
- Ohsawa T. (1933) Surgery of the esophagus. Arch. Jpn. Chir., 10(111): 646–653.
Резюме. Викладено досвід внутрішньогрудної пластики стравоходу при його рубцевому стенозі. Наведено варіанти операцій залежно від довжини ураженого сегмента стравоходу. Мета виконаних пластик стравоходу — зберегти незмінену частину власного стравоходу і тим самим досягти кращих функціональних результатів порівняно із субтотальною і тотальною езофагопластикою. Летальних випадків не було. Функція відновленого стравоходу у віддалений період хороша.
Ключові слова:рубцевий стеноз, стравохід, пластика стравоходу
Summary. Experience of intrathoracic esophagoplasty at cicatrical esophageal stenosis is represented in the article. The variants of operations are expounded depending on the length of the affected segment of the esophagus. The purpose of the performed esophagoplasties was to save the unaffected part of the esophagus and thus to obtain the best functional results in comparison with subtotal and total esophagoplasty. Fatal outcomes were not observed. The function of the restored esophagus in a period was good.
Key words: cicatrical stenosis, esophagus, esophagoplasty