ВСТУП
Підвищений інтерес до ідентифікації прогностичних факторів ішемічного інсульту та вивчення їх впливу на клінічний перебіг і наслідки визначаються необхідністю удосконалення лікувальної тактики, попередження прогресування інсульту, медичних ускладнень, зменшення вираженості інвалідизації та фатальних наслідків.
У публікаціях попередніх і останніх років оцінено різні прогностичні фактори клінічного перебігу і наслідків мозкового інсульту (Uchino K. et al., 2001; Kasner S.E. еt al., 2001; Bhalla A. et al., 2002; Lernfelt B. et al., 2002; Prosser J. et al., 2007). Одні автори вважають, що у більшості випадків наслідки ішемічного інсульту визначаються патогенетичним механізмом розвитку захворювання, калібром ураженої артерії, локалізацією осередку ураження (Moroney J.T. et al., 1998; Dávalos A. et al., 1999; Ferro J.M., 2003). В інших роботах визначальна роль для прогнозу відводиться вихідному неврологічному дефіциту, тоді як підтип інсульту має менше значення (Schlegel D. et al., 2003; Ng Y.S. et al., 2007). Несприятливі наслідки ішемічного інсульту деякі автори пов’язують із великим розміром вогнища ішемії та порушенням свідомості в 1-й день хвороби (Saunders D.E. et al., 1995).
На клінічний перебіг інсульту суттєво впливають також неврологічні ускладнення (набряк головного мозку, дислокаційний синдром, повторне порушення мозкового кровообігу, геморагічна трансформація інфаркту мозку), медичні або неневрологічні ускладнення (пневмонія, тромбоемболія легеневої артерії, інфаркт міокарда, тромбоз глибоких вен кінцівок, шлунково-кишкові кровотечі, інфекція сечостатевого тракту, пролежні тощо) та зміни системних фізіологічних показників організму (артеріальний тиск (АТ), температура тіла, рівень глюкози в крові, порушення системи гемостазу) (Парфенов В.А., Вахнина Н.В., 2001; MacWalter R.S. et al., 2002; Castillo J. et al., 2004; Bae H.J. et al., 2005; Vargas M. еt al., 2006).
Кожен із наведених факторів помітно впливає на ступінь порушення неврологічних функцій та летальність. Безумовно, визначальним для прогнозу ішемічного інсульту є не один фактор, а їх поєднання, комплекс порушень, патогенетично зв’язаних між собою. Однак вивченню синергічної дії предикторів на наслідки ішемічного інсульту присвячені лише поодинокі дослідження. До того ж їх дані здебільшого суперечливі (Weimar C. et al., 2002; Johnston K.C. et al., 2003; Яворская В.А., Фломин Ю.В., 2004). Тому дослідження особливостей впливу на клінічний перебіг і наслідки ішемічного інсульту не окремих потенційних предикторів, а їх поєднань у взаємозв’язку з системною серцево-судинною патологією допоможе поліпшити курацію таких хворих, прогнозувати наслідки інсульту.
Мета роботи — визначити частоту окремих найвагоміших прогностичних факторів та оцінити їх поєднану дію у взаємозв’язку з наявною серцево-судинною патологією на клінічний перебіг і наслідки гострого ішемічного інсульту.
ОБ’ЄКТ і МЕТОДИ ДОСЛІДЖЕННЯ
До дослідження було залучено 287 хворих з гострим ішемічним інсультом віком від 41 до 82 років (середній вік — 65,2±8,9 року). Чоловіків було 135, жінок — 152. Діагноз «ішемічний інсульт», локалізацію вогнища ураження та його розмір підтверджували за допомогою спіральної комп’ютерної томографії (СКТ), магнітно-резонансної томографії (МРТ) головного мозку, у фатальних випадках — даними автопсії. Підтип ішемічного інсульту визначали за критеріями TOAST (Adams Н.P. Jr, 1993). Виділили такі варіанти: атеротромботичний інсульт — у 110 (38,3%); кардіоемболічний — у 113 (39,4%); лакунарний інфаркт — у 40 (13,9%); гемодинамічний інсульт — у 10 (3,5%), гемореологічний — у 8 (2,8%) та інсульт з нез’ясованим патогенетичним механізмом — у 6 (2,1%) хворих.
У 245 (85,4%) пацієнтів гостре порушення мозкового кровообігу виникло в каротидному басейні, а у 42 (14,6%) — у вертебрально-базилярному.
Залежно від наслідків ішемічного інсульту хворих розподілили на дві групи: 1-шу становили 147 (51,2%) пацієнтів зі сприятливими наслідками захворювання, 2-гу — 140 (48,8%) обстежених із фатальними наслідками інсульту. Здебільшого хворих було госпіталізовано до клініки в перші 24 год від початку інсульту. Вираженість неврологічного дефіциту оцінювали за шкалою Національного інституту інсульту США (National Institutes of Health Stroke Scale — NIHSS) при госпіталізації, в 1- шу, 7- му, 21- шу добу захворювання. Рівень порушення свідомості визначали за шкалою ком Глазго. Для оцінки функціональних наслідків інсульту використовували індекс Бартел.
Стан магістральних артерій голови та інтракраніальних судин оцінювали методом ультразвукової допплєрографії (УЗДГ). Визначали наявність стенозу внутрішньої сонної артерії в екстракраніальному відділі, середньої мозкової артерії, хребетних та основної артерій. Проводили добове моніторування АТ у перші дні інсульту, за допомогою електрокардіограми фіксували порушення серцевого ритму, оцінювали лабораторні показники: глюкоза крові, швидкість осідання еритроцитів, рівень лейкоцитів, фібриногену, β-нафтоловий тест. Статистичну обробку отриманих даних проводили за допомогою програми SPSS 13.0.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Результати нашого дослідження свідчать, що важливим для прогнозу ішемічного інсульту є віковий фактор. Зокрема, середній вік осіб із фатальними наслідками захворювання становив 70,8±9,1 року, водночас у групі обстежених зі сприятливими наслідками ішемічного інсульту він становив 62,4±10,6 року (р<0,01). Несприятливий прогноз інсульту у хворих, безперечно, зумовлений більш значною поширеністю і тривалістю перебігу артеріальної гіпертензії, ішемічної хвороби серця, наявністю миготливої аритмії, атеросклерозу церебральних судин, цукрового діабету. Зокрема, поєднання артеріальної гіпертензії, атеросклерозу судин, миготливої аритмії, цукрового діабету виявлялося у 28,6% хворих із фатальними наслідками. Ще у 35,7% випадків на перебіг інсульту впливала поєднана дія артеріальної гіпертензії, атеросклерозу судин і миготливої аритмії.
Рівень свідомості у хворих зі сприятливими і фатальними наслідками при госпіталізації також достовірно відрізнявся. У пацієнтів 1-ї групи стан свідомості за шкалою ком Глазго становив 14,8±0,5 бала, а в обстежених 2-ї групи — 12,2±2,9 бала (р<0,05). До того ж у 102 (72,8%) обстежених із фатальними наслідками виявилося порушення свідомості за шкалою ком Глазго в середньому 10,7±2,3 бала: з них 19 (13,6%) пацієнтів госпіталізовано в коматозному стані (6,9±0,7 бала), 52 (37,1%) — у стані сопора (10,6±1,0 бала), ще у 31 (22,1%) хворого виявляли оглушення (13,4±0,4 бала).
Статистичний аналіз показав, що рівень порушення свідомості тісно взаємозв’язаний із фатальним наслідком інсульту (коефіцієнт кореляції Пірсона становив r=0,62). Результати динамічних спостережень свідчать, що у разі пригнічення свідомості пацієнта нижче 12 балів за шкалою ком Глазго протягом 1–2-ї доби відзначали несприятливий прогноз для виживання. За нашими спостереженнями сопор або кома частіше виникали у разі локалізації великого осередку інфаркту в підкірково-капсулярній ділянці півкуль великого мозку. У цьому разі він супроводжувався набряком тканини мозку, мас-ефектом, що призводило до розвитку вторинного дислокаційно-стовбурового синдрому. Пригнічення свідомості було зумовлене патофізіологічними процесами, які безпосередньо впливають на висхідну активуючу сітчасту формацію стовбура мозку. Як відомо, саме великі супратенторіальні ураження призводять до вторинної компресії стовбура мозку (Віничук С.М., Прокопів М.М., 2006).
Важливе значення для прогнозування наслідків ішемічного інсульту має оцінка стану фонового неврологічного дефіциту хворого на мозковий інсульт. Результати аналізу клінічних даних свідчать, що у хворих 1- ї групи початковий об’єм неврологічних порушень у середньому становив 9,5±3,5 бала за шкалою NIHSS, що відповідало інсульту середнього ступеня тяжкості. Серед них у 65 (44,2%) пацієнтів діагностували інсульт із неврологічним дефіцитом легкого і в 47 (32%) — середнього ступеня тяжкості, у решти — 35 (23,8%) — тяжкий ішемічний інсульт. Об’єм неврологічних порушень у хворих 2-ї групи становив 17,2±3,1 бала і був достовірно вищим (р<0,001) порівняно з пацієнтами 1-ї групи. У 102 (72,8%) хворих з фатальними наслідками вихідний неврологічний дефіцит відповідав надто тяжкому стану (18,9±1,3 бала). Неврологічний статус у них нерідко проявлявся порушенням свідомості (сопор, кома), парезом погляду, геміплегією з низьким м’язовим тонусом кінцівок, геміанестезією, розладами функції тазових органів. Ще у 38 (27,2%) обстежених неврологічний дефіцит відповідав інсульту середнього (11,2±0,9 бала) і тяжкого (14,1±0,6 бала) ступеня тяжкості. Протягом періоду спостереження у них реєстрували прогресуючий перебіг інсульту, поглиблювався неврологічний дефіцит, набряк головного мозку, нерідко виникали медичні ускладнення.
Результати нашого дослідження виявили взаємозв’язок між розміром осередку інфаркту і тяжкістю неврологічного дефіциту при госпіталізації. Зокрема, у хворих 1-ї групи за даними СКТ головного мозку об’єм осередку ішемії в середньому становив 35,3±15,2 см³. У 2-й групі з фатальними наслідками за даними нейровізуалізаційного обстеження та автопсії у 109 (78%) померлих виявляли великі інфарктні осередки з локалізацією в підкірково-капсулярній ділянці чи в лобно-тім’яно-скроневій частках півкуль головного мозку. Розміри вогнища ураження сягали в середньому 154,1±63,8 см³ (р<0,001). Проведений кореляційний аналіз показав статистично значущий взаємозв’язок між розміром ішемічного вогнища та початковим неврологічним дефіцитом (коефіцієнт кореляції Пірсона становив r=0,6). До того ж результати нашого дослідження виявили взаємозв’язок між об’ємом ішемічного пошкодження тканини мозку та несприятливими наслідками інсульту (коефіцієнт кореляції — r=0,5).
На клінічний перебіг та наслідки ішемічного інсульту значний вплив справляли локалізація вогнища ішемії, а також калібр ураженої артерії, у якій сталося порушення кровообігу. У хворих 1-ї групи здебільшого виявляли субкортикальний інсульт — 67 (45,7%), інфаркт кіркової локалізації — 58 (39,6%) та задньоциркулярний інфаркт — 22 (17,7%). Вони характеризувалися значною варіабельністю розмірів осередку ураження, відмінностями в механізмі їх розвитку (тромбоз, оклюзія), калібром ураженої судини (гілки середньої (СМА), передньої (ПМА) та задньої (ЗМА) мозкових артерій, короткі або довгі огинальні, парамедіанні артерії хребетних і основної артерій, перфорівні артерії), а також індивідуальними особливостями колатерального кровообігу по судинах вілізієвого кола. Все це визначало менший початковий об’єм неврологічного дефіциту і сприятливі наслідки захворювання.
У 16 (11,4%) хворих 2-ї групи ішемічний інсульт був зумовлений ураженням великих магістральних судин голови в екстракраніальному відділі. У них відзначали ознаки порушення функцій не лише кірково-підкіркових структур, а навіть всієї півкулі головного мозку (рис. 1). Виражений неврологічний дефіцит виявляли і в разі ураження основного стовбура СМА або інтракраніального відділу внутрішньої сонної артерії (ВСА) (територіальний інсульт). У 104 (74,3%) хворих із фатальними наслідками інсульту вогнище інфаркту займало більше половини території кровопостачання СМА. Великовогнищевий інфаркт призводив до вимушеної нерухомості хворого, що значно підвищувало ризик розвитку медичних ускладнень, які погіршували перебіг та наслідки захворювання. Ще у 20 (14,3%) пацієнтів із фатальними наслідками велике ішемічне вогнище із середніми розмірами 45,7±9,8 см3 локалізувалося у стовбурі головного мозку, що призводило до порушення життєвоважливих функцій та їх смерті в 1-шу добу захворювання.
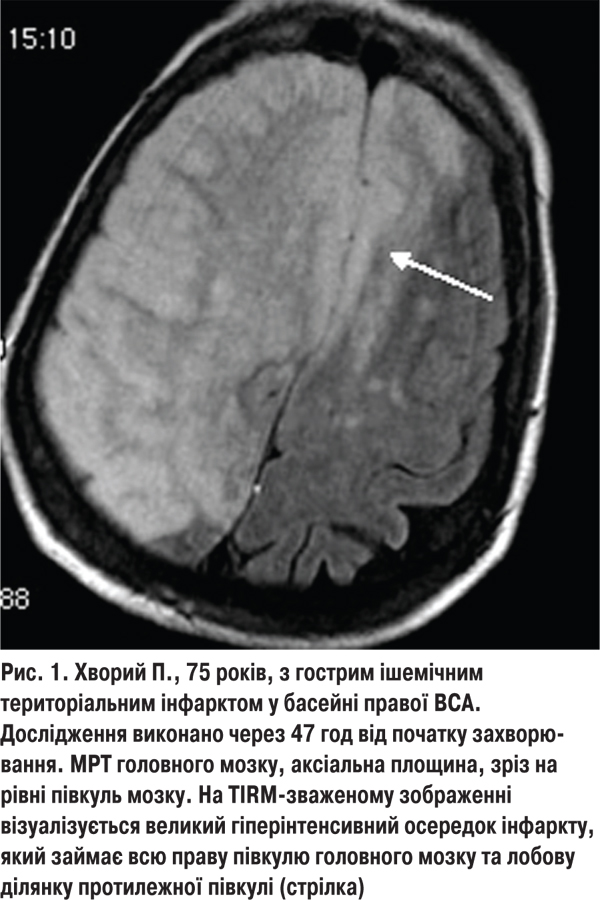
Нами проаналізовано також наслідки ішемічного інсульту залежно від його підтипу. У 40 (27,2%) хворих 1-ї групи гостре порушення мозкового кровотоку виникало внаслідок ураження (плазморагії, фібриноїдний некроз, гіаліноз) дрібних перфорівних артерій каротидного або вертебрально-базилярного басейнів. Це призводило до розвитку лакунарних інфарктів. Клінічно вони проявлялися у 32 (21,8%) хворих чисто моторним або сенсорним інсультом, атаксичним геміпарезом — у 5 (3,4%), ознаками екстрапірамідної недостатності — у 3 (2%) хворих. Неврологічний дефіцит у них за шкалою NIHSS у середньому становив 7,1±1,5 бала, що відповідало інсульту легкого ступеня тяжкості. Звичайно, у таких пацієнтів відзначали швидкий темп відновлення втрачених неврологічних функцій впродовж перших 7–14 діб. На 21- шу добу об’єм неврологічного дефіциту становив 2,0±1,1 бала, а рівень повсякденної життєвої активності за індексом Бартел перевищував 95 балів. Фатальних наслідків у пацієнтів із лакунарним інфарктом не було.
Як уже зазначалось, атеросклеротичний підтип виявлено у 110 пацієнтів. Він виникав на тлі атеросклеротичного ураження магістральних судин голови в екстракраніальному відділі або інтракраніальних судин, їх стенозу чи оклюзії; у 39 (26,5%) хворих 1-ї групи — на фоні атеросклеротичного стенозу ВСА. За даними УЗДГ здебільшого переважали гемодинамічно незначущі стенози (<50%) магістральних артерій голови в екстракраніальному відділі. Неврологічний дефіцит у них в 1-шу добу захворювання в середньому становив 10,7±2,8 бала за шкалою NIHSS. Після лікування 29 (74,4%) хворих не потребували сторонньої допомоги у виконанні найважливіших життєвих функцій, а об’єм неврологічних порушень становив 6,3±1,8 бала. Решта 10 (25,6%) пацієнтів були залежними від сторонньої допомоги в повсякденному житті. Результати аналізу фатальних 71 (50,7%) випадків з атеротромботичним підтипом ішемічного інсульту свідчать, що за даними УЗДГ та автопсії виявляли гемодинамічно значущі стенози просвіту судини (>75%) — ВСА в екстракраніальному відділі, основної чи хребетних артерій. У 12 (8,6%) померлих з атеротромботичним підтипом інфаркт мозку локалізувався в судинах вертебрально-базилярного басейну (ВББ). Несприятливі наслідки інсульту у них пояснювалися системним атеросклерозом церебральних і коронарних судин, розповсюдженою гіпоперфузією тканини мозку, циркуляторно-метаболічними порушеннями.
Із 113 обстежених з кардіоемболічним підтипом інфаркту мозку в 44 (29,9%) хворих 1-ї групи найчастішим джерелом емболії був атеросклеротичний або постінфарктний кардіосклероз із миготливою аритмією, що спричиняло ураження СМА на різних рівнях і зумовлювало відповідну клініку інфаркту мозку в кожному конкретному випадку. У 6 (4,1%) хворих виникав територіальний інфаркт, який був зумовлений оклюзією головного стовбура СМА (рис. 2). У такому разі спостерігався виражений початковий неврологічний дефіцит і повільні темпи відновлення втрачених неврологічних функцій. У 23 (15,6%) хворих ішемічне вогнище було зумовлене закупоркою глибоких гілок СМА і локалізувалось у підкірково-капсулярній ділянці півкулі головного мозку. У 15 (10,2%) хворих ураження кіркових гілок СМА або ПМА призводило до розвитку поверхневих кортикальних інфарктів, а клінічна картина характеризувалася швидким регресом осередкових неврологічних симптомів. Фоновий неврологічний дефіцит за шкалою NIHSS у хворих з кардіоемболічним підтипом ішемічного інсульту і сприятливими наслідками становив 11,6±2,6 бала, а на 21- шу добу — 6,5±1,3 бала. Після лікування 34 (77,2%) пацієнти не потребували сторонньої допомоги у виконанні найважливіших життєвих функцій, водночас 10 (22,8%) хворих залежали від сторонньої допомоги.
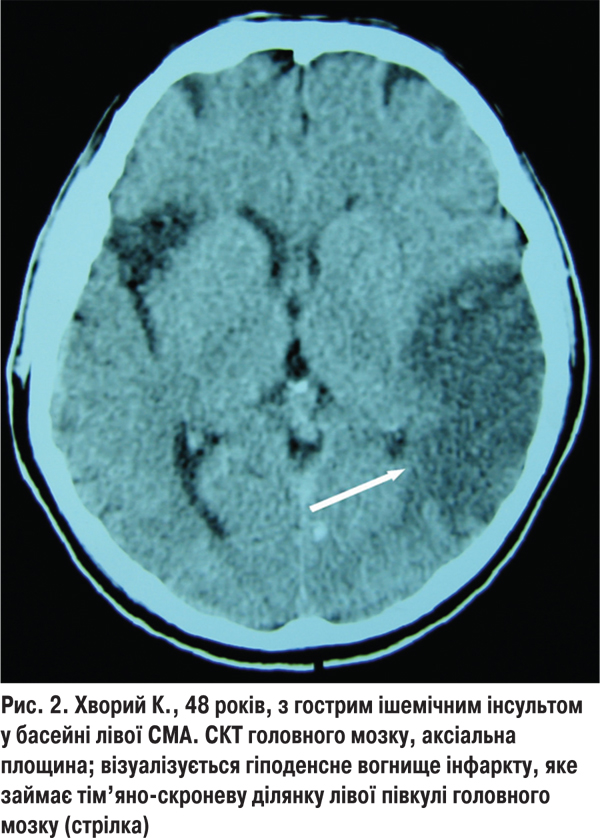
У 69 (49,3%) пацієнтів із кардіоемболічним інсультом і фатальними наслідками в анамнезі виявлялася постійна форма миготливої аритмії (>15 років), а суб’єкти здебільшого не приймали антиагрегантів та непрямих антикоагулянтів (варфарин). За клінічними та нейровізуалізаційними ознаками у 61 (43,6%) пацієнта виявлялось ураження головного стовбура СМА, що призводило до розвитку територіального інфаркту мозку. У хворих із фатальними наслідками кардіоемболічний підтип частіше проявлявся порушенням свідомості (сопор, кома), вираженим неврологічним дефіцитом за шкалою NIHSS (18,3±3,2 бала), а методами нейровізуалізації виявлялося велике вогнище ішемії (>100 см3). У 8 (5,7%) хворих із кардіоемболічним інсультом смерть настала внаслідок гострого порушення мозкового кровообігу в судинах ВББ.
У 8 (2,8%) пацієнтів з інсультом, який виник на фоні гемореологічної оклюзії судин головного мозку, початковий неврологічний дефіцит становив 9,2±0,8 бала, а зворотний розвиток неврологічного дефіциту був суттєвим (2,8±0,4 бала) внаслідок швидкого відновлення кровотоку та покращання реологічних властивостей крові. Сприятливі наслідки ішемічного інсульту також фіксували у 10 (3,5%) пацієнтів з гемодинамічним інсультом та у 6 (2,1%) — з нез’ясованим підтипом захворювання.
Таким чином, несприятливий перебіг і наслідки ішемічного інсульту в основному виникали у разі розвитку атеротромботичного чи кардіоемболічного підтипів.
Прогнозувати наслідки інсульту можна з урахуванням особливостей змін на СКТ головного мозку у перші години. Деякі автори вважають, що в перші 48 год після виникнення ішемічного інсульту верифікувати вогнище ішемії за даними СКТ головного мозку складно внаслідок його ізоденсної стадії, у якій патологічний осередок за інтенсивністю не відрізняється від незміненої мозкової тканини (Трофимова Т.Н. и соавт., 2005). За даними нашого спостереження у 49 (35%) хворих з ішемічним інсультом і летальним наслідком уже в перші 12 год після початку захворювання виявлено масивне ішемічне вогнище в басейні ВСА з перифокальним набряком тканини мозку і мас-ефектом. Це пояснюється швидким формуванням великого інфарктного ядра внаслідок повної оклюзії основного стовбура СМА або ВСА та відсутністю компенсації через систему колатерального кровотоку. Тому можна вважати, що рання поява на СКТ головного мозку (в перші 12 год після розвитку інсульту) великого гіподенсного вогнища в басейні СМА є несприятливим фактором для прогнозу захворювання.Однією з причин ранньої смерті у 98 (70%) хворих 2-ї групи в перші 5 діб був набряк тканини головного мозку, який призводив до дислокаційного синдрому з порушенням функції стовбурових структур. За даними СКТ та на автопсії у них було виявлено великі вогнища ішемії (>80 см3) з мас-ефектом та перифокальним набряком тканини мозку, що проявлялося звуженням підпавутинного простору та згладженістю борозен на боці осередку ураження.
Нами проаналізовано також вплив деяких системних показників (АТ, рівень глюкози в крові, параметри гемостазу) на розвиток набряку мозку та поглиблення неврологічного дефіциту. Як виявилося, артеріальну гіпертензію в перші години інсульту реєстрували у 103 (70%) пацієнтів 1-ї групи та у 105 (75%) — 2-ї групи (середні показники систолічного АТ становили 163,7±38,7 мм рт. ст та 166,4±33,0 мм рт. ст. відповідно). У перші 3 доби після інсульту у 41 (28%) пацієнта 1-ї групи відзначали нормалізацію показників АТ без прийому гіпотензивних засобів. Тому підвищення АТ можна пояснити стресовою реакцією на церебральну подію.
Щодо осіб із фатальними наслідками інсульту, то тривалість захворювання на артеріальну гіпертензію у них становила >10 років, а гіпотензивні препарати вони здебільшого регулярно не приймали. У 56 (40%) осіб із несприятливими наслідками інсульту в перші години захворювання виявляли систолічну артеріальну гіпертензію, рівень систолічного АТ у них перевищував 180 мм рт. ст. Серед пацієнтів зі сприятливими наслідками лише у 35 (24%) обстежених показники систолічного АТ перевищували рівень 180 мм рт. ст. Високі показники систолічного АТ за наявності великовогнищевого інфаркту зумовлювали зрив реакції авторегуляції мозкового кровообігу, що, звичайно, значно поглиблювало набряк тканини головного мозку.
У 56 (38%) хворих зі сприятливими наслідками інсульту виявлялася стресова гіперглікемія. Середні показники рівня глюкози становили 7,5±3,4 ммоль/л. У 98 (70%) хворих із фатальними наслідками інсульту відзначали статистично значущі відмінності показників глікемії — 10,2±4,7 ммоль/л (р<0,01). До того ж серед хворих з фатальними наслідками майже вдвічі частіше виявляли випадки декомпенсації цукрового діабету (гіперглікемія >13 ммоль/л): у 42 (30%) — серед пацієнтів 2-ї групи порівняно з 17 (12%) випадками у 1-й групі.
Високий рівень глюкози крові у хворих із летальними наслідками інсульту можна пояснити наявністю великовогнищевого ураження паренхіми мозку, що може призводити до викиду стресових гормонів, які спричиняють виникнення глікогенолізу та гіперглікемії (Capes S.E. et al., 2001). З іншого боку, гіперглікемія спричиняє розвиток внутрішньоклітинного ацидозу в ділянці ішемічної напівтіні, що призводить до порушення іонного гомеостазу, дисфункції мітохондрій та біоенергетичного порушення в нейронах (Alvarez-Sabín J. et al., 2003). Тривала субкомпенсація цукрового діабету у цьому разі призводить до ураження артерій великого калібру (макроангіопатії), на тлі якого здебільшого і виникає порушення мозкового кровообігу.
Результати аналізу показників периферичної крові свідчать, що у пацієнтів 2-ї групи з фатальними наслідками в 1-шу добу захворювання був достовірно (р<0,01) вищим рівень лейкоцитів (11,3±3,9�109/л), порівняно з пацієнтами 1-ї групи (8,4±2,2�109/л). На нашу думку, це пояснюється тим, що лейкоцитоз є одним із маркерів системної запальної реакції як відповідь на некротично пошкоджену мозкову тканину (Виничук С.М., Черенько Т.М., 2003). Оскільки у хворих 2-ї групи об’єм вогнища ішемії був значно більшим, ніж у пацієнтів 1-ї групи, вищі рівні лейкоцитів у них можна пояснити саме локальною запальною реакцією ішемізованої тканини мозку. До того ж у 33 (24%) хворих із фатальними наслідками інсульту на 5-ту–7-му добу спостерігалося повторне підвищення рівня лейкоцитів у периферичній крові на тлі гіпертермії, що було обумовлене ускладненнями з боку респіраторної системи (розвиток бронхопневмонії). Тому лейкоцитоз (більше 10�109/л) у периферичній крові у 1-шу добу після розвитку інсульту можна вважати маркером великовогнищевого ураження головного мозку, а другу хвилю підвищення рівня лейкоцитів — наслідком інфекційного ускладнення.
Важливим фактором, що впливає на перебіг та наслідки ішемічного інсульту, є порушення реологічних характеристик крові, що зумовлює погіршення мозкового кровотоку на рівні мікроциркуляторного русла. З цією метою ми дослідили деякі показники системи гемореології та гемостазу. У групі хворих з фатальними наслідками ішемічного інсульту показники гематокриту (Ht) (51,2±1,1%) та гемоглобіну (Hb) (154,4±2,8 г/л) порівняно з групою пацієнтів із сприятливими наслідками захворювання (Ht — 44,3±0,8%; Hb — 142,2±3,4 г/л) були достовірно вищими (р<0,05). У пацієнтів 2-ї групи вищим був рівень фібриногену — 4,25±1,2 г/л, порівняно з пацієнтами 1-ї групи — 3,3±1,0 г/л (р<0,05). Крім того, у 105 (75%) хворих з фатальними наслідками відзначали позитивний β-нафтоловий тест, що свідчило про переважання процесів гемокоагуляції. Подібні зрушення спостерігали лише у 35 (23,8%) хворих 1-ї групи. Високий рівень цих показників у хворих із фатальними наслідками інсульту може бути індикатором тривалого порушення в системі коагуляції та фібринолізу з переважанням процесів тромбоутворення. У поєднанні з іншими факторами ризику, такими як цукровий діабет і миготлива аритмія, це може призводити до повторних епізодів кардіоемболії та атеротромбозу (Суслина З.А. и соавт., 2006).
Несприятливі наслідки ішемічного інсульту були пов’язані також із медичними ускладненнями: пневмонія — у 33 (23,6%), інфаркт міокарда — у 8 (5,7%), тромбоз глибоких вен нижніх кінцівок — у 3 (2,1%), тромбоемболії гілок легеневої артерії — у 2 (1,4%) хворих, шлунково-кишкові кровотечі — в 1 (0,7%) хворого.
Таким чином, проведений клініко-неврологічний, біохімічний, комп’ютерно-томографічний аналіз і дані автопсії свідчать, що клінічний перебіг і наслідки гострого ішемічного інсульту визначаються різними прогностичними факторами. Оскільки мозковий інсульт є проявом системної судинної патології, що зумовлює сукупність різноманітних пошкоджень, його клінічний перебіг і несприятливі наслідки, безперечно, зумовлені впливом не окремих потенційних предикторів, а їх поєднаною дією, що каталізує ризик виникнення тих чи інших ускладнень. Патогенетична дія окремих складових поєднань прогностичних факторів неоднакова в кожному конкретному випадку. Тому складно визначити причинно-наслідкові взаємозв’язки. Різна також частота основних поєднань несприятливих предикторів у гострий період ішемічного інсульту (рис. 3).
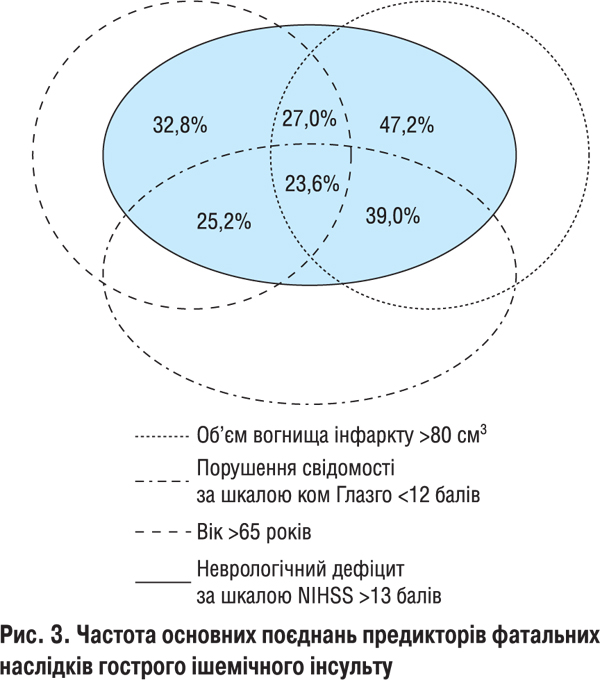
Як видно з даних, наведених на рис. 3, на клінічний перебіг і несприятливі наслідки ішемічного інсульту досить часто (у 32,8% випадків) впливає початкова тяжкість інсульту (>13 балів за шкалою NIHSS), поєднана з віком пацієнта >65 років, тісно взаємозв’язаним з артеріальною гіпертензією, атеросклерозом, ішемічною хворобою серця (ІХС), миготливою аритмією, цукровим діабетом, дисрегуляцією коагуляційного гемостазу. Тяжкість інсульту в пацієнтів цього віку поглиблювалась, а вірогідність фатальних наслідків зростала (у 27% випадків) за умови формування об’єму осередку інфаркту >80 см3 або фонового порушення свідомості в перші дні захворювання (у 25,2%). У 23,6% фатальних випадків виявлялося поєднання несприятливих чинників: розмір осередку ураження >80 см3; неврологічний дефіцит >13 балів; розлади свідомості (сопор, кома) <12 балів за шкалою ком Глазго, вік пацієнта >65 років. Поєднання таких чинників, як розмір осередку інфаркту >80 см3 і початковий неврологічний дефіцит >13 балів, спостерігали у 47,2% випадків. Досить часто у разі такого поєднання виникала втрата свідомості <12 балів за шкалою ком Глазго (39,0%).
ВИСНОВКИ
На клінічний перебіг і несприятливі наслідки ішемічного інсульту суттєво впливає вік хворого, тісно взаємозв’язаний з артеріальною гіпертензією, атеросклерозом, ІХС, миготливою аритмією, цукровим діабетом і порушенням коагуляційного гемостазу. Синергічна дія цих предикторів не лише визначає патогенетичний механізм виникнення інсульту, але і його перебіг (регресуючий або прогресуючий) та наслідки.
Ішемічний інсульт, спричинений атеротромбозом або кардіоемболією, пов’язаний із несприятливим прогнозом. Водночас лакунарний інфаркт, зумовлений гіпертонічною васкулопатією, гемодинамічний та гемореологічний інсульт, а також інсульт із нез’ясованим підтипом мали більш сприятливий прогноз щодо відновлення неврологічних функцій.
Функціональний прогноз гострого ішемічного інсульту еквівалентний фоновій тяжкості вихідного рівня неврологічного дефіциту; ризик несприятливих наслідків вищий у хворих із тяжким і надто тяжким ішемічним інсультом, за наявності в початковому неврологічному статусі таких порушень: тотальна афазія, парез погляду, бульбарні розлади, геміплегія, порушення функції тазових органів.
Несприятливо впливав на виживаність пацієнтів після перенесеного тяжкого ішемічного інсульту у 50,7% випадків фоновий рівень порушення свідомості (сопор, кома тривалістю понад добу) за шкалою ком Глазго < 12 балів.
На клінічний перебіг та фатальні наслідки у гострий період ішемічного інсульту суттєво впливали локалізація та об’єм інфаркту мозку: ризик фатальних наслідків зростав у разі оклюзії ВСА — у 16 (11,4%) хворих; основного стовбура СМА — у 104 (74,3%) хворих з розвитком тотального або територіального супратенторіального інфаркту мозку; закупорки основної артерії, хребтових артерій на екстра- або інтракраніальному рівнях — у 20 (14,3%) обстежених.
Наявність у перші 12 год за даними СКТ головного мозку осередку низької щільності, що займає більше половини території кровопостачання СМА, лейкоцитозу (більше 10�109/л), неврологічного дефіциту >17 балів за шкалою NIHSS, може свідчити про наявність великовогнищевого інфаркту та можливість розвитку фатального набряку головного мозку. Поглиблювати його прояви в перші години захворювання можуть гіперглікемія (>13 ммоль/л) та високі цифри систолічного АТ (>180 мм рт. ст).
Результати клініко-неврологічного дослідження, а також прижиттєвої нейровізуалізації свідчать, що фатальні наслідки гострого ішемічного інсульту зумовлені поєднаною дією несприятливих потенційних предикторів:
- вік пацієнтів у взаємозв’язку з тяжкістю вихідного рівня неврологічного дефіциту;
- об’єм осередку інфаркту, його локалізація і тяжкість неврологічного дефіциту;
- об’єм осередку ураження, тяжкість неврологічного дефіциту і фоновий рівень розладу свідомості (сопор, кома);
- виявлений взаємозв’язок між тяжкістю ішемічного інсульту і порушеннями в системі коагуляції та фібринолізу з переважанням процесів тромбоутворення, що впливає на наслідки інсульту;
- несприятливі наслідки інсульту визначалися також інтеркурентними захворюваннями та медичними ускладненнями: пневмонія, інфаркт міокарда, тромбоз глибоких вен кінцівок, тромбоемболія гілок легеневої артерії.
ЛІТЕРАТУРА
- Віничук С.М., Прокопів М.М. (2006) Гострий ішемічний інсульт. Наукова думка, Київ, 288 с.
- Виничук С.М., Черенько Т.М. (2003) Ишемический инсульт: эволюция взглядов на стратегию лечения. Комполис, Київ, 120 с.
- Парфенов В.А., Вахнина Н.В. (2001) Артериальная гипертония и гипотензивная терапия при ишемическом инсульте. Невролог. журн., 4: 19–22.
- Суслина З.А., Ерофеева А.В., Танашян М.М., Ионова В.Г. (2006) Ишемические инсульты: состояние гемостаза и факторы церебральной эмболии. Инсульт: Приложение к Журналу неврологии и психиатрии им. С.С. Корсакова, 16: 3–9.
- Трофимова Т.Н., Ананьева Н.И., Назинкина Ю.В. и соавт. (2005) Нейрорадиология. СПбМАПО, Санкт-Петербург, 288 с.
- Яворская В.А., Фломин Ю.В. (2004) Взаимосвязь клинических, томографических и лабораторных показателей с ранней летальностью при остром ишемическом инсульте. Експеримент. і клін. медицина, 2: 186–190.
- Adams H.P. Jr, Bendixen B.H., Kappelle L.J. et al. (1993) Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke, 24(1): 35–41.
- Alvarez-Sabín J., Molina C.A., Montaner J. et al. (2003) Effects of admission hyperglycemia on stroke outcome in reperfused tissue plasminogen activator-treated patients. Stroke, 34(5): 1235–1241.
- Bae H.J., Yoon D.S., Lee J. et al. (2005) In-hospital medical complications and long-term mortality after ischemic stroke. Stroke, 36(11): 2441–2445.
- Bhalla A., Gupta O.P., Gupta S.B. (2002) Predicting mortality in stroke. Neurol. India, 50(3) : 279–281.
- Capes S.E., Hunt D., Malmberg K. et al. (2001) Stress hyperglycemia and prognosis of stroke in nondiabetic and diabetic patients: a systematic overview. Stroke, 32(10): 2426–2432.
- Castillo J., Leira R., García M.M. et al. (2004) Blood pressure decrease during the acute phase of ischemic stroke is associated with brain injury and poor stroke outcome. Stroke, 35(2): 520–526.
- Dávalos A., Toni D., Iweins F. et al. (1999) Neurological deterioration in acute ischemic stroke: potential predictors and associated factors in the European cooperative acute stroke study (ECASS) I. Stroke, 30(12): 2631–2636.
- Ferro J.M. (2003) Brain embolism — Answers to practical questions. J. Neurol., 250(2): 139–147.
- Johnston K.C., Connors A.F. Jr, Wagner D.P., Haley E.C. Jr (2003) Predicting outcome in ischemic stroke: external validation of predictive risk models. Stroke, 34(1): 200–202.
- Kasner S.E., Demchuk A.M., Berrouschot J. et al. (2001) Predictors of fatal brain edema in massive hemispheric ischemic stroke. Stroke, 32(9): 2117–2123.
- Lernfelt B., Forsberg M., Blomstrand C. et al. (2002) Cerebral atherosclerosis as predictor of stroke and mortality in representative elderly population. Stroke, 33(1): 224–229.
- MacWalter R.S., Wong S.Y., Wong K.Y. et al. (2002) Does renal dysfunction predict mortality after acute stroke? A 7-year follow-up study. Stroke, 33(6): 1630–1635.
- Moroney J.T., Bagiella E., Paik M.C. et al. (1998) Risk factors for early recurrence after ischemic stroke: the role of stroke syndrome and subtype. Stroke, 29(10): 2118–2124.
- Ng Y.S., Stein J., Ning M., Black-Schaffer R.M. (2007) Comparison of clinical characteristics and functional outcomes of ischemic stroke in different vascular territories. Stroke, 38(8): 2309–2314.
- Prosser J., MacGregor L., Lees K.R. et al. (2007) Predictors of early cardiac morbidity and mortality after ischemic stroke. Stroke, 38(8): 2295–2302.
- Saunders D.E., Clifton A.G., Brown M.M. (1995) Measurement of infarct size using MRI predicts prognosis in middle cerebral artery infarction. Stroke, 26(12): 2272–2276.
- Schlegel D., Kolb S.J., Luciano J.M. et al. (2003) Utility of the NIH Stroke Scale as a predictor of hospital disposition. Stroke, 34(1): 134–137.
- Uchino K., Billheimer D., Cramer S.C. (2001) Entry criteria and baseline characteristics predict outcome in acute stroke trials. Stroke, 32(4): 909–916.
- Vargas M., Horcajada J.P., Obach V. et al. (2006) Clinical consequences of infection in patients with acute stroke: is it prime time for further antibiotic trials? Stroke, 37(2): 461–465.
- Weimar C., Ziegler A., König I.R., Diener H.C. (2002) Predicting functional outcome and survival after acute ischemic stroke. J. Neurol., 249(7): 888–895.
Резюме. В исследование были включены 287 больных с острым ишемическим инсультом. В зависимости от последствий ишемического инсульта пациентов разделили на две группы: 1-ю составили 147 лиц с благоприятным исходом заболевания, 2-ю — 140 обследованных с фатальным исходом инсульта. Анализ полученных результатов свидетельствовал, что на клиническое течение и неблагоприятный исход ишемического инсульта влияет его исходная тяжесть, размер очага ишемии, фоновый уровень нарушения сознания в сочетании с возрастом пациента, тесно взаимосвязанным с артериальной гипертензией, атеросклерозом, ишемической болезнью сердца, мерцательной аритмией, сахарным диабетом, дисрегуляцией коагуляционного гемостаза. Ишемический инсульт, вызванный атеротромбозом или кардиоэмболией, часто связан с неблагоприятным прогнозом. В то же время лакунарный инфаркт, обусловленный гипертонической васкулопатией, гемодинамический и гемореологический инсульт, а также инсульт с неопределенным подтипом имели благоприятный прогноз для восстановления неврологических функций.
Ключевые слова: ишемический инсульт, подтипы, предикторы клинического течения, последствия инсульта
Summary. This study covered 287 patients with acute ischemic stroke. With a view to the outcome of ischemic stroke patients were split into two groups: the first group included 147 patients with favorable outcome of the disease, the second group included 140 patients with fatal stroke outcome. Analysis of the results showed that the clinical course and poor outcome of the ischemic stroke are influenced by the initial severity of the ischemic stroke, size of ischemic focus, initial level of the impairment of consciousness along with patients’ age closely connected with arterial hypertension, atherosclerosis, heart ischemic disease, atrial fibrillation, diabetes mellitus, coagulatory haemostasis dysfunction. Ischemic stroke caused by the atherothrombosis or cardioembolism was often connected with unfavorable prognosis. At the same time lacunar stroke caused by hypertensive vasculopathy, haemodynamic and haemorheology stroke including stroke of undetermined etiology had favorable prognosis for neurological function recovery.
Key words: ischemic stroke, subtypes, predictors of clinical course, stroke outcome





