Вступ
Проблемі виявлення та запобігання помірній гіпергомоцистеїнемії (ГГЦ), клінічного прояву порушень фолатного обміну в осіб репродуктивного віку присвячено чимало робіт, у яких розглядали численні патогенетичні механізми її впливу як безпосередньо на судинну стінку та ендотеліальну дисфункцію, так і на тромбофілічні розлади спадкового або набутого генезу (Fermo I., 1995; Dahlbаck B., 2008; Moll S., 2015; Sørensen J.T., 2016; Stevens S.M., 2016). Тестування поліморфізму гена MTHFR та визначення рівня гомоцистеїну (ГЦ) запропоновано проводити особам груп ризику розвитку тромбофілічних порушень у численних клінічних протоколах та настановах (Baglin T., 2010; Bates S.M., 2012; Stefano V.D., 2013; Россоха З.І., 2014; Levin B.L., 2016). Але пізніше, починаючи з 2013 р., у США з’явилися повідомлення про відсутність доведеного впливу поліморфізму гена MTHFR на розвиток тромбофілічних порушень та запропоновано вилучити генетичне тестування із клінічних протоколів (Hickey S.E., 2013; aruplab, 2016).
Відсутність доказового впливу MTHFR на ризик появи клінічних проявів спадкової тромбофілії та репродуктивних розладів, а також вилучення цих досліджень із клінічних протоколів дослідники пов’язують із наслідком довготривалої фортифікації продуктів харчування в окремих країнах Північної Америки та Європи і культури широкого застосування полівітамінних препаратів та нутрієнтів з профілактичною метою (Holmes M.V., 2011; Hickey S.E., 2013). Водночас в Україні відсутня програма фортифікації продуктів харчування, а прийом полівітамінних препаратів та нутрієнтів особами репродуктивного віку, у тому числі і в преконцепційний період, є обмеженим. Однак відмічаються випадки профілактичного призначення невиправдано надто високих доз фолієвої кислоти (ФК) або неконтрольований прийом вітамінів та нутрієнтів (Rossokha Z.I., 2017). Провідним чинником у розвитку помірної ГГЦ тривалий час розглядали здебільшого поліморфізм гена MTHFR (C677T, rs1801133 та A1298С, rs1801131), при варіантах якого за рахунок зниження активності ферменту метилентетрагідрофолатредуктази недостатньо засвоюються фолати та ФК, що призводить до помірної ГГЦ — клінічного прояву порушень фолатного обміну (Liu F., 2017). Це питання й досі залишається дискусійним, йому присвячують нові дослідження, і тому знову проводиться оцінка можливого зв’язку виникнення репродуктивних розладів (ранніх репродуктивних втрат і безпліддя) та поліморфізму гена MTHFR.
Зважаючи на стан проблеми, варто зазначити, що досі не було комплексних досліджень, які би враховували вплив міжгенної та ген — факторної взаємодій на розвиток помірної ГГЦ при репродуктивних розладах, хоча помірна ГГЦ та варіанти гена MTHFR в Україні оцінюються як несприятливий чинник (Гречаніна О.Я., 2010; Веропотвелян П.Н., 2011; Венцківська І.Б., 2015).
Мета — визначення ролі міжгенної взаємодії MTHFR, MTRR, MTR1 у розвитку порушень фолатного обміну у пацієнток із репродуктивними розладами.
Об’єкт і методи дослідження
До дослідження залучено 185 пацієнток із репродуктивними розладами, направлених на медико-генетичне консультування та обстеження у зв’язку з підозрою на приховану спадкову тромбофілію (загальна група), з яких 127 мали ранні репродуктивні втрати (група I), а у 58 було первинне безпліддя невстановленого генезу тривалістю >5 років (група II).
Критеріями виключення з дослідження були виявлені у подружній парі: аномалії каріотипу, аномалії та вади розвитку статевих органів, хронічні інфекційні та статеві захворювання, соматична та злоякісна патологія, ожиріння, а також трубно-перитонеальне безпліддя у жінок.
У пацієнток, залучених у дослідження, проведено медико-генетичне консультування та анкетування, збір даних про спосіб життя та шкідливі звички. Усі пацієнтки надали інформовану згоду на участь у дослідженні. У всіх пацієнток виконано стандартні клініко-лабораторні обстеження за місцем надання медичної допомоги. Показники ГЦ в плазмі крові, ФК та ціанокобаламіну (вітаміну В12) у сироватці крові визначали на момент звернення методом ECLIA (імунохімічний з електрохемілюмінесцентною детекцією) на автоматичному біохімічному аналізаторі «Cobas 6000» («Roche Diagnostics», Швейцарія). Референтні значення досліджуваних показників: ГЦ в плазмі крові — до 12 мкмоль/л, ФК у сироватці крові — 4,6–18,7 нг/мл; В12 у сироватці крові — 197–771 пг/мл. Молекулярно-генетичне дослідження поліморфних варіантів генів MTHFR (C677T, rs1801133; A1298С, rs1801131), MTRR (A66G, rs1801394), MTR1 (A2756G, rs1805087) проводили за допомогою методів алельспецифічної полімеразної ланцюгової реакції (ПЛР) та ПЛР з аналізом поліморфізму довжини рестрикційних фрагментів. Лабораторні показники представлено у вигляді арифметичних даних (середнє значення (М) ± стандартна помилка середнього (SEM)), розрахованих із використанням програмного пакета «MS Excel» 2010 р. (ліцензійний номер K9366093I2016). Результати аналізу у всіх групах тестовано щодо оцінки нормальності статистичного розподілу показників з використанням тесту Колмогорова — Смирнова SPSS17.0 («IBM SPSS Statistics 17 Free PC Software Full Version», США). Достовірними вважали відмінності при рівні значущості <0,05. Головні незалежні, а також спільні ефекти всіх проаналізованих генів, визначено із використанням статистичної програми мультифакторної просторової редукції (MDR) («GNU General Public License version 2.0», USA).
Результати та їх обговорення
Рівень ГЦ у плазмі крові є важливим клінічним маркером порушень фолатного обміну в медичній практиці. Незважаючи на деякі відмінності у методах його визначення та референтні значення, що надаються різними лабораторіями, у європейських консенсусах та настановах концентрація >12 мкмоль/л розглядається як ГГЦ, а концентрація >10 мкмоль/л — як критична щодо зростання ризику розвитку ГГЦ. Починаючи з концентрації ГЦ 10 мкмоль/л, підвищення ризику виникнення ГГЦ відбувається за лінійною залежністю доза — реакція без певного порогового рівня. Додаткові фактори ризику (куріння, артеріальна гіпертензія, цукровий діабет, гіперліпідемія) аддитивно або синергічно збільшують ризик ГГЦ. Тому відповідно до робочих та консенсус-груп рекомендованим є цільовий рівень ГЦ в плазмі крові не вище 10 мкмоль/л (Stanger O., 2003; Devalia V., 2014; Wilcken B., 2016).
Залежно від зростання рівня ГЦ виділяють тяжку, помірну та легку форму, які розмежовуються за визначенням обраних референтних значень (www.sciencedirect.com/hyperhomocysteinemia). У Міжнародній класифікації хвороб 10-го перегляду (МКХ-10) з 2018 р. ГГЦ, пов’язану з мутаціями в генах фолатного обміну, визнано аутосомно-рецесивним спадковим метаболічним захворюванням — код E72.1 (набула чинності з 01.10.2017 р. (www.icd10data.com/E72.11)). У класифікації МКХ-10 спадковому дефіциту метилентетрагідрофолатредуктази, що призводить до ГГЦ, присвоєно код E72.12 (www.healthline.com). Досі однозначно не доведено, але й не спростовано вплив ГГЦ та поліморфних варіантів генів фолатного обміну на зростання ризику репродуктивних розладів у клінічній практиці. Але для характеристики порушень фолатного обміну, окрім визначення рівня ГЦ, застосовують визначення показників ФК та В12 у сироватці крові, а також проводять молекулярно-генетичний аналіз поліморфних варіантів генів фолатного обміну MTHFR, MTRR, MTR1. Для з’ясування впливу фолат-опосередкованої міжгенної взаємодії в обстежених нами пацієнток із репродуктивними розладами застосовано вищеперераховані критерії виключення відомих та доведених чинників ризику ГГЦ (Stanger O., 2003; Россоха З.И., 2014; Devalia V., 2014). У порівняльній табл. 1 наведено вік, антропометричні показники, індекс маси тіла (ІМТ) та стан фолатного обміну в обстежених нами пацієнток із репродуктивними розладами.
Показник |
Загальна група |
Група I |
Група II |
|---|---|---|---|
| Вік, років | 33,30±0,43 | 32,95±0,55 | 34,05±0,66 |
| Зріст, см | 165,93±0,49 | 166,00±0,56 | 165,77±0,99 |
| Маса тіла, кг | 59,61±0,57 | 59,41±0,71 | 60,06±0,98 |
| ІМТ, кг/м2 | 21,46±0,16 | 21,33±0,16 | 21,78±0,33 |
| ГЦ, мкмоль/л | 9,26±0,33 | 9,68±0,46 | 8,32±0,33 |
| ФК, нг/мл | 13,36±0,61 | 12,73±0,76 | 14,59±1,05 |
| В12, нг/л | 480,99±23,66 | 488,28±29,39 | 481,39±38,43 |
Як свідчать результати дослідження, показники групи I та II вірогідно не відрізнялися (див. табл. 1), хоча у пацієнток групи II спостерігали тенденцію до зниження рівня ГЦ та підвищення вмісту ФК у сироватці крові порівняно з групою I. Частота генотипів та їх комбінацій достовірно не різнилася у пацієнток групи I та II (р>0,05). Тому порівняли показники фолатного обміну залежно від поліморфних варіантів генів у пацієнток загальної групи (табл. 2).
Генотип генів |
ГЦ, мкмоль/л |
ФК, нг/мл |
В12, пг/мл |
|---|---|---|---|
MTHFR (С677Т) |
|||
| 677СС | 8,89±0,25 | 13,74±1,03 | 551,13±30,45 |
| 677CT | 9,78±0,37 | 13,53±0,89 | 476,08±22,36 |
| 677TT | 12,27±1,01 | 11,27±0,67 | 386,36±31,90 |
| MTHFR (А1298С) | |||
| 1298AA | 9,74±0,61 | 14,40±1,23 | 501,95±34,49 |
| 1298AC | 9,17±0,55 | 12,91±0,80 | 477,19±35,54 |
| 1298CC | 8,63±0,32 | 12,38±1,25 | 465,20±32,01 |
| MTRR (A66G) | |||
| 66AA | 9,98±0,78 | 11,73±1,67 | 543,55±43,38 |
| 66AG | 9,37±0,57 | 13,73±0,85 | 455,21±35,97 |
| 66GG | 8,75±0,43 | 13,86±0,99 | 475,64±41,90 |
| MTR1 (A2756G) | |||
| 2756AA | 8,28±0,32 | 13,96±0,85 | 525,57±43,35 |
| 2756AG | 9,46±0,25 | 12,65±0,90 | 462,45±29,85 |
| 2756GG | 10,37±0,36 | 11,32±2,19 | 438,36±25,27 |
Рівень ГЦ достовірно зростав у пацієнток з генотипом 677ТТ (12,27±1,01) порівняно з пацієнтками з генотипами 677СТ (9,78±0,37) та 677СС (8,89±0,25). У пацієнток з генотипом 677ТТ та репродуктивними розладами відмічали достовірне зниження рівня ФК (11,27±0,67) та В12 (386,36±31,90) порівняно з генотипами 677СТ (13,53±0,89 та 476,08±22,36) та 677СС (13,74±1,03 та 551,13±30,45). Подібні особливості порушень фолатного обміну раніше виявлено нами при обстеженні дітей з когнітивними розладами, у яких значуще підвищення рівня ГЦ також спостерігалося при генотипі 677ТТ порівняно з іншими пацієнтами та дітьми контрольної групи. Особливої уваги заслуговує те, що у контрольній групі дітей не виявлено жодного випадку ГГЦ за наявності генотипу 677ТТ (Горовенко Н.Г., 2010). Таку особливість порушень фолатного обміну, як поєднання генотипу 677ТТ з ГГЦ, виявлено при інших патологічних станах (Garakanidze S., 2018).
Процес реметилування ГЦ залежить від генетично детермінованої активності ферментів. При реметилуванні ГЦ у метіонін беруть участь ферменти MTHFR та MTR1, активність яких визначається генетичним поліморфізмом. Для цієї реакції необхідний 5-метилтетрагідрофолат як донор метилу, а вітамін B12 служить «носієм» метильної групи. Дефіцит вітаміну B12 призводить до «фолатної пастки» та внутрішньоклітинного накопичення відновлених фолатів й підвищення рівнів ГЦ в плазмі крові та може бути додатково посилений генетичним поліморфізмом MTR1 2756A→G (Feix A., 2001). Для осіб з генотипом 2756GG за геном MTR1 описано зростання активності ферменту метіонінсинтази та прискорення процесів реметилування В12 у процесах фолатного обміну, і відповідно підвищена потреба у вітаміні В12 (www.omim.org/entry/156570). В обстежених нами пацієнток рівень ГЦ був також достовірно найвищим (але в межах референтних значень) за наявності генотипу 2756GG за геном MTR1 порівняно з генотипом 2756AG, при цьому також виявлене зниження рівня ФК та В12.
На наступному етапі оцінено вплив на стан фолатного обміну комбінацій за двома алельними варіантами C677T та А1298С гена MTHFR (табл. 3). За результатами нашого дослідження серед обстежених пацієнток не виявлено комбінацій таких алельних варіантів гена MTHFR: 677ТТ/1298АС, 677ТТ/1298СС та 677СТ/1298СС. В окремих роботах доведено, що з перерахованими комбінаціями поліморфних варіантів діти взагалі не народжуються, а гинуть антенатально (Isotalo P.A., 2000; Fodinger M., 2001; Zetterberg H., 2002; Bae J., 2007). Ми виявили значуще підвищення ГЦ, зниження ФК та В12 у пацієнток із комбінацією генотипів 677ТТ/1298АА порівняно з генотипами 677СТ/1298АС та 677СС/1298АС. За наявності комбінації генотипів 677СС/1298СС відмічався знижений рівень ГЦ порівняно з генотипом 677ТТ/1298АА (див. табл. 3). Отже, ГГЦ у пацієнток з репродуктивними розладами значуще переважала за наявності комбінації генотипів 677ТТ/1298АА, але при цьому показники ФК та В12 були в межах референтних значень, але достовірно нижчими порівняно з особами з іншими комбінаціями за алельними варіантами гена MTHFR. Подібну асоціацію генотипів 677ТТ/1298АА з підвищенням рівня ГЦ також виявлено у хворих на гемодіалізі (Fodinger M., 2001) та донорів крові після нічного голодування (Zappacosta B., 2014).
Поліморфні варіанти гена MTHFR |
ГЦ, мкмоль/л |
ФК, нг/мл |
В12, пг/мл |
|---|---|---|---|
| 677CC/1298AA | 9,11±0,74 | 14,88±1,63 | 501,19±61,39 |
| 677CC/1298AC | 8,50±0,38 | 13,65±1,20 | 491,86±36,08 |
| 677CC/1298CC | 8,97±0,56 | 12,39±1,25 | 477,20±71,77 |
| 677CT/1298AA | 8,53±0,53 | 13,89±1,89 | 472,68±42,41 |
| 677CT/1298AC | 8,36±0,41 | 12,78±1,05 | 478,96±35,73 |
| 677TT/1298AA | 11,79±1,63 | 10,25±0,74 | 386,36±28,90 |
Показники рівня ГЦ були також найвищими у нашому дослідженні за наявності комбінацій генотипів 2756АА/66АА (10,33±1,08) та 2756GG/66GG (10,90±1,96) генів MTR1 та MTRR, але в межах референтних значень (табл. 4).
Поліморфні варіанти генів MTR1/MTRR |
ГЦ, мкмоль/л |
ФК, нг/мл |
В12, пг/мл |
|---|---|---|---|
| 2756AA/66AA | 10,33±1,08 | 11,96±2,51 | 471,67±70,80 |
| 2756AG/66AA | 9,76±1,20 | 11,50±1,89 | 550,28±60,69 |
| 2756GG/66AA | 7,84±0,60 | 13,29±3,96 | 611,0±97,0 |
| 2756AA/66AG | 9,47±0,84 | 15,06±1,6 | 423,73±51,11 |
| 2756AG/66AG | 9,27±0,51 | 12,68±1,20 | 576,88±44,18 |
| 2756GG/66AG | 9,39±1,80 | 9,41±2,56 | 669,8±77,9 |
| 2756AA/66GG | 8,74±0,48 | 13,23±1,11 | 383,30±36,89 |
| 2756AG/66GG | 8,05±0,47 | 14,66±2,03 | 566,97±62,08 |
| 2756GG/66GG | 10,90±1,96 | 13,33±2,74 | 577,15±85,55 |
Пацієнтки з комбінацією генотипів 2756АА/66АА та 2756GG/66GG мали критичне, відповідно до консенсусу, зростання рівня ГЦ порівняно з іншими варіантами комбінацій генотипів за генами MTRR та MTR1. При цьому рівень В12 був достовірно найвищим за наявності генотипу 2756GG/66AА порівняно з генотипами 2756АА/66AА та 2756АG/66AА. Подібне накопичення В12 може бути пов’язане з тим, що носії генотипу 2756GG за геном MTR1 потребують вищих доз В12 у зв’язку з підвищеною активністю ферменту MTR1 (www.holisticacare.com/mtrr-and-vitamin-b12).
Для показника В12 виявлено достовірні відмінності, за яких найвищий рівень зафіксовано у пацієнток з комбінаціями генотипів 2756GG/66AG та 2756GG/66GG порівняно з 2756АА/66AG, 2756АG/66AG і 2756АА/66GG, 2756АG/66GG відповідно. Найнижчий рівень В12 був за наявності комбінації генотипів 2756АА/66GG — 383,30±36,89. Також достовірну різницю за показником ФК виявлено між пацієнтками з комбінацією генотипів 2756AA/66AG (15,06±2,6) і 2756GG/66AG (9,41±1,12) та 2756AG/66AG (12,68±1,20) і 2756GG/66AG (9,41±1,12), що може бути зумовлено як особливостями витрат при метаболічних фолатзалежних процесах, так і надходженням ФК та В12 з продуктами та вітамінними препаратами.
Як видно з табл. 5, виявлено достовірне зростання ГЦ у пацієнток із комбінацією генотипів 677ТТ/66АА на відміну від комбінацій генотипів 677СС/66АА та 677СТ/66АА. Такі самі достовірності відмінності (р<0,05) відмічено для рівня ФК, який був найнижчим за комбінації генотипів 677ТТ/66АА. Показник В12 у пацієнток був достовірно найвищим (р<0,05) за наявності комбінацій генотипів 677ТТ/66АА порівняно з 677СС/66АА та 677СТ/66АА. На відміну від представлених нами даних щодо впливу комбінацій генотипу 677ТТ на зростання показників ГЦ, за наявності комбінації 677СС/66АG показник ГЦ, навпаки, був достовірно вищим, але в межах референтних значень, порівняно з 677ТТ/66АG, при цьому для комбінації генотипів 677ТТ/66GG виявлено достовірне зростання понад референтне значення.
Отже, за наявності у пацієнток гетерозиготного варіанта 66АG в комбінації з 677ТТ рівень ГЦ, навпаки, знижувався (8,25±0,78). Рівень В12 достовірно відрізнявся за різних поєднань гетерозиготного варіанта 66АG залежно від поліморфізму С677Т. Найвищим показник В12 був у пацієнток з комбінацією генотипів 677СС/66АG (479,11±44,01) порівняно з комбінацією генотипів 677ТТ/66АG (372,25±24,63) та 677СТ/66АG (475,75±43,35). За поєднань із гомозиготним варіантом 66GG достовірний вплив на зростання ГЦ мала комбінація 677ТТ/66GG. І, відповідно, за комбінації генотипів 677ТТ/66GG рівень ФК був достовірно найнижчим (р<0,05) порівняно з комбінаціями генотипів 677СТ/66GG та 677СС/66GG. Показник В12 достовірно відрізнявся за наявності комбінацій генотипів 677СС/66GG (505,90±64,34) та 677ТТ/66GG (410,12±56,64).
Поліморфні варіанти |
ГЦ, мкмоль/л |
ФК, нг/мл |
В12, пг/мл |
|---|---|---|---|
MTHFR/MTRR |
|||
| 677CC/66AA | 9,12±0,54 | 11,07±1,74 | 508,66±51,17 |
| 677CT/66AA | 9,50±0,93 | 14,01±2,69 | 609,25±68,54 |
| 677TT/66AA | 17,80±7,36 | 7,25±1,67 | 619,23±70,15 |
| 677CC/66AG | 9,82±0,80 | 14,24±1,46 | 479,11±44,01 |
| 677CT/66AG | 9,26±0,89 | 13,28±1,15 | 475,75±43,35 |
| 677TT/66AG | 8,25±0,78 | 13,19±1,10 | 372,25±24,63 |
| 677CC/66GG | 8,23±0,40 | 14,45±1,12 | 505,90±64,34 |
| 677CT/66GG | 8,16±0,50 | 14,21±1,27 | 474,47±71,22 |
| 677TT/66GG | 12,45±1,24 | 11,13±0,89 | 410,12±56,64 |
| MTHFR/MTR1 | |||
| 677CC/2756AA | 8,95±0,71 | 13,82±1,8 | 446,02±46,28 |
| 677CT/2756AA | 9,27±0,48 | 14,55±1,44 | 482,24±43,13 |
| 677TT/2756AA | 11,47±2,13 | 12,40±1,40 | 491,98±47,55 |
| 677CC/2756AG | 8,60±0,58 | 13,24±1,39 | 609,67±53,74 |
| 677CT/2756AG | 8,84±0,67 | 13,03±1,35 | 544,57±61,11 |
| 677TT/2756AG | 10,76±1,24 | 8,17±1,84 | 285,17±37,98 |
| 677CC/2756GG | 8,17±1,05 | 12,97±2,99 | 550,45±54,64 |
| 677CT/2756GG | 10,40±1,97 | 8,05±2,30 | 305,60±0,00 |
| 677TT/2756GG | 19,50±0,00 | 5,28±0,00 | 257±21,50 |
Рівень ГЦ був достовірно підвищеним за комбінації генотипів 677ТТ/2756AA (11,47±2,13) порівняно з комбінаціями генотипів 677СС/2756AA (8,95±0,71) та 677СТ/2756AA (9,27±0,48). Рівень ФК був найнижчим у пацієнток з комбінацією генотипів 677ТТ/2756AA порівняно з 677СС/2756AA та 677СТ/2756AA. У пацієнток з варіантом 2756AG рівень ГЦ був достовірно вищим при поєднанні з 677ТТ (див. табл. 5). Найвищий показник ГЦ був у пацієнток з комбінацією генотипів 677ТТ/2756GG порівняно з усіма іншими варіантами комбінацій генотипів. У пацієнток з цією комбінацією генотипів найнижчими були показники ФК та В12. Отже, з усіх перерахованих у табл. 5 комбінацій генетичних варіантів найбільш несприятливою була комбінація генотипів 677ТТ/2756GG. Виявлені відмінності у показниках фолатного обміну залежно від різних комбінацій генотипів, на нашу думку, зумовлені не тільки генетичним поліморфізмом, але й особливостями харчування пацієнтів та прийому вітамінно-нутрієнтних препаратів і потребують подальших детальних досліджень. При розрахунку нами генетичного ризику репродуктивних розладів, зумовлених поліморфізмом генів MTHFR, MTR1, MTRR, з’ясовано необхідність детального аналізу MTR1 та MTRR, враховуючи кофактори фолатного обміну (Россоха З.І., 2018).
Зростання рівня ГЦ >12 мкмоль/л (ГГЦ) виявлено у 37 зі 185 обстежених пацієнток загальної групи (20%), тобто кожна п’ята пацієнтка зазнавала несприятливого впливу підвищеного рівня ГЦ. При аналізі ген — генної взаємодії за допомогою програми мультифакторної просторової редукції найбільш значущою була чотирилокусна модель, яка включала всі варіанти досліджених генів MTHFR (С677Т, А1298С), MTRR, MTR1. Така модель мала предиктивну цінність 67,53%, відтворюваність 10/10. Проведення додаткового коригуючого пермутаційного тесту підтвердило вірогідність отриманих нами результатів (p<0,05). Побудована нами модель довела роль міжгенної взаємодії у розвитку ГГЦ у пацієнток із репродуктивними втратами, чим підтверджено необхідність тестування всіх перерахованих генів у клінічній практиці (рисунок).
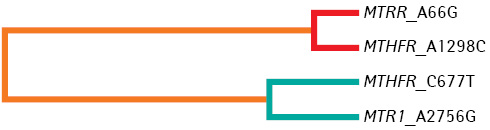
Серед пацієнтів із ГГЦ у 2 (5,41%) виявлено поєднання генотипів 677ТТ/2756AG, а в 1 (2,70%) — 677ТТ/2756GG, а при нормальному рівні ГЦ частка пацієнтів з генотипом 677ТТ/2756GG була меншою — 2 (1,35%), а генотип 677ТТ/2756GG взагалі не зафіксовано. Варіант генотипу 677ТТ/2756GG/66GG виявлено в 1 (2,70%) із пацієнтів із ГГЦ. За даними наукових джерел відомо, що гомозиготи 2756GG за геном MTR1 виявляють рідко, а для з’ясування статистичної розбіжності і доведення його впливу в цьому випадку потрібна більша вибірка. Однак ми встановили вплив поліморфізму MTR1 на розвиток ГГЦ при розрахунку рівня ГЦ залежно від поєднань генотипів. При розрахунку комбінацій генотипів серед обстежених пацієнтів взагалі не виявлено комбінації генотипів 1298СС/2756GG за генами MTHFR та MTR1.
У табл. 6 наведено результати порівняння частоти комбінацій генотипів у пацієнток залежно від рівня ГЦ у плазмі крові. Ми виявили чотири варіанти комбінацій генотипів, за яких підвищується ризик розвитку ГГЦ. Наявність у пацієнток комбінацій генотипів 677СС/1298АС/2756АА достовірно знижувала ризик розвитку ГГЦ.
Поліморфні варіанти |
ГЦ <12 (n=148) |
ГЦ >12 (n=37) |
Результати статистичного аналізу |
|||||
|---|---|---|---|---|---|---|---|---|
n |
% |
n |
% |
χ2 |
p |
Відносний ризик |
95% довірчий інтервал |
|
C677T/A1298C |
||||||||
| 677TT/1298AA | 11 | 7,43 | 8 | 21,62 | 5,02 | 0,025 | 3,44 | 1,27–9,29 |
C677T/A66G |
||||||||
| 677ТT/66GG | 4 | 2,70 | 5 | 13,51 | 5,32 | 0,021 | 5,63 | 1,43–22,12 |
C677T/А1298С/ A66G |
||||||||
| 677ТT/1298АА/ 66GG | 4 | 2,70 | 5 | 13,51 | 5,32 | 0,021 | 5,63 | 1,43–22,12 |
C677T/А1298С/А2756G |
||||||||
| 677СС/1298АС/2756АА | 26 | 17,57 | 1 | 2,70 | 4,12 | 0,042 | 0,13 | 0,02–0,99 |
А1298С/А2756G/A66G |
||||||||
| 1298АС/2756АG/66AG | 3 | 2,03 | 4 | 10,81 | 4,09 | 0,043 | 5,86 | 1,25–27,44 |
R. Reilly та співавтори (2014) в оглядовій роботі щодо впливу поліморфізму гена MTHFR на ризик розвитку мультифакторних захворювань зробили висновок, що необхідно виявляти осіб з 677ТТ-генотипом у регіонах без фортифікації продуктів харчування, тому що існують переконливі докази потенційної користі персоналізованого підходу у призначенні вітамінів групи В для профілактики або лікування захворювань. В Україні не здійснюється фортифікація продуктів харчування, тому генетичний скринінг MTHFR, MTRR, MTR1 є необхідним для запобігання мультифакторним захворюванням та репродуктивним розладам шляхом призначення збалансованих полівітамінних комплексів.
Висновки
ГГЦ (аутосомно-рецесивне спадкове метаболічне захворювання), пов’язана з мутаціями в генах фолатного обміну, виявлена у 20% жінок із репродуктивними розладами.
Рівень ГЦ достовірно підвищений у пацієнток з генотипом 677ТТ за геном MTHFR та його поєднаннями з генотипами 1298АА, 66АА, 66GG та 2756GG за генами MTHFR, MTRR та MTR1, при цьому рівні ФК та вітаміну В12 у сироватці крові були зниженими.
Достовірною моделлю ризику розвитку ГГЦ була чотирилокусна, яка включала всі варіанти досліджених генів MTHFR (С677Т, А1298С), MTRR (А66G), MTR1 (A2756G).
Ризик розвитку ГГЦ достовірно підвищувався за наявності комбінації трьох варіантів генів: 677TT/1298AA/66GG, 1298АС/2756AG/66AG — та знижувався при 677СС/1298АС/2756АА.
Виявлені відмінності у показниках фолатного обміну потребують подальшого аналізу ген — факторних взаємодій з урахуванням прийому вітамінно-нутрієнтних препаратів.
Список використаної літератури
- Венцківська І.Б., Прощенко О.М., Загородня О.С. (2015) Прогнозування невиношування вагітності при поєднанні генетично детермінованої тромбофілії й антифосфоліпідного синдрому. Здоровье женщины, 1(97): 83–86.
- Веропотвелян П.Н., Веропотвелян Н.П., Погуляй Ю.С. (2011) Гипергомоцистеинемия и беременность. Здоровье женщины, 9(65): 87–90.
- Горовенко Н.Г., Ольхович Н.В., Россоха З.І. та ін. (2010) Вплив поліморфізму С677Т гену MTHFR на фолатний статус та рівень гомоцистеїну в сироватці крові у дітей з когнітивними розладами. Актуальні проблеми акушерства і гінекології, клінічної імунології та медичної генетики, 19: 61–70.
- Гречаніна О.Я., Гречаніна Ю.Б., Гусар В.А. (2010) Спосіб профілактики репродуктивних втрат при гіпергомоцистеїнемії. Патент на корисну модель UA 53270, МПК (2009) GO1N33148. Харківський мед. університет, u201005921, Бюл. 18.
- Россоха З.И., Кирьяченко С.П., Горовенко Н.Г. (2014) Диагностика и лечение наследственной тромбофилии в акушерско-гинекологической практике. Обзор клинических рекомендаций и литературы. Мед. аспекты здоровья женщины, 6(81): 5—13.
- Россоха З.І., Кир’яченко С.П., Горовенко Н.Г. (2018) Порівняльна оцінка моделей генетичного ризику репродуктивних розладів, зумовлених поліморфізмом генів MTHFR, MTRR, MTR1. Мед. перспективи, XXIII (2): 85–91.
- aruplab (2016) Methylenetetrahydrofolate Reductase (MTHFR) 2 Variants (http://ltd.aruplab.com/tests/pub/0055655).
- Bae J., Shin J.S., Cha H.S. et al. (2007) Prevalent genotypes of methylenetetrahydrofolate reductase (MTHFR C677T and A1298C) in spontaneously aborted embryos. Fert. Ster., 87: 351–355.
- Baglin T., Gray E., Greaves M. (2010) Clinical guidelines for testing for heritable thrombophilia. Br. J. Haematol., 149(2): 209–220.
- Bates S.M., Greer I.A., Middeldorp S. et al. (2012) VTE, Thrombophilia, Antithrombotic Therapy and Pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-based Clinical Practice Guidelines. CHEST, 141(2): 691–736.
- Dahlbаck B. (2008) Advances in understanding pathogenic mechanisms of thrombophilic disorders. Blood, 112(1): 19–27.
- Devalia V., Hamilton M.S., Molloy A.M. (2014) Guidelines for the diagnosis and treatment of cobalamin and folate disorders. Br. J. Haematol., 166(4): 496–513.
- Feix A., Fritsche-Polanz R., Kletzmayr J. et al. (2001) Increased prevalence of combined MTR and MTHFR genotypes among individuals with severely elevated total homocysteine plasma levels. Am. J. Kid. Dis., 38(5): 956–964.
- Fermo I., Vigano D.S., Paroni R., Mazzola G. (1995) Prevalence of moderate hyperhomocysteinemia in patients with early-onset venous and arterial occlusive disease. Ann. Intern. Med., 123(10): 747—753.
- Fodinger M., Buchmayer H., Heinz G. et al. (2001) Association of two MTHFR polymorphisms with total homocysteine plasma levels in dialysis patients. Am. J. Kid. Dis., 38: 77–84.
- Garakanidze S., Costa E., Bronze-Rocha E. et al. (2018) Methylenetetrahydrofolate reductase gene polymorphism (C677T) as a risk factor for arterial thrombosis in Georgian patients. Clin. Appl. Thromb. Hemost., Jan. 1 [Epub. ahead of print].
- Hickey S.E., Curry C.J., Toriello H.V. (2013) ACMG Practice Guideline: lack of evidence for MTHFR polymorphism testing. Genet. Med., 15(2): 153–156.
- Holmes M.V., Newcombe P., Hubacek J.A. et al. (2011) Effect modification by population dietary folate on the association between MTHFR genotype, homocysteine, and stroke risk: a meta-analysis of genetic studies and randomised trials. Lancet, 378: 584–594.
- Isotalo P.A., Wells G.A., Donnelly J.G. (2000) Neonatal and fetal methylenetetrahydrofolate reductase genetic polymorphisms: an examination of C677T and A1298C mutations. Am. J. Hum. Genet., 67: 986–990.
- Levin B.L., Varga E.J. (2016) MTHFR: addressing genetic counseling dilemmas using evidence-based literature. J. Genet. Counsel., 25: 901–911.
- Liu F., Silva D., Malone M.V., Seetharaman K. (2017) MTHFR A1298C and C677T polymorphisms are associated with increased risk of venous thromboembolism: a retrospective chart review study. Acta Haematol., 138: 208–215.
- Moll S., Varga E.A. (2015) Homocysteine and MTHFR mutations. Circulation, 132 (1): e6–e9.
- Reilly R., McNulty H., Pentieva K. et al. (2014) MTHFR 677TT genotype and disease risk: is there a modulating role for B-vitamins? Proc. Nutr. Soc., 73(1): 47–56.
- Rossokha Z., Gorovenko N. (2017) Assessment of the individual folic acid doses requirement for patients with reproductive disorders. In: Abstracts of the XIII World Congress of Perinatal Medicine, Oct. 26–29, Serbia, р. 349.
- Sørensen J.T., Gaustadnes M., Stabler S.P. et al. (2016) Molecular and biochemical investigations of patients with intermediate or severe hyperhomocysteinemia. Mol. Genet. Metab., 117(3): 344–350.
- Stanger O., Herrmann W., Pietrzik K. et al. (2003) DACH-LIGA homocystein (German, Austrian and Swiss Homocysteine Society): consensus paper on the rational clinical use of homocysteine, folic acid and B-vitamins in cardiovascular and thrombotic diseases: guidelines and recommendations. Clin. Chem. Lab. Med., 41(11): 1392–1403.
- Stefano V.D. (2013) Testing for inherited thrombophilia and consequences for antithrombotic prophylaxis in patients with venous thromboembolism and their relatives. A review of the Guidelines from Scientific Societes and working groups. Thrombosis and Haemostasis, 110(4): 697–705.
- Stevens S.M., Woller S.C., Bauer K.A. et al. (2016) Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J. Thromb.Thrombolysis, 41(1): 154—164.
- Wilcken B. (2017) Therapeutic targets in homocystinuria due to cystathionine β-synthase deficiency: new European guidelines, Expert Opinion on Orphan Drugs, 5: 1–3.
- Zappacosta B., Graziano M., Persichilli S. et al. (2014) 5,10-Methylenetetrahydrofolate reductase (MTHFR) C677T and A1298C polymorphisms: genotype frequency and association with homocysteine and folate levels in middle-southern Italian adults. Cell Biochem. Funct., 32: 1–4.
- Zetterberg H., Regland B., Palmér M. et al. (2002) Increased frequency of combined methylenetetrahydrofolate reductase C677T and A1298C mutated alleles in spontaneously aborted embryos. Eur. J. Hum. Genet., 10(2): 113–118.
Резюме. Цель — определение роли межгенных взаимодействий MTHFR, MTRR, MTR1 в развитии нарушений фолатного обмена у пациенток с репродуктивными расстройствами. Объект и методы исследования. У 185 пациенток с репродуктивными расстройствами проведено молекулярно-генетическое исследование генов: MTHFR (C677T, rs1801133; A1298С, rs1801131), MTRR (A66G, rs1801394), MTR1 (A2756G, rs1805087) — и биохимических показателей фолатного обмена. Результаты. Гипергомоцистеинемия (аутосомно-рецессивное наследственное метаболическое заболевание), связанная с мутациями в генах фолатного обмена, выявлена у 20% женщин с репродуктивными расстройствами. Уровень гомоцистеина достоверно был повышен у пациенток с генотипом 677ТТ по гену MTHFR и его сочетаниями с генотипами 1298АА, 66АА, 66GG и 2756GG по генам MTHFR, MTRR и MTR1, при этом уровни фолиевой кислоты и витамина В12 были пониженными. Достоверной моделью риска гипергомоцистеинемии была четырехлокусная, с вовлечением генов MTHFR, MTRR, MTR1. Риск развития гипергомоцистеинемии достоверно повышался при наличии комбинации генотипов 677TT/1298AA/66GG, 1298АС/2756AG/66AG и снижался при комбинации 677СС/1298АС/2756АА. Выявленные различия в показателях фолатного обмена требуют дальнейшего анализа ген — факторных взаимодействий с учетом применения витаминно-нутриентных препаратов.
Ключевые слова: генетический полиморфизм, гипергомоцистеинемия, репродуктивные расстройства.
Адреса для листування:
Россоха Зоя Іванівна
04112, Київ, вул. Дорогожицька, 9
ДЗ «Референс-центр з молекулярної діагностики МОЗ України»
E-mail: [email protected]
Одержано 27.06.2018





