Вступ
Гіперхолестеринемія — визнаний фактор ризику атеросклерозу та ішемічної хвороби серця (ІХС) (European Association for Cardiovascular Prevention & Rehabilitation et al., 2011). Покращення прогнозу при застосуванні статинів доведене (Stone N.J. et al., 2014). Значною мірою його зумовлюють плейотропні ефекти статинів — вплив на асоційовані патофізіологічні ризик-фактори атеросклерозу (оксидативний стрес, запалення, ендотеліальну дисфункцію та ін.). Проте ці препарати дуже різні та відрізняються один від одного за деякими фармакологічними властивостями (ступінь ліпофільності, основний шлях елімінації) та клінічними ефектами (вплив на метаболізм глюкози, функцію міокарда, здатність до нефропротекції) (Pelliccia F. et al., 2014; Tsimikas S. et al., 2015). Ці відмінності між статинами дуже важливі та в деяких ситуаціях саме вони визначають клінічний результат і дозволяють робити виправданий вибір на користь одного конкретного препарату.
На сьогодні відомі значні клінічні відмінності між гідрофільними (розувастатин) та ліпофільними (аторвастатин) статинами при їх застосуванні у пацієнтів із ІХС (Weng T.C. et al., 2010; DiNicolantonio J.J. et al., 2013; Khera A.V. et al., 2014; Takagi H. et al., 2014). Однак відсутні дані щодо застосування цих гіполіпідемічних засобів та їх впливу на стан ліпідного обміну у пацієнтів з ІХС та ожирінням залежно від поліморфізму генів, хоча фармакогенетика спрямована на персоналізацію вибору ліків і дозування, щоб забезпечити максимальну клінічну вигоду, у той час як побічні ефекти зводяться до мінімуму.
Мета дослідження — оцінити ефективність застосування аторвастатину та розувастатину шляхом додавання до стандартної терапії у пацієнтів з ІХС та ожирінням залежно від генотипів поліморфізму Met235Thr-гена ангіотензиногена (АТГ).
Об’єкт і методи дослідження
Проведено комплексне обстеження 222 пацієнтів із ІХС та ожирінням, які перебували на лікуванні в кардіологічному відділенні Комунального закладу охорони здоров’я «Харківська міська клінічна лікарня № 27», яка є базовим лікувальним закладом кафедри внутрішньої медицини № 2 і клінічної імунології та алергології Харківського національного медичного університету. До групи порівняння включили 115 пацієнтів із ІХС та нормальною масою тіла. До контрольної групи увійшли 35 практично здорових осіб. У дослідження не включали хворих із тяжкою супутньою патологією органів дихання, травлення, нирок та осіб з онкологічними захворюваннями.
Діагноз встановлювали відповідно до чинних наказів Міністерства охорони здоров’я України.
З метою оцінки ефективності застосування аторвастатину та розувастатину шляхом додавання до стандартної терапії у пацієнтів з ІХС та ожирінням залежно від генотипів поліморфізму Met235Thr-гена АТГ визначено дві підгрупи спостереження:
- 1-ша — 116 пацієнтів, які отримували аторвастатин у добовій дозі 20 мг, серед них носіїв Т/Т-генотипу — 34, Т/М-генотипу — 45 і М/М-генотипу — 37 осіб;
- 2-га — 108 пацієнтів, які отримували розувастатин у добовій дозі 10 мг, серед них носіїв Т/Т-генотипу — 30, Т/М-генотипу — 43 і М/М-генотипу — 35 осіб.
Визначення параметрів ліпідного обміну включало оцінку рівня загального холестерину (ЗХС), тригліцеридів (ТГ), холестерину (ХС) ліпопротеїдів високої щільності (ЛПВЩ) ферментативним методом за допомогою наборів реагентів «Cholesterol Liquicolor» та «Triglycerides GPO» («Human», Німеччина).
Вміст ХС ліпопротеїдів низької щільності (ЛПНЩ) обчислювали за формулою W.T. Friedewald:
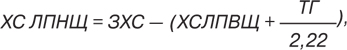
де ТГ/22 — вміст ХС в складі ліпопротеїдів дуже низької щільності (ЛПДНЩ).
Коефіцієнт атерогенності (КА) обчислювали за формулою А.М. Клімова:
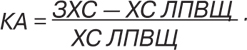
Дослідження алельного поліморфізму Met235Thr-гена АТГ проводили методом полімеразної ланцюгової реакції з електрофоретичною детекцією результатів із використанням наборів реактивів «SNP-ЕКСПРЕС» («Літех», Російська Федерація). Правильність розподілу частот генотипів визначали відповідністю рівноваги Харді — Вайнберга (pi2 + 2 pipj + pj2 = 1). Дослідження проводили у молекулярно-генетичному відділі Центральної науково-дослідної лабораторії Харківського національного медичного університету.
Отримані результати представлено у вигляді середнього значення ± стандартне відхилення від середнього значення (М±m). Статистичну обробку даних здійснювали за допомогою пакета «Statistica», версія 6.0. Оцінку відмінностей між групами при розподілі, близькому до нормального, проводили за допомогою критерію Пірсона. Статистично достовірними вважали відмінності при р<0,05.
Результати та їх обговорення
Аналіз ефективності застосування аторвастатину та розувастатину у пацієнтів з ІХС та ожирінням виявив позитивний вплив на показники ліпідного обміну незалежно від вибраного гіполіпідемічного засобу (таблиця).
| Показник | До лікування | Після лікування аторвастатином, Δ% | Після лікування розувастатином, Δ% | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Т/Т (n=64) | Т/М (n=88) | М/М (n=72) | Т/Т (n=34) | Т/М (n=45) | М/М (n=37) | Т/Т (n=30) | Т/М (n=43) | М/М (n=35) | |
| ЗХС, ммоль/л | 5,60±0,08 | 5,59±0,07 | 5,58±0,09 | –21,6 | –20,2 | –23,7 | –26,4* | –20,6 | –17,4# |
| ТГ, ммоль/л | 1,83±0,07 | 1,79±0,06 | 1,81±0,07 | –15,7 | –14,3 | –16,4 | –19,1* | –15,1 | –11,3# |
| ХС ЛПВЩ, ммоль/л | 0,98±0,02 | 1,02±0,01 | 1,04±0,03 | +7,5 | +8,1 | +7,3 | +7,9 | +8,4 | +8,1 |
| ХС ЛПНЩ, ммоль/л | 3,41±0,07 | 3,38±0,06 | 3,31±0,08 | –9,4 | –8,9 | –10,1 | –10,0 | –9,2 | –11,5 |
| ХС ЛПДНЩ, ммоль/л | 1,85±0,04 | 1,79±0,04 | 1,82±0,03 | –16,3 | –18,4 | –23,6 | –22,1* | –19,8 | –18,2# |
| КА | 4,72±0,10 | 4,58±0,07 | 4,49±0,09 | –14,1 | –13,9 | –13,6 | –15,6 | –14,4 | –14,1 |
У підгрупі хворих з Т/Т-генотипом поліморфізму Met235Thr-гена АТГ, які отримували розувастатин, відзначено вірогідно більш значущі зміни ліпідограми, порівняно із хворими, яким призначено аторвастатин: рівень ЗХС був на 4,8%, ТГ — на 3,4%, а ХС ЛПДНЩ — на 5,8% нижчий, що свідчить про доцільність застосування розувастатину у підгрупі пацієнтів з ІХС та ожирінням, які є носіями Т/Т-генотипу поліморфізму Met235Thr-гена АТГ (p<0,05).
Терапія аторвастатином вірогідно позитивніше відзначалася на показниках ліпідного обміну у носіїв М/М-генотипу поліморфізму Met235Thr-гена АТГ: рівень ЗХС у них був на 6,3%, ТГ — на 5,1%, а ХС ЛПДНЩ — на 5,4% нижчий, ніж у носіїв М/М-генотипу, які застосовували розувастатин як гіполіпідемічний засіб (p<0,05).
Носії Т/М-генотипу поліморфізму Met235Thr-гена АТГ не продемонстрували вірогідних переваг щодо показників ліпідограми після застосування жодного зі статинів (р>0,05).
Разом із цим аналіз ефективності застосування аторвастатину та розувастатину залежно від генотипів поліморфізму Met235Thr-гена АТГ виявив вірогідні відмінності в більш вираженому ліпідознижувальному ефекті при застосуванні розувастатину носіями Т/Т-генотипу та аторвастатину — носіями М/М-генотипу.
Висновки
Результати проведеного дослідження свідчать, що лікування пацієнтів з ІХС та ожирінням гіполіпідемічними засобами (аторвастатин або розувастатин) покращує показники ліпідного обміну за рахунок зниження вмісту проатерогенних фракцій. Застосування аторвастатину у носіїв М/М-генотипу і розувастатину у носіїв Т/Т-генотипу поліморфізму Met235Thr-гена АТГ особливо ефективне й найбільш пріоритетне.
Перспективи подальших досліджень
Перспективи подальших досліджень полягають у визначенні ефективності застосування різних гіполіпідемічних засобів у пацієнтів з ІХС та супутнім ожирінням залежно від поліморфізму інших генів ренін-ангіотензин-альдостеронової системи.
Список використаної літератури
- DiNicolantonio J.J., Lavie C.J., Serebruany V.L., O’Keefe J.H. (2013) Statin wars: the heavyweight match — atorvastatin versus rosuvastatin for the treatment of atherosclerosis, heart failure, and chronic kidney disease. Postgrad. Med., 125(1): 7–16.
- Khera A.V., Everett B.M., Caulfield M.P. et al. (2014) Lipoprotein(a) concentrations, rosuvastatin therapy, and residual vascular risk: an analysis from the JUPITER Trial (Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin). Circulation, 129(6): 635–642.
- Pelliccia F., Rosano G., Marazzi G. et al. (2014) Pharmacodynamic effects of atorvastatin versus rosuvastatin in coronary artery disease patients with normal platelet reactivity while on dual antiplatelet therapy — the PEARL randomized cross-over study. Eur. J. Pharmacol., 725: 18–22.
- European Association for Cardiovascular Prevention & Rehabilitation, Reiner Z., Catapano A.L. et al.; ESC Committee for Practice Guidelines (CPG) 2008–2010 and 2010–2012 Committees (2011) ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur. Heart J., 32(14): 1769–1818.
- Stone N.J., Robinson J.G., Lichtenstein A.H. et al.; American College of Cardiology/American Heart Association Task Force on Practice Guidelines (2014) 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation, 129(25 Suppl. 2): S1–S45.
- Takagi H., Niwa M., Mizuno Y. et al. (2014) Effects of rosuvastatin versus atorvastatin on small dense low-density lipoprotein: a meta-analysis of randomized trials. Heart Vessels, 29(3): 287–299.
- Tsimikas S., Viney N.J., Hughes S.G. et al. (2015) Antisense therapy targeting apolipoprotein(a): a randomised, double-blind, placebo-controlled phase 1 study. Lancet, 386(10002): 1472–1483.
- Weng T.C., Yang Y.H., Lin S.J., Tai S.H. (2010) A systematic review and meta-analysis on the therapeutic equivalence of statins. J. Clin. Pharm. Ther., 35(2): 139–151.
Резюме. Цель — оценить эффективность применения аторвастатина и розувастатина путем добавления к стандартной терапии у пациентов с ишемической болезнью сердца (ИБС) и ожирением в зависимости от генотипов полиморфизма Met235Thr-гена ангиотензиногена (АТГ). Объект и методы исследования. Выделены две подгруппы наблюдения: 1-я — 116 пациентов с ИБС и ожирением, применявшие аторвастатин в суточной дозе 20 мг (среди них носителей Т/Т-генотипа — 34, Т/М-генотипа — 45, М/М-генотипа — 37 человек); 2-я — 108 пациентов с ИБС и ожирением, получавшие розувастатин в суточной дозе 10 мг (среди них носителей Т/Т-генотипа — 30, Т/М-генотипа — 43, М/М-генотипа — 35 человек). Всем больным определяли показатели липидного обмена согласно стандартной биохимической методике, аллельный полиморфизм Met235Thr-гена АТГ методом полимеразной цепной реакции. Результаты. Анализ эффективности применения аторвастатина и розувастатина в зависимости от генотипов полиморфизма Met235Thr-гена АТГ у пациентов с ИБС и ожирением выявил достоверные различия, заключающиеся в более выраженном липидоснижающем эффекте при применении розувастатина у носителей Т/Т-генотипа, аторвастатина — М/М-генотипа. Выводы. Лечение пациентов с ИБС и ожирением гиполипидемическими средствами (аторвастатин или розувастатин) улучшает показатели липидного обмена за счет снижения содержания проатерогенных фракций. Применение аторвастатина у носителей М/М-генотипа и розувастатина у носителей Т/Т-генотипа полиморфизма Met235Thr-гена АТГ особенно эффективно и наиболее предпочтительно.
Ключевые слова: розувастатин, аторвастатин, ишемическая болезнь сердца, ожирение, полиморфизм гена ангиотензиногена.
Адреса для листування:
Кадикова Ольга Ігорівна
61022, Харків, просп. Науки, 4
Харківський національний медичний університет,
кафедра внутрішньої медицини № 2 і клінічної імунології та алергології
E-mail: [email protected]
Одержано 13.03.2018





