 Відкрив роботу конференції та модерував її перебіг Юрій Фещенко, директор НІФП імені Ф.Г. Яновського НАМН України, академік НАМН України, член Президії НАМН України, професор, заслужений діяч науки і техніки України, лауреат Державної премії України в галузі науки і техніки та премії імені Ф.Г. Яновського НАН України, завідувач кафедри фтизіатрії і пульмонології НМАПО імені П.Л. Шупика МОЗ України. Він нагадав основні критерії, що стосуються ведення пацієнтів із хронічним обструктивним захворюванням легень (ХОЗЛ): клінічна симптоматика, загострення (їх кількість та якість), функціональні методи дослідження. «Високе медико-соціальне значення ХОЗЛ слугувало для Всесвітньої організації охорони здоров’я (ВООЗ) підставою, аби вийти з ініціативою видання міжнародного погоджувального документа, присвяченого діагностиці, лікуванню та профілактиці цієї недуги, заснованого на принципах доказової медицини: Global Initiative for Chronic Obstructive Lung Disease (GOLD). На основі цього документа видано наказ МОЗ України від 19.03.2007 р. № 128 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Пульмонологія» (який регламентує питання діагностики та лікування органів системи дихання, зокрема ХОЗЛ). Однак накази МОЗ України переглядаються не так часто, як регулярно оновлювані міжнародні рекомендаційні документи ВООЗ, — а медична наука і практика, тим часом, не товчуться на місці. Тож GOLD-2017 привертають нашу увагу насамперед до перших двох із названих мною пунктів (з точки зору практичної охорони здоров’я): клінічні симптоми та загострення. Роль функціональних досліджень не зменшилася і залишається, однак вони, так би мовити, перенесені трохи «вправо» — мають велике значення в контексті діагностики ХОЗЛ і для того, щоб відстежувати ефективність лікування та динаміку якості життя пацієнтів. А головне у взаємовідносинах між лікарем та пацієнтом залишається незмінним — проведення раціональної терапії (як зазначених загострень, так і ХОЗЛ як патогенетично-клінічного комплексу в цілому). Переконаний, що наші доповідачі неодноразово звернуть увагу на всі ці аспекти, відображені в тексті GOLD-2017, — а наша робота буде, як завжди, продуктивною та корисною», — наголосив головуючий, давши старт пленарній фазі конференції та закликавши її учасників брати активну участь у дискусії, виступати самим і ставити запитання доповідачам.
Відкрив роботу конференції та модерував її перебіг Юрій Фещенко, директор НІФП імені Ф.Г. Яновського НАМН України, академік НАМН України, член Президії НАМН України, професор, заслужений діяч науки і техніки України, лауреат Державної премії України в галузі науки і техніки та премії імені Ф.Г. Яновського НАН України, завідувач кафедри фтизіатрії і пульмонології НМАПО імені П.Л. Шупика МОЗ України. Він нагадав основні критерії, що стосуються ведення пацієнтів із хронічним обструктивним захворюванням легень (ХОЗЛ): клінічна симптоматика, загострення (їх кількість та якість), функціональні методи дослідження. «Високе медико-соціальне значення ХОЗЛ слугувало для Всесвітньої організації охорони здоров’я (ВООЗ) підставою, аби вийти з ініціативою видання міжнародного погоджувального документа, присвяченого діагностиці, лікуванню та профілактиці цієї недуги, заснованого на принципах доказової медицини: Global Initiative for Chronic Obstructive Lung Disease (GOLD). На основі цього документа видано наказ МОЗ України від 19.03.2007 р. № 128 «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Пульмонологія» (який регламентує питання діагностики та лікування органів системи дихання, зокрема ХОЗЛ). Однак накази МОЗ України переглядаються не так часто, як регулярно оновлювані міжнародні рекомендаційні документи ВООЗ, — а медична наука і практика, тим часом, не товчуться на місці. Тож GOLD-2017 привертають нашу увагу насамперед до перших двох із названих мною пунктів (з точки зору практичної охорони здоров’я): клінічні симптоми та загострення. Роль функціональних досліджень не зменшилася і залишається, однак вони, так би мовити, перенесені трохи «вправо» — мають велике значення в контексті діагностики ХОЗЛ і для того, щоб відстежувати ефективність лікування та динаміку якості життя пацієнтів. А головне у взаємовідносинах між лікарем та пацієнтом залишається незмінним — проведення раціональної терапії (як зазначених загострень, так і ХОЗЛ як патогенетично-клінічного комплексу в цілому). Переконаний, що наші доповідачі неодноразово звернуть увагу на всі ці аспекти, відображені в тексті GOLD-2017, — а наша робота буде, як завжди, продуктивною та корисною», — наголосив головуючий, давши старт пленарній фазі конференції та закликавши її учасників брати активну участь у дискусії, виступати самим і ставити запитання доповідачам.
 Професор Юрій Мостовой, завідувач кафедри пропедевтики внутрішніх хвороб Вінницького національного медичного університету (ВНМУ) імені М.І. Пирогова, розпочав свою доповідь з історико-медичного екскурсу до еволюції поглядів на ХОЗЛ. Так, на початку ХХ ст. поняття ХОЗЛ не існувало, а в період 1930–1970 рр. відповідний симптомокомплекс визначався «під куполом» діагнозу хронічної пневмонії, який включав усі хронічні неспецифічні захворювання легень. Тоді стадії розвитку на підставі морфологічних змін у легенях описав видатний радянський патологоанатом, академік АМН СРСР Іполіт Давидовський (1887–1968):
Професор Юрій Мостовой, завідувач кафедри пропедевтики внутрішніх хвороб Вінницького національного медичного університету (ВНМУ) імені М.І. Пирогова, розпочав свою доповідь з історико-медичного екскурсу до еволюції поглядів на ХОЗЛ. Так, на початку ХХ ст. поняття ХОЗЛ не існувало, а в період 1930–1970 рр. відповідний симптомокомплекс визначався «під куполом» діагнозу хронічної пневмонії, який включав усі хронічні неспецифічні захворювання легень. Тоді стадії розвитку на підставі морфологічних змін у легенях описав видатний радянський патологоанатом, академік АМН СРСР Іполіт Давидовський (1887–1968):
- гостра пневмонія, що не завершується;
- прогресуючий пневмосклероз;
- формування вогнищ некрозу, абсцедування, бронхоектазій;
- залучення всієї бронхолегеневої тканини з розвитком тяжкої бронхіальної обструкції та легеневого серця.
Минали десятиліття. Народжувалися нові класифікації (Мінська, 1964 р; Тбіліська, 1972 р.). І з середини 80-х по 90-ті роки ХХ ст. у лексиконі лікарів прописався термін хронічний обструктивний бронхіт: дифузне, зумовлене тривалим подразненням та запаленням (нейтрофільним) прогресуюче ураження бронхіального дерева (згідно з визначенням, наданим наказом МОЗ України від 30.12.1999 р. № 311). «Це був історичний документ: перший в незалежній Україні наказ щодо пульмонології. Згодом йому на зміну прийшов наказ МОЗ України від 28.10.2003 р. № 499, однак слово «запалення» з’явилося ще тоді», — підкреслив учений. І лише через певний час було офіційно усталено термін ХОЗЛ, причому з достатньо оптимістичним тлумаченням: «…хронічне запалення, що можна попередити та лікувати…», — але й у супроводі принципових патогенетично-клінічних застережень: «Поряд з ураженням легень ХОЗЛ призводить до суттєвих системних ефектів, супутніх захворювань…» (згідно з наказом МОЗ України від 19.03.2007 р. № 128 — там же викладено ознаки стадій (ступенів тяжкості перебігу) ХОЗЛ: табл. 1).
Таблиця 1. Стадії та ступені тяжкості перебігу ХОЗЛ (згідно з наказом МОЗ України від 19.03.2007 р. № 128)
| Стадія/ступінь тяжкості | Ознаки ХОЗЛ |
|---|---|
| I, легкий | – ОФВ*1/ФЖЄЛ* <70%
– ОФВ1 80% належного – Звичайно, але не завжди, хронічний кашель, виділення мокротиння |
| II, помірний | – ОФВ1/ФЖЄЛ <70%
– 50% ОФВ1 <80% належного – Симптоми прогресують, з’являється задишка при фізичному навантаженні та під час загострень |
| III, тяжкий | – ОФВ1/ФЖЄЛ <70%
– 30% ОФВ1 <50% належного – Збільшення задишки, повторні загострення, що погіршує якість життя хворих |
| IV, дуже тяжкий | – ОФВ1/ФЖЄЛ <70%*, ОФВ1 <30% належного, або ОФВ1 <50% належного з наявністю хронічної легеневої недостатності
– Подальше прогресування симптомів, якість життя значно погіршена, загострення можуть загрожувати життю |
У цей же період активно обговорюється концепція хронічного системного низькоінтенсивного запалення (підвищення рівня маркерів запалення має місце не лише на «території легень», а й у периферичній крові, що дає підстави говорити про наявність системної запальної реакції або системного запалення при ХОЗЛ). Згодом було виявлено, що низка маркерів системного запалення у пацієнтів із ХОЗЛ асоційована з ризиком коморбідних станів. Так, при лейкоцитозі >9 тис. рівні С-реактивного протеїну >3 мг/л та фібриногену >14 мкмоль/л зростає вірогідність:
- інфаркту міокарда — у 2,32 раза;
- серцевої недостатності — у 2,63 раза;
- цукрового діабету — у 3,54 раза;
- раку легень — у 4,0 раза;
- пневмонії — у 2,71 раза (Thomsen M. et al., 2012).
Серед хворих терапевтичного профілю спостерігається значна поширеність поєднаного перебігу ХОЗЛ з артеріальною гіпертензією — до 90%. Високу «коморбідну спорідненість» демонструють пацієнти зі стабільною стенокардією при ішемічній хворобі серця (ІХС), в яких вперше діагностовано ХОЗЛ — до 30% (згідно з науково-дослідною роботою кафедри пропедевтики внутрішньої медицини ВНМУ імені М.І. Пирогова).

Розглянувши основоположні підвалини, доповідач перейшов до новітніх уявлень, насамперед звернувши увагу аудиторії на суттєві відмінності визначення ХОЗЛ у старому (2016) і чинному новому (2017) переглядах GOLD:
- GOLD-2016: «ХОЗЛ… характеризується стійким, зазвичай прогресуючим, обмеженням прохідності дихальних шляхів та асоціюється з підвищеною хронічною запальною відповіддю дихальних шляхів… Загострення та супутні захворювання зумовлюють тяжкість захворювання…».
- GOLD-2017: «ХОЗЛ є поширеним захворюванням, якому можна запобігти та лікувати його, що характеризується стійкими респіраторними симптомами та обмеженням прохідності дихальних шляхів через патологічні зміни дихальних шляхів та/чи альвеол…».
Згідно з GOLD, лікування ХОЗЛ передбачає різні варіанти терапії для різних груп ризику (табл. 2).
Таблиця 2. Лікування ХОЗЛ: варіанти терапії для різних груп ризику (GOLD-2017)
| Група ризику | Критерії ризику | Терапія першого вибору |
|---|---|---|
| А | Низький ризик загострень
Низький індекс симптомів |
Бронхолітик короткої дії: М-холінолітик або агоніст β2-адренорецепторів короткої дії |
| В | Низький ризик загострень
Високий індекс симптомів |
Бронхолітик тривалої дії: М-холінолітик тривалої дії чи агоніст β2– адренорецепторів тривалої дії |
| С | Високий ризик загострень
Низький індекс симптомів |
Комбінація: інгаляційний кортикостероїд/агоніст β2-адренорецепторів тривалої дії або М-холінолітик тривалої дії |
| D | Високий ризик загострень
Високий індекс симптомів |
Комбінація: інгаляційний кортикостероїд/агоніст β2-адренорецепторів тривалої дії та/чи М-холінолітик тривалої дії |
Зазначалося, що комбінація інгаляційного кортикостероїду з агоністом β2-адренорецепторів тривалої дії ефективніша, ніж монокомпоненти, щодо покращення функції легень, статусу здоров’я і зниження частоти загострень у пацієнтів від середнього до вкрай тяжкого ХОЗЛ із загостреннями в анамнезі (рівень доказовості А). Не менш важливою ввижається інформація щодо впливу тривалого застосування інгаляційних кортикостероїдів на перебіг серцево-судинних захворювань:
- асоціювався зі зниженням ризику смерті від серцево-судинних захворювань на 20% (Lee T.A. et al., 2008);
- прийом будесоніду протягом трьох років асоціювався зі зниженням частоти виникнення ішемічних коронарних подій на 43% (Lofdahl C.G. et al., 2007: EUROSCOP);
- в комбінації з агоністом β2-адренорецепторів тривалої дії: приводив до зниження частоти розвитку кардіальної побічної дії на 31%, загальної смертності — на 56% порівняно з монотерапією тіотропієм (Wedzicha J.A. et al., 2008: INSPIRE).
Водночас, формотерол демонструє низку небронходилатаційних ефектів, зокрема:
- здатен впливати на нейтрофіли, зменшуючи їх кількість у дихальних шляхах;
- знижує концентрацію інтерлейкіну-8 в індукованій мокроті;
- перешкоджає вивільненню бронхоконстрикторних медіаторів та гістаміну гладкими клітинами;
- знижує ексудацію плазми крові, що зумовлює зменшення локального набряку.
Нарешті, відміна комбінації інгаляційного кортикостероїду з агоністом β2-адренорецепторів тривалої дії (чи навіть ізольованого інгаляційного кортикостероїду) у пацієнтів із ХОЗЛ призводить до значного погіршення легеневої функції протягом наступних 5 років. Зниження функції легень залежно від ступеня застосування інгаляційного кортикостероїду:
- найбільша швидкість зниження ОФВ1 (–84 до –106 мл/рік, p≤0,01) — у пацієнтів, які не отримували інгаляційного кортикостероїду;
- найменша швидкість зниження ОФВ1 (–59 мл/рік; р=0,02) — у пацієнтів, які застосовували інгаляційний кортикостероїд (Kunz L.I.Z. et al., 2015: CHEST).
На тлі окресленої доповіддю інформації професор Ю. Мостовой зробив такі висновки:
- запалення є ключовою причиною прогресування, а особливо загострень, при ХОЗЛ та відіграє важливу роль в ураженні життєво важливих органів та систем людини;
- найвагоміше значення у стримуванні прогресування та профілактиці загострень при ХОЗЛ належить комбінаціям інгаляційних кортикостероїдів та агоністам β2-адренорецепторів тривалої дії, зокрема будесоніду/формотеролу;
- нові комбіновані бронхолітики мають рівнозважене значення в лікуванні пацієнтів із ХОЗЛ поряд з іншими лікарськими засобами, що мають потужну доказову базу;
- вибір препарату для лікування при ХОЗЛ залежить від конкретної клінічної ситуації та індивідуальної відповіді пацієнта на призначені ліки.
 Проблему коморбідності у пацієнтів з ХОЗЛ продовжила, розвинула та поглибила Тетяна Перцева, член-кореспондент НАМН України, професор, ректор Дніпропетровської медичної академії, заслужений працівник народної освіти України, відмінник охорони здоров’я України. За результатами сучасних міжнародних досліджень, до 37% пацієнтів з ХОЗЛ хворіють на цукровий діабет, у 21–53% — гіперглікемія; ХОЗЛ підвищують ризик розвитку цукрового діабету в 1,4–2,0 раза (Song Y. et al., 2010). Патогенетично: тютюнопаління та оксидативний стрес спричинюють накопичення вісцерального жиру та формування інсулінорезистентності; хронічна гіпоксія при ХОЗЛ підвищує потребу тканин у кисні та знижує їх чутливість до глюкози).
Проблему коморбідності у пацієнтів з ХОЗЛ продовжила, розвинула та поглибила Тетяна Перцева, член-кореспондент НАМН України, професор, ректор Дніпропетровської медичної академії, заслужений працівник народної освіти України, відмінник охорони здоров’я України. За результатами сучасних міжнародних досліджень, до 37% пацієнтів з ХОЗЛ хворіють на цукровий діабет, у 21–53% — гіперглікемія; ХОЗЛ підвищують ризик розвитку цукрового діабету в 1,4–2,0 раза (Song Y. et al., 2010). Патогенетично: тютюнопаління та оксидативний стрес спричинюють накопичення вісцерального жиру та формування інсулінорезистентності; хронічна гіпоксія при ХОЗЛ підвищує потребу тканин у кисні та знижує їх чутливість до глюкози).
Серед особливостей перебігу ХОЗЛ у поєднанні з цукровим діабетом названо такі:
- зниження функції зовнішнього дихання (при ХОЗЛ та цукровому діабеті вона продовжує знижуватися за рахунок рестриктивного компонента: мікроангіопатія та потовщення базальної мембрани);
- на тлі цукрового діабету загострення ХОЗЛ відбуваються частіше, ніж у пацієнтів з нормальною утилізацією глюкози (2,4 vs 0,7 за рік), а тривалість загострень — більша (7,5 vs 5,0 днів);
- частота госпіталізацій — коморбідні хворі частіше госпіталізуються внаслідок загострень, зумовлених грамнегативною флорою; у 50% госпіталізованих відзначали декомпенсацію цукрового діабету;
- зменшення скелетних м’язів: на тлі цукрового діабету маса тіла у пацієнтів із ХОЗЛ зменшується удвічі швидше, ніж у пацієнтів з ізольованим ХОЗЛ (інсулін — важливий анаболічний гормон) (Kupeli E. et al., 2010).
Детально розглянувши особливості різних терапевтичних схем при різних комбінаціях захворювань, доповідач зазначила, що для хворих на бронхіальну астму чи ХОЗЛ, які мають таку супутню патологію, як цукровий діабет та/чи ожиріння, основу базисної терапії має становити комбінація інгаляційних кортикостероїдів та стимуляторів β2-адренорецепторів (зокрема будесоніду та формотеролу), — оскільки це дозволяє досягти належного контролю симптомів при меншому стероїдному навантаженні, а також ефективно уникнути ризику розвитку загострень.
 Професор Микола Островський, завідувач кафедри фтизіатрії та пульмонології з курсом професійних хвороб Івано-Франківського національного медичного університету, наголосив, що ХОЗЛ залишається глобальною проблемою охорони здоров’я: за надійними прогнозами, станом на 2030 р. ця недуга стане третьою провідною причиною смерті у світі (Mathers C.D., Loncar D., 2006; World Health Organization. Burden of COPD, 2015; Фещенко Ю.І. та співавт., 2016). Основні 4 фактори, від яких залежить природний перебіг ХОЗЛ — це маса тіла, вік, наявність серцево-судинної патології, гіподинамія (Sutherland E., 2004); вже на ранніх етапах ХОЗЛ з’являються загострення (Hurst J.R. et al., 2010). Загострення відіграють важливий коротко- та довгостроковий вплив на пацієнтів із ХОЗЛ (Фещенко Ю.І. та співавт., 2016), викликаючи:
Професор Микола Островський, завідувач кафедри фтизіатрії та пульмонології з курсом професійних хвороб Івано-Франківського національного медичного університету, наголосив, що ХОЗЛ залишається глобальною проблемою охорони здоров’я: за надійними прогнозами, станом на 2030 р. ця недуга стане третьою провідною причиною смерті у світі (Mathers C.D., Loncar D., 2006; World Health Organization. Burden of COPD, 2015; Фещенко Ю.І. та співавт., 2016). Основні 4 фактори, від яких залежить природний перебіг ХОЗЛ — це маса тіла, вік, наявність серцево-судинної патології, гіподинамія (Sutherland E., 2004); вже на ранніх етапах ХОЗЛ з’являються загострення (Hurst J.R. et al., 2010). Загострення відіграють важливий коротко- та довгостроковий вплив на пацієнтів із ХОЗЛ (Фещенко Ю.І. та співавт., 2016), викликаючи:
- зростання захворюваності;
- підвищення госпіталізації та смертності;
- сильно впливають на якість життя, пов’язану зі здоров’ям.
Із частими тяжкими загостреннями пов’язана вища смертність (Soler-Cataluna J.J. et al., 2005). Середня виживаність після одного тяжкого загострення серед пацієнтів ХОЗЛ становить 3,6 року (Suissa S. et al., 2012). Тож цілком виправдано однією з головних цілей лікування пацієнтів із ХОЗЛ доповідач назвав запобігання тяжким загостренням. А інструментом такого запобігання вважає холінергічний контроль дихальних шляхів. У контексті протидії загостренням ХОЗЛ професор М. Островський рекомендує колегам практичної ланки уважніше придивитися до тіотропію — високобронхоселективного холінолітика тривалої дії, який:
- є високоселективним стосовно М1– та особливо до М3– рецепторів;
- швидко звільняється зі зв’язку з М2-рецепторами;
- за результатами досліджень доведено не лише можливості зменшення проявів хвороби, а й сповільнення швидкості зниження ОФВ1 упродовж 4 років;
- за рахунок багатовекторності свого впливу на різноманітні патогенетичні механізми розвитку патологічного процесу, будучи засобом базової терапії, здатний проявити себе не тільки як пролонгований бронхолітик, а й показати інші точки прикладання свого потенціальну до патогенетичного ланцюга ХОЗЛ (Barnes P.J., 2001; Фещенко Ю.І. та співавт., 2016).

Застосування цього препарату допомагало пацієнтам залишатися в зоні низького ризику і подовжувало період до першого загострення ХОЗЛ, а також переводити пацієнтів із зони високого ризику в зону низького ризику у зв’язку зі зменшенням кількості загострень ХОЗЛ. Доведена значна порівняльна ефективність зазначеного лікувального методу (введеного до свіжооновленого тексту GOLD-2017 як базова терапія при ХОЗЛ) у запобіганні загостренням цього захворювання за результатами цілої низки високоякісних рандомізованих подвійно-сліпих міжнародних багатоцентрових досліджень (Dusser D. et al., 2006; Vogelmeier C. et al., 2011; Tashkin D.P. et al., 2012; Decramer M.L. et al., 2013; Wedzicha J.A. et al., 2013: SPARK; Decramer M. et al., 2014; Maleki-Yazdi M.R. et al., 2014), де, зокрема, продемонстровано:
- зменшення кількості загострень в 1-річному дослідженні на 39% порівняно з комбінацією стимуляторів β2-адренорецепторів короткої дії та інгаляційними кортикостероїдами (MISTRAL);
- зменшення кількості загострень за 4 роки порівняно зі стандартним лікуванням на 17%, а також подовження часу до настання першого загострення у пацієнтів з ХОЗЛ різних клінічних груп за класифікацією GOLD (UPLIFT);
- зменшення кількості загострень протягом 1 року на 28% порівняно з сальметеролом (POET);
- зменшення кількості загострень протягом 1 року на 29% порівняно з індакатеролом (INVIGORATE);
- зменшення кількості загострень протягом понад 1 року на 33% порівняно з глікопіронієм (SPARK) тощо.
В окремій доповіді професор М. Островський окреслив здобутки та нові горизонти β2-агоністів тривалої дії у лікуванні пацієнтів із ХОЗЛ:
- здобутки:
− β2-агоністи тривалої дії, відповідно до GOLD-2017, при ХОЗЛ набрали неабиякої ваги, особливо у фенотипах із високою частотою загострень;− ХОЗЛ — нейтрофільний запальний процес, при якому інгаляційні кортикостероїди діють гірше, ніж при еозинофільному.
У цьому контексті слід пам’ятати про виражені протизапальні ефекти β2-агоністів тривалої дії.
- нові горизонти: необхідність оцінки досвіду країн Європейського Союзу щодо менеджменту лікування при ХОЗЛ та його наслідків.
Було наведено основні доступні на вітчизняному фармацевтичному ринку препарати групи короткодіючих і пролонгованих β2-агоністів згідно з Державним реєстром лікарських засобів України (табл. 3).
Таблиця 3. Основні препарати групи короткодіючих і пролонгованих β2-агоністів (згідно з Державним реєстром лікарських засобів України, 2017)
| Міжнародна назва | Добова доза, мкг |
|---|---|
| β2-агоністи короткої дії | |
| Сальбутамол | 400 |
| Фенотерол | 400 |
| β2-агоністи тривалої дії | |
| Сальметерол | 100 |
| Формотерол | 24 |
Ефекти стимуляції β2-адренорецепторів вчений-клініцист порівняв із відкриттям другого дихання і стисло розглянув механізми дії та клінічні характеристики пролонгованих β2-агоністів:
- формотерол — повний агоніст: покриває відносно менше рецепторів, але стимулює їх повністю; повторне застосування приводить до більшого покриття і до підсилення терапевтичної активності при високому рівні безпеки; клінічно: здійснює більш швидкий і тривалий приріст ОФВ1 (Grembiale R.D. et al., 2002), викликає дозозалежний бронхопротекторний ефект порівняно із сальметеролом (Palmqvist M. et al., 1999);
- сальметерол — частковий агоніст: покриває більше рецепторів, але стимулює їх частково; повторне застосування не приводить до більшого покриття (вже покриті), але провокує ризик виникнення побічних ефектів за рахунок втрати селективності (Княжеская Н.П., Потапова М.О., 2007).
Серед додаткових можливостей β2-агоністів тривалої дії названо:
- пригнічення нейтрофільного запалення;
- зменшення гіперреактивності бронхів;
- зменшення адгезії мікроорганізмів до епітелію;
- пожвавлення мукоциліарного транспорту;
- розслаблення гладких м’язів бронхів;
- збільшення продукції сурфактанта (Аверьянов А.В., 2006).
Відповідно, застосування препаратів цієї групи для лікування пацієнтів з ХОЗЛ:
- запобігає розвитку гострої бронхообструкції;
- забезпечує розслаблення скорочених гладких м’язів;
- зменшує наслідки оксидативного стресу у пацієнтів із ХОЗЛ;
- дає можливість ширше застосовувати для лікування у разі супутніх патологій інші лікарські засоби, навіть інгібітори цитохрому Р450 (Толох О.С., Рудницька Н.Д., 2015).
* * *
Як і передрікав на початку конференції головуючий академік Ю. Фещенко, особливу увагу аудиторії прикуло питання: що нового містить GOLD-2017 порівняно з версією 2016 р.? Кожен із доповідачів тією чи іншою мірою, у тому чи в іншому контексті чи площині давав відповідь на це запитання. Проте, мабуть, найбільш прицільно з практичної (так би мовити, клініко-стратегічної) точки на нього відповів гість зі славного Прикарпаття — професор М. Островський. Ключові стратегічні контрапункти та клінічні тренди нового видання документа він охарактеризував словами:
- персоналізований;
- прогностичний;
- профілактичний;
- такий, що передбачає активну участь пацієнта в лікуванні.
(А це, зауважимо від себе, цілком співзвучно — як у комплексі, так і поодинці — сучасній парадигмі ВООЗ. — Прим. авт.).
Personalized — персоналізований підхід: врахування індивідуальних та клінічних особливостей пацієнта: фенотипу ХОЗЛ (стать, вік, тютюнопаління, зовнішні фактори ризику, наявність гіперінфляції, швидкість падіння ОФВ1, супутня патологія, зниження толерантності до фізичних навантажень, надмірна чи недостатня маса тіла, схильність до загострень, порушення газообміну тощо). А відтак — і персоналізований підбір терапії для:
- виконання завдань лікування пацієнтів із ХОЗЛ;
- GOLD-2017 характеризується новим, більш персоналізованим (індивідуальним) принципом оцінки належності до груп ABCD:
- стратифікація пацієнтів за групами ABCD для подальшого вибору фармакотерапії базується на оцінці симптомів (за допомогою опитувальників CAT або mMRC) та історії загострень і не враховує дані спірометрії;
- дані спірометрії залишаються важливим аспектом діагностики, прогнозу та рішення щодо інших необхідних терапевтичних підходів;
- новий алгоритм фармакологічного лікування з можливістю ескалації чи деескалації терапії.
GOLD-2017 виголошує новий алгоритм терапії пацієнтів з ХОЗЛ відповідно до груп ризику ABCD (ознаки груп — див. вище; оновлені рекомендації — див. нижче).
Група А. Усім пацієнтам групи А необхідно призначити бронходилататори залежно від їх впливу на задишку. Це можуть бути препарати як короткої, так і тривалої дії. Це лікування необхідно продовжувати за наявності позитивного впливу на симптоми.
Група В. Як ініціальну терапію слід вибрати бронходилататор тривалої дії. Немає доказів щодо переваг того чи іншого класу бронходилататорів тривалої дії у зменшенні вираженості симптомів у цієї групи пацієнтів. Вибір між класами препаратів залежить від індивідуального сприйняття зменшення вираженості симптомів пацієнтом. Пацієнтам із персистуючою задишкою, які перебувають на монотерапії, рекомендовано застосовувати два бронходилататори. У пацієнтів із тяжкою задишкою два бронходилататори можна розглядати як початкову терапію. При цьому зазначається: якщо додання другого бронходилататора не привело до зменшення вираженості симптомів, необхідно повернутися до монотерапії. У пацієнтів групи В здебільшого наявна коморбідність, що додає симптоматику, впливає на прогноз та потребує додаткового обстеження (Karner C. et al.; Cochrane Database Syst Rev, 2012; Lange P. et al., 2012; Augusti A. et al., 2013).
Група С. Пацієнти з персистуючими загостреннями можуть мати переваги від додання другого бронхолітика або від застосування комбінації β2-агоністів тривалої дії/інгаляційних кортикостероїдів. Оскільки інгаляційні кортикостероїди підвищують ризик розвитку пневмонії у деяких пацієнтів, першим вибором є комбінація β2-агоніст тривалої дії/М-холінолітик тривалої дії. Стартова терапія має складатися з монотерапії бронходилататором. У двох прямих порівняльних дослідженнях (Vogelmeier C. et al., 2011; Decreamer M.L. et al., 2013) М-холінолітик тривалої дії краще запобігав загостренню, ніж β2-агоніст тривалої дії. Таким чином, рекомендовано починати терапію в зазначеній групі з М-холінолітика тривалої дії.
Група D. Комбінацію β2-агоніст тривалої дії/М-холінолітик тривалої дії в дослідженнях оцінювали пацієнти як більш ефективне лікування порівняно з монопрепаратами. Якщо для ініціальної терапії вибраний монобронходилататор, то М-холінолітику тривалої дії надається перевага. Комбінація β2-агоніст тривалої дії/М-холінолітик тривалої дії ефективніше профілактує загострення, ніж комбінація β2-агоніст тривалої дії/інгаляційний кортикостероїд, а також має переваги щодо впливу на інші кінцеві точки у пацієнтів групи D (у яких, крім іншого, існує високий ризик розвитку пневмонії при прийомі інгаляційних кортикостероїдів). У деяких пацієнтів препаратами першого вибору можна розглядати інгаляційні кортикостероїди/β2-агоніст тривалої дії. Високий рівень еозинофілів у крові також може бути критерієм вибору при призначенні інгаляційних кортикостероїдів, проте це питання ще перебуває на стадії обговорення.
У пацієнтів із загостреннями, незважаючи на терапію β2-агоністом тривалої дії/М-холінолітиком тривалої дії, існують два альтернативні шляхи:
- ескалація до комбінації β2-агоніст тривалої дії/М-холінолітик тривалої дії/інгаляційний кортикостероїд (порівняння ефективності у профілактиці загострень подвійної та потрійної комбінацій — у процесі дослідження);
- переключення на β2-агоніст тривалої дії/інгаляційний кортикостероїд (щоправда, бракує доказів, що таке переключення приведе до кращого запобігання загостренням; однак якщо терапія із застосуванням β2-агоніста тривалої дії/інгаляційного кортикостероїду не мала позитивного впливу на симптоми/загострення, можливе додання М-холінолітика тривалої дії).
Якщо ж навіть при прийомі комбінації β2-агоніст тривалої дії/М-холінолітик тривалої дії/інгаляційний кортикостероїд у пацієнта все ще зберігається загострення, слід розглянути:
- додання рофлуміласту (у пацієнтів з ОФВ1 <50% належного та з хронічним бронхітом, зокрема у разі мінімум однієї госпіталізації у зв’язку з загостренням за попередній рік);
- додання макроліду (найкращу з існуючих доказових баз має азитроміцин); при прийнятті рішень також необхідно враховувати можливість розвитку резистентності;
- відміну інгаляційних кортикостероїдів (недостатня ефективність, підвищення ризику небажаних явищ (включаючи пневмонію) та доказова база, що демонструє їх відміну без шкоди, підтримують цю рекомендацію).

* * *
Назустріч 25-річчю НАМН України
Користуючись нагодою, в кулуарах конференції ми поцікавились у директора ДУ «НІФП ім. Ф.Г. Яновського НАМН України» академіка Юрія Фещенка найвагомішими здобутками та надбаннями, з якими очолювана ним славетна науково-клінічна установа підходить до знаменної дати, що відзначатиметься наступного року, — 25-річчя НАМН України. Отримана нами вичерпно-лаконічна відповідь була систематизованою в глобальному контексті й, вочевидь, цілком дозволяє визначити і зрозуміти те непересічне місце, яке посідає українська пульмонологія в короні світової медичної науки. Отже, до вашої уваги — ТОП-10 найвагоміших свіжих розробок співробітників НІФП імені Ф.Г. Яновського НАМН України.

І. ВПЕРШЕ У СВІТІ
1. Спосіб розтину м’яких тканин при виконанні торакотомії за допомогою біологічного зварювання (професор І.А. Калабуха та співавтори). При цьому шкіру розтинають скальпелем, а всі наступні шари грудної стінки — за допомогою біполярного затискача зі стандартного комплекту, підключеного до комплексу біологічного зварювання ЕК 300 М1 в режимі різання. Так пошарово виконують розтин м’яких тканин відповідно до звичайної для торакотомії послідовності перетину анатомічних утворень (без додаткових їх розшарувань), до повного формування адекватного доступу. При цьому забезпечується одночасний розтин тканини і гемостаз; немає негативних ефектів звичайної електрокоагуляції; тривалість операційного доступу скорочується на 13 хв, а частота післяопераційних ускладнень з боку торакотомної рани знижується на 96,4%, і, відповідно, кількість повторних операцій у зв’язку з ускладненнями з боку рани зменшується на 99,1% (рис./відео 1).
 |
Рис./відео 1. Розтин м’яких тканин при виконанні торакотомії за допомогою біологічного зварювання
2. Спосіб закриття нориці кукси головного бронха після пневмонектомії (професор І.А. Калабуха та співавтори). Суть способу полягає у тому, що одночасно проводять торакоскопію на боці ураження і фібробронхоскопію, під час яких норицю кукси головного бронха обтурують модифікованим клапаном-бронхоблокатором. Завдяки цьому відпадає потреба проводити повторне торакотомне хірургічне втручання; відсутні ризики травматичних ускладнень; мінімальна операційна травма; економляться наркотичні анальгетики та антибіотики; пацієнти рано стають активними без порушення функції зовнішнього дихання; тривалість госпіталізації скорочується на 42,5% (рис./відео 2).
 |
Рис./відео 2. Спосіб закриття нориці кукси головного бронха (бронхоблокація) після пневмонектомії
3. Cпосіб відеоасистованої голкової біопсії периферичного новоутворення легені (професор М.С. Опанасенко та співавтори). Розробка полягає у тому, що спершу проводять комп’ютерну томографію органів грудної клітки, на боці ураження накладають діагностичний пневмоторакс із досягненням колапсу легені на ⅓ і повторно проводять комп’ютерну томографію для визначення місць постановки торакопортів. І тоді під однолегеневим інтубаційним наркозом проводять відеоторакоскопію з виконанням біопсії новоутворення під відеоконтролем, після чого місця проколів легені обробляють 3% розчином перекису водню і проводять їх діатермокоагуляцію. Потім проводять ревізію плевральної порожнини для визначення поширеності й операбельності патологічного процесу. В кінці операції переходять на трахеальний наркоз і поступове роздування легені для оцінки аеро- і гемостазу. Біоптати направляють на цитологічне і гістологічне дослідження. Cпосіб відеоасистованої голкової біопсії периферичного новоутворення легені дозволяє досягти зниження рівня інтра- та післяопераційних ускладнень на 13,8% випадків; підвищити інформативність біопсії — на 36,1% випадків і на 13,6% раніше діагностувати патологію (рис. 3).

Рис. 3. Cпосіб відеоасистованої голкової біопсії периферичного новоутворення легені
ІІ. ВПЕРШЕ В СНД ТА АЗІЇ
4. Парентеральна антимікобактеріальна терапія в інтенсивній фазі лікування хворих на вперше діагностований туберкульоз легень (професор М.М. Кужко та співавтори). На відміну від стандартних режимів лікування хворих на вперше діагностований туберкульоз легень, в інтенсивній фазі антимікобактеріальної терапії застосовують ін’єкційні форми основних протитуберкульозних препаратів першого ряду (ізоніазид, рифаміцину натрієва сіль та етамбутолу гідрохлорид), а перорально щоденно призначають піразинамід 1 раз на добу протягом 2 міс інтенсивної фази. Такий підхід зменшує прояви інтоксикації в перші 2 тиж лікування на 18,3%, а у хворих на поширені форми туберкульозу бактеріовиділення припиняється на (1,7±0,1) міс раніше, загальна переносимість антимікобактеріальної хіміотерапії поліпшується на 15,4%, а частота побічних реакцій з боку шлунково-кишкового тракту знижується на 10,8% випадків.
ІIІ. ВПЕРШЕ В УКРАЇНІ
5. Рівень мультирезистентного туберкульозу в Україні за даними першого національного епідеміологічного дослідження 2015 р. (доктор медичних наук О.А. Журило). Вперше в Україні у 2015 р. проведено мікробіологічний скринінг 1237 нових випадків і 313 повторних випадків туберкульозу зі всіх адміністративних територій, окрім Автономної Республіки Крим і територій Донбасу, не підконтрольних українській владі. Отримані результати (табл. 4) стали підставою до розроблення відповідних режимів антимікобактеріальної терапії.
Таблиця 4. Результати першого національного епідеміологічного дослідження рівня мультирезистентного туберкульозу в Україні, проведеного НІФП імені Ф.Г. Яновського НАМН України (за О.А. Журило, 2015)
| Стійкість мікобактерій, % | Нові випадки | Повторні випадки |
|---|---|---|
| Чутливі | 57,1 | 30,0 |
| Монорезистентні | 10,5 | 6,1 |
| Полірезистентні | 8,1 | 5,7 |
| Мультирезистентні | 24,3 | 58,2 |
6. Cпосіб морфологічної діагностики ступеня активності запального процесу при туберкульомах у резектатах легень (доктор медичних наук І.В. Ліскіна). При нечіткому традиційному визначенні ступеня активності туберкульозного процесу додатково проводять гістохімічне забарвлення серійних зрізів легеневої тканини за методикою помаранчевий-червоний-голубий у модифікації Зербіно — Лукасєвича, і виявлення при цьому локусів яскраво-помаранчево-червоного кольору в певних структурах туберкульоми чи прилеглої до туберкульоми легеневої тканини свідчить про активність специфічного туберкульозного запалення, яку виражають у цифрових величинах. Спосіб підвищує точність морфологічної діагностики з 92,09 до 97,74%.
7. Методика розрахунку потреби у протитуберкульозних препаратах (академік НАМН України Ю.І. Фещенко та співавтори). Розроблено програмне забезпеченням з уніфікованою електронною формою, яка дозволяє провести розрахунки потреби у протитуберкульозних препаратах у будь-якій адміністративній території або загалом в Україні. Розрахунок здійснюється автоматично на підставі внесення даних, які містяться в офіційній статистичній документації. Розрахунок потреби у протитуберкульозних препаратах розроблений як для лікування хворих на туберкульоз за стандартними режимами антимікобактеріальної терапії, так і для проведення хіміопрофілактики у групах диспансерного нагляду. Методика спрощує розрахунки для формування заявки на отримання протитуберкульозних препаратів, дозволяє створити реальний запас препаратів для проведення в повному обсязі лікування у різних категорій хворих та хіміопрофілактики у диспансерних групах. За умов вчасних закупівель зазначені розрахунки підвищують ефективність лікування хворих на туберкульоз на 12–15%, зменшують кількість хворих на хіміорезистентний туберкульоз на 3–4% внаслідок відсутності переривів у лікуванні.
8. Прогнозування ступеня тяжкості перебігу бронхіальної астми у дітей (професор В.П. Костроміна та співавтори). Прогнозування ступеня тяжкості перебігу бронхіальної астми у дітей здійснюється шляхом визначення генотипу за генами ферментів детоксикації ксенобіотиків другої фази — GSTP1 і GSTM1 та додаткового визначення генотипів за генами серцево-судинного тонусу ACE, АТ2R1. При виявленні комбінації генотипів AT2R1-1166CC і ACE-DD/або AT2R1-1166CC і GSTМ1-делеція/або AT2R1-1166CC, ACE-DD і GSTМ1-делеція — прогнозують тяжкий ступінь перебігу бронхіальної астми, а при виявленні комбінації генотипів GSTP1-AG і ACE-ID — середній ступінь перебігу. Це дозволяє надавати дітям не лише кваліфіковану, але й індивідуалізовану допомогу, що поліпшує її ефективність.
9. Технологія лікування хворих на саркоїдоз з ураженням паренхіми легень (професор В.К. Гаврилюк та співавтори). У рамках зазначеної технології всім хворим на саркоїдоз з ураженням паренхіми легень незалежно від наявності чи відсутності клінічних проявів і порушень функції зовнішнього дихання проводять специфічну кортикостероїдну терапію, але не за загальноприйнятою схемою, а за схемою, розробленою авторами: по 0,4 мг/кг/добу метилпреднізолону протягом 1 міс з подальшим зниженням дози до 0,2 мг/кг/добу — до кінця 3-го місяця і до 0,1 мг/кг/добу — до кінця 6-го місяця. Після досягнення клінічного ефекту з нормалізацією радіологічних даних підтримувальна терапія триває протягом 6 міс з метою профілактики рецидивів. Протипоказанням до використання цієї технології є серйозна побічна дія кортикостероїду і резистентність до кортикостероїдної терапії. Застосування технології дозволяє запобігти прогресуванню саркоїдозу з переходом у IV стадію захворювання і розвитком тяжкої респіраторної недостатності.
10. «Автоматизована медична інформаційна система» (АМІС) на базі спеціалізованого програмного забезпечення «ЕМСІМЕД» (доктор медичних наук В.О. Юхимець). Впроваджена в клініці НІФП імені Ф.Г. Яновського НАМН України в 2016 р. АМІС функціонально складається із двох взаємозалежних компонентів: апаратного та програмного. Апаратний компонент — це локальна комп’ютерна мережа у складі сучасного серверного пула, 14 комутаційних вузлів, 350 автоматизованих робочих місць (АРМ), мережних принтерів, сканерів, а також програмних продуктів, що безпосередньо забезпечують їхнє функціонування. Програмний компонент — це спеціалізований програмний продукт «ЕМСІМЕД», що працює на базі апаратного компонента і забезпечує функціонування власне АМІС. Протягом 2 років впровадження підготовлені технічне завдання, ескізний проект і технічний проект АМІС, створена структура керування системою, визначений порядок її впровадження у клініці, визначений перелік клінічних і наукових підрозділів інституту, робота яких автоматизується; розроблені Положення про роботу з АМІС різних категорій медичного й технічного персоналу, проведені масштабні роботи з розширення існуючої раніше інфраструктури локальної комп’ютерної мережі інституту, при цьому число АРМ медичного персоналу збільшене зі 130 до 350, настроєно, адаптовано до потреб клініки інституту й помодульно прийнято в експлуатацію спеціалізоване програмне забезпечення АМІС «ЕМСІМЕД». При цьому проведене інтенсивне навчання старшого й середнього медичного персоналу клінік роботі із системою, в АМІС інтегровано 50 од. автоматизованого діагностичного медичного обладнання, у тому числі комп’ютерний томограф, цифрові рентгенологічні апарати, клініко-біохімічні аналізатори, мікробіологічний аналізатор, електронний мікроскоп, автоматизовані спірографічні комплекси.
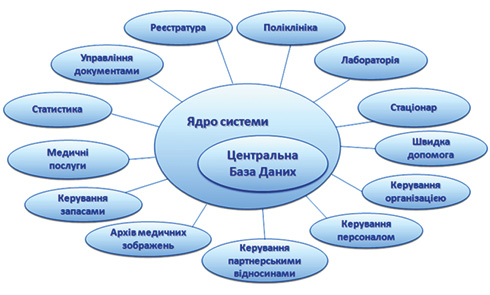
Рис. 4. Схема програмно-апаратного комплексу АМІС, запровадженого в НІФП імені Ф.Г. Яновського НАМН України
Уперше в історії інституту на сучасному рівні автоматизована (рис. 4) рутинна робота медичного персоналу шляхом впровадження електронної медичної документації хворих: карти стаціонарного хворого, карти амбулаторного хворого, виписок, медичних висновків, результатів діагностичних досліджень тощо. Проект дозволяє підвищити ефективність і продуктивність роботи медичного персоналу шляхом створення повністю цифрового робочого середовища, забезпечення високої якості обслуговування пацієнтів, скорочення кількості медичних помилок, оперативного забезпечення лікарів потрібною інформацією для прийняття правильних рішень.
Пилип Снєгірьов,
фото Сергія Бека
Інтраопераційні фото та відео люб’язно надані
НІФП імені Ф.Г. Яновського НАМН України





